贝伐单抗相关性高血压对结直肠癌和非小细胞肺癌患者预后的影响研究
2017-01-09冯谢敏
年 亮,冯谢敏,卢 喜
·论著·
贝伐单抗相关性高血压对结直肠癌和非小细胞肺癌患者预后的影响研究
年 亮,冯谢敏,卢 喜
目的 探讨贝伐单抗相关性高血压对结直肠癌和非小细胞肺癌患者预后的影响。方法 选取2010年3月—2016年3月于延安大学附属医院行贝伐单抗治疗的384例结直肠癌患者和384例非小细胞肺癌患者,其中结直肠癌患者采用贝伐单抗联合细胞毒性药物化疗,非小细胞肺癌患者采用贝伐单抗联合标准化疗方案治疗。记录所有患者高血压发生情况、高血压分级及处理方法、生存情况,结直肠癌和非小细胞肺癌患者贝伐单抗相关性高血压的影响因素分析采用多因素logistic回归分析。结果 768例患者出现贝伐单抗相关性高血压188例(24.5%),其中结直肠癌患者出现贝伐单抗相关性高血压108例(28.1%),非小细胞肺癌患者出现贝伐单抗相关性高血压80例(20.8%)。结直肠癌患者出现1级贝伐单抗相关性高血压48例(44.5%),2级贝伐单抗相关性高血压35例(32.4%),3级贝伐单抗相关性高血压25例(23.1%)。非小细胞肺癌患者出现1级贝伐单抗相关性高血压37例(46.3%),2级贝伐单抗相关性高血压26例(32.5%),3级贝伐单抗相关性高血压17例(21.2%)。绘制Kaplan-Meier生存曲线发现,结直肠癌患者中出现高血压者较未出现高血压者更具有生存优势,非小细胞肺癌患者中出现高血压者较未出现高血压者亦更具生存优势(P<0.05)。多因素logistic回归分析结果显示,贝伐单抗治疗时间〔OR=2.82,95%CI(1.49,7.85)〕是结直肠癌患者贝伐单抗相关性高血压的影响因素,贝伐单抗治疗周期〔OR=1.83,95%CI(1.12,2.97)〕是非小细胞肺癌患者贝伐单抗相关性高血压的影响因素(P<0.05)。结论 贝伐单抗相关性高血压可延长结直肠癌和非小细胞肺癌患者总生存时间,可在一定程度上改善患者预后。
结直肠肿瘤;癌,非小细胞肺;贝伐单抗;高血压;预后
年亮,冯谢敏,卢喜.贝伐单抗相关性高血压对结直肠癌和非小细胞肺癌患者预后的影响研究[J].实用心脑肺血管病杂志,2016,24(11):44-48.[www.syxnf.net]
NIAN L,FENG X M,LU X.Impact of bevacizumab-induced hypertension on prognosis of colorectal cancer patients and non-small cell lung cancer patients[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2016,24(11):44-48.
贝伐单抗是一种人源化的治疗性单克隆抗体,可靶向结合血管内皮生长因子(vascular endothelial growth factor,VEGF),目前已广泛应用于转移性结直肠癌和局部晚期、复发性或转移性非小细胞肺癌等的治疗,但常诱发胃肠道穿孔、切口延迟愈合、大出血、动脉血栓、蛋白尿、感染和充血性心力衰竭等。高血压是贝伐单抗治疗结直肠癌和非小细胞肺癌最常见的不良反应,其发生率为11%~16%,临床常采用口服降压药物治疗高血压[1-2]。研究表明,贝伐单抗相关性血压的作用机制与一氧化氮(NO)有关,VEGF可促进NO合成,故抑制VEGF可减少NO;另外,NO是血管扩张剂,降低NO可导致血管收缩、减少Na+肾排泄,最终导致血压升高[3-6]。有研究表明,癌症患者出现的贝伐单抗相关性高血压可延长其无进展生存时间和总生存时间[7-10],但也研究表明,癌症患者出现贝伐单抗相关性高血压未改善患者临床效果和预后[11]。因此,贝伐单抗相关性高血压与癌症患者预后的关系尚不明确。本研究回顾性分析了于延安大学附属医院行贝伐单抗治疗的结直肠癌和非小细胞肺癌患者的临床资料,旨在探讨贝伐单抗相关性高血压对结直肠癌和非小细胞肺癌患者预后的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2010年3月—2016年3月于延安大学附属医院行贝伐单抗治疗的384例结直肠癌患者和384例非小细胞肺癌患者。纳入标准:晚期、转移或复发的非鳞状非小细胞肺癌和结直肠癌;排除标准:伴有咯血、肿瘤侵犯或毗邻大血管、有血栓或出血性疾病病史患者。
1.1.1 结直肠癌患者 结直肠癌患者中男207例,女177例;年龄32~85岁,中位年龄64岁;癌症分期:Ⅰ期4例,Ⅱ期38例,Ⅲ期135例,Ⅳ期207例;总生存时间21.0~33.2个月,中位总生存时间20.8个月;治疗时间1.0~55.2个月,中位治疗时间9.7个月;贝伐单抗治疗周期1~88个周期,中位贝伐单抗治疗周期11个周期;联合治疗方案:mFOLFOX-6 (奥沙利铂联合氟尿嘧啶、亚叶酸钙)135例(35.2%),XELOX (奥沙利铂联合卡培他滨)100例(26.0%),DeGramont (氟尿嘧啶、亚叶酸钙)85例(22.1%),FOLFIRI (伊利替康联合氟尿嘧啶、亚叶酸钙)64例(16.7%)。
1.1.2 非小细胞肺癌患者 非小细胞肺癌患者中男247例,女137例;年龄36~82岁,中位年龄65岁;癌症分期:Ⅰ期6例,Ⅱ期32例,Ⅲ期157例,Ⅳ期189例;总生存时间22.8~37.9个月,中位总生存时间24.6个月;治疗时间1.0~58.6个月,中位治疗时间8.5个月;贝伐单抗治疗周期1~41个周期,中位贝伐单抗治疗周期8个周期;联合治疗方案:贝伐单抗联合卡铂215例(56.0%),贝伐单抗联合培美曲塞115例(29.9%),贝伐单抗联合紫杉醇20例(5.2%),其他34例(8.9%)。有高血压病史患者于贝伐单抗治疗前服用降压药物控制血压;血压控制达标标准:舒张压<90 mm Hg(1 mm Hg=0.133 kPa),收缩压<140 mm Hg。本研究经医院伦理委员会审核批准。
1.2 方法 非小细胞肺癌患者给予贝伐单抗(瑞士罗氏公司生产,生产批号:10136082)15 mg/kg,1次/3周,同时予以标准化疗方案。结直肠癌患者采用贝伐单抗5 mg/kg行一线治疗,或贝伐单抗10 mg/kg、1次/2周行二线治疗,同时予以细胞毒性药物进行化疗。
通过全身CT断层扫描,并根据实体瘤疗效评价标准[12]对患者临床疗效进行评估。于每个治疗周期前测量患者血压,根据通用不良反应术语标准4.0版(CTCAE v4.0)[13]进行高血压分级:1级:患者出现短暂、无症状的血压升高,无需予以降压药物治疗;2级:贝伐单抗治疗期间患者出现复发、持续或症状明显的血压升高,需予以降压药物治疗;3级:与2级相比,需一种或多种降压药物维持治疗。

2 结果
2.1 高血压及其他不良反应发生情况 768例患者出现贝伐单抗相关性高血压188例(24.5%),其中结直肠癌患者出现贝伐单抗相关性高血压108例(28.1%),非小细胞肺癌患者出现贝伐单抗相关性高血压80例(20.8%)。
768例患者行贝伐单抗治疗后出现蛋白尿72例(9.4%)、出血18例(2.3%)、血栓栓塞9例(1.2%)、胃肠道穿孔5例(0.7%)。非小细胞肺癌患者致死性不良反应发生率为1.4%,结直肠癌患者致死性不良反应发生率为0.5%。
2.2 高血压分级与处理方法 结直肠癌患者出现1级贝伐单抗相关性高血压48例(44.5%),其中41例患者通过调节生活方式降压,7例患者采用口服硝苯地平缓释片(德国拜耳公司生产,生产批号:BAXXE)10mg/d降压;2级贝伐单抗相关性高血压35例(32.4%),其中33例患者口服硝苯地平缓释片10mg/d降压,2例患者口服培哚普利(法国施维雅药厂生产,生产批号:3230783)4mg/d降压;3级贝伐单抗相关性高血压25例(23.1%),其均有高血压病史,均通过口服硝苯地平缓释片10mg/d联合利尿剂(苏州立新制药有限公司生产,生产批号:20121201)25mg/d降压。
非小细胞肺癌患者出现1级贝伐单抗相关性高血压37例(46.3%),其中35例患者通过调节生活方式降压,2例患者通过口服硝苯地平缓释片10mg/d降压;2级贝伐单抗相关性高血压26例(32.5%),其中23例患者通过口服硝苯地平缓释片10mg/d降压,3例患者通过口服培哚普利4mg/d降压;3级贝伐单抗相关性高血压17例(21.2%),其均有高血压病史,均通过口服硝苯地平缓释片10mg/d联合利尿剂25mg/d降压。
2.3 生存分析 结直肠癌患者经贝伐单抗治疗5个周期后出现高血压;非小细胞肺癌患者经贝伐单抗治疗3个周期后出现高血压。绘制Kaplan-Meier生存曲线发现,结直肠癌患者中出现高血压者中位总生存时间为25.9个月,未出现高血压者为17.3个月,结直肠癌患者中出现高血压者较未出现高血压者更具生存优势(log-rankχ2=5.83,P<0.05,见图1)。非小细胞肺癌患者中出现高血压者中位总生存时间为28.5个月,未出现高血压者为23.2个月,非小细胞肺癌患者中出现高血压者较未出现高血压者更具生存优势(log-rankχ2=6.27,P<0.05,见图2)。
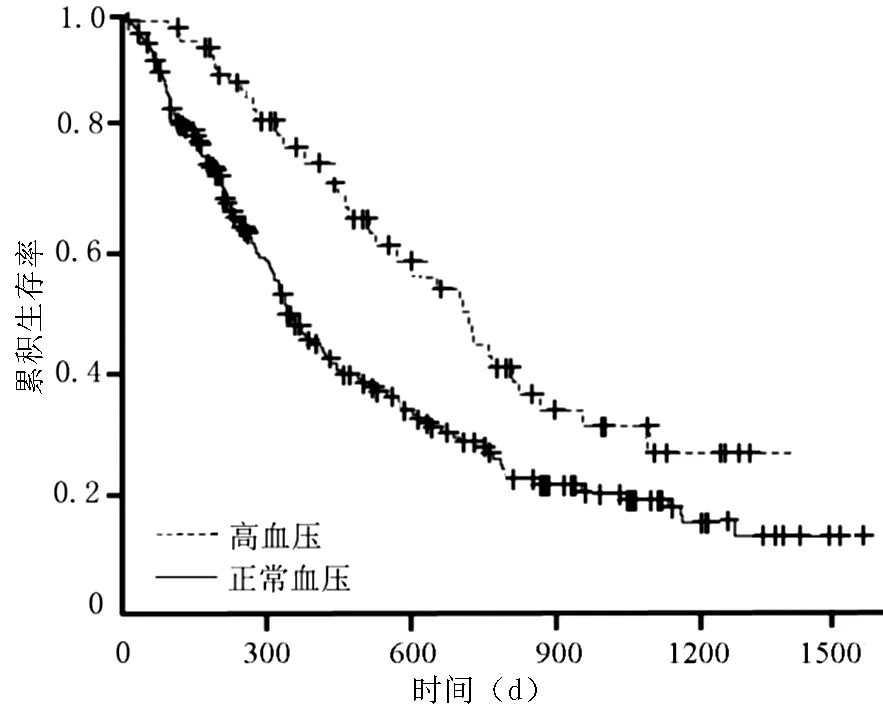
图1 结直肠癌中出现与未出现高血压患者生存曲线
Figure1Survivalcurveforcolorectalcancerpatientsappearedbevacizumab-inducedhypertensionornot

图2 非小细胞肺癌中出现与未出现高血压患者生存曲线
Figure 2 Survival curve for non-small cell lung cancer patients appeared bevacizumab-induced hypertension or not
2.4 多因素logistic回归分析 根据临床经验以年龄(赋值:<65岁=0,≥65岁=1)、性别(赋值:女=0,男=1)、贝伐单抗治疗周期(赋值:<10个周期=0,≥10个周期=1)、高血压病史(赋值:无=0,有=1)、贝伐单抗治疗时间(赋值:<6个月=0,≥6个月=1)、蛋白尿(赋值:无=0,有=1)为自变量,以贝伐单抗相关性高血压(赋值:无=0,有=1)为因变量进行多因素logistic回归分析,结果显示,贝伐单抗治疗时间是结直肠癌患者贝伐单抗相关性高血压的影响因素,贝伐单抗治疗周期是非小细胞肺癌患者贝伐单抗相关性高血压的影响因素(P<0.05,见表1~2)。
表1 结直肠癌患者贝伐单抗相关性高血压影响因素的多因素logistic回归分析
Table 1 Multivariate logistic regression analysis on influencing factors of bevacizumab-induced hypertension in colorectal cancer patients
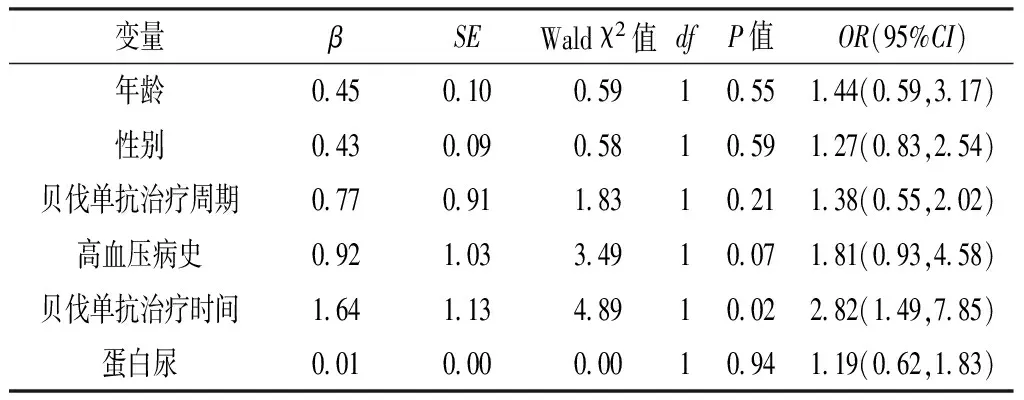
变量βSEWaldχ2值dfP值OR(95%CI)年龄0450100591055144(059,317)性别0430090581059127(083,254)贝伐单抗治疗周期0770911831021138(055,202)高血压病史0921033491007181(093,458)贝伐单抗治疗时间1641134891002282(149,785)蛋白尿0010000001094119(062,183)
表2 非小细胞肺癌患者贝伐单抗相关性高血压影响因素的多因素logistic回归分析
Table 2 Multivariate logistic regression analysis on influencing factors of bevacizumab-induced hypertension in non-small cell lung cancer patients
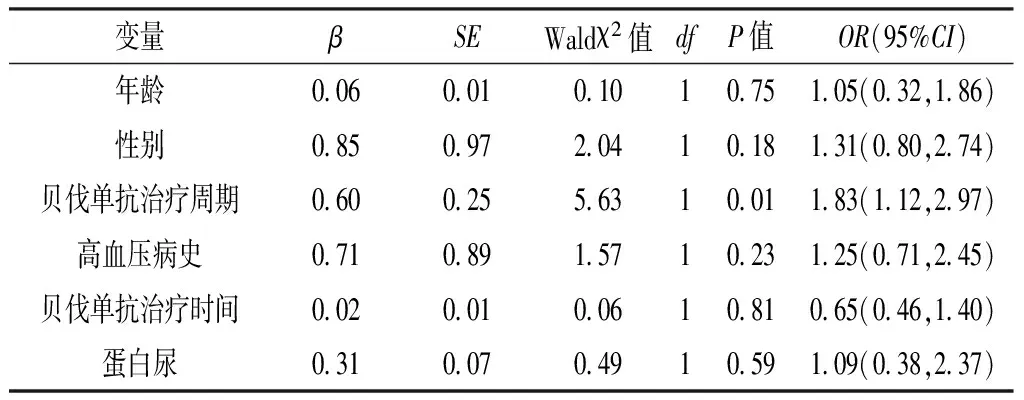
变量βSEWaldχ2值dfP值OR(95%CI)年龄0060010101075105(032,186)性别0850972041018131(080,274)贝伐单抗治疗周期0600255631001183(112,297)高血压病史0710891571023125(071,245)贝伐单抗治疗时间0020010061081065(046,140)蛋白尿0310070491059109(038,237)
3 讨论
贝伐单抗是获得美国食品药品监督管理局(FDA)批准的血管生成抑制剂,常作为转移性结直肠癌和局部晚期、复发或转移性非小细胞肺癌的一线治疗药物,但这种靶向性作用于血管生成信号通路的药物常引发高血压[1-2]。研究表明,贝伐单抗相关性高血压可能是癌症患者临床疗效的预测因子。
DAHLBERG等[7]研究表明,肺癌患者常于贝伐单抗治疗第1个月内出现高血压,且患者总生存时间延长,提示贝伐单抗性高血压是肺癌患者预后的预测因子。ÖSTERLUND等[9]研究表明,结直肠癌患者常于贝伐单抗治疗后3个月内出现高血压,且其是患者预后的影响因素。MIR等[14]研究表明,非小细胞肺癌、结直肠癌和卵巢癌患者常于贝伐单抗治疗早期(42 d)出现高血压,且可影响贝伐单抗治疗效果。本研究结果显示,结直肠癌和非小细胞肺癌患者采用贝伐单抗治疗后早期出现贝伐单抗相关性高血压,且出现贝伐单抗相关性高血压的患者总生存时间明显延长,提示早期出现贝伐单抗相关性高血压可能会在一定程度上改善结直肠癌和非小细胞肺癌患者预后。HURWITZ等[15]回顾性分析了转移性结直肠癌、乳腺癌、非小细胞肺癌、胰腺癌和肾细胞癌患者共6 486例,发现贝伐单抗治疗早期患者出现的贝伐单抗相关性高血压并未延长患者无进展生存时间和总生存时间,故贝伐单抗相关性高血压不能作为患者预后的影响因素。
本研究多因素logistic回归分析结果显示,贝伐单抗治疗时间是结直肠癌患者贝伐单抗相关性高血压的影响因素,贝伐单抗治疗周期是非小细胞肺癌患者贝伐单抗相关性高血压的影响因素。RECK等[16]研究表明,癌症患者长期接受贝伐单抗治疗会增加高血压发生风险。故贝伐单抗治疗周期或治疗时间可能是贝伐单抗相关性高血压的危险因素。
综上所述,贝伐单抗相关性高血压可延长结直肠癌和非小细胞肺癌患者总生存时间,可在一定程度上改善患者预后。但本研究为回顾性单中心研究,且研究终点为总生存时间,不是无进展生存时间,导致患者治疗反应的评价较模糊,且血压测量仅在医院进行,可能将高血压过度诊断的患者纳入本研究,造成一定偏倚,为了减少偏倚及客观条件等对研究结果的影响,在今后的研究中应改善血压测量方式,分析无进展生存时间。
作者贡献:年亮进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;冯谢敏、卢喜进行实验实施、评估、资料收集、质量控制及审校。
本文无利益冲突。
【延伸阅读】
贝伐单抗联合以铂为基础的化疗是晚期非鳞非小细胞肺癌(NSCLC)患者的一线标准治疗。日本九州大学医学科学研究院胸部疾病研究所的Isamu Okamoto等学者探讨了一线治疗后疾病进展的患者使用贝伐单抗的临床疗效,结果显示,经贝伐单抗和铂双药一线治疗后NSCLC患者使用多西他赛联合贝伐单抗可改善无进展生存期。但美国德克萨斯大学安德森癌症中心胸部/头颈部肿瘤学部的Irene Guijarro-Muoz等学者表示,贝伐单抗在治疗NSCLC中虽具有重要作用,但仍需要进一步研究探讨最佳用药方案。
[1]KAMBA T,MCDONALD D M.Mechanisms of adverse effects of anti-VEGF therapy for cancer[J].Br J Cancer,2007,96(12):1788-1795.
[2]YANG J C,HAWORTH L,SHERRY R M,et al.A randomized trial of bevacizumab,an anti-vascular endothelial growth factor antibody,for metastatic renal cancer[J].N Engl J Med,2003,349(5):427-434.
[3]VAN HEECKEREN W J,ORTIZ J,COONEY M M,et al.Hypertension,proteinuria,and antagonism of vascular endothelial growth factor signaling:clinical toxicity,therapeutic target,or novel biomarker?[J].J Clin Oncol,2007,25(21):2993-2995.
[4]MOURAD J J,DES GUETZ G,DEBBABI H,et al.Blood pressure rise following angiogenesis inhibition by bevacizumab.A crucial role for microcirculation[J].Ann Oncol,2008,19(5):927-934.
[5]SANE D C,ANTON L,BROSNIHAN K B.Angiogenic growth factors and hypertension[J].Angiogenesis,2004,7(3):193-201.
[6]HOROWITZ J R,RIVARD A,VAN DER ZEE R,et al.Vascular endothelial growth factor/vascular permeability factor produces nitric oxide-dependent hypotension.Evidence for a maintenance role in quiescent adult endothelium[J].Arterioscler Thromb Vasc Biol,1997,17(11):2793-2800.
[7]DAHLBERG S E,SANDLER A B,BRAHMER J R,et al.Clinical course of advanced non-small-cell lung cancer patients experiencing hypertension during treatment with bevacizumab in combination with carboplatin and paclitaxel on ECOG 4599[J].J Clin Oncol,2010,28(6):949-954.
[8]SCARTOZZI M,GALIZIA E,CHIORRINI S,et al.Arterial hypertension correlates with clinical outcome in colorectal cancer patients treated with first-line bevacizumab[J].Ann Oncol,2009,20(2):227-230.
[9]ÖSTERLUND P,SOVERI L M,ISONIEMI H,et al.Hypertension and overall survival in metastatic colorectal cancer patients treated with bevacizumab-containing chemotherapy[J].Br J Cancer,2011,104(4):599-604.
[10]DEWDNEY A,CUNNINGHAM D,BARBACHANO Y,et al.Correlation of bevacizumab-induced hypertension and outcome in the BOXER study,a phase II study of capecitabine,oxaliplatin (CAPOX) plus bevacizumab as peri-operative treatment in 45 patients with poor-risk colorectal liver-only metastases unsuitable for upfront resection[J].Br J Cancer,2012,106(11):1718-1721.
[11]RANPURA V,HAPANI S,WU S.Treatment-related mortality with bevacizumab in cancer patients:a meta-analysis[J].JAMA,2011,305(5):487-494.
[12]EISENHAUER E A,THERASSE P,BOGAERTS J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline (version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
[13]CAMPO R A,AGARWAL N,LASTAYO P C,et al.Levels of fatigue and distress in senior prostate cancer survivors enrolled in a 12-week randomized controlled trial of Qigong[J].J Cancer Surviv,2014,8(1):60-69.
[14]MIR O,CORIAT R,CABANES L,et al.An observational study of bevacizumab-induced hypertension as a clinical biomarker of antitumor activity[J].Oncologist,2011,16(9):1325-1332.
[15]HURWITZ H I,DOUGLAS P S,MIDDLETON J P,et al.Analysis of early hypertension and clinical outcome with bevacizumab:results from seven phase III studies[J].Oncologist,2013,18(3):273-280.
[16]RECK M,VON PAWEL J,ZATLOUKAL P,et al.Phase Ⅲ trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-small-cell lung cancer:AVAil[J].J Clin Oncol,2009,27(8):1227-1234.
(本文编辑:李洁晨)
Impact of Bevacizumab-induced Hypertension on Prognosis of Colorectal Cancer Patients and Non-small Cell Lung Cancer Patients
NIAN Liang,FENG Xie-min,LU Xi.
Department of Oncology,the Affiliated Hospital of Yan′an University,Yan′an 716000,China
Objective To investigate the impact of bevacizumab-induced hypertension on prognosis of colorectal cancer patients and non-small cell lung cancer patients.Methods A total of 384 colorectal cancer patients and 384 non-small cell lung cancer patients treated with bevacizumab were selected in the Affiliated Hospital of Yan′an University from March 2010 to March 2016,thereinto colorectal cancer patients received bevacizumab combined with cytotoxic drugs for chemotherapy,while non-small cell lung cancer patients received bevacizumab combined with standard chemotherapy.Incidence,grading and treatment of bevacizumab-inoluced hypertension,survival situation were recorded,and influencing factors of bevacizumab-inoluced hypertension were analyzed by multivariate logistic regression analysis.Results Of all the 768 patients,188 cases occurred bevacizumab-induced hypertension(accounting for 24.5%),including 108 cases in colorectal cancer patients(accounting for 28.1%)and 80 cases in non-small cell lung cancer patients(accounting for 20.8%).Of the colorectal cancer patients,48 cases occurred 1-grade bevacizumab-induced hypertension(accounting for 44.5%),35 cases occurred 2-grade bevacizumab-induced hypertension(accounting for 32.4%),25 cases occurred 3-grade bevacizumab-induced hypertension(accounting for 23.1%).Of the non-small cell lung cancer patients,37 cases occurred 1-grade bevacizumab-induced hypertension(accounting for 46.3%),26 cases occurred 2-grade bevacizumab-induced hypertension(accounting for 32.5%),17 cases occurred 3-grade bevacizumab-induced hypertension(accounting for 21.2%).Kaplan-Meier survival curve showed that,colorectal cancer patients appeared bevacizumab-induced hypertension had better survival advantage than those patients did not appear bevacizumab-induced hypertension,non-small cell lung cancer patients appeared bevacizumab-induced hypertension had better survival advantage than those patients did not appear bevacizumab-induced hypertension,too(P<0.05).Multivariate logistic regression analysis results showed that,treatment time of bevacizumab〔OR=2.82,95%CI(1.49,7.85)〕was the influencing factor of bevacizumab-induced hypertension in colorectal cancer patients,treatment cycle of bevacizumab〔OR=1.83,95%CI(1.12,2.97)〕was the influencing factors of bevacizumab-induced hypertension in non-small cell lung cancer patients(P<0.05).Conclusion Bevacizumab-induced hypertension can lengthen the overall survival of colorectal cancer patients and non-small cell lung cancer patients,improve the prognosis to some extent.
Colorectal neoplasms;Carcinoma,non-small-cell lung;Bevacizumab;Hypertension;Prognosis
716000陕西省延安市,延安大学附属医院肿瘤科(年亮,冯谢敏);新疆医科大学肿瘤医院胸腹放疗科(卢喜)
R 735.34 R 730.26
A
10.3969/j.issn.1008-5971.2016.11.012
2016-08-09;
2016-11-16)
