人源RAD9A基因真核表达载体的构建及其在肾癌细胞中的表达
2017-01-09陈怡香邱尧一
刘 杰,陈怡香,岳 虎,邱尧一,何 衎,喻 昕
(湖北理工学院 肾脏疾病发生与干预湖北省重点实验室,湖北 黄石 435003)
人源RAD9A基因真核表达载体的构建及其在肾癌细胞中的表达
刘 杰,陈怡香,岳 虎,邱尧一,何 衎,喻 昕
(湖北理工学院 肾脏疾病发生与干预湖北省重点实验室,湖北 黄石 435003)
构建人源细胞周期检测点蛋白RAD9A基因真核细胞表达载体, 转染至肾癌细胞786-0中,使EGFP-RAD9A融合蛋白得到高效表达。通过PCR法从293T细胞cDNA中扩增RAD9A基因编码区,经双酶切后连接入表达载体 pEGFP-N1多克隆位点,并对阳性重组子进行鉴定。将pEGFP-RAD9A转染至肾癌细胞786-0中,荧光显微镜观察GFP-RAD9A融合蛋白的表达及亚细胞定位, Western blot免疫印记法检测转染pEGFP-RAD9A后的肾癌细胞786-0中的融合蛋白。通过定向克隆的方法获得了含有RAD9A基因编码区的真核表达载体pEGFP-RAD9A。与对照组相比,转染pEGFP-RAD9A的肾癌786-0细胞中高效表达了EGFP-RAD9A融合蛋白,后者定位在786-0的细胞核。 构建的RAD9A基因重组真核表达载体能够在肾癌细胞786-0中高效表达,为研究RAD9A在肾癌发生发展中的作用奠定了基础。
周期检测点蛋白RAD9A;定向克隆;真核细胞表达载体;肾癌
人源RAD9A(RAD9 checkpoint clamp component A)基因定位于人染色体11q13.1~q13.2,是裂殖酵母RAD9的同源基因,作为细胞周期检测点蛋白对细胞周期阻滞和DNA损伤修复具有重要意义[1-3]。这种蛋白具有3'到5' 核酸外切酶活性,因此它的功能主要是切除和修复DNA损伤。在哺乳动物中,RAD9A在多种组织和器官中表达,在睾丸中表达量较高[4]。近期的研究表明,RAD9A基因是一种潜在的抑癌基因,在前列腺癌、睾丸癌等癌症中的表达下调,对乳腺癌以及儿童癌症患者二次罹癌风险也有重要意义[4-7]。将 RAD9A基因导入肿瘤细胞、建立高表达RAD9A蛋白的细胞株,是探讨 RAD9A基因作用机制的关键。因此,为了进一步探究RAD9A基因的生物学功能,考察它在肿瘤中的作用,我们通过聚合酶链式反应(PCR)的方法克隆了人源RAD9A基因,设计并构建了RAD9A-GFP真核表达载体,在肾癌细胞786-0中瞬时表达,以期为研究RAD9A在DNA损伤修复与肾癌的发生发展过程中的生物学功能奠定基础。
1 材料与方法
1.1 细胞、菌株及质粒
293T人胚肾细胞株(简称293T 细胞)、人肾癌细胞786-0(简称786-0细胞)购自武汉大学生命科学院细胞中心;感受态大肠杆菌 DH5α 购自天根生化科技有限公司;pEGFP-N1载体由本实验室保存。
1.2 主要试剂
Primer Star DNA聚合酶购自Takara公司、限制性内切酶 XhoⅠ和 HindⅢ、T4 DNA 连接酶均购自 fermentas公司;胶回收试剂盒、质粒小量提取试剂盒购自天根生化科技有限公司;Trizol 试剂、SuperScriptⅢ Re-verse Transciptase反转录酶、Lipofectamine 2000 均购自 Invitrogen 公司。
1.3 引物设计及合成
根据 NCBI 数据库(http://www.ncbi.nlm.nih.gov/)登录的 Homo sapiens RAD9A基因序列(NM_004584.2)设计 RAD9A特异性的PCR扩增引物,引物序列如下:①上游引物RAD9A-F: 5′-CCGCTCGAGATGCAGTCTTTCCTGTCT′ (下划线部分为 XhoⅠ酶切位点);②下游引物RAD9A-R:5′- CCCAAGCTTGCCTTCACCCTCACTGTC-3′ (下划线部分为HindⅢ酶切位点)。扩增片段大小为 1 173 bp。引物由苏州金唯智生物科技有限公司合成,规格为2O D。
1.4 293T细胞RNA的提取
取汇合度为90%~100%的293T细胞,去上清,PBS洗涤,加1 mL TRIZOL试剂消化3~5 min。转移细胞裂解液到1.5 mL EP管中,加氯仿0.2 mL ,剧烈震荡1 min。室温静置2~3 min,12 000 r/min, 4 ℃,15 min。取上清无色水相,加等体积的异丙醇,冰上沉淀10 min,12 000 r/min离心10 min。75%乙醇洗涤RNA沉淀,弃去上层清液。RNA沉淀用超纯水溶解,测OD值,并用琼脂糖凝胶检测RNA的完整性。
1.5 反转录合成cDNA
取0.5 mL EP管,加入总RNA 1~5 μg,Oligo(dT)1 μL,加适合量ddH2O,使总体积达11 μL。70 ℃热激10 min,冰浴3 min,加入下列试剂的混合物:10×PCR buffer 2 μL,25 mM MgCl22 μL,10mM dNTP mix 1μL,0.1 M DTT 2 μL,混匀后42 ℃温水浴2 h。
1.6 PCR扩增RAD9A基因的片段
以293T细胞 cDNA为模板,采用PCR 法获得RAD9A基因的蛋白质编码区DNA序列。PCR扩增条件为:94 ℃预变性 5 min ;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,重复39个循环。72 ℃延伸 5 min。1%琼脂糖凝胶电泳回收DNA产物。
1.7 pEGFP-N1-RAD9A真核表达载体构建及鉴定
对PCR回收产物和pEGFP-N1载体进行双酶切。根据载体上的多克隆位点和RAD9A基因内部的限制性内切酶位点的双向选择,选取XhoⅠ和 HindⅢ 进行酶切,酶切体系总体积20 μL:DNA片段5 μL,XhoⅠ酶1μL; HindⅢ 酶1 μL;Red buffer 2 μL;超纯水11 μL。酶切产物回收后经T4 DNA连接酶4 ℃过夜连接。 将连接产物转化到感受态大肠杆菌E.Coli.One Shot stbl3菌株中,涂布在含卡那霉素的LB固体培养基的平板中,37 ℃ 过夜培养。从平板中挑取10个重组转化子单菌落,用含卡那霉素的LB液体培养基小量摇菌, 之后进行菌液PCR实验验证。菌液PCR反应体系总体积为 20 μL:超纯水 12 μL;10×Taq Buffer 2 μL;2 mM dNTP Mix 2 μL;2 μM上游引物1 μL;2 μM下游引物1 μL;Taq DNA 酶1 μL;菌液模板1 μL。PCR 扩增条件:94 ℃预变性5 min ;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,重复28个循环。设立阴性对照组(空载质粒为模板)排除假阳性结果。菌液PCR产物经琼脂糖凝胶电泳检测之后挑取1个PCR阳性克隆送武汉擎科生物技术有限公司进行测序鉴定。测序结果与NCBI数据库(http://www.ncbi.nlm.nih.gov/)进行Blast比对。将测序正确的阳性克隆载体用去内毒素质粒中量抽提试剂盒抽提质粒,命名为pEGFP-RAD9A。
1.8 重组质粒转染肾癌786-0细胞 将pEGFP -RAD9A重组质粒和空载对照质粒(pEGFP-N1)分别转染肾癌786-0细胞。将肾癌786-0细胞接种于6孔板,置于37 ℃、5% CO2培养箱中培养,待细胞汇合度达到80%左右进行转染,转染前给细胞换成无血清培养基;将2 μg质粒与5 μL Lipofectamine 2 000转染试剂用无血清培养基混匀,室温静置20 min,滴加到每孔待转染的细胞当中,混匀,置于培养箱中培养;转染4~6 h后,吸走含转染试剂的培养基,加入含10%胎牛血清的培养基,继续培养。48 h后荧光显微镜下观察融合蛋白绿色荧光表达和定位情况。
1.9 Western blot检测786-0细胞中RAD9A的表达
收集转染后48 h的786-0细胞,加入裂解液抽提蛋白,BCA法进行蛋白定量。每个样品取20 μg进行SDS-聚丙烯酰胺凝胶电泳,经转膜、封闭后一抗4 ℃过夜孵育(GFP抗体和内参GAPDH抗体),之后用二抗室温杂交1 h,洗膜,ECL发光,最后进行胶片曝光、显影定影。
2 结果
2.1 RAD9A基因的克隆
从293T细胞中提取RNA,经琼脂糖凝胶电泳检测能观察到清晰的28SrRNA 和18SrRNA的条带,说明所提取的RNA质量较高。3组293T细胞总RNA的完整性如图1所示。所提取的RNA经过反转录反应得到了293T细胞的cDNA,以此cDNA为模板,通过PCR反应扩增出与NCBI数据库中人源RAD9A基因蛋白质编码区预期大小1 173 bp相符的特异条带,RAD9A基因PCR扩增的特异产物如图2所示。
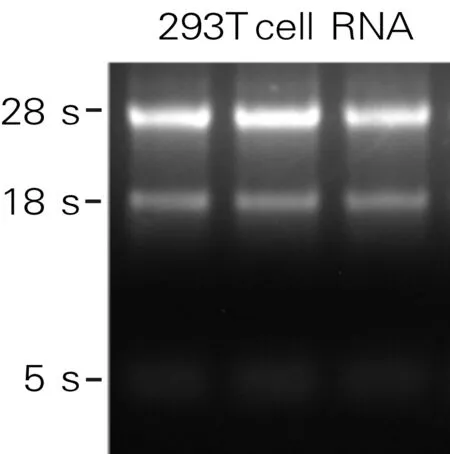
图1 3组293T细胞总RNA的完整性
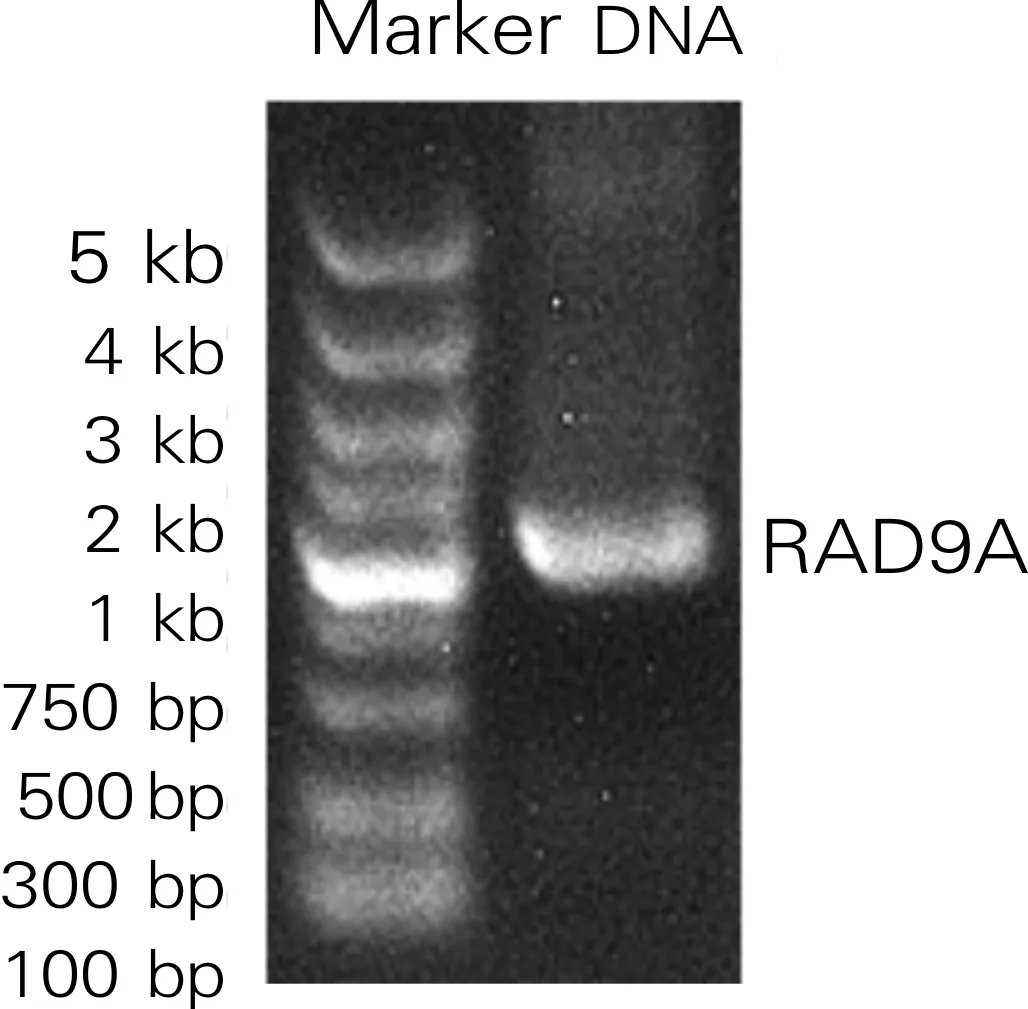
图2 RAD9A基因PCR扩增的特异产物
2.2 pEGFP-RAD9A真核表达载体成功构建
RAD9A基因的扩增产物经定向克隆的方法插入到pEGFP-N1载体中。通过菌液PCR验证,在10个重组转化子中有4个是阳性克隆,2,4,7,8号重组转化子可扩增出预期1 173 bp大小的条带,菌液PCR克隆鉴定结果如图3所示。提示在这4个阳性克隆的菌斑中,RAD9A基因已经成功地构建到表达载体当中。挑选2号重组子送测序,通过与NCBI上收录的RAD9A序列(NM_004584.2)进行比对分析后,与RAD9A基因编码序列完全一致。重组质粒pEGFP-RAD9A构建成功。

图3 菌液PCR克隆鉴定结果
2.3 肾癌786-0细胞中表达EGFP -RAD9A融合蛋白
在转染了真核表达载体pEGFP- N1对照质粒和pEGFP-RAD9A重组质粒的肾癌786-0细胞中,培养48 h后在荧光显微镜下观察到pEGFP-RAD9A融合蛋白的表达。pEGFP -RAD9A融合蛋白的荧光定位如图4所示。对照图4(a)和图4(b)可知,融合后的荧光蛋白主要在细胞核中表达,而在细胞质中则没有观察到明显的绿色荧光(见图4(b))。

图4 pEGFP -RAD9A融合蛋白的荧光定位
2.4 Western blot免疫印迹法检测786-0细胞中EGFP-RAD9A融合蛋白
真核表达载体pEGFP-N1对照质粒和pEGFP-RAD9A重组质粒分别转染786-0细胞后提取蛋白,用Western blot免疫印迹法检测pEGFP-RAD9A融合蛋白的表达。pEGFP -RAD9A融合蛋白的免疫印迹结果如图5所示。在图5中,内参蛋白GAPDH作为参照物,在转染了pEGFP-N1对照质粒的细胞中,可以在27 kD的位置检测到EGFP蛋白的特异性条带(见图5,第1泳道);在转染了pEGFP-RAD9A重组质粒的细胞中,观察到55~72 kD之间有一条很明显的特异性条带,其大小和RAD9A-GFP融合蛋白(32 kD+27 kD=59 kD)相符合(见图5,第2泳道),说明真核表达载体pEGFP-RAD9A转染细胞后的确显著增加了RAD9A蛋白的表达。

图5 pEGFP -RAD9A融合蛋白的免疫印迹结果 (*表示非特异条带)
3 讨论
DNA的损伤与修复(repair of DNA damage)是指DNA分子上碱基的改变,包括替换、插入、缺失等,导致DNA分子结构的改变之后对于已发生的损害而进行的修复机制。DNA损伤修复系统在维持体内的DNA结构完整和稳定性、肿瘤的发生、癌症的发生等重要方面占有举足轻重的地位。目前已经发现的人类遗传性疾病有4 000多种,其中多种遗传性疾病都与DNA修复缺陷有关。因此,DNA损伤与修复对人类遗传性疾病以及肿瘤的治疗具有重要意义。
RAD9A(RAD9 checkpoint clamp component A)是一种细胞周期检测点蛋白,具有3' 到5' 核酸外切酶活性,主要功能是切除和修复DNA损伤,对细胞周期阻滞和DNA损伤修复具有重要意义。它与Hus1和Rad1共同组成检测点夹复合体(Rad9-Hus1-Rad1 complex)被招募到DNA损伤位点,激活细胞周期检查点以调节细胞周期进程。Li T 等人通过细胞体外紫外暴露实验证明,RAD9A在核苷酸切除修复中发挥着重要作用, RAD9A缺失会导致紫外线的光化学产物6-4PP(6,4嘧啶嘧啶酮)和BPDE的清除受损。同时RAD9A缺失会导致紫外线诱导的核苷酸切除修复因子DDB2、XPC、DDB1、DDB2和XPB基因转录以及蛋白水平不同程度的下调[2]。而Tsai FL等研究则进一步证实RAD9A在DNA损伤修复过程中,促进了DNA末端切除,并防止异源末端的错误添加,保证了DNA损伤修复的正确性[3]。
Vivian Chan等人对乳腺癌的研究表明,与非肿瘤上皮细胞相比,RAD9A蛋白更多地累积在乳腺癌细胞的核内,且RAD9A蛋白过度磷酸化的形式能够减轻由于DNA损伤带来的基因组不稳定现象[6]。Weis E等人发现,儿童二次罹癌患者个体成纤维细胞中RAD9A的mRNA和蛋白水平均呈现下调,预示RAD9A以及其他细胞周期和DNA损伤蛋白对儿童癌症患者二次罹癌风险有重要意义[7]。尽管如此,但RAD9A基因在其他肿瘤例如肾癌中的表达情况、在肿瘤发生中的具体通路的功能以及在DNA损伤与细胞增殖和凋亡中的调节机制未完全阐明,因此将 RAD9A基因导入肿瘤细胞、建立表达RAD9A蛋白的786-0细胞株,对研究 RAD9A基因在肾癌中的作用机制十分重要。
pEGFP-N1是一类带有绿色荧光蛋白报告基因的真核细胞表达载体。与其他表达系统相比,pEGFP-N1载体带有强启动子PCMV和SV40,保证了外源基因在细胞中的高效表达;该载体可以随宿主细胞分裂时将外源基因遗传给新生的子细胞,保证了目的基因的稳定表达;其本身多携带优化的突变型GFP(pEGFP)产生的荧光较普通GFP强35倍,它与外源基因产生的融合蛋白性质稳定,在紫外线的激发下即可观察到绿色荧光,能够直观地检测外源基因的表达;同时,该载体具有neo基因,可以采用G418来筛选已成功转染了该载体的靶细胞。在本实验中,我们通过定向克隆的方法将人源RAD9A连接到真核表达载体 pEGFP-N1上,转染肾癌786-0细胞,观察pEGFP-RAD9A融合蛋白在细胞中的定位及表达情况。RAD9A蛋白的细胞定位与它的功能是相符合的,作为细胞周期监测点蛋白,RAD9A在细胞核发生DNA损伤时与Hus1和Rad1蛋白共同组成复合体被招募到损伤位点来参与细胞周期阻滞和DNA损伤修复。在对乳腺癌的研究中显示,与正常细胞相比,hRad9在2类细胞质中的表达没有差别,然而hRad9在癌细胞的细胞核中表达量显著升高[6]。在非小细胞肺癌NSCLC的细胞核中能检测到磷酸化形式的hRad9[8]。在本实验中,转染后的786-0细胞高效表达EGFP-RAD9A融合蛋白,为研究RAD9A在肾癌发生发展中的作用奠定了基础。EGFP-RAD9A融合蛋白主要在细胞核中表达,而在细胞质中没有观察到明显的荧光表达,提示RAD9A基因可能参与调控了肾癌的DNA损伤修复以及细胞周期进程。
[1] Lieberman H,Hopkins K,Nass M,et al.A human homolog of the Schizosaccharomyces pombe rad9+checkpoint control gene[J].Proceedings of the National Academy of Sciences,1996,93(24):13890-13895.
[2] Li T,Wang Z,Zhao Y,et al.Checkpoint protein Rad9 plays an important role in nucleotide excision repair[J].Dna Repair,2013,12(4):284-292.
[3] FL Tsai,Kai M.The checkpoint clamp protein Rad9 facilitates DNA-end resection and prevents alternative non-homologous end joining[J].Cell Cycle,2014,13(21):3460-3464.
[4] Hopkins KM,X Wang,Berlin A,et al.Expression of mammalian paralogues of HRAD9 and Mrad9 checkpoint control genes in normal and cancerous testicular tissue[J].Cancer Research,2003,63(17):5291-5298.
[5] Wang L,Hsu CL,Ni J,et al.Human checkpoint protein hRad9 functions as a negative coregulator to repress androgen receptor transactivation in prostate cancer cells[J].Molecular & Cellular Biology,2004,24:2202-2213.
[6] Chan V,Khoo US,Wong MS,et al.Localization of hRad9 in breast cancer[J].BMC Cancer,2008,8(1):196.
[7] Weis E,Schoen H,Victor A,et al.Reduced mRNA and protein expression of the genomic caretaker RAD9A in primary fibroblasts of individuals with childhood and independent second cancer[J].PLos One,2011,6(10):e25750.
[8] Maniwa Y,Yoshimura M,Bermudez VP,et al.Accumulation of hRad9 protein in the nuclei of nonsmall cell lung carcinoma cells[J].Cancer,2005,103(1):126-132.
(责任编辑 吴鸿霞)
Construction of Eukaryotic Expression Vector of Human RAD9A Gene and Its Expression in Renal Carcinoma Cell
LiuJie,ChenYixiang,YueHu,QiuYaoyi,HeKan,YuXin
(Hubei Key Laborary of Kidney Disease Pathogenesis and Intervention,Hubei Polytechnic University,Huangshi Hubei 435003)
Objective:to construct the human cell cycle checkpoint protein RAD9A gene in eukaryotic expression vector,transfect the plasmid into renal carcinoma cell line 786-0 and explore the high expression of EGFP-RAD9A fusion protein.Methods:Amplified RAD9A gene protein-coding region by PCR from of 293T cDNA.After restrictive enzyme digestion,this fragment was inserted into multiple clone site of pEGFP-N1 vector.Then the positive ecombinants were identified by PCR and DNA sequencing analysis.The plasmid pEGFP-RAD9A was transfected into renal carcinoma cell line 786-0 to explore the expression and subcellar localization of GFP-RAD9A fusion protein by fluorescence microscope.Then the Western blot was further used to detect the expression of GFP-RAD9A fusion protein in 786-0 cell.Results:recombinant eukaryotic expression vector pEGFP -RAD9A was obtained by directed cloning of RAD9A gene.Compared with the control group,the EGFP-RAD9A fusion protein expressed efficiently in transfected 786-0 cell line,and was identified in the nucleus of 786-0 cell.Conclusion:The eukaryotic expression vector pEGFP-RAD9A was successfully constructed and highly effective expressed in 786-0 cells,which can be used for the further research on the function of RAD9A gene in progression of renal cell carcinoma(RCC).
cell cycle checkpoint protein RAD9A;directed cloning;eukaryotic expression vector;renal cell carcinoma(RCC)
2016-09-27
湖北理工学院大学生科技创新项目(项目编号:201510920019);湖北理工学院人才引进项目(项目编号:16xjz08R);湖北省教育厅科学技术研究计划青年人才项目(项目编号:000713)。
刘杰,讲师,博士,研究方向:癌症发生的细胞分子机制。
10.3969/j.issn.2095-4565.2016.06.013
Q786
A
2095-4565(2016)06-0056-05
