氯丙醇分子印迹自组装胶束的制备及其电化学传感性能
2017-01-09黄雪雯赵鑫犇肖恬英刘晓亚
黄雪雯, 赵鑫犇, 肖恬英, 季 磊, 梁 雪, 刘晓亚
(江南大学食品胶体与生物技术教育部重点实验室,江苏 无锡 2142)
氯丙醇分子印迹自组装胶束的制备及其电化学传感性能
黄雪雯, 赵鑫犇, 肖恬英, 季 磊, 梁 雪, 刘晓亚
(江南大学食品胶体与生物技术教育部重点实验室,江苏 无锡 2142)
以双亲性无规聚合物和氯丙醇为组装基元,在选择性溶剂中制得氯丙醇分子印迹胶束,并将其电沉积在金电极表面得到分子印迹电化学传感器。采用Zeta电位及纳米粒度分析仪、透射电子显微镜表征了组装环境对形貌的影响。乳酸量、盐浓度和氯丙醇浓度对印迹胶束的组装行为有较大影响,当氯丙醇浓度为10-10~10-4mmol/L时制得的电化学传感器具有良好的线性响应。
自组装胶束; 氯丙醇; 电化学传感器
2005年,Science在专刊中提出21世纪急需解决的25个重大科学问题,其中与化学相关的唯一问题是“我们能够推动化学自组装走多远?”[1]。大分子自组装从最初的双亲性嵌段共聚物[2],逐步发展到如今的支化或无规等非嵌段不规则双亲大分子。随着对大分子自组装研究的深入,自组装新方法及组装体功能化越来越受到研究者关注。通过自组装方法得到的多尺度新物质、新功能材料以及新功能器件,在医药[3]、微反应器[4-5]、催化[6]、传感器[7-8]、光电器件[9]等领域展现出极其重要的应用价值。
分子印迹技术(MIT)是指以特定目标分子为模板,制备对该分子有特异选择性的聚合物的过程。通过大分子自组装方法实现分子印迹从根本上是指聚合物官能基元和模板分子通过非共价键相互作用,使聚合物交联成网络,除去模板分子后可以形成与模板分子大小、形状和化学位点互补的结合空穴[10]。该空穴可以特异性识别吸附模板分子。分子印迹聚合物(MIP)具有构效预定性、特定识别性、化学稳定性和可重复性等优点,因此在手性分离[11]、固相萃取[12]、生物传感器[13]和药物控制释放[14]等领域具有广泛应用前景。
通过双亲无规聚合物自组装制备基于水溶性模板分子的分子印迹聚合物胶束(MIPMs),并利用其在酸性或碱性条件下带电特性将其电沉积在基材表面形成电化学传感器的相关研究得到广泛关注[15-16]。所制得传感器对模板分子检测表现出较宽的线性范围、良好的选择性和重复性。电沉积技术可以通过控制沉积条件调控沉积膜的性能[17]。因此,带电大分子与模板分子通过弱相互作用形成具有分子识别性能的纳米复合材料,对于制备基于大分子自组装和电泳沉积工艺制造的电化学传感器是一种简单绿色的方法。
3-氯-1,2-丙二醇(3-MCPD)是在加工酸水解植物蛋白的过程中,通过盐酸和植物脂肪之间的水解和取代反应产生的一种氯丙醇类物质,广泛地存在于酱油等调味品中[18-19]。而3-MCPD有致癌性、生殖毒性、肾毒性等危害。采用分子印迹技术对3-MCPD实现微量检测具有重要意义[19],但其制备大多使用有毒原料及有机溶剂,因此限制了其应用。本文结合大分子自组装技术与分子印迹技术,以3-MCPD为模板分子,在选择性溶剂中诱导双亲性无规共聚物与3-MCPD自组装形成MIPMs。在此过程中,3-MCPD通过氢键等弱相互作用与聚合物形成络合物[20],以水为不良溶剂诱导其胶束化时,大量3-MCPD分子被聚合物包裹进胶束内部,由此完成印迹过程。同时,探讨了不同组装条件对MIPMs形貌的影响。最后利用电沉积技术[21],使MIPMs在金电极表面二次组装形成分子印迹膜,经紫外光辐射交联固定印迹膜中的识别位点,洗脱除去3-MCPD,得到选择性、灵敏性良好的3-MCPD分子印迹电化学传感器。
1 实验部分
1.1 主要原料
甲基丙烯酸二甲氨乙酯(DMA)、丙烯酸羟乙酯(HEA)、丙烯酸异辛酯(EHA)、苯乙烯(St)、异佛尔酮二异氰酸酯(IPDI)、二月桂酸二丁基锡(DBTDL)、2,6-二叔丁基对甲苯酚(DBHT)、偶氮二异丁腈(AIBN)、3-MCPD、2-氯-1,3-丙二醇(2-MCPD):分析纯,阿拉丁试剂(上海)有限公司;超纯水:18.2 MΩ/cm,通过NW Ultra-pure Water System(Heal Forece)制备;乳酸、乙二醇单丁醚、二苯甲酮、铁氰化钾、亚铁氰化钾、氯化钾、氯化钠、丙三醇:分析纯,国药集团化学试剂有限公司。
1.2 双亲性无规共聚物P(St-co-HEA-co-DMA-co-EHA)的合成
双亲性无规共聚物P(St-co-HEA-co-DMA-co-EHA)采用文献[16]报道的合成方法制备,合成路线如图1所示。其数均分子量(Mn)为5×104,玻璃化转变温度(Tg)为20.3 ℃。该聚合物组成比通过核磁氢谱确定得到n(DMA)∶n(HEA-g-IPDI prepolymer)∶n(EHA)∶n(St)=21.3∶18.6∶32.2∶27.9,其中以IPDI为桥梁引入双键的接枝率约为18.6%。
1.3 MIPMs的制备
以乙二醇丁醚为溶剂、二苯甲酮为光引发剂(质量分数3%),制备质量分数为10%的P(St-co-HEA-co-DMA-co-EHA)溶液。逐滴滴加0.5 mL不同质量浓度的3-MCPD水溶液,通过乳酸调节pH至酸性,搅拌过夜。加入2 mL超纯水诱导共聚物和3-MCPD形成MIPMs,将所得溶液反滴至7倍体积超纯水中固定胶束,密封保存备用。
1.4 电化学传感器的制备
将裸金电极用三氧化铝粉末抛光,经超纯水反复超声洗涤3次,以乳酸量为10 μL、3-MCPD质量浓度为0.1 g/mL条件下制备的MIPMs为沉积液,金电极为工作电极,通过控制电位电解(CPE)的方法进行电沉积,得到分子印迹膜,然后进行15 min紫外光照。用c(HNO3)=4 mol/L 的甲醇-水(甲醇与水的体积比2∶1)溶液洗脱模板分子,得到“MIP传感器”,晾干保存备用。
1.5 测试与表征
用美国安捷伦公司Agilent 1100凝胶渗透液相色谱仪测定聚合物的数均分子量,流动相为DMF,标样为聚苯乙烯。用德国布鲁克公司Bruker-DMX500核磁共振仪测试核磁谱图,溶剂为CDCl3,标样为TMS;用德国耐驰仪器制造有限公司204 F1差示扫描量热仪测试聚合物的玻璃化转变温度,升温速率为10 ℃/min,从-20 ℃到150 ℃进行两次扫描。用日本日立公司Hitachi S-4800型扫描电子显微镜观测沉积膜形貌。用日本电子公司EOLJEM-2100型透射显微镜观测胶束粒子形貌,加速电压为200 kV,为避免制样干燥过程中各因素对MIPMs形貌的影响,MIPMs经超纯水透析后进行制样。用美国布鲁克海文仪器公司ZetaPALS 型Zeta电位及纳米粒度分析仪测试胶束粒子的粒径和电位。用日本阿耐思特岩田株式会社UV-100D紫外光固化系统进行紫外光固化。用上海辰华CHI660电化学工作站进行控制电位电解(CPE)法、差示脉冲伏安(DPV)法、循环伏安(CV)法测试,其中CPE测试条件为沉积液温度25 ℃,控制电压-2 V,沉积时间2 min,响应时间0.5 ms;DPV测试在c(KCl)=0.1 mol/L、c(K3[Fe(CN)6])=2.5 mmol/L的3-MCPD溶液中进行,扫描范围-0.2~0.6 V,孵化时间5 min;CV测试在c(K3[Fe(CN)6])=10 mmol/L和c(KNO3)=0.4 mmol/L水溶液中进行,扫描范围-0.2~0.6 V,扫描速率100 mV/s,静置时间5 s。

图1 可光交联双亲性共聚物P(St-co-HEA-co-DMA-co-EHA)的合成路线Fig.1 Synthetic route of photo-crosslinkable amphiphilic copolymer P(St-co-HEA-co-DMA-co-EHA)
2 结果与讨论
2.1 MIPMs组装行为的研究
2.1.1 乳酸量对MIPMs的影响 P(St-co-HEA-co-DMA-co-EHA)含有氨基基团,改变印迹胶束溶液的pH将会影响氨基质子化平衡,即胶体粒子荷电平衡。聚合物最初溶解在乙二醇丁醚中,故采用有机酸调节其荷电平衡。未加入乳酸时,胶束溶液pH约为7.0,制备MIPMs过程中,通过改变加入乳酸量调节MIPMs质子化程度。乳酸加入量对MIPMs粒径的影响如图2所示,随着乳酸量的增加,粒径先减小后增大。这可能是因为当乳酸加入量较少时,氨基质子化程度较小,胶束表面疏水性较强,粒子间静电排斥作用较弱,粒径较大。当乳酸量增大时,由于胶束表面荷电量增加,疏水链段进一步收缩,粒子间静电排斥作用增大,从而使粒径减小[22]。随着乳酸量继续增加,胶束表面质子化程度较高,使得亲水性增大,粒子极度溶胀,粒径增大。图3为不同乳酸加入量制得的MIPMs的TEM图,可以看出胶束呈球形,当加入乳酸量为10 μL时,粒径最小,这与粒径表征相一致。由于较小粒径具有更大比表面积,从而存在更多识别位点,故后续研究采用乳酸加入量10 μL。

图2 乳酸用量对胶束粒径(a)及电位(b)的影响Fig.2 Diameters(a) and Zeta potentials(b) of MIPMs with different dosages of lactic acid
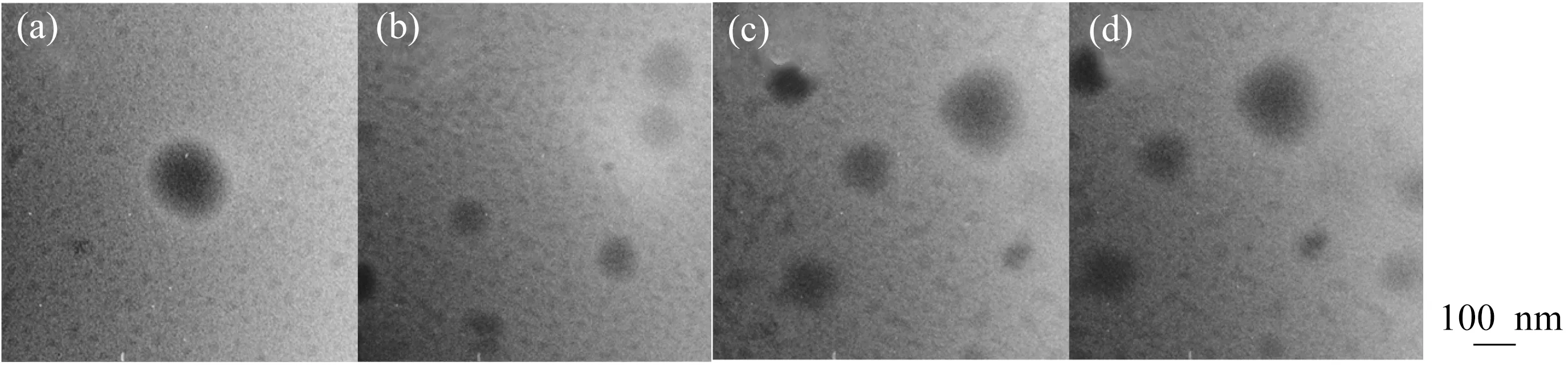
V(Lactic acid)/μL:a—5;b—10;c—15;d—20图3 不同乳酸加入量制得的MIPMs的TEM图Fig.3 TEM images of MIPMs with different dosages of lactic acid
2.1.2 3-MCPD质量浓度对MIPMs的影响

图4 3-MCPD质量浓度对胶束粒径的影响Fig.4 Diameters of MIPMs variety with different mass concentrations of 3-MCPD
3-MCPD含有羟基,可以与N、O等原子形成氢键。将一定质量浓度的3-MCPD水溶液滴加入聚合物溶液中,使其与聚合物通过氢键作用形成络合物,之后加入非溶剂水诱导络合物形成胶束,完成分子印迹过程。3-MCPD质量浓度对MIPMs胶束粒径的影响如图4所示。随着3-MCPD质量浓度增加,胶束粒径先减小后增大。这是因为低浓度3-MCPD的加入使其与聚合物形成氢键,聚合物链段紧缩,粒径减小;继续增加3-MCPD质量浓度,更多的模板分子与聚合物相互作用,使胶束粒径增大;当3-MCPD质量浓度较大时,胶束因粒径增大而发生聚并,甚至沉淀。图5为不同3-MCPD质量浓度制得的MIPMs的TEM图,可以看出胶束呈球形,当3-MCPD质量浓度为0.10 g/mL时粒径最小,这与粒径结果相一致,下文研究采用此浓度。

ρ(3-MCPD)/(g·mL-1):a—0.05;b—0.10;c—0.15;d—0.20图5 不同3-MCPD质量浓度制得的MIPMs的TEM图Fig.5 TEM images of MIPMs with different mass concentrations 3-MCPD
2.1.3 盐浓度对MIPMs的影响 由于MIPMs质子化带正电,故盐浓度会影响粒子在水溶液中的表面荷电量,从而影响胶束的表面亲疏水性。通常盐的存在会使聚合物链段上亲水基团的亲水性降低,疏水性基团更加疏水,因此盐的加入会影响粒子粒径[22]。盐浓度对MIPMs粒径及Zeta电位的影响如图6所示。随着胶束溶液盐浓度增加,粒子粒径呈减小趋势,这是因为盐的加入使聚合物链段疏水性增加,导致链段收缩,粒径减小。而Zeta电位先增大后降低,这可能是因为胶束粒子表面Zeta电荷是反离子和同离子共同吸附作用的结果,随着盐浓度的增加,在某种程度上反离子吸附位饱和后开始发生同离子吸附,使得Zeta电位随盐浓度的增加而增加。而在相对较高盐浓度条件下,胶束粒子不再发生离子吸附,其表面双电层被压缩,Zeta电位呈现下降趋势。图7为不同盐浓度下MIPMs的TEM图,可以看出胶束呈良好的球形形貌,这可能是盐的存在起到了保护作用,使胶束结构更为紧密不易发生坍塌或形变。
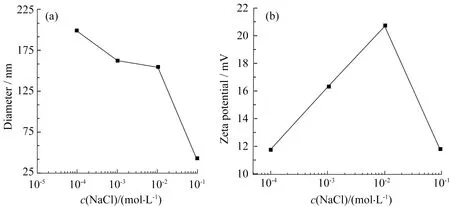
图6 氯化钠浓度对胶束粒径(a)及电位(b)的影响Fig.6 Diameters(a) and Zeta potentials(b) of MIPMs variety with different concentrations of NaCl
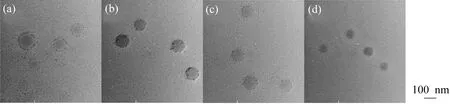
c(NaCl)/(mol·L-1):a—10-4;b—10-3;c—10-2;d—10-1图7 不同氯化钠浓度MIPMs的TEM图Fig.7 TEM images of MIPMs with different concentrations of NaCl
2.2 分子印迹膜的制备
图8为分子印迹电化学传感器在沉积过程中电流随时间的变化曲线。可以看出,沉积过程中电流随时间单调下降,30 s之后趋于稳定,表明分子印迹膜已经在电极表面形成。膜形成过程的SEM观察结果如图9所示。电沉积30 s之后,大量MIPMs沉积到电极表面,呈现粒子和膜两种形貌同时出现的过渡状态(图9(b));随着沉积时间延长,越来越多的MIPMs沉积到电极表面并逐渐形成MIP膜(图9(c))。沉积2 min后,如图9(d)所示,电极表面形成了一个连续的、具有一定粗糙度的分子印迹膜。粗糙表面带来的高比表面积更有利于目标分子的吸附富集。

图8 MIPMs的沉积曲线Fig.8 Current-time curve of MIPMs electrodeposition

t/s:a—0;b—30;c—60;d—120图9 分子印迹膜的SEM图Fig.9 SEM images of MIP film
将所得到的MIP膜通过紫外辐照交联,固定模板分子与聚合物的结合位点,得到分子印迹传感涂层。以K3[Fe(CN)6]为探针,研究其在不同电极表面的氧化还原过程。图10显示的是K3[Fe(CN)6]典型的循环伏安曲线,可以看出其在裸金电极上产生了一对峰形很好、几乎对称的氧化还原峰;而在分子印迹传感涂层上,K3[Fe(CN)6]的氧化还原峰消失,这说明在-2 V电压下沉积2 min后,MIPMs已经在金电极表面形成了致密的膜结构,阻碍了K3[Fe(CN)6]与金电极表面的直接接触;紫外光交联后,K3[Fe(CN)6]的氧化还原电流值进一步减小,说明紫外辐照可以有效地提高沉积膜致密程度,膜稳定性得以改善。之后通过洗脱液除去沉积膜中3-MCPD分子,得到可检测3-MCPD的电化学传感器。

图10 不同电极在铁氰化钾溶液中的循环伏安曲线Fig.10 CV voltammograms of different electrodes in K3[Fe(CN)6] solution
2.3 分子印迹传感器的检测性能
图11(a)为分子印迹电化学传感器在不同3-MCPD浓度下的检测曲线。可以看出,随着3-MCPD浓度升高,峰电流逐渐下降。这是因为3-MCPD重新结合后,在电极表面形成致密的分子印迹膜,抑制了铁氰化钾在电极表面的扩散[16]。其检测线性曲线如图11(b)所示,该电化学传感器对3-MCPD浓度响应的线性范围为10-10~10-4mmol/L,线性方程I=-0.242 2 lgc+0.254 2(相关系数R2=0.994 7)。在相同检测条件下,非印迹(NIP)对比电极的电流值对3-MCPD浓度几乎无响应。较宽的线性检测范围说明本文方法构筑的分子印迹膜引入了大量有效印迹位穴,同时这种基于电沉积的分子印迹聚合物胶束传感器具有良好的分子识别能力。

图11 分子印迹传感器的检测性能:(a)不同3-MCPD浓度下的峰电流;(b)对3-MCPD的检测线性曲线Fig.11 Detection performance of MIP sensor:(a) plots of peak currents as a function of the different concentrations of 3-MCPD;(b) the linear detection curves for 3-MCPD
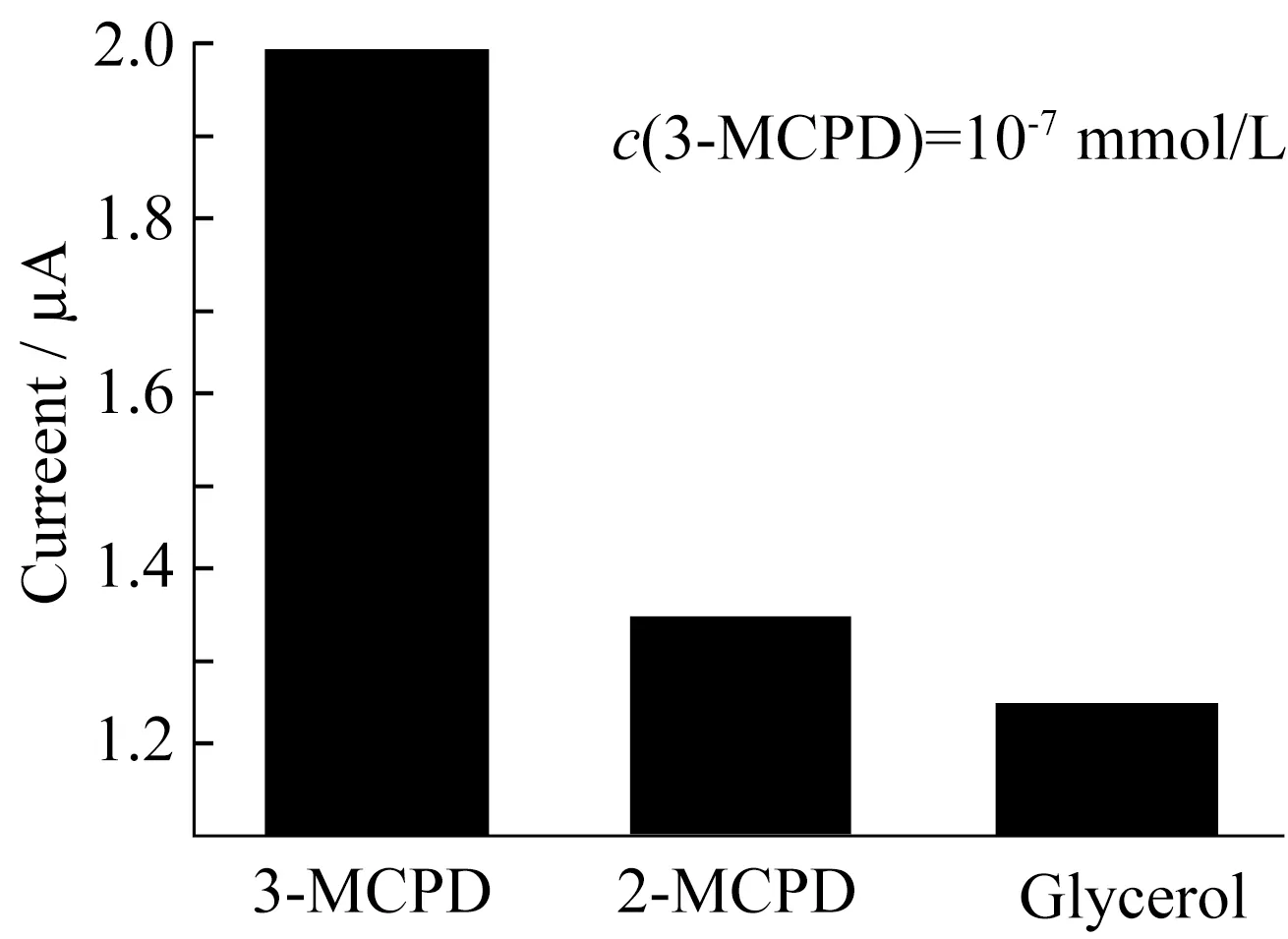
图12 分子印迹电化学传感器的响应电流Fig.12 Peak currents of MIP sensor
分子印迹电化学传感器的选择性,取决于模板分子和结合位点之间特异性的相互作用,这是评价传感器性能的重要因素。为考察传感器对3-MCPD的选择性,利用同一只传感器分别对浓度为10-7mmol/L的3-MCPD及其结构类似物丙三醇、2-MCPD进行DPV检测,结果如图12所示。可以看出传感器对3-MCPD响应最大,而对其他两种类似物响应较小。这是由于分子印迹膜中存在大量与3-MCPD分子尺寸及分子结构相匹配的三维空穴结合位点,能够实现特异性识别目标分子,具有良好的选择性。
3 结 论
利用大分子自组装技术和分子印迹技术,以3-MCPD为模板分子,制得分子印迹聚合物胶束。通过电沉积技术,将印迹胶束沉积到金电极表面,经紫外光交联后洗脱印迹分子形成分子印迹膜,得到可定量检测3-MCPD的分子印迹电化学传感器。该分子印迹电化学传感器对3-MCPD具有良好的选择性和较宽浓度的响应线性范围(10-10~10-4mmol/L)。
[1] SERVICE R F.How far can we push chemical self-assembly?[J].Science,2005,309(5731):95-95.
[2] 江明,艾森伯格 A,刘国军,等.大分子自组装[M].北京:科学出版社,2006:1-11.
[3] LIANG Gaolin,YANG Zhimou,ZHANG Rongjun,etal.Supramolecular hydrogel of aD-amino acid dipeptide for controlled drug releaseinvivo[J].Langmuir,2009,25(15):8419-8422.
[4] SIMONYAN A,GITSOV I.Linear-dendritic supramolecular complexes as nanoscale reaction vessels for “green” chemistry.Diels-Alder reactions between fullerene C60and polycyclic aromatic hydrocarbons in aqueous medium[J].Langmuir,2008,24(20):11431-11441.
[5] PORTERFIELD J P,NGUYEN T L,BARABAN J H,etal.Isomerization and fragmentation of cyclohexanone in a heated micro-reactor[J].Journal of Physical Chemistry A,2015,119(51):12635-12647.
[6] POLLINO J M,WECK M.Tandem catalysis and self-assembly:A one-pot approach to functionalized polymers[J].Organic Letters,2002,4(5):753-756.
[7] JUNG Y S,JUNG W,TULLER H L,etal.Nanowire conductive polymer gas sensor patterned using self-assembled block copolymer lithography[J].Nano Letters,2008,8(11):3776-3780.
[8] YUAN Wenjing,HUANG Liang,ZHOU Qinqin,etal.Ultrasensitive and selective nitrogen dioxide sensor based on self-assembled graphene/polymer composite nanofibers[J].Acs Applied Materials and Interfaces,2014,6(19):17003-17008.
[9] LI Hongguang,CHOI J,NAKANISHI T.Optoelectronic functional materials based on alkylated-π molecules:Self-assembled architectures and nonassembled liquids[J].Langmuir,2013,29(18):5394-5406.
[10] LIMA M M,VIEIRA A C,MARTINS I,etal.On-line restricted access molecularly imprinted solid phase extraction of ivermectin in meat samples followed by HPLC-UV analysis[J].Food Chemistry,2016,197(Pt A):7-13.
[11] KAO Changlong,CHEN Yanfu,HUANG P C,etal.A facile one-pot synthesis of L-DOPA imprinted silica nanospheres for chiral separation and in vitro controlled release[J].Rsc Advances,2015,5(20):15511-15517.
[12] PRIETO A,SCHRADER S,BAUER C.Synthesis of a molecularly imprinted polymer and its application for microextraction by packed sorbent for the determination of fluoroquinolone related compounds in water[J].Analytica Chimica Acta,2011,685(2):146-152.
[13] JIANG Hui,JIANG Donglei,SHAO Jingdong,etal.Magnetic molecularly imprinted polymer nanoparticles based electrochemical sensor for the measurement of gram-negative bacterial quorum signaling molecules(N-acyl-homoserine-lactones)[J].Biosensors and Bioelectronics,2016,75:411-416.
[14] 阚文涛.氟尿嘧啶印迹水凝胶作为药物缓释载体的研究[D].哈尔滨:哈尔滨工业大学,2011.
[15] ZHANG Rongli,XU Sheng,LUO Jing,etal.Molecularly imprinted photo-sensitive polyglutamic acid nanoparticles for electrochemical sensing of hemoglobin[J].Microchimica Acta,2015,182(1):175-183.
[16] YANG Yiqun,YI Chenglin,LUO Jing,etal.Glucose sensors based on electrodeposition of molecularly imprinted polymeric micelles:A novel strategy for MIP sensors[J].Biosensors and Bioelectronics,2011,26(5):2607-2612.
[17] SHI Xiaowen,TSAO C Y,YANG Xiaohua,etal.Electroaddressing of cell populations by co-deposition with calcium alginate hydrogels[J].Advanced Functional Materials,2009,19(13):2074-2080.
[18] 王悦宏.快速测定HVP和酱油中3-MCPD方法的研究与应用[D].长春:东北师范大学,2008.
[19] 张立娟.食品中3-氯-1,2-丙二醇的电化学检测及其毒性评价[D].江苏无锡:江南大学,2015.
[20] HABIBI N,KAMALY N,MEMIC A,etal.Self-assembled peptide-based nanostructures:Smart nanomaterials toward targeted drug delivery[J].Nano Today,2016,11(1):41-60.
[21] MEYER W L,LIU Yi,SHI Xiaowen,etal.Chitosan-coated wires:Conferring electrical properties to chitosan fibers[J].Biomacromolecules,2009,10(4):858-864.
[22] 张荣莉.基于γ-聚谷氨酸复合组装体系的传感涂层及其性能研究[D].江苏无锡:江南大学,2015.
Preparation and Electrochemical Sensing Properties of Chloropropanol Molecularly Imprinted Self-Assembled Micelle
HUANG Xue-wen, ZHAO Xin-ben, XIAO Tian-ying, JI Lei, LIANG Xue, LIU Xiao-ya
(Key Laboratory of Food Colloids and Biotechnology of Ministry of Education,Jiangnan University,Wuxi 214122,Jiangsu,China)
Chloropropanol molecularly imprinted micelles were prepared in a selective solvent,using amphiphilic random polymer and chloropropanol as assembly elements,and electrodeposited on the surface of a gold electrode to obtain the molecularly imprinted electrochemical sensor.The influences of different assembly environments (the amount of lactic acid,salt concentration,chloropropanol concentration) on their morphologies were measured by Zeta potential and nanometer particle size analyzer and transmission electron microscope.Results showed that the amount of lactic acid,salt concentration and chloropropanol concentration had a great effect on the assembly behavior of the imprinted micelles.The electrochemical sensor had a good linear response to chloropropanol concentration in the range of 10-10-10-4mmol/L.
self-assembled micelle; chloropropanol; electrochemical sensor
1008-9357(2016)04-0456-007
10.14133/j.cnki.1008-9357.2016.04.012
2016-05-31
国家级大学生创新创业训练计划(201510295038)
黄雪雯(1995-),女,浙江温州人,本科生,主要研究方向为自组装胶束应用。E-mail:hxwjnu@163.com
刘晓亚,E-mail: lxy@jiangnan.edu.cn
O63
