不同方法对苦瓜核糖体失活蛋白的PEG化学修饰后蛋白浓度测定的差异*
2017-01-07钟春燕何夏燕王复林金家贵
李 丹,肖 雪,钟春燕,王 颖,何夏燕,王复林,金家贵,孟 尧
成都医学院 检验医学院(成都 610500)
·论 著·
不同方法对苦瓜核糖体失活蛋白的PEG化学修饰后蛋白浓度测定的差异*
李 丹,肖 雪,钟春燕,王 颖,何夏燕,王复林,金家贵△,孟 尧△
成都医学院 检验医学院(成都 610500)
目的 探究PEG化学修饰对4种常用蛋白浓度测定方法的影响。方法 采用福林-酚试剂法(Lowry法)、二喹啉甲酸法(BCA法)、考马斯亮蓝法(Bradford法)和紫外分光光度法(UV法)分别测定样品中α-苦瓜素和抗人类免疫缺陷病毒植物蛋白MAP30经PEG修饰前、后的蛋白含量;并用Lowry法和BCA法对低浓度游离PEG修饰前、后的样品蛋白含量进行测定。结果 发现考马斯亮蓝不与样品发生颜色反应,PEG修饰后会使UV法测定值变大,Lowry法测定值略有变大,BCA法基本不受影响;低浓度的游离PEG对测定方法无影响,但高浓度的PEG会吸附Folin-酚,形成黄色絮状物。结论 PEG化学修饰对蛋白浓度测定方法影响最小的为BCA法,Lowry法最灵敏,Bradford法不适用;而PEG化学修饰会使UV法测定值增大20%~30%,可作为快速测定时的校准参考。
PEG化学修饰;苦瓜籽;核糖体失活蛋白;蛋白浓度测定
α-苦瓜素(Alpha-momorcharin, α-MMC)和抗人类免疫缺陷病毒植物蛋白MAP30(momordica anti-HIV protein, MAP30)都是从苦瓜中提取分离得到的核糖体失活蛋白(ribosome inactive protein, RIP),目前已有多篇研究[1-3]报道,上述两种蛋白均有较强的抗病毒和抗肿瘤效果,特别是抗HIV作用显著。目前这两种蛋白已成为抗肿瘤和抗病毒药物研发的热点。然而,在应用于临床时却发现其具有明显抗原性,且在体内半衰期很短。本课题组研究[4-7]发现,利用聚乙二醇(polyethylene glycol,PEG)化学修饰技术可较好解决上述问题。我们在后续的实验过程中还发现,利用PEG修饰蛋白质后,采取紫外分光光度法(UV法)快速测定蛋白含量,其值有显著增加,用福林-酚试剂法(Lowry法)测定时结果相当,且有时有黄色沉淀物析出,这对之后的实验结果判读有较大影响。本研究利用考马斯亮蓝法(Bradford法)和二喹啉甲酸法(BCA法)测定α-MMC和MAP30的浓度,并与UV法和Lowry法进行比较。
1 材料与方法
1.1 材料 Folin-酚试剂、考马斯亮蓝G250、2,2-联喹啉-4,4-二甲酸二钠(BCA)购自Sigma公司,总蛋白(BSA)标准品购自上海生物制品研究所;其他试剂均为国产分析纯。UNICOUV-2102PC型分光光度计(上海第三分析仪器厂)含石英材质微量比色皿。α-MMC和MAP30蛋白样品均由本实验室纯化,(mPEG)2-Lys-NHS(20 kDa)购于美国Shearwater Polymers公司。
1.2 方法
1.2.1 标准曲线的制作 UV法标准曲线制作:在1组干的样品管中,用0.9% NaCl将1 mg/mL的牛血清白蛋白(BSA)分别稀释至0.1、0.2、0.3、0.4、0.5 mg/mL。体积均为4 mL。用紫外可见分光光度计于280 nm处分别测定每一浓度的白蛋白溶液的吸光度值,以0.9% NaCl作为空白调基线,记录所得读数,作标准工作曲线。Bradford法标准曲线制作:先配制1 mg/mL的牛血清蛋白(BSA)母液,再往母液中加入磷酸缓冲液(PBS)配制1组浓度分别为1.0、0.8、0.6、0.4、0.2 mg/mL的BSA溶液,再将这组溶液稀释10倍,待用。另量取1 mL的PBS溶液(BSA溶液浓度为0 mg/mL)作对照试验。静置10 min后,测得这组BSA溶液的吸光度并绘制标准曲线。Lowry法标准曲线的制作:参考文献[8],在1组干的样品管中,分别加入0、0.1、0.2、0.4、0.6、0.8、1.0 mL标准蛋白质溶液(浓度为250 mg/ml)。用水补足到1.0 mL,然后每支试管加入5 mL试剂甲,在旋涡混合器上迅速混合,于室温(20~25 ℃)放置10 min。再逐管加入0.5 mL试剂乙(folin-酚试剂),同样立即混匀,然后在室温下放置30 min,以未加蛋白质溶液的第一支试管作为空白对照,于595 nm处测定各管中溶液的吸光度值。以蛋白质的量为横座标,吸光度值为纵座标,绘制出标准曲线。BCA法标准曲线制作:同上配制1、0.5、0.25、0.125、0.062 5、0.031 25、0.015 625 mg/mL共8个浓度的蛋白标准溶液,后按照参考文献[8]所述加入BCA工作液,根据测定值绘制标准曲线。
1.2.2 PEG修饰前、后蛋白含量测定 Lowry法,UV法,Bradford法以及BCA法操作参考文献[8]进行,分别以各自标准曲线求得蛋白浓度。为保证实验过程顺利进行并平行比较,本实验将Bradford法进行了稍许改变,即取0~500 μg/mL的样品100 μL加Bradford试剂2.5 mL,室温放置2 min,在595 nm波长处测定吸光度值。同样,BCA法和Lowry法也加入工作液2.5 mL。分别用4种方法测定α-MMC和MAP30修饰前和修饰后样品含量;然后把单个样品α-MMC等分为两份,一份用PEG修饰,另一份添加不含PEG的硼酸硼砂缓冲液(pH=8.4)作为对照,检测各自的蛋白含量;最后使用未活化的40 kDa PEG分子与α-MMC等浓度混合,探讨PEG修饰剂浓度对测定方法的影响。
1.2.3 不同浓度PEG修饰后蛋白含量测定 低浓度组蛋白浓度为5 mg/mL,PEG∶α-MMC=1∶1(质量比)和PEG∶MAP30=2∶1(质量比);高浓度组为α-MMC或MAP30蛋白浓度为5 mg/mL,PEG∶α-MMC=2∶1(质量比)和PEG∶MAP30=4∶1(质量比),50 mM的硼酸-硼砂缓冲液(pH 8.5),在室温下不断震摇反应1 h。分离结合物的方法采用SP-Sepharose离子交换层析柱结合Sepharcyl S-100分子筛凝胶层析柱的方法,获得的结合产物应用1.2.2所述方法进行蛋白含量测定。
2 结果
2.1 4种方法BSA标准曲线比较
4种方法所测数据均线性良好,差异主要体现在有效范围和灵敏度上,其中Lowry法标准曲线斜率最大,灵敏度最高,但测定范围窄,BCA法测定范围大,UV法灵敏度较低(表1和图1)。
2.2 PEG修饰前、后蛋白测定结果比较
Bradford法测定蛋白含量时,在PEG修饰前、后均未出现颜色变化,因此在595 nm波长处没有吸收峰;其他3种方法测定结果差异较小。PEG修饰后,其他3种方法的测定值均有所增加,其中UV法增加了32.7%,Lowry法增加了20.9%,BCA法增加了7.2%(表2和图2)。
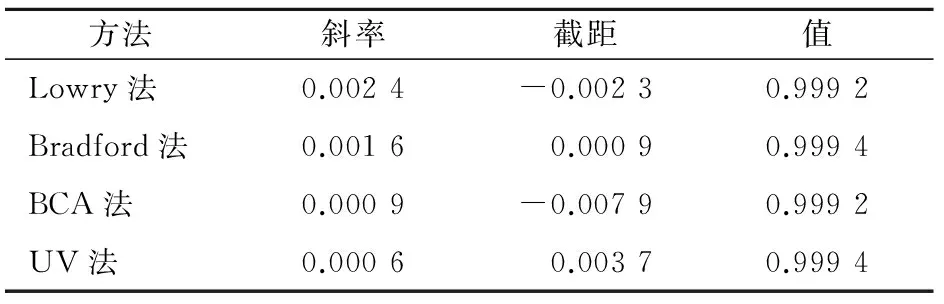
表1 4种方法BSA标准曲线比较
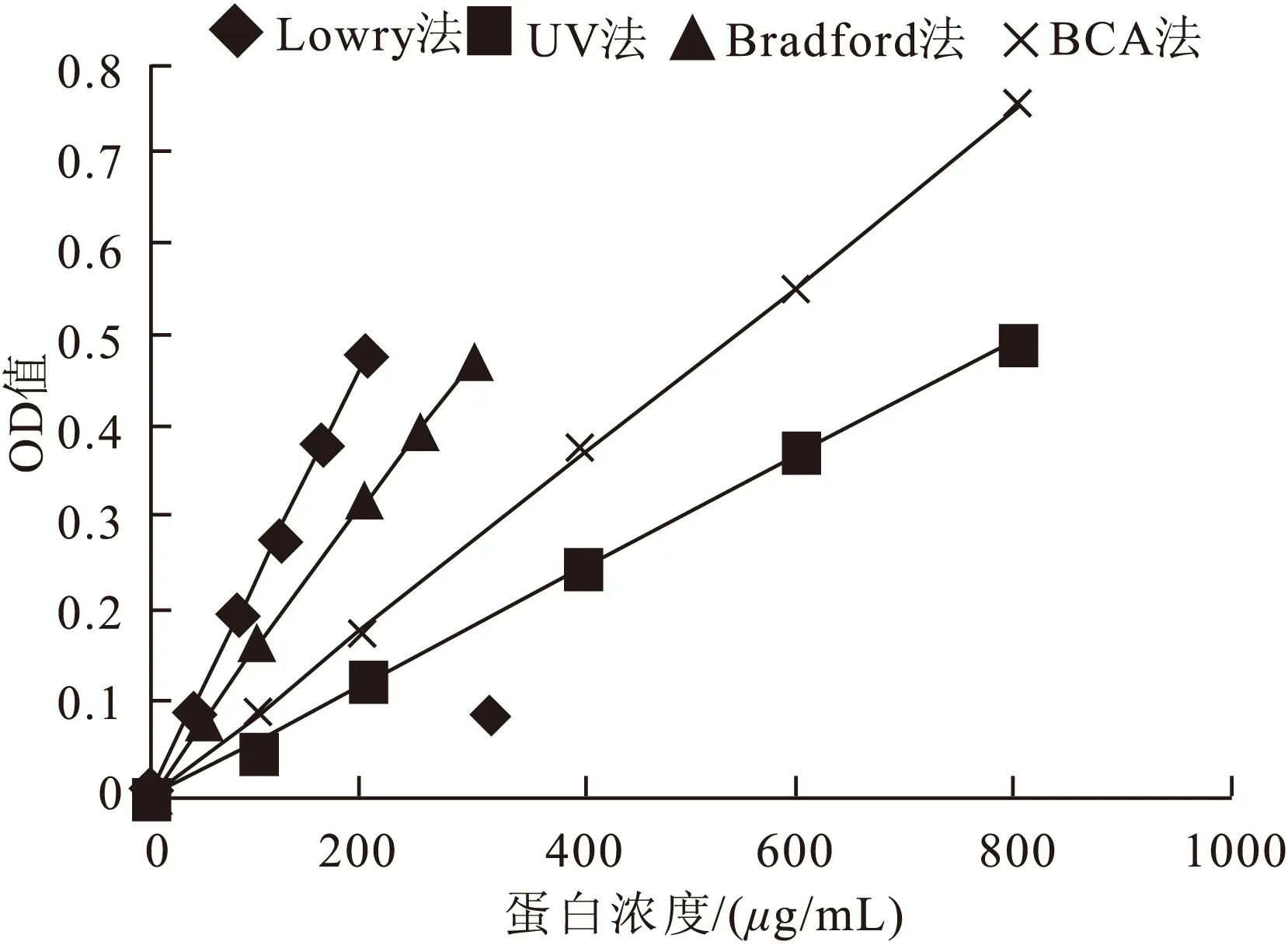
图1 4种方法BSA标准曲线

图2 α-MMC样品经PEG修饰前后蛋白测定结果比较
2.3 PEG修饰剂浓度对测定方法的影响
低浓度的游离PEG对测定方法没有影响(图3),但高浓度的游离PEG会吸附Folin-酚,形成黄色絮状沉淀,且此时BCA法的测定结果低于Lowry法。
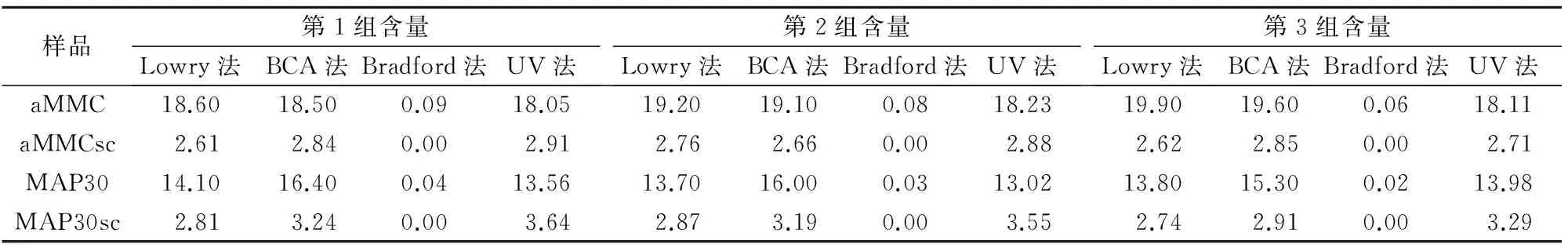
表2 4种样品含量测定结果比较(mg/mL)
注:α-MMC与MAP30为同一批次苦瓜籽提取的蛋白,α-MMCsc和MAP30sc是同一批经过PEG修饰的样品。

图3 PEG修饰剂浓度对测定方法的影响
3 讨论
Lowry法利用蛋白质与碱性硫酸铜作用形成铜-肽键络合物,后者与色氨酸和酪氨酸共同作用,使酚试剂中的磷钼酸和磷钨酸生成蓝色化合物[9];BCA法则利用蛋白质将Cu2+还原成Cu+,后者在碱性溶液中与BCA结合生成紫红色络合物;Bradford法属于染料结合法,即考马斯亮蓝G250在酸性溶液中显红棕色,与蛋白质中的碱性氨基酸以及芳香族氨基酸结合后转变为蓝色,颜色深浅与蛋白浓度呈正比。UV法则是利用芳香族氨基酸在280 nm处有最大吸收峰[10]。上述4种检测方法中,UV法操作简单且重复性好,Lowry法和BCA法次之。对于MAP30蛋白及其PEG修饰产物而言,BCA法测定值大于Lowry法,分析原因可能为MAP30蛋白与α-MMC蛋白在氨基酸组成上的差异所致。
此外,在蛋白质PEG修饰反应过程中,PEG分子结合到氨基酸上并释放一个羟基琥珀酰亚胺(hydroxysuccinimide, NHS)基团,该基团在紫外具有部分吸收峰,所以UV法测定时读数明显增加。在Lowry法测定中,Folin-酚试剂中的磷钼酸盐-磷钨酸盐被蛋白质中的酪氨酸和苯丙氨酸残基还原产生深蓝色混合物,在一定条件下颜色深度与蛋白质的量呈正比,而Folin-酚易被游离的PEG分子结合,从而影响蛋白质中酪氨酸和苯丙氨酸与Folin-酚试剂的结合,进而对Lowry法测定值造成一定影响。这些实验结果与之前学者关于PEG修饰HM-3测定蛋白含量的结果相一致[11-12],这说明无论哪种蛋白含量测定方法,其与蛋白质的空间结构均有密切关系,随PEG修饰剂分子量的增加及浓度的增高,所得浓度具有一定程度的变化,这在实验过程中需引起重视。由于PEG修饰反应并不是完全的,因此在反应后会存在一些游离的PEG分子,在一定程度上会对蛋白质测定造成影响,但本研究发现,低浓度的游离PEG对测定方法无影响。
综上所述,BCA法是4种方法中最稳定的一种,不受PEG修饰反应影响,但灵敏度不高,且BCA试剂较昂贵。Lowry法灵敏度高,试剂获取容易,但Folin-酚易被游离的PEG分子结合,在修饰程度不高时易造成较大误差。Bradford法不发生颜色变化,不适用于苦瓜籽蛋白含量的测定,但其不反应的原因还有待进一步探究。UV法是一种实验室快速检测蛋白含量的方法,但相比其他方法误差较大,且PEG反应产生的NHS基团会干扰测定,导致测定值有20%~30%的增加,同时NHS基团的多少取决于PEG修饰的程度。对于PEG修饰反应条件确定的实验流程,通过UV法与BCA方法的比较、受PEG修饰反应的影响情况可建立换算公式,对UV法进行校准,从而简化实验,提高实验效率。
[1]Lee-Huang S, Huang P L, Nara P L,etal.MAP 30: a new inhibitor of HIV-1 infection and replication[J]. FEBS Letters, 1990, 272(1-2): 12-18.
[2]Zheng Y T, Ben K L, Jin S W. Alpha-momorcharin inhibits HIV-1 replication in acutely but not chronically infected T-lymphocytes[J]. Acta Pharmacologica Sinica,1999, 20(3): 239-243.
[3]Fang F F, Zhang C Z, Wong J H,etal. The MAP30 Protein from bitter gourd (Momordicacharantia) seeds promotes apoptosis in liver cancer cells in vitro and in vivo[J]. Cancer Letters, 2012, 324(1): 66-74.
[4]Meng Y, Yao X, Wang S,etal. Preparation and identifica-tion of monoclonal antibody against alpha-momorcharins[J]. Journal of Biomedical Engineering, 2011, 28(6): 1181-1184.
[5]Meng Y, Liu S, Li J,etal. Preparation of an antitumor and antivirus agent: chemical modification of α-MMC and MAP30 from Momordica Charantia L. with covalent conjugation of polyethylene glycol[J]. Int J Nanomedicine, 2012, 7: 3133-3142.
[6]Meng Y, Lin S, Liu S,etal. A novel method for simultaneous production of two ribosome-inactivating proteins, α-MMC and MAP30, from Momordica charantia L[J]. PLoS One, 2014, 9(7): e101998.
[7]姜忠义, 高蓉, 许松伟, 等. 药物蛋白的聚乙二醇修饰[J]. 中国药学杂志, 2002, 37(6): 409-412.
[8]汪家政, 范明. 蛋白质技术手册[M]. 北京,科学出版社, 2000:38-54.
[9]Redmile-Gordon M A, Armenise E, White R P,etal. A comparison of two colorimetric assays, based upon Lowry and Bradford techniques, to estimate total protein in soil extracts[J]. Soil Biol Biochem, 2013, 67(100): 166-173.
[10] 李力, 郑意端. 蛋白药物聚乙二醇化技术的研究进展[J]. 中国临床药理学杂志, 2003, 19(3): 226-229.
[11] Zhu B, Xu H M, Zhao L,etal. Site-specific modification of antiangiogenesis peptide HM-3 by polyethylene glycol molec-ular weight of 20kDa[J]. The Journal of Biochemistry, 2010, 148(3): 341-347.
[12] Liu Z, Ren Y, Pan L,etal. In vivo anti-tumor activity of polypeptide HM-3 modified by different polyethylene glycols (PEG)[J]. Int J Mol Sci, 2011, 12(4): 2650-2663.
Different Methods of Determining Protein Concentration of Ribosome-Inactivating Proteins After PEG Chemical Modification
LiDan,XiaoXue,ZhongChunyan,WangYin,HeXiayan,WangFulin,JinJiagui△,MengYao△.
SchoolofMedicalLaboratoryScience,ChengduMedicalCollege,Chengdu610500,China
Objective To study the effect of PEG chemical modification of proteins on the 4 different methods of determining the protein concentration. Methods The determination methods including the Folin-phenol method, bicinchoninic acid method, Coomassie brilliant blue method and ultraviolet spectrophotometry method were adopted to determine the protein content of Alpha-momorcharin (α-MMC) and momordica anti-HIV protein (MAP30) before and after chemical modification, and the Folin-phenol method and bicinchoninic acid method were used to determine the protein content of the samples modified by low concentration of PEG. Results There was no color change in Coomassie brilliant blue method. The PEG modification enhanced the values evidently in the ultraviolet spectrophotometry method, but it had no effect in the bicinchoninic acid method. Low density of free PEG has no effect on the determination method, but high density of PEG absorbed Folin-Phenol reagent and resulted in yellow sediment. Conclusion The PEG chemical modification has the least effect on the Folin-phenol method which is the most sensitive method. The Coomassie brilliant blue method is ineffective in assaying the samples. The PEG chemical modification will make the values increase by 20%~30% in the ultraviolet spectrophotometry method, which can be used as the fastest method though its values need calibration.
PEG chemical modification; Bitter melon seed; Ribosome-inactivating protein; Protein concentration determination
http://www.cnki.net/kcms/detail/51.1705.R.20160728.1836.024.html
10.3969/j.issn.1674-2257.2016.06.011
国家大学生创新创业训练计划项目(No: 201413705 019);四川省大学生创新创业训练计划项目(No:201613705026)
R446.1
A
△通信作者:孟尧,E-mail:myaoworks@foxmail.com;金家贵,E-mail: jinjiagui2014@126.com
