兴仁金线莲中槲皮素、异鼠李素的薄层鉴别及不同部位的含量测定
2017-01-07刘志海范红梅
刘志海 范红梅 金 昭 隆 林 余 兰
黔西南州食品药品检验检测中心,贵州 兴义 562400
兴仁金线莲中槲皮素、异鼠李素的薄层鉴别及不同部位的含量测定
刘志海 范红梅 金 昭 隆 林 余 兰
黔西南州食品药品检验检测中心,贵州 兴义 562400
目的:建立兴仁金线莲的槲皮素、异鼠李素薄层鉴别及不同部位的含量测定方法。方法:采用薄层色谱法,以甲苯-甲酸乙酯-甲酸(10∶8∶1)为展开剂,用槲皮素、异鼠李素为对照品,建立其薄层鉴别方法;采用高效液相色谱法,Gemini-NX 5u C18 110A(250mm×4.6mm)色谱柱,以乙腈-0.4%磷酸溶液(30∶70)为流动相,在波长370nm处测定兴仁金线莲不同部位中的含量。结果:建立了兴仁金线莲TLC法,测定了兴仁金线莲不同部位槲皮素、异鼠李素含量,该两种成分主要富集中叶中,茎、根含量较微。结论:该薄层色谱法简便、专属性强,可用于兴仁金线莲的鉴别,含量测定方法灵敏、准确、稳定,可用于测定兴仁金线莲不同部位中的含量。
兴仁金线莲;薄层鉴别;槲皮素;异鼠李素;含量测定
兴仁金线莲(AnoectochilusxingrensisZ.H.Tsi et X.H.Jin)为兰科多年生草本植物的全草,2002年吉占和、金效华等在贵州兴仁等地发现并命名的新种[1]。该植物临床用于冶疗高血压、高血脂、糖尿病、肿瘤、肺结核咳血、重症肌无力肝炎、肾炎、小儿急惊风、风湿性及类风湿性关节炎、妇女白带以及毒蛇蛟伤等症。民间素有“药王”、“金草”、“神草”、“乌人参”等美称,是极其稀少的濒危药用植物[2]。目前野生兴仁金线莲资源日益匮乏,金线莲品种又较为复杂,同时金线莲作用民间习用药,价格昂贵,但由于金线莲尚未收入《中国药典》,缺乏统一的标准规范,急切需要科学的鉴别及定量方法对质量进行控制。因此本文应用TCL法,以槲皮素、异鼠李素为对照品,建立了其薄层鉴别方法,为兴仁金线莲的资源开发及质量评价提供参考;采用高效液相色谱法,测定了兴仁金线莲不同部位槲皮素、异鼠李素含量,叶中含量最高,茎、根中较低,以期为兴仁金线莲药材质量控制和开发利用提供一定的科学依据。
1 仪器与材料
1.1 仪器 Waters e2695型高效液相色谱仪,Empower色谱数据工作站;日本岛津AUY220电子天平(万分子一);赛多利斯CPA2250电子天平(十万分子一);电热恒温干燥箱(上海博讯实验有限公式医疗设备);预制硅胶G薄层板(青岛海洋化工厂分厂);ZF-2三用紫外仪(上海安亭仪器有限公司)。
1.2 材料 槲皮素(批号:10081-200907,含量为96.5%)、异鼠李素(批号:110860-201109,含量为99.0%)购自中国食品药品研究院;兴仁金线(Anoectochilus xingrensis Z.H.Tsi et X.H.Jin)、福建金线(Anoectochilus roxburghii)、台湾金线莲(Anoectochilus formosanus Hay)由兴义师范学院周丽教授提供,中科院昆明植物研究所彭华研究员鉴定。乙腈(色谱纯,德国默克,批号:1728130408)、水(娃哈哈,批号:1122QG),盐酸(西陇化工股份有限公司,批号:150426)、磷酸(成都金山化学试剂有限公司,批号:20120130)、乙醇(天津市福展化学试剂厂,批号:20141120)、甲醇(西陇化工股份有限公司,批号:150402)、甲苯(国营重庆无机化学试剂厂,批号:20040301)、甲酸乙酯(中国医药集团上海化学试剂公司,批号:20030102)、甲酸(西陇化工股份有限公司,批号:1405132)均为分析纯。
2 薄层色谱鉴别
2.1 供试品的制备 取本品粉末1g,加80%甲醇50mL,加热回流1h,放冷,滤过,滤液蒸干,残渣加水20mL使溶解,用乙醚振摇提取2次,每次20mL,弃去乙醚液,水液加盐酸5mL,加热回流1h,取出,立即冷却,用乙醚振摇提取2次,每次20mL,合并乙醚液,用水10mL洗涤,弃去水液,乙醚液用铺有适量无水硫酸钠的滤纸滤过,滤液挥干,残渣加乙醇lml使溶解,作为供试品溶液。
2.2 对照品溶液的制备 取槲皮素对照品、异鼠李素对照品,加乙醇制成每lmL各含 0.5mg 的溶液,作为对照品溶液。2.3 薄层色谱条件及薄层鉴别 将供试品及对照品溶液各10μL点于同一硅胶G板(已活化30min),置双槽展开缸中,饱和10min,以甲苯-甲酸乙酯-甲酸(10∶8∶1)为展开剂,展开(展距约8cm),取出,晾干,喷以3 %三氯化铝乙醇溶液,在 105°C 加热至斑点显色清晰,分别置日光和紫外光灯( 365nm) 下检视,薄层色谱图见图1。
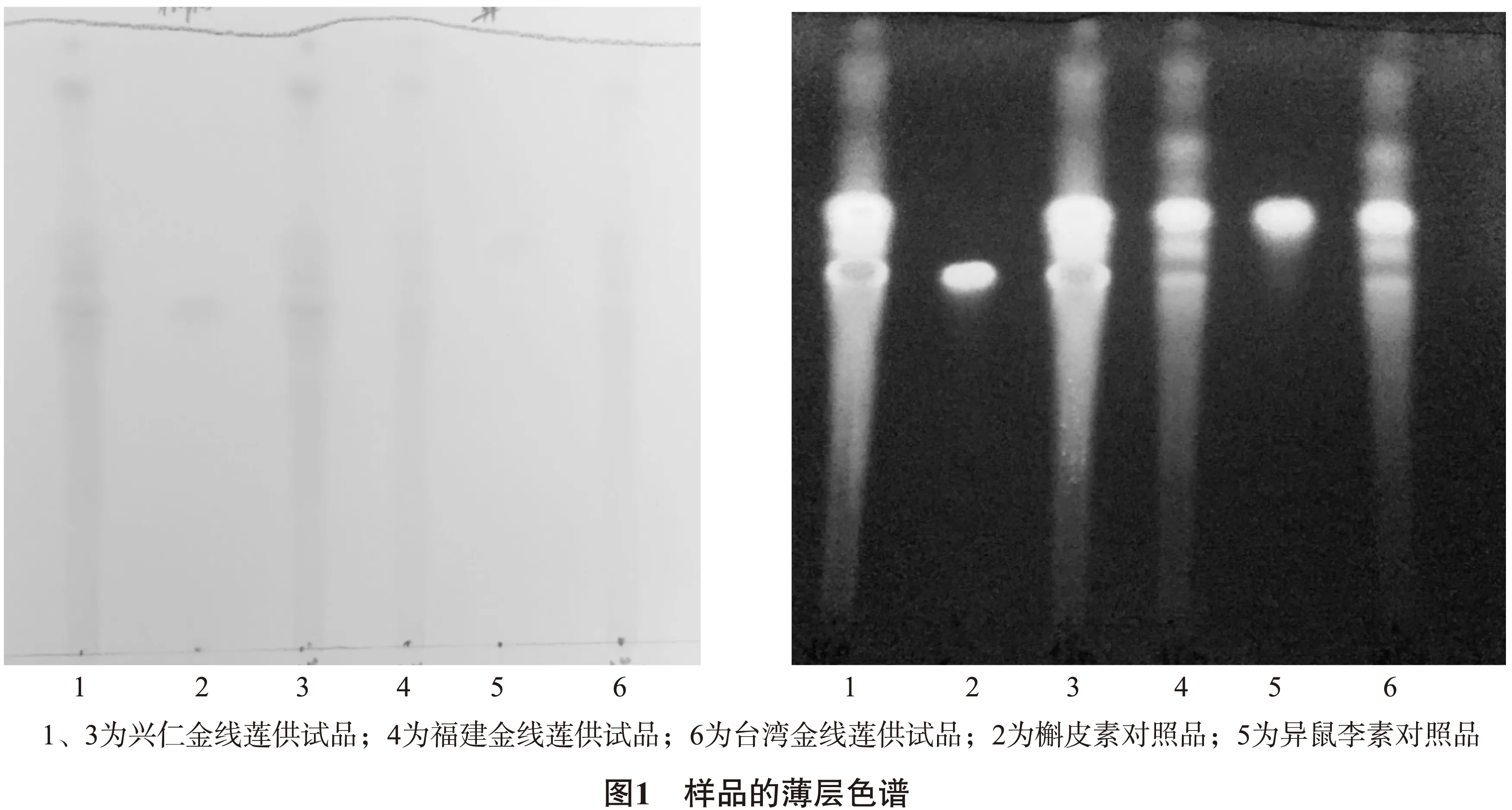
3 不同部位槲皮素、异鼠李素含量测定
3.1 色谱条件 Gemini-NX 5u C18 110A(250mm×4.6mm)色谱柱,以乙腈-0.4%磷酸溶液(30∶70)为流动相, 柱温:30℃;流速:1mL/min;进样量:10μL; 检测波长:370nm。

3.2 对照品溶液的制备 精密称取槲皮素对照品、异鼠李素对照品适量,加甲醇制成每1mL各含槲皮素12.18μg、异鼠李素10.62μg的混合对照溶液,对照品色谱图见图2。
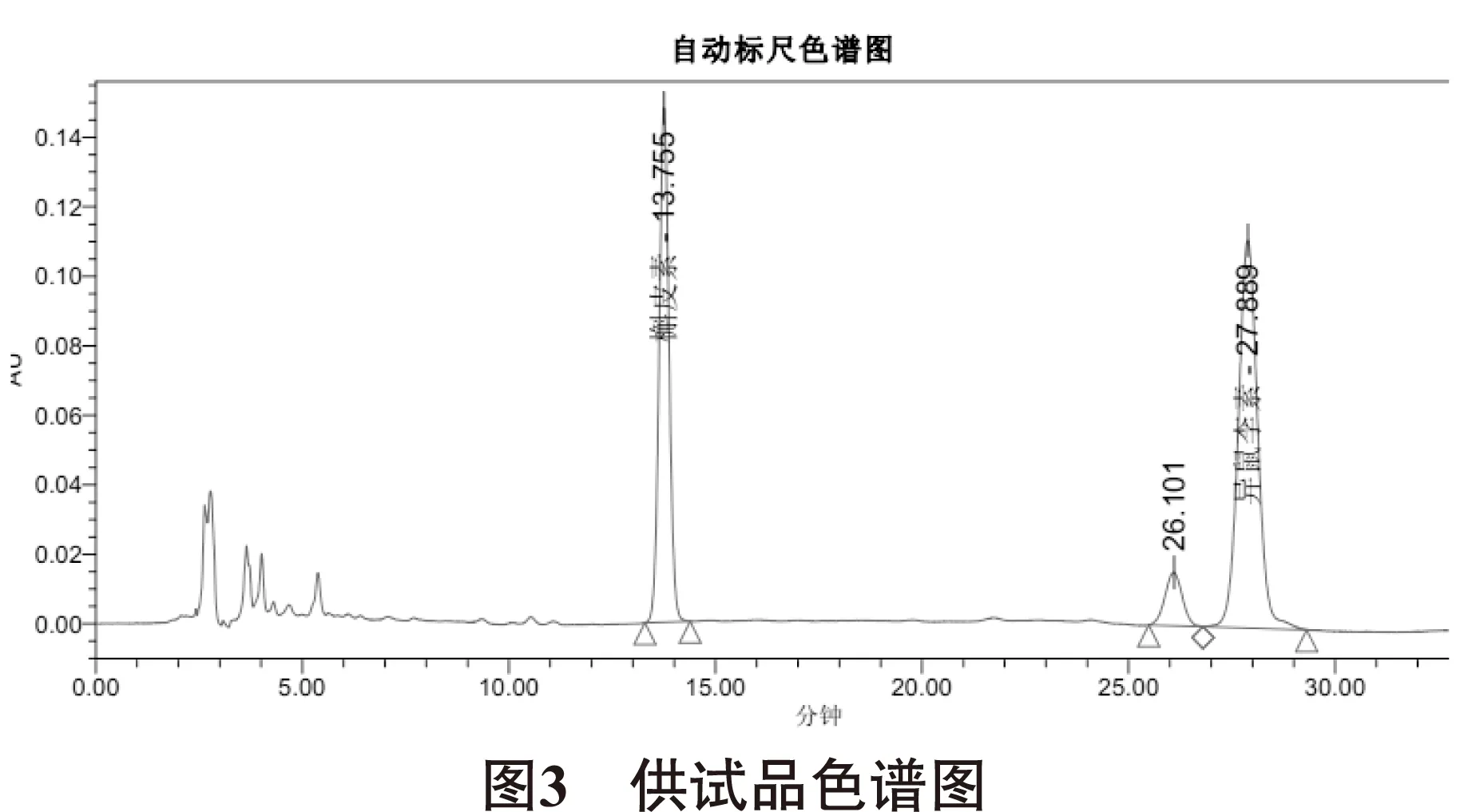
3.3 供试品溶液的制备 取兴仁金线莲药材不同部位粉末2g,精密称定,精密加入5%盐酸乙醇溶液50mL,称定重量,水浴加热回流2h,取出,放冷,用乙醇补足减失的重量,滤过,取续滤液,即得,所得色谱图见图3。
3.4 线性关系的考察 分别取上述槲皮素、异鼠李素对照品混合溶液2、5、10、20、25μL注入液相色谱仪,按3.1项下进行色谱分析,以对照品进样量为横坐标(X),峰面积为纵坐标(Y),计算回归方程,槲皮素为Y=37346X+2147,R=0.9999,异鼠李素为为Y=773056X+5446,R=0.9998,结果表明:槲皮素在2.436~30.45μg、异鼠李素在2.124~26.55μg范围内线性关系良好。3.5 精密度试验 精密吸混合对照品溶液10μL,连续进样6次,按“3.1”项下进行色谱分析,计算槲皮素RSD值为0.4%;异鼠李素RSD值0.3%。3.6 重复性试验 精密称取同一批兴仁金线莲粉末6份,按3.3操作,制备供试品溶液,按“3.1”项下进行色谱分析,计算其含量,结果槲皮素RSD值为1.7%,异鼠李素RSD值1.4%。
3.7 稳定性考察 取同一批兴仁金线莲供试品溶液,在0、2、4、8、12h,按“3.1”项下进行色谱分析,计算槲皮素峰面积RSD值为1.3%,异鼠李素峰面积RSD值为1.8%。
3.8 加样回收试验 精密称取已知含量的样品(批号:2013080905)兴仁金线莲药材6份,每份约1g,加入同等量的槲皮素、异鼠李素对照品,按“3.2”供试品的制备方法制备,“3.1”项下进行色谱分析,记录峰面积,计算回收率,槲皮素平均加样回收率为93.2%,异鼠李素平均加样回收率为95.3%。3.9 样品水分的测定 精密称定样品(不同部位)2g,置称量瓶中,打开瓶盖在105℃干燥5h,将瓶盖盖好,移置干燥器中,冷却30min,精密称定,再在上述温度干燥1h,冷却,称重,至连续两次称重的差异不超过5mg为止。根据减失的重量,计算供试品中含水量(%),结果见表1。
3.10 样品的测定 分别精密称取3批次的兴仁金线莲药材(不同部位,9批次)、1批台湾金线莲、1批福建金线莲,按“2.2”供试品的制备方法制备,“3.1”项下进行色谱分析,记录峰面积,计算槲皮素、异鼠李素含量(见表1)。

表1 样品不同部位含量测定表
4 讨论
本实验建立了兴仁金线莲薄层色谱鉴别,根据槲皮素、异鼠李素的化学性质,选择了预制硅胶G板、GF254板、及聚酰胺薄膜为展开载体,展开剂参考资料[3-4]选择乙醇-水(7∶3)、甲苯-甲酸乙酯-甲酸(10∶8∶1)、正己烷-乙酸乙酯-甲酸(7∶5∶0.8),提取方法参考了《中国药典》2015年版罗布麻叶[鉴别](3),经多次试验,最终选择硅胶G板为载体、甲苯-甲酸乙酯-甲酸(10∶8∶1)为展开剂、药典的水解萃取法为提取方法,该法提取简便、分离效果好、专属性强,该试验同时还收集了福建金线莲及台湾金线莲进行薄层比较实验,无显著差异,该薄层鉴别方法适用于其它金线莲品种。研究还参考文献[5]测定了兴仁金线莲不同部位的槲皮素、异鼠李素的含量,从表1可以看出不同部位的槲皮素、异鼠李素含量有显著差异,两种成分主要富集中叶中,茎、根中含量较微。
[1]金效华,吉占和,覃海宁,等. 贵州兰科植物增补[J].植物分类学报,2002,40(1):82-88.
[2] 隆林,范红梅,周丽.兴仁金线莲的HPLC指纹图谱研究[J]. 中国民族民间医药,2016,(4) :40-44.
[3] 刘亮,冯华,刘英波,等.黔产辣蓼中槲皮素的薄层鉴别与含量测定[J]. 贵州农业科学,2015,43(10) :191-194.
[4] 国家药典委员会.中华人民共和国药典(一部)[M]. 北京:中国医药科技出版社,2015:211.
[5] 隆林.高效液相色谱法测定兴仁金线莲中黄酮的含量[J]. 医药卫生,2015,(2): 86-87.
(编辑:梁志庆)
TLC Identification of Quercetin and Isorhamnetin of Anoectochilus xingrensis Z.H.Tsi et X.H.Jin and Content Determination in Different Parts
LIU Zhihai FAN Hongmei JIN Zhao LONG Lin YU Lan
Qianxinan Food and Drug Testing Center, Xiyi 562400,China
Object To establish the TLC identification method of quercetin and isorhamnetin in Anoectochilus xingrensis Z.H.Tsi et X.H.Jin and determined the content in different parts.Methods The TLC identification method is established by using toluene-ethhyl formate-formic acid (10∶8∶1) and taking quercetin and isorhamnetin as CK. The contents of quercetin and isorhamnetin in different parts of Anoectochilus xingrensis Z.H.Tsi et X.H.Jin were determined by HPLC under the conditions including chromatographic column of Gemini-NX 5u C18 110A (250mm×4.6mm),moving phase of acetonitrile-0.2% phosphate, and the detection wavelength at 370nm.Result The TLC identification method of Anoectochilus xingrensis Z.H.Tsi et X.H.Jin is established. It is determined that the contents of quercetin and isorhamnetin in different parts of Anoectochilus xingrensis Z.H.Tsi et X.H.Jin. The results shows the two components accumulated mainly in leaves, but little in stems and roots.Conclusion The method of TLC is convenient and highly specific, which could be used for identification Anoectochilus xingrensis. The content determination method is sensitive, accurate and stale, which could be used for the content determination in different parts of Anoectochilus xingrensis.
AnoectochilusxingrensisZ.H.Tsi et X.H.Jin; Thin Layer Chromatography; Quercetin; Isorhamnetin; Content Determination
2016-10-12
刘志海(1982-),男,本科,主管中药师,主要从事中药、中成药检检测工作,同时从事中药、中成药质量标准研究。E-mail:19889504@qq.com
R719
A
1007-8517(2016)24-0025-03
