酸性溶液中双子表面活性剂对金属锌的缓蚀性能
2017-01-06赵地顺李静静胡晶晶任培兵
刘 静,赵地顺,李静静,胡晶晶,任培兵,2
(1. 河北科技大学 化学与制药工程学院,石家庄 050018; 2. 石家庄焦化集团有限责任公司,石家庄 050031)
酸性溶液中双子表面活性剂对金属锌的缓蚀性能
刘 静1,赵地顺1,李静静1,胡晶晶1,任培兵1,2
(1. 河北科技大学 化学与制药工程学院,石家庄 050018; 2. 石家庄焦化集团有限责任公司,石家庄 050031)
采用失重法和电化学方法研究了双子表面活性剂在1 mol/L HCl溶液中对锌的缓蚀性能,通过对吸附热力学和腐蚀动力学参数的计算,探讨了缓蚀机理。结果表明:[C12-4-C12im]Br2在盐酸溶液中对锌具有较好的缓蚀作用,是一种混合型缓蚀剂。缓蚀率随着缓蚀剂加入量的增加而增大,随着温度的升高而减小。该缓蚀剂在锌表面的吸附符合Langmuir吸附等温式,吸附过程是自发的,同时兼有物理和化学吸附。
双子表面活性剂;缓蚀;吸附
锌在电化学序列中属于低电位两性金属,在中性介质中具有较高的稳定性,在酸性介质中会受到不同程度的腐蚀[1]。最初,对锌缓蚀剂的研究主要集中在无机缓蚀剂方面[2],但其对锌的缓蚀作用不理想,故研究重点转为有机缓蚀剂。研究发现,含膦化合物[3]、吡啶季铵盐[1]、吡唑衍生物[4]等在酸溶液中对锌有良好的缓蚀作用。锌用有机缓蚀剂根据结构可分为杂环化合物和表面活性剂[5]。
Gemini(双子)表面活性剂是一种新型表面活性剂,由于其独特的结构,与传统表面活性剂相比具有较高的表面活性,可有效降低水的表面张力,较低的临界胶束浓度等性能[6-8]。李俊等[9]介绍了Gemini表面活性剂在金属防腐蚀方面的研究。本工作合成了一种双子Gemini表面活性剂 [C12-4-C12im]Br2,通过失重法和电化学方法研究了其在1 mol/L HCl溶液中对锌的缓蚀作用,探讨了其在锌表面的吸附行为,并对吸附热力学和腐蚀动力学进行分析计算。
1 试验
1.1 [C12-4-C12im]Br2的合成
在250 mL的三口瓶中加入0.1 mol NaBr和30 mL四氢呋喃,室温下充分溶解,分批加入0.12 mol咪唑,不断搅拌直至无气体生成。在氮气保护下,缓慢滴加0.05 mol 1,4-二溴丁烷,在65 ℃下回流搅拌12 h。趁热过滤出NaBr,并用四氢呋喃洗涤。滤液经旋蒸后用蒸馏水重结晶,干燥后得到白色固体。取上述产物溶解在35 mL乙腈中,缓慢滴加0.1 mol 1-溴代十二烷,在80 ℃下反应42 h,氮气保护。反应结束后旋蒸,产品溶解在丙酮中,静置出现白色晶体,重结晶5次后真空干燥,得白色固体,即为目标产物[C12-4-C12im]Br2[10-12]。
1.2 失重试验
锌片尺寸为20 mm×20 mm×1 mm,用砂纸抛光,依次用丙酮、去离子水、乙醇洗涤,烘干后称量。在298.15~328.15 K条件下置入含有不同量[C12-4-C12im]Br2的100 mL的1 mol/L HCl中浸泡6 h。取出后依次用蒸馏水、丙酮、乙醇洗涤,烘干后称量。每个试验重复测定3次。根据式(1)和式(2)[13]分别计算腐蚀速率v和缓蚀率η。
式中:m1和m2分别为锌片在溶液中浸泡前、后的质量;S为锌片的表面积;t为浸泡时间;vcorr和vcorr(inh)为锌片浸泡在不含缓蚀剂和加有缓蚀剂溶液中的腐蚀速率。
1.3 电化学方法
电化学试验采用传统的三电极体系。试验温度为298.15 K,参比电极为饱和甘汞电极(SCE),辅助电极为铂电极,工作电极为锌电极,文中电位若无特指,均相对于SCE。锌电极按照失重法处理,工作面积为0.5 cm2,除工作面积外用环氧树脂将锌片与铜线密封。极化曲线扫描速率为0.01 V/s,扫描范围-1.6~-0.6 V(相对于开路电位)。电化学阻抗谱频率范围为10-1~105Hz,交流信号幅值为5 mV。
2 结果与讨论
2.1 [C12-4-C12im]Br2结构表征
由图1可见,3 140 cm-1附近为咪唑环上C-H伸缩振动峰;2 952,2 820 cm-1附近为甲基、亚甲基伸缩振动峰;1 595 cm-1附近为咪唑环中-C=N-伸缩振动峰;1 477 cm-1附近为亚甲基上C-H弯曲振动峰;1 192 cm-1附近为咪唑环上C-H弯曲振动峰。1H-NMR(500 MHz,CDCl3)δH:10.281(s,2H),8.108(d,2H.j=6.0Hz),7.277(d,2H,j=9.5Hz),4.601(s,4H),4.268(t,4H,j=19.5Hz),2.212(s,4H),1.903(m,4H),1.326(m,36H),0.890 (t,6H,j=16.5Hz)。通过分析IR和1H-NMR谱图数据[14],可知合成产物即为目标产物。
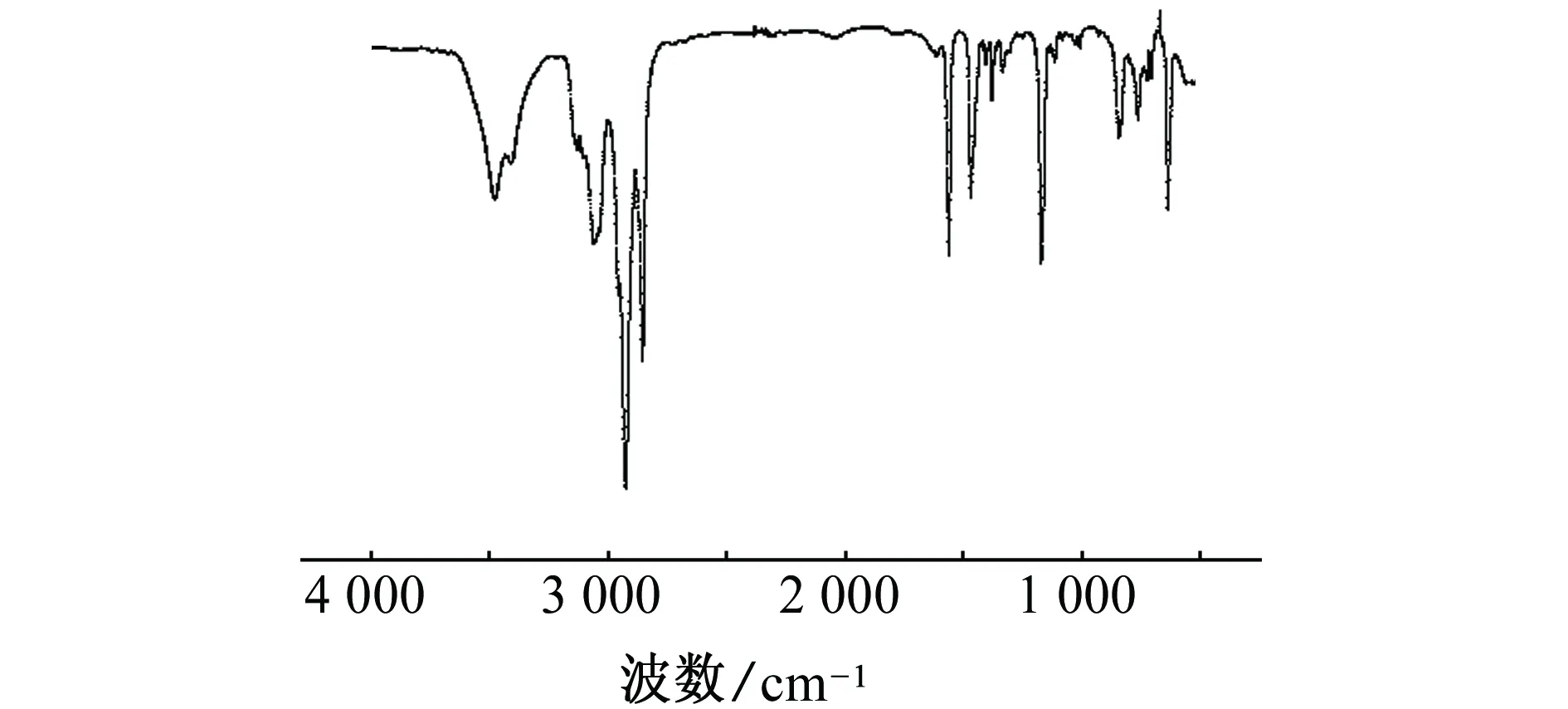
图1 [C12-4-C12im]Br2的红外谱图Fig. 1 IR spectra of [C12-4-C12im]Br2
2.2 失重法
由表1和表2可见,在1 mol/LHCl溶液中添加不同浓度的[C12-4-C12im]Br2对锌片具有良好的缓蚀作用。随着[C12-4-C12im]Br2浓度的增加,锌片的腐蚀速率下降,缓蚀率增大。这是因为[C12-4-C12im]Br2吸附在锌片表面,形成保护层,阻止了锌片与腐蚀介质的接触,随着[C12-4-C12im]Br2浓度的增加,形成的保护层更加紧密,可以更有效地保护锌片。但是当缓蚀剂浓度为5×10-4mol/L时,继续增加其浓度,缓蚀率变化不大,有可能是咪唑类双子表面活性剂在溶液中形成胶束,影响其缓蚀效率[15]。随着腐蚀介质温度的升高,吸附在锌片表面的[C12-4-C12im]Br2分子会发生脱落,缓蚀率逐渐下降。
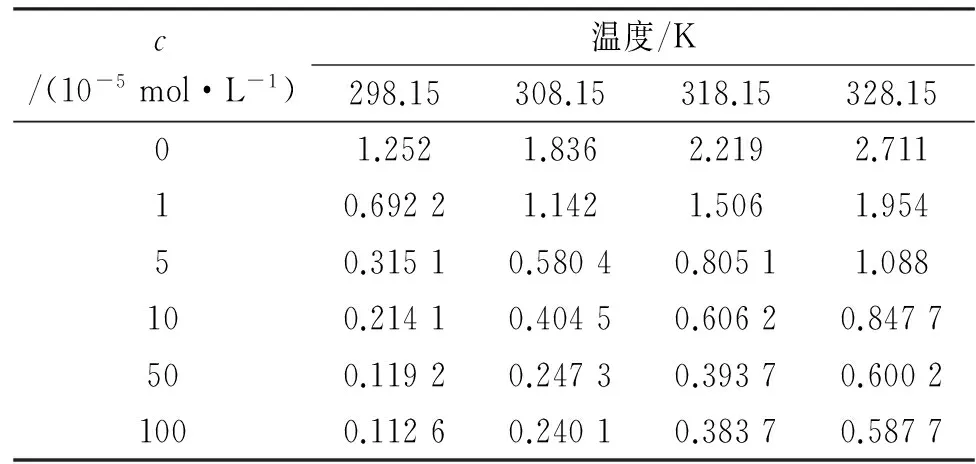
表1不同温度下锌片在含有不同量[C12-4-C12im]Br2的1 mol/L HCl溶液中的腐蚀速率Tab. 1 Inhibition efficiency of zinc in 1 mol/L HCl solution containing different concentrations of [C12-4-C12im]Br2 g/(m2·h)
2.3 动电位极化曲线
由图2可见,加入[C12-4-C12im]Br2后,阴、阳极的极化曲线都向低电流方向移动,腐蚀电位有小幅度变化。对极化曲线相关电化学参数进行拟合,并按式(3)[16]计算缓蚀率,结果见表3。由表3可见,随着[C12-4-C12im]Br2量的增大,βa逐渐增大,βc先增大后减小,Jcorr逐渐减小,缓蚀率逐渐增大。由此可知,[C12-4-C12im]Br2为混合型缓蚀剂,且极化曲线得到的缓蚀率变化趋势与失重法得到的结果吻合。
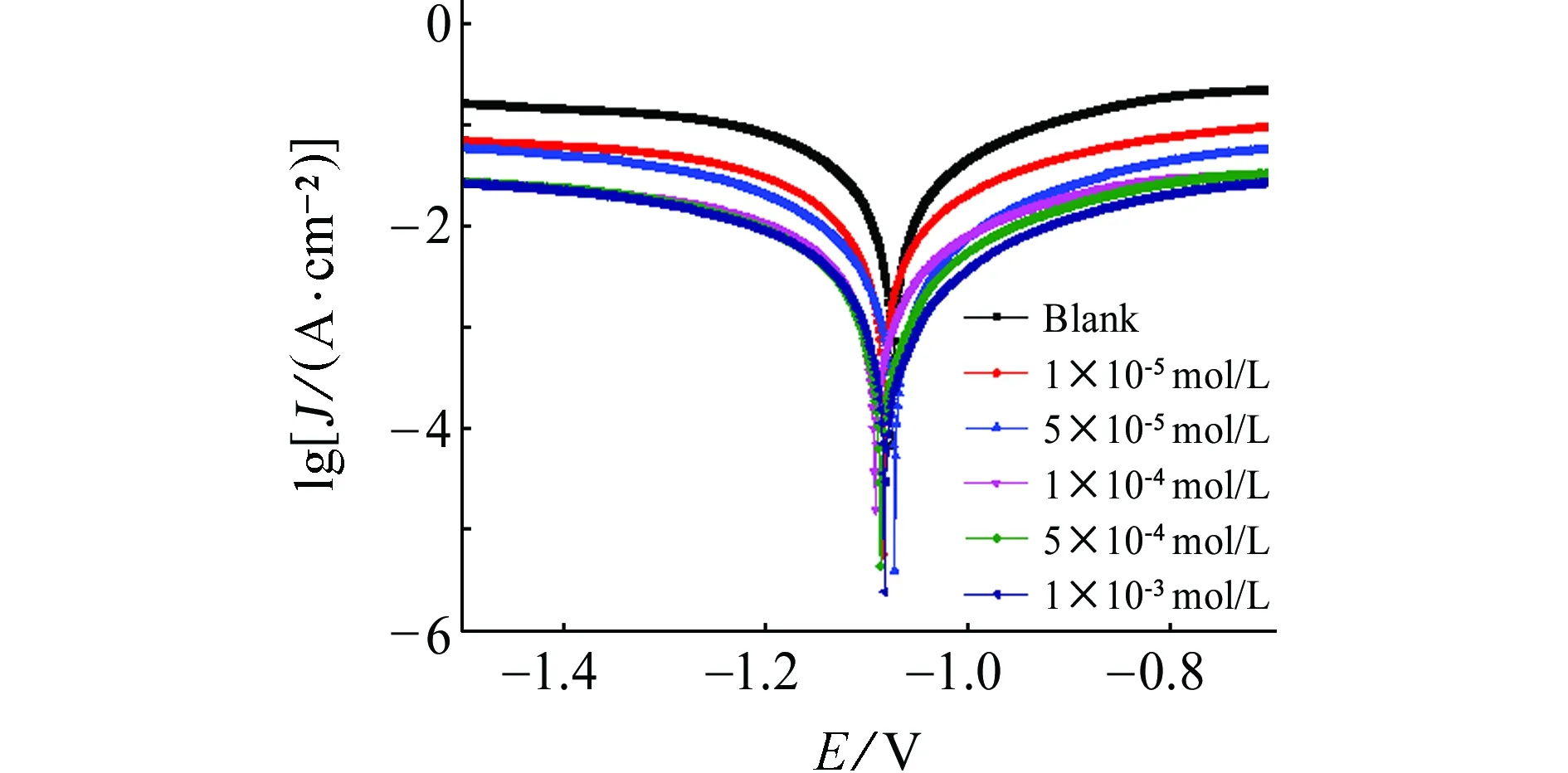
图2 锌片在含不同量[C12-4-C12im]Br2的1 mol/L HCl溶液中的极化曲线Fig. 2 Polarization curves of zinc in 1 mol/L HCl solution containing different concentrations of [C12-4-C12im]Br2

表3 极化曲线相关电化学参数拟合结果及锌片在含不同量[C12-4-C12im]Br2的1 mol/LHCl溶液中的缓蚀率Tab. 3 Fitting results of polarization curves and inhibition effects of [C12-4-C12im]Br2 on zinc in 1 mol/L HCl solution %
2.4 电化学阻抗谱图
由图3可见,阻抗图谱均为半圆形,半圆的直径越大说明表面活性剂在锌表面的吸附能力越强,缓蚀率越高[17]。与空白体系相比,添加缓蚀剂后容抗弧直径明显增大,且随着缓蚀剂浓度的增加而增大。同时,由表4可见,电荷传递电阻Rct随着缓蚀剂浓度的增加而增大。阻抗谱的等效电路拟合图见图4。缓蚀率根据公式(4)[18]计算:


图3 锌片在含不同量[C12-4-C12im]Br2的1 mol/L HCl溶液中的Nyquist谱Fig. 3 Nyquist plots of zinc in 1 mol/L HCl solution containing different concentrations of [C12-4-C12im]Br2
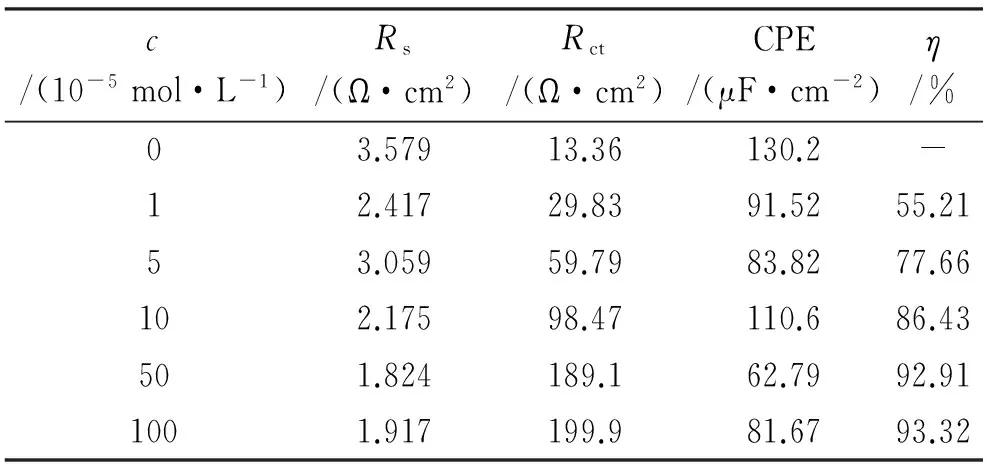
表4 锌片在含不同量[C12-4-C12im]Br2的1 mol/L HCl溶液中的阻抗拟合参数Tab. 4 Impedance data of zinc in 1 mol/L HCl solution containing different concentrations of [C12-4-C12im]Br2

图4 阻抗谱等效电路图Fig. 4 Equivalent circuit for EIS
2.5 吸附热力学
根据失重试验数据,假设[C12-4-C12im]Br2在锌片表面的吸附符合Langmuir吸附等温式,即:
式中:c为缓蚀剂浓度;θ为表面覆盖度,近似等于缓蚀率;K为吸附平衡常数。拟合曲线如图5所示。由图5可知,[C12-4-C12im]Br2在锌片表面的吸附符合Langmuir吸附模型,即[C12-4-C12im]Br2在锌片表面形成致密的单分子吸附层。根据直线斜率可求得K值。吸附过程中的吉布斯自由能按式(6)[19-20]计算:
式中:R是气体常数;T是热力学温度(K);55.5是水在溶液中的浓度(mol/L)。根据计算结果可知,20 kJ/mol<|ΔG|<40 kJ/mol,说明[C12-4-C12im]Br2在锌表面的吸附为物理和化学吸附共同作用。而且,ΔG为负值,说明[C12-4-C12im]Br2在锌表面的吸附过程为自发的。吸附过程中的吸附热和熵变可根据式(7)计算,以ΔG对T作图,结果见图6。通过斜率可知熵变ΔS,吸附热ΔH由截距可知,结果列于表5。
ΔH<0,说明[C12-4-C12im]Br2在锌表面的吸附过程为放热过程。ΔS>0,说明[C12-4-C12im]Br2吸附在锌表面会增大体系的混乱程度[20]。

图5 [C12-4-C12im]Br2在锌片表面的Langmuir吸附曲线Fig. 5Langmuir adsorption plots of [C12-4-C12im]Br2on the surface of zinc

图6 ΔG与T的关系曲线Fig. 6 The relationship between ΔG and T
2.6 腐蚀动力学
金属发生腐蚀反应的难易程度可根据金属表面

表5 [C12-4-C12im]Br2在锌片表面的吸附参数Tab. 5 Adsorption parameters of [C12-4-C12im]Br2 on the zinc surface %
活化能大小来判断,根据Arrhenius方程(8)及其变换式(9)[21]可计算出动力学参数。
式中:v为腐蚀速率;Ea为表观活化能;A为前因子。以lnv对1/T作图,如图7所示。根据直线斜率可计算出Ea。以ln(v/T)对1/T作图,如图8所示。根据直线斜率计算出活化焓 ,截距可计算出活化熵 。将所计算出的动力学参数列于表6。
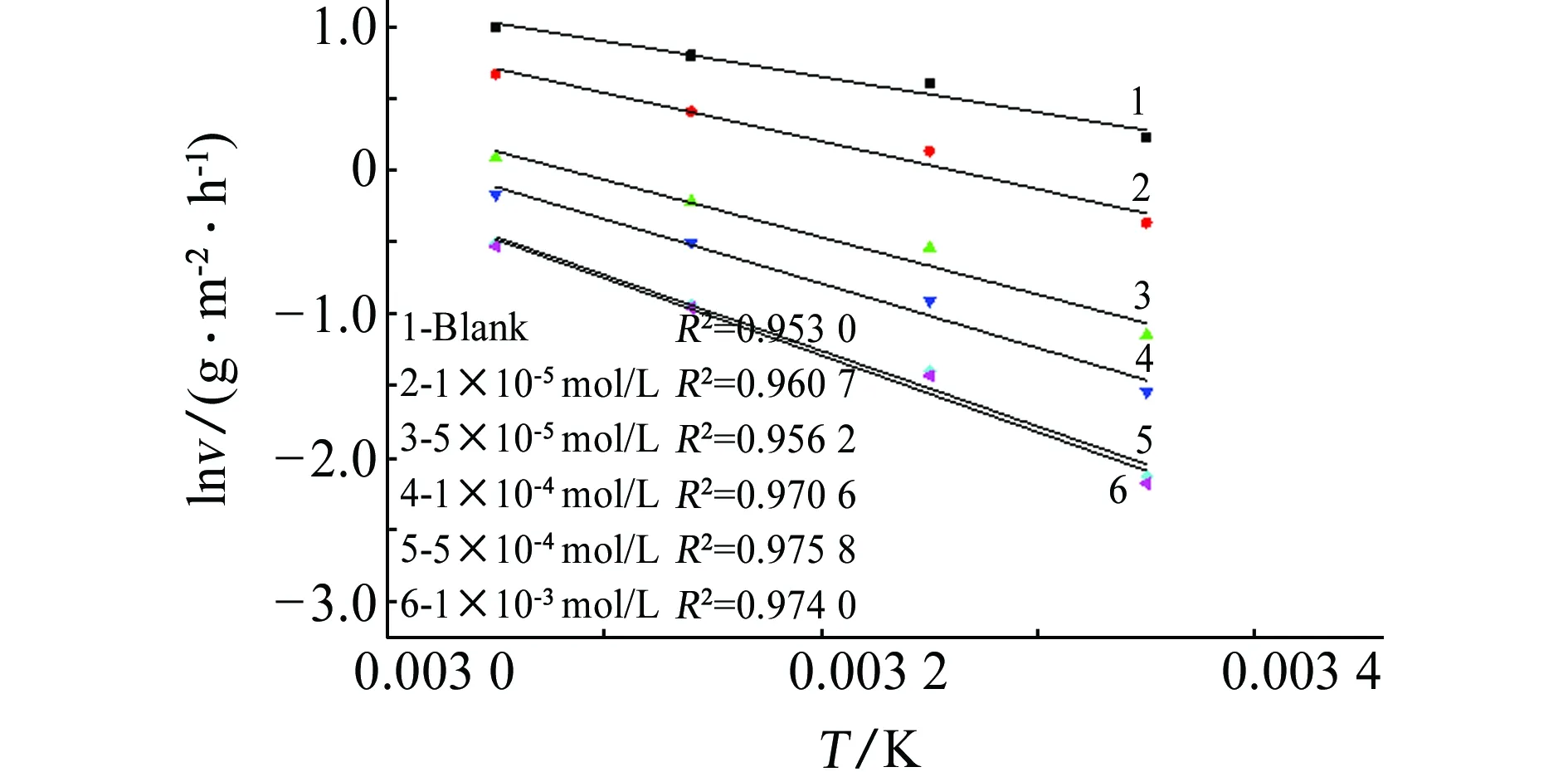
图7 含不同量[C12-4-C12im]Br2的HCl溶液中lnv与1/T的关系曲线Fig. 7 Relationship between lnv and 1/T in HCl solution containing different concentrations of [C12-4-C12im]Br2

图8 含不同量[C12-4-C12im]Br2的1mol/L HCl溶液中ln(v/T)与1/T的关系曲线Fig. 8 Relationship between ln(v/T)and 1/T in 1mol/L HCl solution containing different concentrations of [C12-4-C12im]Br2

表6 锌片在HCl溶液中腐蚀反应的动力学参数Tab. 6 The corrosion kinetic parameters of zinc in HCl solution containing different concentrations of [C12-4-C12im]Br2 %
从表6可以看出,与空白体系相比,加入缓蚀剂后Ea变大,并且随着缓蚀剂浓度的增加逐渐增大,表明缓蚀剂的加入减缓了锌片的腐蚀。活化焓ΔH*>0,说明锌片溶解是吸热过程。加入缓蚀剂后活化熵ΔS*逐渐变大,说明腐蚀反应越来越难进行。
3 结论
(1) [C12-4-C12im]Br2在1 mol/L HCl中能有效抑制锌的腐蚀,而且在研究范围内缓蚀率随着缓蚀剂加入量的增加而增大,随着腐蚀介质温度的升高而减小。
(2) [C12-4-C12im]Br2是一种混合型缓蚀剂,通过物理和化学方式自发地吸附在锌表面抑制其腐蚀,并且符合Langmuir吸附等温式。
[1] 黄魁元. 锌在酸性介质中的腐蚀及缓蚀剂[J]. 化工防腐与防护,1996(3):24.
[2] 张天胜. 缓蚀剂[M]. 北京:化学工业出版社,2002.
[3] FIAUD C,BENSARSA S,DEMESY D A,et al. Inhibiting properties of phosphines against zinc corrosion in acidic media[J]. Br Corros J,1987,22(2):109-120.
[4] GAD A A G,HEFNY M M,SALIH S A,et al. Corrosion inhibition of zinc in HCl solution by several pyrazole derivatives[J]. Corrosion,1989,45(7):574-585.
[5] 蒋金枝,孟凡桂,唐有根. 金属锌有机缓蚀剂研究进展[J]. 有色金属,2003,55(1):21-24.
[6] 唐善法,刘忠运,胡小冬. 双子表面活性剂研究与应用[M]. 北京:化学工业出版社,2011:22.
[7] 朱沛沛,侯韬,雷杰,等. 阳离子Gemini表面活性剂的合成及应用研究综述[J]. 中国洗涤用品工业,2013(5):60-65.
[8] 孙玉海,董宏伟,冯玉军,等. 系列阳离子双子表面活性剂的合成及其表面活性的研究[J]. 化学学报,2006,64(18):1925-1928.
[9] 李俊,赵景茂. Gemini表面活性剂作为金属缓蚀剂的研究进展[J]. 腐蚀与防护,2011,32(7):543-547.
[10] MEI Y,KATHRIN S,ANJA-VERENA M. Bis-cationic ionic liquid crystals[J]. Mater Chem C,2014(2):458.
[11] RONDLA R,CHING-KUAN L,JUNG-TANG L,et al. Symmetrical 1,3-dialkylimidazolium based ionic liquid crystals[J]. J Chin Chem Soc,2013,60:321-335.
[12] JASON E B,EVAN S H,CHRISTOPHER J G,et al. Synthesis and light gas separations in cross-linked gemini room temperature ionic liquid polymer membranes[J]. Membrane Science,2008,316:186-191.
[13] TU S,JIANG X H,ZHOU L M,et al. Synthesis of N-alkyl-4-(4-hydroxybut-2-ynyl) pyridinium bromides and their corrosion inhibition activities on X70 steel in 5M HCl[J]. Corrosion Science,2012,65(12):13-25.
[14] 于婷婷. 咪唑类表面活性离子液体的合成及性能研究[D]. 齐齐哈尔:齐齐哈尔大学,2013.
[15] AO M Q,XU G Y,ZHU Y Y,et al. Synthesis and properties of ionic liquid-type gemini imidazolium surfactants[J]. Colloid and Interface Science,2008(326):490-495.
[16] LOTO R T,LOTO C A,FEDOTOVA T. Electrochemical studies of mild steel corrosion inhibition in sulfuric acid chloride by aniline[J]. Res Chem Intermed,2014,40(4):1501-1516.
[17] 曹楚南. 腐蚀电化学原理[M]. 北京:化学工业出版社,2008.
[18] 王青,马雪梅,石海燕,等. 苯并咪唑衍生物在1 mol/L HCl溶液中对45#碳钢缓蚀行为的研究[J]. 中国腐蚀与防护学报,2015,35(1):49-54.
[19] 左秀丽,舒建华,王志民,等. 高氯油田水溶液中咪唑类缓蚀剂的性能[J]. 腐蚀与防护,2015,36(2):148-176.
[20] 丁其晨,陈上. 聚N-乙烯基咪唑对盐酸介质中Q235钢的缓蚀性能[J]. 中国腐蚀与防护学报,2015,35(1):55-60.
[21] OBOT I B,OBI-EGBEDI N O. Anti-corrosive properties of xanthone on mild steel corrosion in sulphuric acid:experimental and theoretical investigations[J]. Curr Appl Phys,2011,11(3):382-392.
Inhibition Performance of Gemini Surfactant for Znic in Acid Medium
LIU Jing1, ZHAO Di-shun1, LI Jing-jing1, HU Jing-jing1, REN Pei-bing1,2
(1. College of Chemistry and Chemical Engineering, Hebei University of Science and Technology, Shijiazhuang 050018, China;2. Shijiazhuang Coking and Chemical Group Co., Ltd., Shijiazhuang 050031, China)
The adsorption and corrosion inhibition of gemini surfactant ([C12-4-C12im]Br2) on zinc surface in 1mol/L HCl was investigated using weight loss method and electrochemical methods. The inhibition mechanism was discussed through analysis of the adsorption thermodynamics and corrosion kinetics. The results showed that [C12-4-C12im]Br2was a good inhibitor for zinc in 1 mol/L HCl, and the inhibition efficiency increased with increasing inhibitor concentration, while decreased with the increase in temperature of acid medium and [C12-4-C12im]Br2acted as a mixed-type inhibitor. The adsorption mechanism of the gemini surfactant on zinc surface was found to be fitted with Langmuir adsorption model.
gemini surfactant; corrosion inhibition; adsorption
2015-06-18
国家自然科学基金项目(21106032)
赵地顺(1945-),教授,从事绿色催化过程、清洁化工研究,0311-88632231,zhao_dsh@hebust.edu.cn
10.11973/fsyfh-201612008
TG174.42
A
1005-748X(2016)12-0983-05
