微波等离子体炬质谱法快速测定大米中黄曲霉毒素B1的研究
2017-01-06赵晓静肖赛金杨水平朱志强
蒋 涛,李 云,赵晓静,肖赛金,杨水平,朱志强
(1.东华理工大学 江西省质谱科学与仪器重点实验室,江西 南昌 330013;2.上饶师范学院 化学与化工学院,江西 上饶 334001)
研究简报
微波等离子体炬质谱法快速测定大米中黄曲霉毒素B1的研究
蒋 涛1,李 云1,赵晓静1,肖赛金1,杨水平1,朱志强2*
(1.东华理工大学 江西省质谱科学与仪器重点实验室,江西 南昌 330013;2.上饶师范学院 化学与化工学院,江西 上饶 334001)
以微波等离子体炬(MPT)为离子化源,在无需样品预处理的条件下,建立了快速测定大米中黄曲霉毒素B1(AFB1)的直接质谱分析方法。在正离子检测模式下,根据黄曲霉毒素B1的特征质谱离子(m/z285)进行定量分析。结果表明,黄曲霉毒素B1在0.5~20 μg/L范围内线性关系良好,相关系数(r2)为0.999 4,方法检出限为0.12 μg/kg。直接检测复杂基体大米中的黄曲霉毒素B1,平均回收率为95.8%~107.2%,相对标准偏差(RSD,n=9)为2.2%~10.1%;将该方法与主成分分析(PCA)相结合,能够准确地鉴别大米是否霉变。该方法分析速度快、灵敏度高,适合霉变大米的快速、高通量筛查,有望应用于粮油食品、动植物食品质量监控等领域。
微波等离子体炬(MPT);质谱;黄曲霉毒素B1(AFB1);大米
大米是人类最重要的主食之一,其质量的好坏直接关系到食用者的身体健康。近年来,毒大米事件引起人们对大米质量的关注。毒大米主要包括米中重金属超标、米表面含有农药或大米发生霉变等,其中霉变大米含有剧毒物质黄曲霉毒素(Aflatoxins)。黄曲霉毒素为分子真菌毒素,主要包括黄曲霉毒素B1,B2,G1,G2,M1,M2,而霉变的粮食中以黄曲霉毒素B1的毒性最大,量最多[1],致癌性最强[2]。AFB1属于肝脏毒素,诱发肝癌的能力比二甲基亚硝胺大75倍[1],国际癌症研究机构已将其列为人类致癌物[3]。根据中国食品中真菌毒素的限量规定,大米中黄曲霉毒素的含量不得超过10 μg/L[4]。因此很有必要对大米中黄曲霉毒素B1进行严格的监测。
目前国内外检测黄曲霉毒素B1的方法主要有薄层色谱法[5]、毛细管电泳[6]、免疫化学分析方法[7-8]和色谱-质谱法[9-11]等,这些方法需复杂的预处理过程。大气常压质谱技术是近年来发展的可快速分析复杂基体样品的质谱方法,如电喷雾解吸电离(DESI)[12]、实时在线分析(DART)[13]、电喷雾萃取电离(EESI)[14]、表面解吸常压化学电离(DAPCI)[15]以及低温等离子体探针(LTP)[16]等,这些方法可在无需样品预处理或少量样品预处理的条件下高通量、高灵敏地分析原生态的样品,但很少直接用于大米中黄曲霉毒素的分析检测。

图1 MPT-MS实验装置示意图Fig.1 Experimental schematic of MPT-MS
微波等离子体炬(MPT)是由金钦汉教授课题组发明和发展的一种新兴等离子产生装置。本文将该技术应用于质谱离子化源,发掘其在质谱中的应用潜力。如图1所示,MPT炬管是三管同轴的结构。从微波能传输的角度看,可将这种炬管看成是一端开放的同轴线;在其开放的一端向外,电场分布和流体动力学均有利于形成一个具有中央通道的等离子体[17]。这种结构设计类似于ICP离子源,但其三管均为金属制成[18]。而且当MPT以微波作为能量来源时,与传统的微波等离子体(MWP)类似,易形成常压下Ar,N2甚至空气的等离子体[19]。故而,MPT离子源兼顾了此二者的优点,不但能克服样品耐受力不足的缺陷,而且具有结构简单、操作简便、功耗低和普适性强等特点。近年来,MPT离子源不仅能检测元素周期表上大多数元素,而且对有机化合物能进行良好的解析,因而广泛地应用于食品安全、石油化工、临床医学等领域[20-21]。以MPT为离子源,与多种质谱仪器(LTQ,TOF)相结合,采用外部直接解析的模式,已成功地检测一系列有机化合物[22-23]。本文通过采用MPT-MS实验平台对大米中黄曲霉毒素B1进行检测,并利用黄曲霉毒素B1的碎片离子m/z285作定量分析,可快速测定大米中黄曲霉毒素B1的含量,且在半定量意义下数据可靠。
1 实验部分
1.1 仪器与装置
LTQ-XL型线性离子阱质谱仪(美国Finnigan公司,配备有Xcalibur数据处理系统);微波等离子体炬管,WGY-20微波功率源(均由吉林大学于爱民教授课题组提供);超纯水仪(美国赛默飞世尔科技公司)。
1.2 材料与试剂
黄花黏米、奉新发米、泰太香油黏米、皇阳贡米购于南昌市旺中旺超市;龙南大米购于江西赣州龙南县;柳河大米购于吉林柳河县。
黄曲霉毒素B1(10 mg,上海百灵威化学技术有限公司);甲醇(色谱纯,国药集团化学试剂有限公司);用甲醇-去离子水(体积比1∶1)的混合溶液,将10 mg黄曲霉毒素B1 溶解于100 mL容量瓶中,制得100 mg/L储备液。
1.3 实验条件
LTQ-MS为正离子检测模式,离子传输管温度150 ℃,质谱扫描范围为m/z100~500,其它参数LTQ-MS自动优化;微波等离子体炬(MPT)离子源;MPT的载气(Ar)流量400 mL/min,维持气(Ar)流量600 mL/min,微波功率为50 W(其可调范围30~200 W)。固定炬焰离质谱口距(d)约12 mm,炬焰离液面高3 mm,炬管与水平面成30°。
1.4 实验方法
微波等离子体炬(MPT)直接分析液体样品的原理如图1所示[21],采用外部进样的方式,与以往采用的中心管道进样方式有所不同[24-26]。中心管道进样时,需要辅以去溶装置,样品形成干燥的气溶胶后从MPT中心管道引入等离子体,以使充分吸收微波能量,形成的离子导入质谱仪中检测。这种方式适合分析水样中的金属元素,但不适合分析有机样品,因为有机分子在等离子体中易分解,得不到样品的原始信息。然而,外部进样可通过固定炬焰与有机样品间的距离,MPT炬管与水平面固定成30°角架置,炬焰尖端离质谱口约12 mm,炬焰略高于溶液液面3 mm。通过MPT炬焰外层对装在表面皿中的样品萃取液进行解析,能得到有机样品中黄曲霉毒素B1的指纹谱图,而且经该方式产生的待测物离子可由质谱仪进行检测。
配制一系列浓度梯度的标准品,通过表面烧蚀进样,获得特征质谱图。以AFB1的二级质谱信号(m/z285)作为定量依据绘制工作曲线,再对大米样品进行检测。将所得质谱数据导出至Excel中进行分析。
2 结果与讨论
2.1 MPT离子化技术
MPT源是一种可用于现场直接质谱分析的新型离子化技术,对中性复杂基质样品能进行较好的解析。为避免样品污染或质谱仪损伤,采用甲醇-去离子水(1∶1)[27]对大米进行萃取,再通过MPT表面烧蚀大米萃取液,形成的待测离子进入质谱仪器进行检测。该方法具有分析检测复杂样品的能力,降低了对样品预处理的要求;串联质谱分析结果给出了较丰富的离子结构信息。与以往内管进样分析液态样品的方式不同,MPT第一次以表面解析的方式分析有机液体样品,且对有机液体样品能进行较好的解吸,获得清晰的样品指纹谱图。由于MPT装置操作简单,易集成和小型化,通过与小型质谱仪器的耦合能运用于复杂基质样品的现场分析。
2.2 黄曲霉毒素B1的一级质谱与二级质谱分析
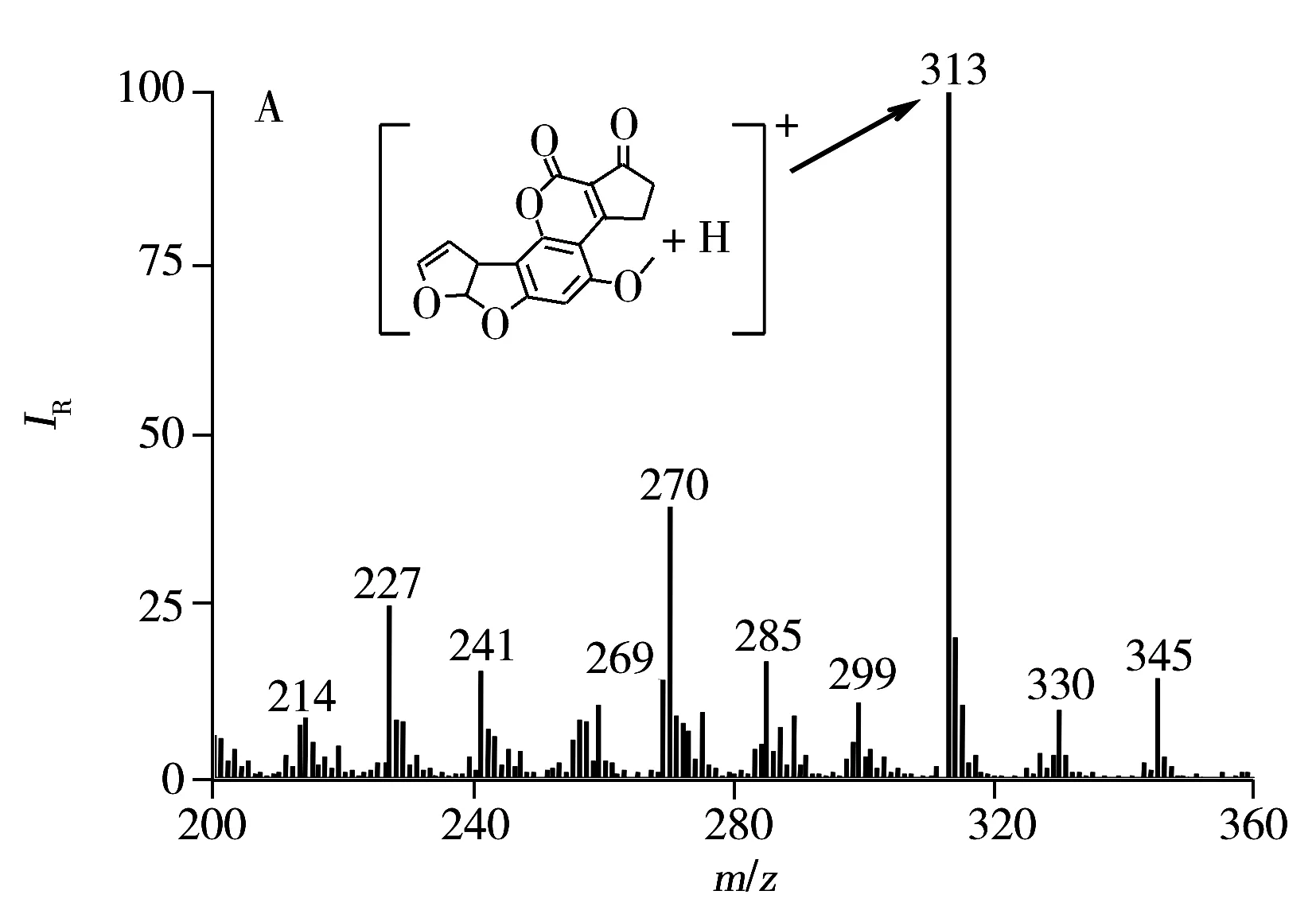
MPT是一种软电离技术,一般经质子化、去质子化或与其它基团结合后形成待测物离子。通过MPT对溶液表面烧蚀发现,正离子模式下得到黄曲霉毒素B1的信号。从分子结构上看,黄曲霉毒素B1易形成质子化的分子离子[M+H]+(m/z313)(如图2A),这是由于黄曲霉毒素B1中氧原子电负性比碳原子大,质子易与其中的氧原子结合得到m/z313离子峰,再对母离子m/z313进行串联质谱分析。从串联质谱(图2B)可以看出,大部分母离子(m/z313)失去中性碎片CO或C2H4得到m/z285,而少部分母离子丢失醚键后得到基峰m/z269,这些碎片离子(如图2B)与文献研究结果一致[28-29]。
2.3 实验条件的优化
通常在MPT质谱仪工作中,载气流量、维持气流量及微波功率均会对离子信号强度有较大的影响。为了利用m/z285的信号作定量测量,需研究检测m/z285的最佳条件。图3A显示了载气流量与信号强度的关系,载气流量在200~400 mL/min范围内与信号强度呈正相关,当超过400 mL/min时,信号逐渐减弱,这可能是由于气体流速过大而导致等离子体焰炬不稳定所致,因此选择最佳载气流量为400 mL/min。如图3B所示,维持气的最优条件为600 mL/min。本实验尝试调节微波功率源来控制等离子体焰炬能量的大小,从而得到样品最佳的离子化焰炬。结果显示,微波能量在30~50 W范围内时,等离子体焰炬使样品离子化的效果逐渐上升,当微波能量大于50 W时,微波等离子体炬的焰炬能量过高,使得AFB1在高温等离子的作用下碎裂程度更加剧烈,难以得到m/z285的质谱信号。实验选择最佳微波功率为50 W。

2.4 大米中AFB1的快速MPT-质谱法检测
MPT对大米萃取液进行表面烧蚀,可以看到特征离子峰m/z313丰度较低(如图4A)。为了排除假阳性信号,需对大米萃取液的指纹谱中m/z313离子峰进行串联质谱研究。选取母离子为m/z313,获得二级质谱(如图4B)。在串联质谱中可以看出,通过母离子(m/z313)进行碰撞诱导解离产生的碎片离子(m/z285,m/z269)与标准品黄曲霉毒素B1的碎片离子吻合,可以确认该大米已发生霉变。该方法操作简单,每种大米的检测可在0.5~1 min内完成。因此,这种微波等离子体炬质谱检测方法快速、灵敏、准确,且MPT质谱仪成本低、操作简易,适于发展成为现场分析仪器,用于食品质量方面的实时在线监控。
在优化条件下利用串联质谱信号m/z285,可对大米中黄曲霉毒素B1的含量做定量分析。在大米萃取液中通过标准加入法,配成一系列浓度梯度的黄曲霉毒素B1标准溶液,每种浓度测10次,绘制出黄曲霉毒素B1的工作曲线。结果显示,黄曲霉毒素B1的线性范围为0.5~20 μg/L,相关系数为0.999 4。根据 LOD=3σc/S(σ为标准偏差,c为标准品浓度,S为相应信号强度的平均值)可计算出此方法的检出限为0.12 μg/kg。对每个实验点10次重复实验数据获得的相对标准偏差(RSD)为7.1%~12.5%。对实际大米样品作实测分析,用所得数据由AFB1的工作曲线计算得到样品中AFB1的含量。结果如表1所示,实际样品的加标回收率为95.8%~107.2%,10次测量的RSD为2.2%~10.1%,可见该检测方法在半定量意义下结果可靠。


SampleOriginal(ng/L)Added(ng/L)Found(ng/L)RSD(%)Recovery(%)Huanghuastickyrice(黄花黏米)52485001003524958LongnanCountryrice(龙南大米)5376500106781011060Liuherice(柳河大米)5012500942538940Thaitoosesameoilstickyrice(泰太香油黏米)-5005026451005HuangyangKongmy(皇阳贡米)586050011221221072
-:no detected
2.5 主成分分析
为了更清晰地区分大米是否霉变,采用Matlab软件中“Princomp”函数对霉变前后大米的质谱数据进行PCA分析,图5表明霉变前密封的大米(正常大米)与霉变后的大米(霉变大米)可以较好地区分开。在大米霉变前后的三维PCA得分图(图5A)中,PC1,PC2和PC3的贡献率分别为62.5%,20.9%和5.4%,三者总和88.8%,该结果进一步说明,久置霉变大米的化学成分与正常大米存在较大差异。根据PCA相应的载荷图(图5B)可以看出,对三维PCA得分图贡献较大的m/z范围在250~320之间。而且在PC1方向上区分较好,其贡献较大的质谱信号为m/z269和285。同时,在PC2和PC3的载荷分布图(图5B)也清晰地显示特征峰m/z269,257,298和313等对区分霉变前后大米的贡献较大,说明这些物质在霉变前后大米中的含量存在较大差异。研究表明,MPT-MS可在分子水平上快速区分大米质量的好坏,同时为粮油、动植物等食品的质量分析提供了一种快速分析的途径。

3 结 论
本文建立了无需样品预处理或是少量样品预处理的条件下,可直接检测大米样品中黄曲霉毒素B1含量的分析方法。以MPT作为线性离子阱质谱仪的离子源,通过用MPT表面烧蚀的进样方式,结合PCA分析,能在痕量水平检测大米中黄曲霉毒素B1的总含量,并快速区分大米是否霉变;这种新型等离子体质谱(MPT-LTQ-MS)的整体设备搭建简单,检测速度快,灵敏度高,有望发展成为一种便携式分析仪,在食品质量监控方面具有一定的应用潜力。
[1] Xiao C Y,Feng G P,Wei J T,Zheng J Y.LivestockandPoultryIndustry(肖传英,冯广鹏,魏金涛,郑金玉.畜禽业),2007,(5):4-7.
[2] Liu J,He B Y,Sun J H.Chin.J.PublicHealth(柳洁,何碧英,孙俊红.中国公共卫生),2006,22(1):112-113.[3] Liu H,Zhang Y,Xiong B,Han Z Y,Chen L,Zhao M Q.GuangdongChem.Ind.(刘辉,张燕,熊波,韩振亚,陈磊,赵明桥.广东化工),2015,4(42):29-30.
[4] GB 2761-2005.Maximum Levels of Mycotoxins in Foods.National Standards of the People's Republic of China(食品中真菌毒素限量.中华人民共和国国家标准).
[5] Var I,Kabak B,Gök F.FoodControl,2007,18(1):59-62.
[6] Maragos C M.MycotoxinProtocols,2006,157:51-58.
[7] Ardic M,Karakaya Y,Atasever M.FoodChem.Toxicol.,2008,46(5):1596-1599.
[8] Sun X L,Zhang Y Z,Shao J D,Zeng J.Chem.J.Chin.Univ.(孙秀兰,张银志,邵景东,曾洁.高等学校化学学报),2007,28(8):1449-1453.
[9] Scott P M,Kanhere S R,Weber D.FoodAddit.Contam.,1993,10(4):381-389.
[10] Sulyok M,Berthiller F,Krska R,Schuhmacher R.RapidCommun.MassSpectrom.,2006,20:2649-2659.
[11] Nonakaa Y,Saitob K,Haniokaa N,Narimatsua S,Kataokab H.J.Chromatogr.A,2009,1216:4416-4422.
[12] Zhu Z Q,Han J,Zhang Y,Zhou Y F,Xu N,Zhang B,Gu H W,Chen H W.RapidCommun.MassSpectrom.,2012,26:2770-2776.
[13] Cody R B.Anal.Chem.,2009,81:1101-1107.
[14] Chen H W,Lai J H,Zhou Y F,Xun Y F,Li J Q,Zhang X,Wang Z C,Luo M B.Chin.J.Anal.Chem.(陈焕文,赖劲虎,周瑜芬,郇延富,李建强,张燮,王志畅,罗明标.分析化学),2007,35(8):1233-1240.
[15] Chen H W,Zheng J,Zhang X,Luo M B,Wang Z C,Qiao X L.J.MassSpectrom.,2007,42:1045-1056.
[16] Wiley J S,Garcia-Reyes J F,Harper J D,Charipar N A,Ouyang Z,Cooks R G.Analyt,2010,135:971-979.
[17] Wan T Q.ConstructionandBasicStudyonApplicationofMicrowavePlasmaTorchIonizationSource.Hangzhou:Zhejiang University(万同青.微波等离子体炬离子化源的构建及其应用基础研究.杭州:浙江大学),2011:22.
[18] Jin Q H,Zhou J G,Cao Y B,Zhang H Q,Yu A M,Yang W J,Liang F,XunY F,Xu B.Mod.Sci.Instrum.(金钦汉,周建光,曹彦波,张寒琦,于爱民,杨文军,梁枫,郇延富,徐彬.现代科学仪器),2002,4:3-11.
[19] Jin Q H.Chin.J.Anal.Chem.(金钦汉.分析化学),1988,16(7):668-674.
[20] Zhao L,Zhang J S,Li L H.J.Anal.Sci.(赵丽,张金生,李丽华.分析科学学报),2014,30(4):563-565.
[21] Jiang J,Fei Q,Feng G D,Dou W C,Li M,Jin Q H,Jin W.Chin.J.Anal.Chem.(姜杰,费强,冯国栋,窦文超,李明,金钦汉,金伟.分析化学),2007,35(1):91-94.
[22] Zhang T Q,Jin W,Zhou J G,Zhang Y,Zhu Z Q,Zhou W,Jin Q H.Chem.J.Chin.Univ.(张体强,金 伟,周建光,张莹,朱志强,周炜,金钦汉.高等学校化学学报),2012,33(9):1938-1944.
[23] Zhang T Q,Zhou W,Jin W,Zhou J G,Eric H,Zhu Z Q,Chen H W,Jin Q H.J.MassSpectrom.,2013,4:669-676.[24] Xu H L,Ling X,Zhang X H,Jiang T,Zhu Z Q,Qiu C L,Tian D.Chin.J.Anal.Chem.(许华磊,凌星,张小华,蒋 涛,朱志强,邱春玲,田地.分析化学),2015,43(12):1955-1961.
[25] Jiang T,Liu Q J,Yi L F,Qi W H,Zeng B,Zhou Y M,Zhu Z Q,Chen H W.J.Instrum.Anal.(蒋涛,刘秋菊,易兰芳,漆文豪,曾斌,周跃明,朱志强,陈焕文.分析测试学报),2016,35(1):79-84.
[26] Jiang T,Xiong X H,Wang S X,Luo Y L,Fei Q,Yu A M,Zhu Z Q.Int.J.MassSpectrom.,2016,399/400:33-39.[27] Sun X L,Zhao X L,Tang J.FoodSci.(孙秀兰,赵晓联,汤坚.食品科学),2004,25(7):128-130.
[28] Luo X H,Wang R,Wang L,Wang Y,Chen Z X.FoodControl,2013,31:331-336.
[29] Ventura M,Guillen D,Anaya I,Broto-Puig F,Lliberia J L,Agut M,Comellas L.RapidCommun.MassSpectrom.,2006,20:3199-3204.
Direct Analysis of Aflatoxin B1 in Rice by Microwave Plasma Torch Mass Spectrometry
JIANG Tao1,LI Yun1,ZHAO Xiao-jing1,XIAO Sai-jin1,YANG Shui-ping1,ZHU Zhi-qiang2*
(1.Jiangxi Key Laboratory for Mass Spectrometry and Instrumentation,East China Institute of Technology,Nanchang 330013,China;2.School of Chemistry and Chemical Engineering,Shangrao Normal University,Shangrao 334001,China)
A novel and simple mass spectrometric method based on microwave plasma torch(MPT) was developed for the rapid detection of aflatoxin B1(AFB1) in rice without sample pretreatment.The MPT mass spectra of AFB1 were obtained,and the quantitative analysis mainly was based on the characteristic fragments of AFB1(m/z285).The results showed that there was a good linear relationship in the concentration range of 0.5-20 μg/L with correlation coefficient(r2) of 0.999 4,and the evaluated limit of detection(LOD) was 0.12 μg/kg.The direct detection of AFB1 in some kinds of rice were conducted,with recoveries of 95.8%-107.2% and relative standard deviations(RSD,n=9) of 2.2%-10.1%.With the help of principle component analysis(PCA),the moldy rice and normal rice could be rapidly distinguished.With the advantages of rapidness and high sensitivity,the MPT-MS is a powerful tool for the high-throughput detection of moldy rice,and also shows a great potential in the monitoring of cereal and oil,animal,plant food,etc.
microwave plasma torch(MPT);mass spectrometry;aflatoxin B1(AFB1);rice
2016-03-09;
2016-06-23
国家科技部项目国家重大仪器专项(2011YQ14015009);国家自然科学基金(21565003);江西省科技支撑项目(2014BBG70091);东华理工大学2011质谱科学与仪器协同创新中心及东华理工大学朱志强博士科研启动基金
10.3969/j.issn.1004-4957.2016.12.010
O657.6;S852.44
A
1004-4957(2016)12-1575-06
*通讯作者:朱志强,博士,副教授,研究方向:质谱分析,Tel:0791-83896370,E-mail:zhiqiangz@iccas.ac.cn
