miR-155靶向调控SP1、E2F2 mRNA转录水平的功能验证
2017-01-06赵盼刘真管静芝袁龙舒彬尹斌
赵盼,刘真,管静芝,袁龙,舒彬,尹斌
(1河北北方学院研究生部,河北张家口075000;2中国人民解放军第309医院)
miR-155靶向调控SP1、E2F2 mRNA转录水平的功能验证
赵盼1,刘真2,管静芝2,袁龙2,舒彬2,尹斌2
(1河北北方学院研究生部,河北张家口075000;2中国人民解放军第309医院)
目的 观察微小RNA155(miR-155)对端粒酶逆转录酶(hTERT)调控相关蛋白特异性蛋白1(SP1)及转录因子E2F2重组质粒表达的影响,为进一步研究miR-155调控肿瘤细胞hTERT表达的机制提供实验基础。方法 采用生物信息学预测软件TargetScan和Miranda预测SP1和E2F2 mRNA 3′-UTR是否是人miR-155的作用靶点。针对SP1和E2F2 mRNA 3′-UTR设计互补的两条寡核苷酸,包括目标序列(即SP1、E2F2野生型序列)及突变序列(SP1-mu、E2F2-mu),构建SP1和E2F2 mRNA 3′-UTR报告基因载体pMIR-SP1、pMIR-E2F2、pMIR-SP1-mu和pMIR-E2F2-mu。培养HEK-293细胞,采用脂质体法将SP1和E2F2的野生型和突变型pMIR-Luc质粒共转染HEK-293细胞24 h。将细胞分为SP1空白对照组、SP1目标序列组、SP1突变序列组、E2F2空白对照组、E2F2目标序列组、E2F2突变序列组,均加入0.2 μg重组质粒、0.01 μg对照质粒和0.375 μL寡核苷酸,培养24 h。采用双荧光素酶报告基因系统检测双荧光素酶活性,以萤火虫荧光素酶活性值(F)/海肾荧光素酶活性值(R)比值评价miR-155与SP1及E2F2 mRNA 3′-UTR结合效果。结果 在线预测结果示,SP1 mRNA 3′-UTR和E2F2 mRNA 3′-UTR均有与miR-155完全互补配对的序列,确定二者均为miR-155的靶基因。经鉴定,SP1和E2F2报告基因重组质粒构建成功。SP1目标序列组F/R低于SP1空白对照组及SP1突变序列组(P均<0.05),E2F2目标序列组F/R低于E2F2空白对照组及E2F2突变序列组(P均<0.05)。结论 成功构建了SP1和E2F2报告基因重组质粒,证实miR-155能够靶向结合SP1和E2F2 mRNA 3′-UTR,在转录后水平抑制SP1和E2F2的表达。
特异性蛋白1;E2F2转录因子;微小RNA155;荧光素酶报告基因;人端粒酶逆转录酶;质粒
端粒位于真核生物线状染色体末端,是维持染色体完整性与稳定性的重要结构。端粒酶是细胞内具有延长端粒作用的逆转录酶,可保持端粒伸缩的动态平衡,弥补DNA复制过程中端粒末端的消耗[1]。端粒酶逆转录酶(hTERT)是端粒酶的主要结构之一,与端粒酶活性有关[2]。近年研究发现,hTERT在癌组织及癌前病变组织中高表达,而在正常组织中低表达或不表达[3]。hTERT转录位点上游的核心启动子中有与多种转录因子结合的位点,与不同的转录因子结合后可激活或抑制hTERT表达。特异性蛋白1(SP1)和转录因子E2F2是与细胞周期调控有关的转录激活因子,能够调控hTERT的表达[4,5]。微小RNA(miRNA)是一类广泛存在于真核细胞中的内源性非编码RNA,参与基因转录后表达的调控,其中miRNA155(miR-155)在多种肿瘤组织中高表达,在肿瘤的发生发展中发挥重要作用。但miR-155是否通过调控转录因子SP1、E2F2进而调控hTERT的表达,目前尚不明确。2015年3~10月,我们构建了SP1及E2F2 mRNA的3′端非翻译区(3′-UTR)报告质粒并转染人胚肾HEK-293细胞,与miR-155共培养,观察miR-155对SP1和E2F2重组质粒表达的影响,为进一步研究miR-155调控肿瘤细胞hTERT表达的机制提供实验基础。
1 材料与方法
1.1 试剂与仪器 大肠杆菌感受态DH5α、对照质粒pRL-TK和人胚肾HEK-293细胞由解放军第309医院结核病研究所孙卫国博士惠赠。miR-155模拟物(miR-155 mimics)、miRNA对照剂(miRNA-control)(上海吉玛制药技术有限公司);寡核苷酸片段(Invitrogen公司);限制性内切酶SpeⅠ、Hind Ⅲ、Apa I和T4 DNA连接酶(大连Takara生物有限公司);Dual-Luciferase报告基因检测系统(Promega公司);LipofectmineTM2000和Opti-MEM®Ⅰ不含血清的优化培养基(Promega公司);低温连接仪(珠海黑马医学仪器有限公司);IMS-30全自动雪花制冰机(雪科电器有限公司);恒温培养振荡器(上海智城分析仪器制造有限公司);琼脂糖凝胶DNA回收试剂盒(美国Omega Bio-Tek公司);质粒中量制备试剂盒(AxyGen公司);Gen5酶标仪(美国Bio-Tek公司);低温台式高速离心机(德国Eppendorf公司);CO2恒温细胞培养箱(日本SANYO公司)。
1.2 SP1、E2F2 mRNA 3′-UTR与miR-155靶基因互补性预测 采用生物信息学预测软件TargetScan和Miranda,预测SP1和E2F2 mRNA 3′-UTR是否是人miR-155的作用靶点。以SP1、E2F2 mRNA 3′-UTR二者与miR-155的结合序列至少各存在7个互补结合位点,作为判定SP1和E2F2为人miR-155靶基因的标准。
1.3 SP1和E2F2 mRNA 3′-UTR报告基因载体的构建及鉴定 在TargetScan网站获取SP1 mRNA 3′-UTR和E2F2 mRNA 3′-UTR与miR-155相结合的碱基序列,分别对SP1和E2F2 mRNA 3′-UTR设计互补的两条50~60 nt寡核苷酸,包括目标序列(即SP1、E2F2野生型序列)及突变序列(SP1-mu、E2F2-mu),分别在5′端添加SpeⅠ和HindⅢ酶切位点,以备后续连接,同时插入ApaⅠ酶切位点,作为后续鉴定的位点。序列如下(下划线部分为SpeⅠ或HindⅢ酶切位点):SP1正义链为5′-CTAGTGGGCCCCATGGAAGAGAGAGCCATGAAGCATTAAAATGC-ATGGTGTTGAGAAGA-3′,SP1反义链为5′-AGCTTC-TTCTCAACACCATGCATTTTAATGCTTCATGGCTCT-CTCTTCCATGGGGCCCA-3′;SP1-mu正义链为5′-CT-AGTGGGCCCCATGGAAGAGAGAGCCATGAGTAGC-GCGAATGCATGGTGTTGAGAAGA-3′,SP1-mu反义链为5′-AGCTTCTTCTCAACACCATGCATTCGCGCTACTCATGGCTCTCTCTTCCATGGGGCCCA-3′;E2F2正义链为5′-CTAGTGGGCCCCACTTTTTAGAAAAGT-TTGTAGCATTAAGCTGGTTTAAAATATGAAGA-3′,E2F2反义链为5′-AGCTTCTTCATATTTTAAACCAGCT-TAATGCTACAAACTTTTCTAAAAAGTGGGGCCCA-3′;E2F2-mu正义链为5′-CTAGTGGGCCCCACTTTTTA-GAAAAGTTTGTCTAGCGGCGCTGGTTTAAAATATG-AAGA-3′,E2F2-mu反义链为5′-AGCTTCTTCATAT-TTTAAACCAGCGCCGCTAGACAAACTTTTCTAAAA-AGTGGGGCCCA-3′。寡核苷酸链两两互补进行退火,作为与pMIRREPORTTM Luciferace质粒(为携带荧光素酶基因的载体,以下简称为pMIR-Luc质粒)连接的目的片段。将空载体pMIR-Luc质粒(SpeⅠ或HindⅢ)双酶切后,与插入的各目的序列连接过夜。连接完成后,将连接产物重组质粒pMIR-Luc-SP1、pMIR-Luc-SP1-mu、pMIR-Luc-E2F2和pMIR-Luc-E2F2-mu分别转化至感受态大肠埃希菌DH5α进行扩增,挑取阳性单克隆菌落摇菌过夜,构建SP1和E2F2 mRNA 3′-UTR报告基因载体pMIR-SP1、pMIR-E2F2、pMIR-SP1-mu和pMIR-E2F2-mu。质粒抽提并进行酶切鉴定后,送至北京博艾永华生物科技公司测序。
1.4 细胞培养 HEK-293细胞贴壁培养于含10%胎牛血清的1640培养基,放置于37 ℃、5%CO2培养箱进行培养。取对数生长期细胞进行实验。
1.5 质粒转染及分组 采用脂质体法将SP1和E2F2的野生型和突变型pMIR-Luc质粒共转染HEK-293细胞24 h。转染前24 h,将对数生长期的HEK-293细胞消化脱壁后,调整细胞悬液密度至2×105/mL,接种于96孔板,每孔加无抗1640培养基100 μL,37 ℃培养至细胞密度约培养孔面积的75%~80%时开始转染。转染分组:SP1空白对照组、SP1目标序列组、SP1突变序列组、E2F2空白对照组、E2F2目标序列组、E2F2突变序列组,每组均设3个复孔,用25 μL Opti-MEM®Ⅰ培养基稀释LipofectamineTM2000脂质体0.5 μL,轻柔混合,室温静置5 min,然后按每孔量用25 μL Opti-MEM®Ⅰ培养基稀释0.2 μg重组质粒、0.01 μg对照质粒pRL-TK和0.375 μL寡核苷酸(SP1空白对照组加入pMIR-SP1质粒0.2 μg、pRL-TK质粒0.01 μg、miRNA-control 0.375 μL;SP1目标序列组加入pMIR-SP1质粒0.2 μg、pRL-TK质粒0.01 μg、miR-155 mimics 0.375 μL;SP1突变序列组加入pMIR-SP1-mu质粒0.2 μg、pRL-TK质粒0.01 μg、miR-155 mimics 0.375 μL;E2F2空白对照组加入pMIR-E2F2质粒0.2 μg、pRL-TK质粒0.01 μg、miR-control 0.375 μL;E2F2目标序列组加入pMIR-E2F2质粒0.2 μg、pRL-TK质粒0.01 μg、miR-155 mimics 0.375 μL;E2F2突变序列组加入pMIR-E2F2-mu质粒0.2 μg、pRL-TK质粒0.01 μg、miRNA-155 mimics 0.375 μL),分别将各组50 μL最终混合物混匀室温孵育20 min后,加至含细胞和培养基的培养孔,轻柔震荡培养板混匀,37 ℃、5%CO2条件下孵育细胞,4 h后更换完全1640培养基,继续培养至24 h。
1.6 miR-155与SP1及E2F2 mRNA 3′-UTR结合效果检测 采用双荧光素酶活性检测实验。取各组转染后细胞,依据Dual-Luciferase报告基因检测试剂盒说明书,使用酶标仪Gen5检测各孔细胞萤火虫荧光素酶活性值(F)与海肾荧光素酶活性值(R),以F/R值作为各孔细胞的相对活性值。
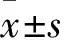
2 结果
2.1SP1、E2F2mRNA3′-UTR与miR-155靶基因的互补性TargetScan及Miranda在线预测结果示,SP1mRNA3′-UTR和E2F2mRNA3′-UTR均有与miR-155完全互补配对的序列,其中miR-155与SP1mRNA3′-UTR的98~105位点结合、与E2F2mRNA3′-UTR的1540~1547位点结合,其互补结合序列均在7个位点以上,预测二者均为miR-155的靶基因。
2.2SP1、E2F2mRNA3′-UTR报告基因载体鉴定结果 酶切鉴定示,SP1、E2F2mRNA3′-UTR重组质粒均被成功线性化,出现大小6 500bp左右的条带。测序结果证实在SP1、E2F2mRNA3′-UTR中插入的目的片段与设计片段完全相符,见图1。

图1 SP1、E2F2 mRNA 3′-UTR报告基因载体测序结果
2.3 miR-155与SP1 mRNA 3′-UTR结合效果检测 SP1空白对照组、SP1目标序列组、SP1突变序列组F/R分别为3 744.93±48.96、2 852.31±340.65、4 356.38±690.45,SP1目标序列组F/R低于SP1空白对照组及SP1突变序列组(P均<0.05),SP1空白对照组与SP1突变序列组差异无统计学意义(P>0.05)。
2.4 miR-155与E2F2 mRNA 3′-UTR结合效果检测 E2F2空白对照组、E2F2目标序列组、E2F2突变序列组F/R分别为3 640.64±611.93、2 103.35±137.12、3 066.05±245.93,E2F2目标序列组F/R低于E2F2空白对照组及E2F2突变序列组(P均<0.05),E2F2空白对照组与E2F2突变序列组差异无统计学意义(P>0.05)。
3 讨论
端粒酶激活是肿瘤发生发展的关键因素之一。正常人体只有造血细胞、干细胞和成纤维细胞等具有端粒酶活性,而在恶性肿瘤细胞中端粒酶则广泛存在。hTERT是决定端粒酶活性的关键因素,也是端粒酶的限速亚单位,它的表达受多种转录因子调控,与肿瘤的发生密切相关。SP1是由Kadonaga等[6]发现的细胞转录因子,参与细胞的生长分化、癌基因与抑癌基因的调控、细胞周期调控等多种生物学进程,与凋亡、肿瘤转移及侵袭关系密切。研究发现,转录因子SP1能与hTERT启动子特异性结合,明显增加转录活性[4],被认为是hTERT强大的转录激活因子。转录因子E2F2属于E2F转录因子家族,参与细胞周期的调控并发挥重要作用,通过调节细胞周期中靶基因的转录,从而调控细胞的增殖[7]。E2F家族可根据其在细胞周期中的作用分为两大类:激活转录作用的激活子和抑制转录作用的抑制子,其中E2F2是转录激活因子[7,8]。E2F2作为转录因子能够在体外和体内的增殖肝细胞中调节hTERT的差异性表达[5]。
miRNA自发现以来,由于其对基因的靶向调控和在生物学中的重要作用而成为研究热点[9~11]。miRNA可通过互补结合特定的mRNA 3′-UTR,从而降解目的mRNA,或抑制其转录后蛋白质翻译,负向调控靶基因的表达水平[12]。miRNA可与多种靶基因结合,一种miRNA可能调控千百种靶基因。研究发现,miRNA对于肿瘤发生发展的调控发挥重要的作用,其中miR-155被证实在多种肿瘤组织中高表达,参与肿瘤的发生、发展及侵袭。研究发现,miR-155可能通过结合多种靶基因来抑制肿瘤的发生,miR-155在肝细胞癌中高表达,通过上调癌基因胰岛素样生长因子Ⅱ、胰岛素样生长因子I型受体和下调抑癌基因胰岛素样生长因子结合蛋白3,促进肝细胞癌的增殖和迁移[13]。miR-155可通过抑制叉头状转录因子O1增加ROS的产生,从而促进非小细胞肺癌的细胞增殖[14]。miR-155还可靶向结合X连锁凋亡抑制蛋白,调控顺铂诱导的卵巢癌细胞凋亡,是增加卵巢癌干预效果的潜在治疗靶点[15]。
目前研究已证实,miRNA能够通过调控hTERT的表达来影响端粒及肿瘤的生长,如miR-1182在转录后水平通过与hTERT的开放阅读框相结合,调控hTERT的表达,抑制胃癌细胞的增殖和转移[16]。Kasiappan等[17]研究表明,在卵巢恶性肿瘤中miR-498低表达,miR-498能与hTERT的3′UTR靶向结合,抑制hTERT的mRNA水平,这可能是miRNA调节端粒酶的新机制。因此,研究miRNA在hTERT调控中的作用,对于进一步明确肿瘤的发生发展、诊断、治疗及预防具有重要意义。
目前,miRNA调控hTERT的具体机制及转录因子在该调控通路中发挥的作用尚未见报道。报告基因实验是研究miRNA对靶基因调控最常用的方法。本研究采用Targetscan在线预测方法,发现miR-155与转录因子SP1和E2F2 mRNA 3′-UTR互补配对,提示miR-155在mRNA序列水平可与SP1和E2F2互补结合并调控二者的表达;转染后SP1目标序列组F/R低于SP1空白对照组及SP1突变序列组,表明miR-155能与SP1互补结合,抑制SP1 mRNA的表达;转染后E2F2目标序列组F/R低于E2F2空白对照组及E2F2突变序列组,表明miR-155能与E2F2互补结合,抑制E2F2 mRNA的表达,以上结果表明,SP1和E2F2均是miR-155直接调控的靶基因。
综上所述,本研究成功构建了SP1和E2F2报告基因重组质粒,证实miR-155能够靶向结合SP1和E2F2 mRNA 3′-UTR,在转录后水平抑制SP1和E2F2的表达,为后续研究miR-155靶向调控肿瘤细胞hTERT的表达提供了实验依据。
[1] Blackburn EH. Switching and signaling at the telomere[J]. Cell, 2001,106(6):661-673.
[2] Bodnar AG, Ouellete M, Frolkis M, et al. Extension of life-span by introduction of telomerase into normal human cells[J]. Science, 1998,279(5349):349-352.
[3] Dhaene K, Wauters J, Weyn B, et al. Expression profile of telomerase subunits in human pleural mesothelioma[J]. J Pathol, 2000,190(1):80-85.
[4] Deeb D, Brigolin C, Gao X, et al. Induction of apoptosis in pancreatic cancer cells by CDDO-Meinvolves repression of telomerase through epigenetic pathways[J]. J Carcinog Mutagen, 2014,5:177.
[5] Sirma H, Kumar M, Meena JK, et al. The promoter of human telomerase reverse transcriptase is activated during liver regeneration and hepatocyte proliferation[J]. Gastroenterology, 2011,141(1):326-337.
[6] Kadonaga JT, Carner KR, Masiarz FR, et al. Isolation of cDNA encoding transcription factor Sp1 and functional analysis of the DNA binding domain[J]. Cell, 1987,51(6):1079-1090.
[7] Slansky JE, Farnham PJ. Introduction to the E2F family: protein structure and gene regulation[J]. Curr Top Microbiol Immunol, 1996,208(1):1-30.
[8] DeGregori J, Johnson DG. Distinct and overlapping roles for E2F family members in transcription, proliferation and apoptosis[J]. Curr Mol Med, 2006,6(7):739-748.
[9] Liu Z, Wang D, Hu Y, et al. MicroRNA-146a negatively regulates PTGS2 expression induced by Helicobacter pylori in human gastric epithelial cells[J]. J Gastroenterol, 2013,48(1):86-92.
[10] Xiao B, Liu Z, Li BS, et al. Induction of microRNA-155 during Helicobater pylori infection and its negative regulatory role in the inflammatory respons[J]. J Infect Dis, 2009,200(6):916-925.
[11] 田伟,张娟,王利娜.miR-181c在胶质母细胞瘤组织中的表达变化及其对肿瘤细胞侵袭、迁移能力的影响[J]. 山东医药,2016,56(27):1-4.
[12] Hernandez YG, Lucas AL. MicroRNA in pancreatic ductal adenocarcinoma and its precursor lesions[J]. World J Gastrointest Oncol, 2016,8(1):18-29.
[13] El Tayebi HM, Waly AA, Assal RA, et al. Transcriptional activation of the IGF-Ⅱ/IGF-1R axis and inhibition of IGFBP-3 by miR-155 in hepatocellular carcinoma[J]. Oncol Lett, 2015,10(5): 3206-3212.
[14] Hou L, Chen J, Zheng Y, et al. Critical role of miR-155/FoxO1/ROS axis in the regulation of non-small cell lung carcinomas[J]. Tumour Biol, 2016,37(4):5185-5192.
[15] Chen W, Huang L, Hao C, et al. MicroRNA-155 promotes apoptosis in SKOV3, A2780, and primary cultured ovarian cancer cells[J]. Tumour Biol, 2016,37(7):9289-9299.
[16] Zhang D, Xiao YF, Zhang JW, et al. miR-1182 attenuates gastric cancer proliferation and metastasis by targeting the open reading frame of hTERT[J]. Cancer Lett, 2015,360(2):151-159.
[17] Kasiappan R, Shen Z, Tse AK, et al. 1,25-Dihydroxyvitamin D3suppresses telomerase expression and human cancer growth through microRNA-498[J]. J Biol Chem, 2012,287(49):41297-41309.
国家自然科学基金资助项目(81170329);全军医学科技青年培育项目(15QNP049);解放军309医院院管课题(2014MS-001)。
管静芝(E-mail: jzjz1970@hotmail.com)
10.3969/j.issn.1002-266X.2016.46.009
R730.231
A
1002-266X(2016)46-0035-04
2016-05-14)
