阴沟肠杆菌产AmpC酶和ESBLs的检测及耐药性分析*
2017-01-06杨洪芬杨焕婕
杨洪芬,李 美,3,刘 宝,万 珊,杨焕婕,费 樱,3△
(1.贵州省贵阳市第二人民医院检验科 550081;2.贵州医科大学附属医院微生物免疫科,贵阳 550001;3.贵州医科大学医学检验学院,贵阳 550004)
·论 著·
阴沟肠杆菌产AmpC酶和ESBLs的检测及耐药性分析*
杨洪芬1,李 美1,3,刘 宝2,万 珊2,杨焕婕2,费 樱2,3△
(1.贵州省贵阳市第二人民医院检验科 550081;2.贵州医科大学附属医院微生物免疫科,贵阳 550001;3.贵州医科大学医学检验学院,贵阳 550004)
目的 明确阴沟肠杆菌产头孢菌素酶(AmpC酶)和超广谱β-内酰胺酶(ESBLs)的情况,分析细菌产酶与药物耐药间的关系,指导临床合理用药。方法 非重复阴沟肠杆菌共174株采用Microscan walkaway-40SI全自动细菌鉴定与药敏分析仪进行细菌鉴定及药敏试验;采用多底物协同-拮抗法(MSSAT)检测ESBLs和AmpC酶。结果 174株阴沟肠杆菌中,单产AmpC酶92株(52.87%),其中高诱导型25株,部分去阻遏型33株,完全去阻遏型22株;同时产AmpC酶和ESBLs 54株(31.03%);单产ESBLs 1株(0.57%);AmpC酶和ESBLs均不产有27株(15.52%);阴沟肠杆菌产酶株的耐药率明显高于不产酶株的耐药率(P<0.05),同时产AmpC酶和ESBLs菌株的耐药率高于单产AmpC酶株的耐药率(P<0.05);产AmpC酶和ESBLs菌株对头孢曲松、头孢噻肟、哌拉西林的耐药率均高于92.0%,对氨曲南耐药率高达88.9%,对阿米卡星耐药率较低(14.8%),对亚胺培南耐药率为0%。结论 阴沟肠杆菌以产AmpC酶为主,单产ESBLs菌株少,同时产AmpC酶和ESBLs的菌株对三代头孢菌素、单环类、青霉素类具有高度耐药性,对碳青霉烯类药物敏感;碳青霉烯类抗菌药物依然是治疗多重耐药阴沟肠杆菌感染的首选。
阴沟肠杆菌; 头孢菌素酶; 超广谱β-内酰胺酶; 耐药性
阴沟肠杆菌是医院感染常见的条件致病菌之一,可引起呼吸道、伤口、血液系统、泌尿道等多部位感染[1]。随着广谱抗菌药物的广泛使用,细菌的耐药情况变得越来越严重。大多常见致病菌对β-内酰胺类抗菌药物耐药的主要机制产生β-内酰胺酶,而阴沟肠杆菌产头孢菌素酶(AmpC酶)和超广谱β-内酰胺酶(ESBLs)是导致其对β-内酰胺类抗菌药物耐药的重要原因之一[2]。鉴于本地区对阴沟肠杆菌产AmpC酶和ESBLs检测状况的研究报道甚少,本文选用明德松等[3]建立的多底物协同拮抗法(MSSAT)检测贵阳市第二人民医院阴沟肠杆菌产AmpC酶和ESBLs的情况,分析细菌产酶与耐药间的关系,旨在为临床控制感染及临床合理使用抗菌药物提供一定的理论参考依据,现具体报道如下。
1 材料与方法
1.1 菌株来源 收集2013年6月至2014年6月临床检出的鉴定率达98.0%以上的阴沟肠杆菌共174株,去除同一病例同一部位标本的重复菌株。质控菌株:大肠埃希菌 ATCC25922、铜绿假单胞菌 ATCC27853和肺炎克雷伯菌 ATCC700603(由贵州医科大学附属医院微生物免疫科保存)。
1.2 仪器与试剂 Microscan WalkAway-40 SI全自动细菌鉴定与药敏分析仪(Siemens,德国);鉴定药敏复合检测板NC50(Siemens,德国);药敏纸片:头孢噻肟(CTX,30微克/片)、头孢噻肟/克拉维酸(CTX/CA,30/10微克/片)、头孢他啶(CAZ,30微克/片)、头孢他啶/克拉维酸(CAZ/CA,30/10微克/片)、头孢吡肟(FEP,30微克/片)、亚胺培南(IPM,10微克/片)和头孢西丁(FOX,30微克/片),均购自英国Oxoid公司。
1.3 方法
1.3.1 阴沟肠杆菌耐药性分析 细菌分离、培养按照《全国临床检验操作规程》第3版要求进行[4],采用Microscan walkaway-40SI全自动细菌鉴定与药敏分析仪和鉴定药敏复合检测板进行细菌鉴定及药敏试验,结果判读参照美国临床实验室标准化委员会2013版标准进行[5],并得出药敏数据。
1.3.2 阴沟肠杆菌产AmpC酶和ESBLs表型检测及结果判读 参照明德松等[3]建立的多底物协同拮抗法(MSSAT)进行检测及结果判读。
1.4 统计学处理 采用WHONET5.6软件和SPSS17.0软件进行统计分析,计数资料以率表示,比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 阴沟肠杆菌产不同表型AmpC酶和ESBLs MSSAT结果显示,174株阴沟肠杆菌中,单产ESBLs 1株,单产AmpC酶 92株,同时产ESBLs和AmpC酶 54株,2种酶均不产27株。见表1。
2.2 阴沟肠杆菌产酶株耐药情况 对产酶株与不产酶株耐药结果分析显示,产酶株的耐药率明显高于不产酶株的耐药率(P<0.05),同时产AmpC酶+ESBLs的阴沟肠杆菌耐药率明显高于单产AmpC酶耐药率(P<0.05),见表2。
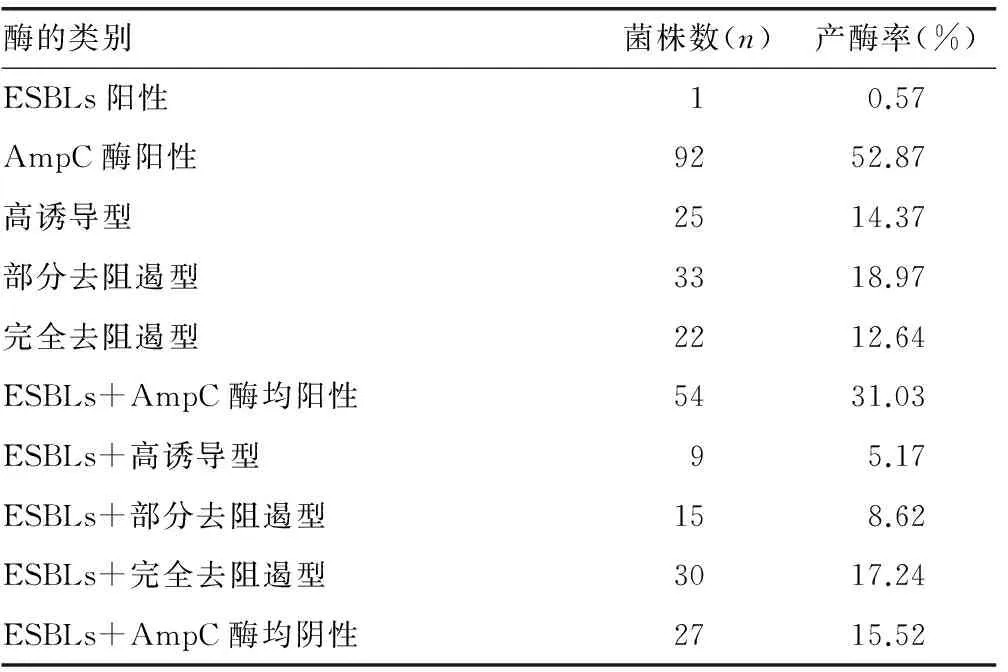
表1 174株阴沟肠杆菌的产酶率
表2 174株阴沟肠杆菌对15种抗菌药物的耐药率(%)

药物名称阴沟肠杆菌(n=174)AmpC酶阳性(n=92)AmpC酶+ESBLs均阳性(n=54)AmpC酶+ESBLs均阴性(n=27)阿米卡星5.21.114.80.0氨曲南40.820.788.911.1头孢他啶36.222.874.13.7环丙沙星20.19.844.43.7头孢曲松42.520.798.13.7头孢噻肟42.020.796.33.7头孢吡肟33.315.277.83.7庆大霉素23.010.953.70.0亚胺培南1.12.20.00.0左氧氟沙星12.13.331.53.7哌拉西林42.522.892.67.4复方磺胺甲噁唑32.816.374.13.7替卡西林/克拉维酸32.822.863.03.7妥布霉素21.39.850.00.0
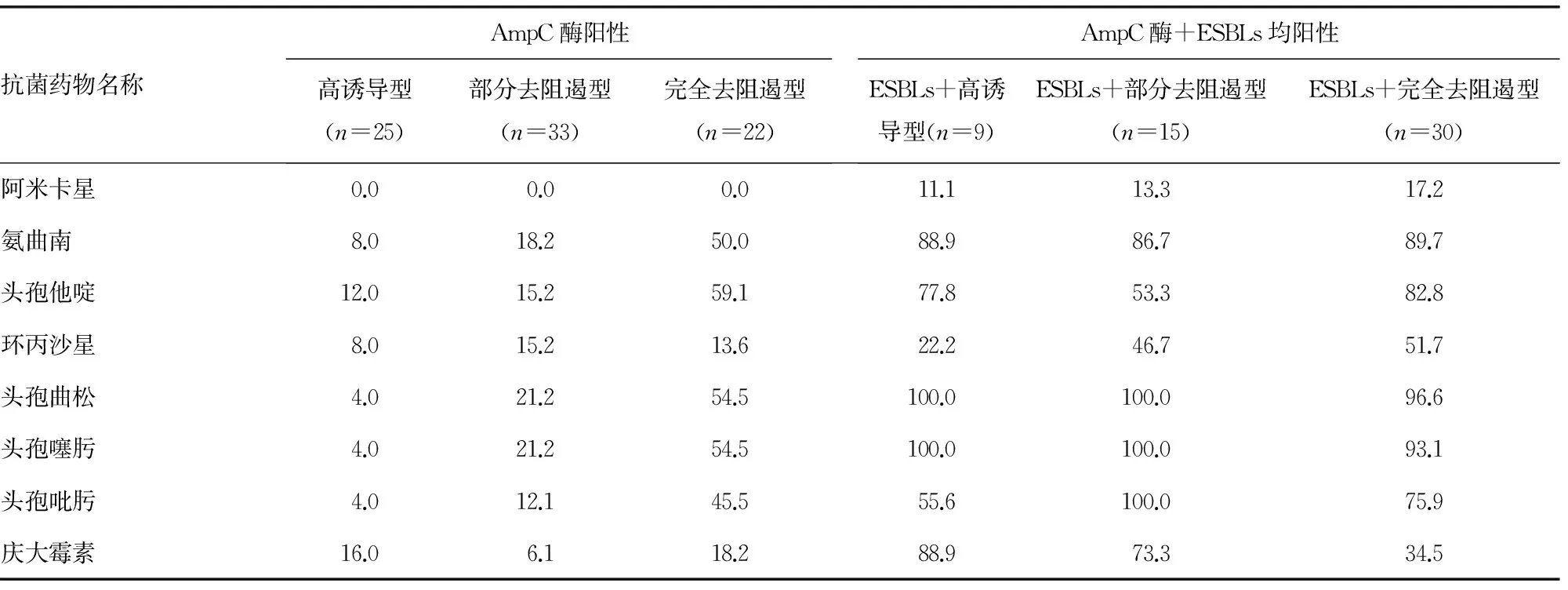
表3 阴沟肠杆菌不同表型产酶株对15种抗菌药物的耐药率(%)
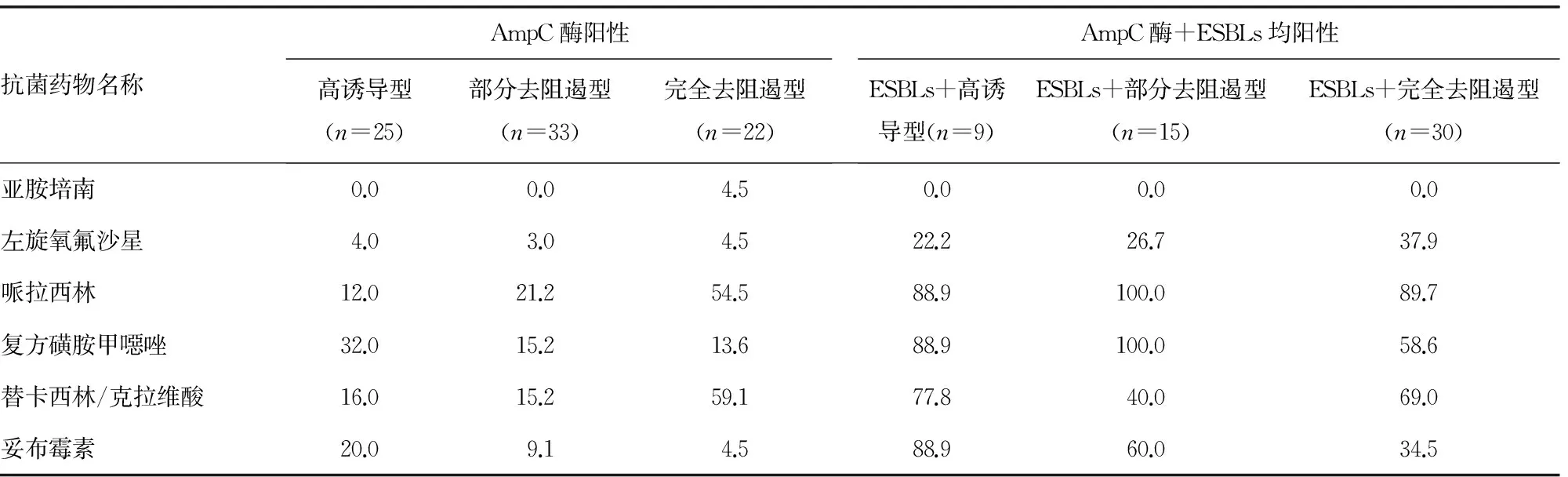
续表3 阴沟肠杆菌不同表型产酶株对15种抗菌药物的耐药率(%)
2.3 阴沟肠杆菌不同表型产酶株耐药情况 产不同表型AmpC酶的阴沟肠杆菌耐药率显示,完全去阻遏型的耐药率最高,其次是部分去阻遏型,高诱导型的耐药率最低;同时产AmpC酶及ESBLs菌株的高诱导型、部分去阻遏型、完全去阻遏型阴沟肠杆菌耐药率明显高于单产AmpC酶各型的耐药率。见表3。
3 讨 论
近来研究发现,高产AmpC酶和ESBLs是阴沟肠杆菌对β-内酰胺类抗菌药物耐药的主要机制[6]。因此,及时、正确地检测出产酶菌株具有重要的临床意义,至今尚无公认的关于阴沟肠杆菌产ESBLs和AmpC酶表型检测的确认方法。美国临床与实验室标准协会推荐的用于大肠埃希菌和肺炎克雷伯菌产ESBLs检测的双纸片确证法是检测阴沟肠杆菌产ESBLs借鉴最多的方法。目前,检测AmpC酶的方法有改良三维试验、头孢菌素初筛试验、等电聚焦及氟氯西林抑制试验等,而改良三维实验较为经典,且文献运用较多,但该方法操作繁琐,影响因素较多。MSSAT能够一步检测出产ESBLs、3种类型(高诱导型、部分去阻遏型、完全去阻遏型)AmpC酶及二者不同组合产酶情况,但对于AmpC酶存在的其他表型,此法也不能一步同时检测。本研究对产AmpC酶的不同表型结果显示,92株单产AmpC酶中,有12株阴沟肠杆菌表型出现头孢西丁耐药、亚胺培南敏感,但亚胺培南与周边5种纸片并没有出现拮抗现象而产生内外缘半径差,故而不能分型,可能是阴沟肠杆菌中还存在其他类型的AmpC酶而本法不能检测出,有待科研工作者进一步发现更加全面的检测方法。由于本实验结果是通过量取内外缘半径差来判断产不同类型的AmpC酶,测量误差对实验影响大,对内外缘半径的测量要严格,相差1 mm则就可能被判定为不同表型。为了试验结果的准确性,最好选用游标卡尺进行测量。本研究实验过程中,同时选用直径为90 mm和150 mm的M-H琼脂平板检测菌株产ESBLs与AmpC酶表型情况,结果发现使用直径为150 mm的M-H琼脂平板比使用90 mm的M-H琼脂平板更易于结果的判断,减少了因测量误差所导致的分型错误,从而提高了试验的准确性。
本次研究结果显示,174株阴沟肠杆菌中,单产AmpC酶占52.87%,高于陆丹倩等[7]报道的12.35%和赵德军等[8]报道的23.1%,低于杨月琳[9]的64.0%;同时产ESBLs与AmpC酶检出率为31.03%,均高于以上地区的相应报道。对阴沟肠杆菌在不同地区、不同医院之间产AmpC酶和ESBLs存在着的明显差异,可能与其感染情况、用药习惯、环境、医院感染及消毒隔离措施等诸多原因有关。
有研究学者将同一细菌所产生的ESBLs及质粒介导的AmpC酶称之为超超广谱β-内酰胺酶(SSBLs),其表现为对第三代头孢菌素、头霉素及酶抑制剂复合制剂均耐药[10]。本研究对阴沟肠杆菌产酶株与耐药性分析发现,同时产AmpC酶和ESBLs菌株耐药率明显高于单产AmpC酶和不产酶株的耐药率(P<0.05),同时产AmpC酶及ESBLs菌株对青霉素类的哌拉西林、三代头孢类药物头孢曲松和头孢噻肟、单环类抗菌药物氨曲南表现出高度耐药性,对四代头孢药物头孢吡肟的耐药率也高达77.8%;对喹诺酮类与氨基糖苷类抗菌药物也有较高的耐药率;对阿米卡星较敏感,对亚胺培南敏感。而单产AmpC酶菌株与非产酶株耐药率之间差异无统计学意义(P>0.05),表现为对三代头孢,氨曲南,哌拉西林等各类抗菌药物的耐药率均不高(<23%),对亚胺培南的耐药率均为100.0%。AmpC酶的强诱导剂是碳青霉烯类抗菌药物,但因其空间构象特殊,使其具有很强的抗菌活性,能在诱导产生足量AmpC酶之前快速杀灭细菌,且对AmpC酶高度稳定,所以是治疗产酶菌株感染的有效药物,可作为阴沟肠杆菌重症感染的首选抗菌药物,其次为阿米卡星,而喹诺酮类及氨基糖苷类抗菌药物对产AmpC酶和ESBLs的耐药状况各地报道不一,需根据当地药敏情况进行选择。
阴沟肠杆菌是产生AmpC酶的典型细菌[11]。抗菌药物诱导调节是染色体介导AmpC酶基因表达的一种经典模式。例如,在缺乏β-内酰胺类抗菌药物(如头孢西丁、亚胺培南等)诱导时,许多革兰阴性杆菌只产生少量的AmpC酶,但在β-内酰胺类抗菌药物存在时,AmpC酶的产量明显增加,其表型为产高诱导型AmpC酶。AmpC酶的诱导表达是由染色体上的amp复合操纵子调控的,其包括上游的调节基因ampR、ampG、ampD、ampE和结构基因ampC。当调节基因ampD发生突变时,其编码产生的AmpD蛋白的功能部分或全部丧失,致使AmpC酶表达部分或完全去阻遏效应,使得细菌持续高产AmpC酶,对应的AmpC酶表型分别为部分去阻遏型(非诱导型)和完全去阻遏型。本次研究对阴沟肠杆菌不同表型产酶株的耐药情况分析发现,单产AmpC酶的不同表型对15种抗菌药物的耐药率基本是高诱导型最低,其次是部分去阻遏型,完全去阻遏型的耐药率最高(均不超过60%),这可能是由于诱导型AmpC酶产酶率低,故其耐药率低;而同时产ESBLs及AmpC酶3种表型菌株对15种抗菌药物(亚胺培南除外)的耐药率均明显高于单产AmpC酶的3种表型菌株的耐药率(P<0.05),提示阴沟肠杆菌在产ESBLs的同时存在产AmpC酶的话,会使细菌对抗菌药物的耐药性明显提高。
综上所述,产AmpC酶和ESBLs的阴沟肠杆菌存在的多重耐药问题给临床抗感染治疗及控制耐药菌株的产生带来极大困难,及时、准确地检测阴沟肠杆菌产AmpC酶和ESBLs情况可以了解其耐药机制,对临床抗感染治疗有重要意义。当前检测AmpC酶的方法多种多样,但还没有一种国际公认的标准方法,有待广大的科研人员研究出一种简单、快速而准确的检测方法。
[1]刘琪,杨山虹,孙各琴,等.阴沟肠杆菌医院感染分布及耐药性分析[J].中国病原生物学杂志,2012,7(2):149-151.
[2]王凤霞,宿振国.阴沟肠杆菌对临床常用抗菌药物耐药机制的研究进展[J].国际流行病学传染病学杂志,2013,40(2):133-135.
[3]明德松,吴一波,谢尊金.多底物协同一拮抗法同时检测超广谱β-内酰胺酶和AmpCβ-内酰胺酶[J].中国感染控制杂志,2003,2(4):286-288.
[4]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006:357-360.
[5]中华医学会.抗菌药物敏感性试验执行标准[J].中华检验医学杂志,2013,33(1):21-23.
[6]JeongHS,BaeIK,ShinJH,etal.Prevalenceofplasmid-mediatedquinoloneresistanceanditsassociationwithextended-spectrumbeta-lactamaseandAmpCbeta-lactamaseinEnterobacteriaceae[J].KoreanJLabMed,2011,31(4):257-264.
[7]陆丹倩,顾向明,邓冲,等.阴沟肠杆菌高产AmpC酶和ESBLs的检测及其多重耐药研究[J].国际检验医学杂志,2013,34(7):870-872.
[8]赵德军,胡昭宇,武静,等.产AmpC酶及ESBLs阴沟肠杆菌的检测及耐药性分析[J].国际检验医学杂志,2011,32(10):1118-1119.
[9]杨月琳.产AmpC酶阴沟肠杆菌的检测[J].中国实验诊断学,2008,12(7):933-935.
[10]TenoverFC,MohammedMJ,GortonTS,etal.Detectionandreportingoforganismsproducingextended-spectrumbeta-lactamases:surveyoflaboratoriesinConnecticut[J].JClinMicrobiol,1999,37(12):4065-4070.
[11]王玉春.β-内酰胺类抗生素诱使阴沟肠杆菌产生β-内酰胺酶的研究[J].华夏医学,2010,23(1):96-98.
Analysis of antibiotic resistance and detection of AmpC producing and ESBLs producing E.cloacae*
YANGHongfen1,LIMei1,3,LIUBao2,WANShan2,YANGHuanjie2,FEIYing2,3△
(1.DepartmentofClinicalLaboratory,GuiyangMunicipalSecondPeople′sHospital,Guiyang,Guizhou550081,China;2.DepartmentofMicroorganismandImmunology,AffiliatedHospitalofGuizhouMedicalUniversity,Guiyang,Guizhou550001,China;3InstituteofClinicalLaboratory,GuizhouMedicalUniversity,Guiyang,Guizhou550004,China)
Objective To determine the situation of E.cloacae for producing extented spectrum beta-lactamases(ESBLs) and cephalosporinase (AmpC) and to analyze the relationship between bacterial enzyme production and drug resistance for guiding rational drug use in clinic.Methods A total of 174 strains of non-repetitive E.cloacae were performed the identification and drug susceptibility test by adopting the Microscan walkaway 40SI fully automatic bacterial identification and drug susceptibility analyzer;the multi-substrates synergy-antagonize test(MSSAT) was used for detecting ESBLs and AmpC.Results Among 174 strains of E.cloacae,92 strains(52.87%) only produced AmpC,25 strains produced highly inducible AmpC,33 strains produced partially derepressed AmpCs and 22 strains produced completely derepressed AmpCs;54 strains(31.03%) produced both AmpC and ESBLs;1 strain (0.57%) only produced ESBLs;27 strains(15.52%) did notproduced AmpC and ESBLs.The drug resistance rate of enzyme producing E.cloacae strains was significantly higher than that of non-enzyme producing E.cloacae strains (P<0.05).The resistance rate of both AmpC producing and ESBLs producing strains was significantly higher than that of only AmpC producing strains(P<0.05).The resistance rates of E.cloacae producing both AmpC and ESBLs to ceftriaxone,cefotaxime and piperacillin were more than 92.0%,which to aztreonam was up to 88.9%,which to amikacin was relatively low(15.1%) and which to imipenem was 0%.Conclusion E.cloacae is dominated by AmpC producing,simply producing ESBLs strains is little.Both AmpCs and ESBLs producing E.cloacae strain shows high drug resistance to third generation cephalosporin,single ring antibiotics and penicillins,and sensitive to carbapenem drugs.Carbapenem antibacterial drugs are still the first choice for treating multi-drug resistant E.cloacae infection.
Enterobacter cloacae; AmpC; extented spectrum beta-lactamase; drug resistance
贵州省贵阳市科技局基金资助项目(筑科合同[20151001]社34号)。
杨洪芬,女,主任技师,主要从事病原生物学检测研究。△
,E-mail:645903661@qq.com。
10.3969/j.issn.1673-4130.2016.24.006
A
1673-4130(2016)24-3400-04
2016-09-01
2016-10-20)
