植物木质素的合成与调控研究进展
2017-01-05丁霄曹彩荣李朋波吴翠翠曹美莲杨六六
丁霄,曹彩荣,李朋波,吴翠翠,曹美莲,杨六六
(山西省农业科学院棉花研究所,棉花种质资源利用与分子设计育种山西省重点实验室,山西运城044000)
植物木质素的合成与调控研究进展
丁霄,曹彩荣,李朋波,吴翠翠,曹美莲,杨六六
(山西省农业科学院棉花研究所,棉花种质资源利用与分子设计育种山西省重点实验室,山西运城044000)
木质素作为植物次生细胞壁的重要组分,分布于输导组织和木质化组织细胞壁中,不仅具有提高细胞壁的隔水性和机械强度,而且在提高植物的抗病抗逆方面也发挥着重要作用。对植物木质素的种类、合成调控和利用基因工程从源头调控植物木质素含量等方面的研究现状进行了概述;随着转基因技术的发展,有望通过更多更有效的途径来改变植物木质素的组成。
木质素;合成与调控;基因工程
木质素是植物经类苯丙酸途径合成的单体经进一步分化形成的3个苯丙烷衍生物通过化学键聚合而成的高分子化合物[1]。其大量存在于植物的木质部纤维素纤维之间,通过形成交织网来硬化细胞壁,能够使木质部维持极高的硬度,以形成植株的形态,承载整株植物的重量,并形成较强的抗压能力,因此,木质素在维管植物的进化中发挥着重要作用[2]。在木本植物中,木质素占25%~30%;在草本植物中,木质素占16%;在自然界有机物中的含量仅次于纤维素,是植物转化太阳能形成的重要有机物之一[3]。此外,木质素还密切参与植物的生长过程,如水分运输、抗病及对逆境的适应能力[4]。
1 木质素结构的单体类型
组成木质素的单体类型主要有香豆醇、松柏醇和芥子醇3种木质醇,这3种木质醇是苯丙烷衍生物经不同的羟基化和甲基化进而形成的并通过不同化学键连接而成[5]。3种木质醇香豆醇、松柏醇与芥子醇进一步形成香豆醇残基型(p-hydroxyphenyl H)木质素、松柏醇残基型(guaiacyl G)木质素和芥子醇残基型(syringyl S)木质素(图1),形成的木质素残基通过共价方式如醚键(-O-)与碳-碳键(C-C)2种方式连接起来[6]。
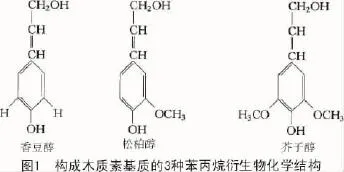
不同的植物类群中,木质素所占的比例及其3种不同类型成分的百分比也不尽相同。G型木质素主要由松柏醇聚合而成,该类植物存在于蕨类植物与裸子植物;G-S型木质素主要由松柏醇与芥子醇聚合而成,该类植物存在于双子叶植物;H-G-S型木质素不同程度地包含了3种木质醇单体,该类植物主要是单子叶植物[7]。不仅不同物种间木质素的组成有差异,同一物种在不同时期不同部位其木质素的组成也是不同的,在同一物种间木质素的差异往往需要借助细胞水平上的检测手段如组织细胞化学染色、紫外光谱学及利用细胞壁免疫抗体等手段进行检测分析和相对测定[8]。除了上述常见的3种木质素单体外,自然界中还存在少量其他类型的木质素单体参与木质素的合成,如自由基偶联产生的阿魏酸脱氢二聚体及乙酰化的木质素单体[9]。
2 木质素的功能
作为植物次生细胞壁的重要组成成分之一,木质素在植物中具有抗倒伏、保证水分养分输送的功能。木质素渗入到由纤维素、半纤维素等大分子构成的细胞壁骨架中并与之互相结合,从而增加了细胞机械强度,进而提高茎秆组织的抗倒伏能力[10]。通过抑制木质素合成途径相关的基因,发现在双子叶和单子叶植物细胞中的木质素含量均出现下降,伴随木质素含量的下降,植物细胞壁的抗压强度下降并出现细胞壁坍塌现象[11]。胡丹等[12]测定不同抗倒性甜荞木质素含量发现,在不同时期木质素含量的多少与甜荞的倒伏性状均呈显著相关。木质素作为高分子聚合物,其所具有的不溶于水的特性使得构成植物维管部的细胞壁具有疏水性,保证了植物中的水分、溶解其中的矿物质及有机物等能够通过植物维管系统实现长距离输送[13]。
木质素与植物的抗病性具有密切的关系[14]。木质素技揳入到由纤维素等物质构成的细胞壁骨架中形成物理屏障,进一步降低了病原菌及其多种变种的入侵,在细胞结构水平上提高了植物对病原菌及害虫的防御能力[14-16]。吴立柱等[17]研究黄萎病对棉花导管的影响发现,抗病品种导管中木质素含量相较于感病品种高,因此抗病棉花品种在接种黄萎病菌后,输送水分养分的导管未发生明显堵塞。许勇等[18]对西瓜接种枯萎病病菌,发现在抗病西瓜品种中枯萎病病菌诱导西瓜的组织结构抗性,结果显示,木质素在根茎的维管束病害抗性中具有重要地位。毛爱军等[19]通过水杨酸处理研究辣椒抗疫病的生化机制,结果显示,木质素含量与抗病性显著相关,其中,相同辣椒品种经水杨酸处理相较于对照,木质素含量升高,抗病性增强。方东鹏等[20]对大豆的研究表明,在正常情况下,不同抗性的野生大豆品种木质素的含量差异不显著,但分别接种大豆疫霉菌后,感病初期(12 h)抗病性强的野生大豆品种比感病品种木质素含量平均增加50%。在丹参的木质素合成研究中发现,接种病原菌后丹参木质素合成基因SmCCR2随着时间的推移呈周期性波动,说明木质素参与到丹参的抗病过程[21]。
木质素参与植物对低温胁迫的响应。研究发现,鸭儿芹经低温处理后,木质素合成基因CjHCT显著下降,木质素含量减少[22],同时对木质素合成基因CjC4H研究发现,该基因高温条件下响应迅速,低温条件下表达推迟,并且低温条件下鸭儿芹表现出更加脆嫩的商品价值[23];通过1-MCP抑制枇杷果实中木质素的合成可有效减缓枇杷果实的冷害性状[24],因此,抑制木质素的合成可以有效提高商品作物冷链储藏时间。
在棉花中的研究显示,调控木质素合成的NAC类转录因子GhNAC12,GhNAC20明显受到低温诱导[25];对比不同抗冻能力的杨树品种,抗冻能力强的杨树品种在低温条件下木质素含量提升显著,而较弱的杨树品种在低温条件下木质素含量差异不显著[26],因此,通过提高木质素含量进而减少植物在低温条件下电解液的渗出,或是通过提高木质素前体物质的合成,减少氧化物对植物的毒害来应对低温胁迫都存在可能。
3 木质素合成过程的关键基因
前人的研究结果显示,莽草酸途径、类苯丙酸途径和特异途径是生物体中合成木质素的必经过程。第1步是植物通过光合作用形成的葡萄糖转化为酪氨酸与色氨酸等芳香族氨基酸即莽草酸途径[27];第2步将第一步所形成的化合物经过脱氨基、羟基化与甲基化等步骤,将芳香族氨基酸转化为羟基肉桂酸类化合物(Hydroxycinnamic acids,HCAs)及羟基肉桂酸酯酞辅酶A类化合物(Hydroxycinnamic acid Coenzyme A,HCA-CoA)即类苯丙酸途径;最后一步是将第2步形成的HCAs及HCA-CoA还原为木质醇单体即木质素合成的特异途径,形成的单体再通过氧化聚合作用形成木质素[28]。在合成木质素的过程中,第2步和第3步起主要作用,因此,类苯丙酸途径和特异途径成为研究木质素合成的关键所在[29](图2)。
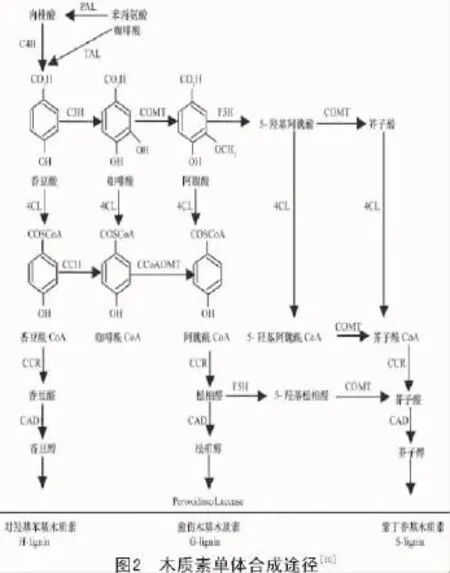
最近几年的研究表明,木质素合成的总量与苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)、肉桂酸-4-羟基化酶(cinnamate-4-hydroxylase,C4H)和4-香豆酸辅酶A连接酶(4-Coumarate: CoA ligase,4CL)生成量及其活性的水平密切相关[12];而木质素的特异性与阿魏酸5-羟基化酶(ferulate 5-hydroxylase,F5H)、咖啡酸/5-羟基阿魏酸O-甲基转移酶(caffeicacid O-methyltransfenase,COMT)和咖啡酰辅酶A/5-羟基阿魏酰辅酶A O-甲基转移酶(caffeoyl-CoA O-methyltransfenase,CCoAOMT)这3种酶紧密相关,决定了3种不同的单体在木质素结构中所占比例[31]。
3.1 苯丙氨酸解氨酶(PAL)
PAL位于类苯丙酸途径的源头(图2),除了参与木质素合成途径外,同时还参与香豆酸酯类和类黄酮等次生物质的合成,因此,PAL同时也是合成其他酚类物质的必经途径,并非只是单一控制植物木质素的合成。尽管PAL作为木质素合成的限速步骤之一,但对PAL的抑制研究显示,转基因植物在木质素合成受到抑制的同时也破坏了植物对其所处逆境的应答响应机制,因此,通过基因工程改变PAL进而改善作物性状的成果较少[32]。但通过外源激素处理手段增强PAL的表达进而提高木质素含量,最终实现竹根姜抗病性提高[33]。此外,Xu等[34]通过转录组测序技术发现,在侵染了黄萎病病菌后,棉花感、抗品种间PAL表达差异十分显著,因此,通过启动子改造不失为一种更有效的途径。
3.2 肉桂酸-4-羟基化酶(C4H)
C4H是一类单加氧酶,在木质素合成途径中位于PAL之后,催化肉桂酸转化为香豆酸即木质素单体的前体,PAL和C4H被认为是苯丙氨酸转为香豆酸的唯一途径,但与PAL一样,C4H除了参与木质素的代谢合成也参与植物其他酚类物质的合成。对C4H的转基因植物研究显示,抑制C4H并未出现植物生长异常,但改变了木质素单体S/G的值,尤其是降低了木质素单体S的含量,推测木质素单体G很可能存在其他的通路来进行补偿或者C4H与其他酶形成复合酶进行木质素单体S的合成[35]。
3.34 -香豆酸辅酶A连接酶(4CL)
4CL催化不同底物如香豆酸、咖啡酸、阿魏酸和肉桂酸等的羟基苯乙酸形成相应的CoA酯,位于类苯丙烷代谢途径中控制形成不同木质素单体类型的转折点,是调控木质素单体合成的关键酶[36]。目前,已在多种植物中发现并克隆验证的了4CL的功能,抑制4CL的表达可明显降低转基因植物中木质素的含量且转基因材料表现出明显的生长加快现象,可能与木质素含量降低生物量不变导致纤维素含量增加有关[37]。同时,转基因植物细胞壁出现明显的颜色变化,说明其分子结构已发生明显的变化并呈褐色,因此,可以利用4CL基因改变茎秆木质部颜色的特征挖掘其作为植物安全筛选标记的应用潜力。
3.4 阿魏酸5-羟基化酶(F5H)
F5H为S型木质素合成的唯一环节。Marita等通过研究拟南芥f5h缺失突变体发现,其木质素主要由G型木质素组成,过表达F5H将极大地提高S型木质素的含量并提高S/G的比值,因此,F5H为合成S型木质素的关键限速酶之一[38]。对F5H的表达研究发现,F5H存在于植物茎秆的微粒体中,在茎秆的木质部特别是厚壁组织中活性最高[32]。
3.5 咖啡酸/5-羟基阿魏酸-O-甲基转移酶(COMT)
COMT可以催化3类底物即咖啡酸、5-羟基松柏醛、5-羟基松柏醇甲基,其催化产物分别形成阿魏酸、芥子醛和芥子醇(图2)。将绿竹中的COMT通过农杆菌侵染烟草反义抑制烟草中的COMT表达,转基因烟草中出现木质素含量下降、茎秆变红以及植株矮化现象[39]。抑制玉米中的COMT表达后玉米木质素含量尤其是S型木质素含量显著降低,进而改善玉米的饲用价值[40]。Rastogi等[41]通过将白杨中得到的COMT抑制银合欢中的COMT表达,发现在转基因银合欢中木质素含量下降并出现纤维素增加的性状,其中木质素的减少主要是由S型木质素含量的下降造成的。通过RNAi技术干扰丹参中COMT的表达,结果显示,转基因丹参中木质素和S型木质素含量均出现下降[42]。植物中的COMT活性将直接影响转基因植物中的S型木质素的合成,证明COMT通过对S型木质素前体的合成进而实现对S型木质素的控制。同时,COMT的表达也具有时空特异性,在植物木质部中大量表达,在叶中几乎检测不到COMT。
3.6 咖啡酰辅酶A/5-羟基阿魏酰辅酶A O-甲基转移酶(CCoAOMT)
CCoAOMT通过控制咖啡酰CoA转化成阿魏酰CoA来调控植物木质素的合成及类型。对CCoAOMT转基因植物研究显示,抑制CCoAOMT合成的同时对S型木质素和G型木质素的合成形成抑制,但对G型木质素的抑制尤为明显,进而提高了S/G的值。Li等[43]通过RNA干扰技术抑制玉米中的CCoAOMT,结果显示,转基因玉米中木质素含量下降22.4%,纤维素含量提高23.3%,S/G的值提高57.08%。研究新西兰松ccoaomt缺失突变体和RNAi干扰材料证明,CCoAOMT对木质素合成具有调控的作用[44],利用竺麻CCoAOMT构建植物干扰表达载体分别对烟草和亚麻进行转化,转基因烟草和亚麻木质素含量均出现下降[29]。因此,CCoAOMT主要是通过对G型木质素的合成控制进而改变木质素的含量。CCoAOMT在棉花中各个部位均有表达,以茎秆中的表达量为最高[45]。
4 调控木质素合成的转录因子
在木质素的合成调控网络中存在许多对木质素合成相关基因进行调控的转录因子,其中主要有MYB类转录因子和NAC类转录因子。
4.1 MYB类转录因子
MYB类转录因子的特点是在其N端有一处串联不同的MYB结构域(R1,R2,R3)并根据不同的串联分为3个亚类。MYB结构域通过Helix-Turn-Helix(HTH)与DNA中的大沟结合。同时在其C端有一处由酸性氨基酸组成通过折叠成双亲的α-螺旋形成的转录激活区。
MYB类转录因子已在拟南芥中证明参与了植物木质素的调控,如R2R3型和LIM[46]等通过结合参与苯丙烷途径的基因PAL,C4H,4CL,C3H,CCoAOMT,CCR和CAD启动子区中存在的AC元件发挥调控作用,上述基因的启动子区均含有包括AC-Ⅰ(ACCTACC),AC-Ⅱ(ACCAACC)或AC-Ⅲ(ACCTAAC)中一个或多个AC元件[47],这种转录因子通过与苯丙烷途径基因的启动子结合使得整个苯丙烷代谢受到统一的调控[48]。已有的研究结果也证明了上述结论,如在拟南芥中2个myb103突变体中,F5H的表达受到抑制,导致了转基因拟南芥中S型木质素含量下降,G型木质素含量增加,转录因子MYB103通过对F5H的调控被证明是木质素合成所必需的;在myb32突变体中,COMT的表达量上升,转录因子MYB32通过抑制COMT的表达实现对木质素合成的调控;Omer等[49]将银合欢中的转录因子LlMYB1转入烟草中过表达,发现转基因烟草中的木质素含量显著降低;在杨树的次生细胞壁形成区域转录因子Ptt MYB21a表达量较高,通过转基因抑制杨树转录因子PttMYB21a的生成使得转基因材料中CCoAOMT表达量升高,证明转录因子PttMYB21a抑制CCoAOMT的转录[50];在转基因烟草中过表达MYB308和MYB330发现,4CL1,C4H和CAD的表达量下降,进而导致转基因烟草中木质素含量下降,证明转录因子MYB308和MYB330是4CL1,C4H和CAD的负调控因子[51];在石榴种皮木质素含量的研究中发现,PgMYB表达量与木质素含量及籽粒硬度呈显著负相关,表明PgMYB对石榴中的木质素呈负调控[52]。
4.2 NAC类转录因子
NAC类转录因子在植物体中存在多种功能,对木质素的调控只是其中的一类,其结构特点是在N端有150个氨基酸组成的保守性NAC结构域,其C端是差异较大的转录激活区。NAC类转录因子通过与调控木质素合成的MYB类转录因子的结合进而间接对木质素生物合成进行调控,由于NAC位于木质素调控网络的上游,因此,通过NAC调控还存在很多不确定性,目前已在模式植物拟南芥中克隆验证了部分NAC类转录因子参与木质素合成的调控[53]。NST1(NAC secondary wall thickening promoting factor1,NST1)是在拟南芥中发现的参与植物木质素合成调控的NAC类转录因子,通过在拟南芥中过表达NST1发现转基因材料中的木质素含量提高[54];SND1(secondary wall-associated nac domain protein,SND1)主要是控制纤维素的,通过转基因过表达NAC类转录因子SND1发现其也影响木质素在细胞壁中的沉积[55]。
除了上述两大类转录因子外,还有其他的转录因子参与植物木质素的调控。如WRKY类转录因子与MYB类转录因子相似,与NST2的启动子区结合,通过对髓细胞中木质素的沉积进行负调控[16],实现对植物木质素的调控作用[56];bHLH(Basic helix-loop-helix)类转录因子在拟南芥中过表达,表现出MYB83,MYB46和MYB63等转录水平升高,进而降低4CL1,HCT,COMT,PAL1和CCR1的表达量,使得转基因植株的木质素含量显著降低,因而,SbbHLH1在调控木质素代谢中的地位大于MYB[56]。
5 展望
由于调控木质素合成途径的很多关键酶如CCoAOMT,F5H,COMT以及4CL在许多植物中往往是多拷贝,利用转基因过表达木质素调控相关基因往往由于同源抑制无法获得提高木质素含量或改变木质素结构组成的预期效果,结果是过表达与反义核酸表现一致,因此,采用共抑制、反义抑制技术在实现对木质素合成的分子调控更有效[57]。但木质素的合成调控是一个很大的代谢网络,具有很强的可塑性和替补性,当其合成代谢发生异常时,往往会存在其他的补偿机制以保证木质素在植物体内的生理功能。随着多个物种基因序列的公布,可以实现对木质素合成调控相关基因的精确定位,并进行序列差异性、多态性、内含子剪切及启动子方面的分析[58-59],并利用基因组编辑技术[60]进行定向诱变,避免多倍体植物中存在的同源抑制现象,以期获得抗病抗倒伏植物材料。
[1]程华.银杏黄酮和木质素代谢相关基因功能分析[D].南京:南京林业大学,2012.
[2]谷振军.赤桉木质素单体合成途径的基因家族研究[D].长沙:中南林业科技大学,2014.
[3]曾育才,张学先,刘小玲.造纸黑液木质素及其综合利用[J].广东化工,2005,32(10):17-20,81.
[4]李晓荣.东方百合木质素合成相关基因的克隆及功能分析[D].南京:南京林业大学,2009.
[5]Ralph J,Mackay J J,Hatfield R D,et al.Abnormal lignin in a loblollypine mutant[J].Science,1997,277:235-239.
[6]蔺占兵.小麦肉桂酰辅酶A还原酶(CCR)基因的分离和功能分析[D].北京:中国科学院研究生院(植物研究所),2003.
[7]Faix O.Classification of lignins from different botanical origins by ft-ir spectroscopy[J].Holzforschung-international Journal of the Biology,Chemistry,Physics and Technology of Wood,1991,45(S1):21-28.
[8]石坚.OsSHN1和OsMYB48参与水稻木质素合成调控的研究[D].武汉:华中农业大学,2014.
[9]赵华燕.利用反义RNA技术进行木质素生物合成调控的研究[D].北京:中国科学院研究生院(植物研究所),2004.
[10]陈晓光,史春余,尹燕枰,等.小麦茎秆木质素代谢及其与抗倒性的关系[J].作物学报,2011,37(9):1616-1622.
[11]Li X,Chapple C.Understanding lignification:challenges beyond monolignol biosynthesis[J].Plant Physiology,2010,154(2):449-452.
[12]胡丹,刘星贝,汪灿,等.不同抗倒性甜荞茎秆木质素合成关键酶基因的表达分析[J].中国农业科学,2015,48(9):1864-1872.
[13]师竹娟.甘蓝型油菜木质素单体合成基因COMT和F5H的克隆及表达调控[D].北京:中国农业科学院,2006.
[14]武青山,武峻新,申琼.不同基因型西葫芦感病毒病前后几种酶活性的变化[J].山西农业科学,2013,41(12):1368-1371.
[15]李尧臣,戚存扣.抗倒伏甘蓝型油菜(Brassica napus L.)木质素含量及木质素合成关键基因的表达[J].江苏农业学报,2011,27(3):481-487.
[16]郭光艳,柏峰,刘伟,等.转录因子对木质素生物合成调控的研究进展[J].中国农业科学,2015,48(7):1277-1287.
[17]吴立柱,王省芬,张艳,等.酸不可溶性木质素和漆酶在棉花抗黄萎病中的作用[J].作物学报,2014,40(7):1157-1163.
[18]许勇,王永健,葛秀春,等.枯萎病菌诱导的结构抗性和相关酶活性的变化与西瓜枯萎病抗性的关系[J].果树科学,2000,17(2):123-127.
[19]毛爱军,王永健,冯兰香,等.水杨酸诱导辣椒抗疫病生化机制的研究[J].中国农学通报,2005,21(5):219-222,468.
[20]方东鹏,靳立梅,董利东,等.野生大豆接种大豆疫霉菌后木质素含量的变化[J].大豆科学,2015,34(1):99-102.
[21]陈尘,王政军,曹鑫林,等.丹参肉桂酰辅酶A还原酶基因克隆与生物信息学分析[J].西北植物学报,2011,31(10):1963-1968.
[22]吴雪君,谭国飞,徐志胜,等.鸭儿芹羟基肉桂酸转移酶基因的克隆及其对不同温度的响应[J].西北植物学报,2015,35(7):1289-1296.
[23]谭国飞,王枫,王广龙,等.鸭儿芹肉桂酸4-羟化酶基因的克隆与不同温度下的表达分析[J].西北植物学报,2014,34(7):1298-1304.
[24]孙旭科.枇杷果实冷藏过程中细胞壁代谢机理及生物保鲜剂的研究[D].金华:浙江师范大学,2013.
[25]李鹏.转录因子NAC1在棉花纤维中的表达及在次生壁发育中的功能研究[D].武汉:华中师范大学,2011.
[26]张静波.杨树抗冻性生理学基础及低温诱导对烂皮病发生的影响[D].哈尔滨:东北林业大学,2009.
[27]Tsai C J,Kayal W E,Harding S A.Populus,the newmodel system for investigatingphenylpropanoid complexity[J].International Journal ofApplied Science and Engineering,2006,4(3):221-233.
[28]Boerjan W,Ralph J,Baucher M.Lignin biosynthesis[J].Annual ReviewofPlant Biology,2003,54(1):519-546.
[29]邓晶.苎麻CCoAOMT基因干扰表达载体构建及其遗传转化[D].长沙:湖南农业大学,2008.
[30]李魏,谭晓风,陈鸿鹏.植物肉桂酰辅酶A还原酶基因的结构功能及应用潜力[J].经济林研究,2009,27(1):7-12.
[31]Humphreys J M,Hemm M R,Chapple C.New routes for lignin biosynthesis defined by biochemical cCharacterization of recombinantferulate5-hydroxylase,amultifunctionalcytochrome P450-dependent monooxygenase[J].Proceedings of the National AcademyofSciences,1999,96(18):10045-10050.
[32]金顺玉.毛竹四个木质素合成相关酶基因的克隆及组织特异性表达分析[D].北京:中国林业科学研究院,2009.
[33]周大祥,熊书.外源茉莉酸甲酯诱导竹根姜对青枯菌的抗性[J].西北植物学报,2015,35(7):1415-1420.
[34]Xu L,Zhu L,Tu L,et al.Lignin metabolism has a central role in the resistance ofcotton tothe wilt fungus verticilliumdahliae as revealed by rna-seq-dependent transcriptional analysis and histochemistry[J].Journal of Experimental Botany,2011,62(15):5607-5621.
[35]陈安和.甘蓝型油菜及其亲本物种C4H基因家族克隆及比较基因组学研究[D].重庆:西南大学,2006.
[36]倪志勇,王娟,吕萌,等.棉花4-香豆酸辅酶A连接酶基因克隆及原核表达[J].西北植物学报,2010,30(3):429-436.
[37]龙松华,李翔,陈信波,等.亚麻4CL基因克隆及RNAi遗传转化[J].西北植物学报,2014,34(12):2405-2411.
[38]Marita J M,Ralph J,Hatfield R D,et al.Nmr characterization of lignins in arabidopsis altered in the activity of ferulate 5-hydroxylase[J].Proceedings of the National Academyof Sciences,1999,96(22):12328-12332.
[39]李雪平,彭镇华,高志民,等.抑制COMT基因表达对转基因烟草木质素合成的影响[J].分子植物育种,2012,10(6):689-692.
[40]Pichon M,Deswartes C,Gerentes D,et al.Variation in lignin and cell wall digestibility in caffeic acid O-methyltransferase downregulated maize half-sib progenies in field experiments[J].Molecular Breeding,2006,18(3):253-261.
[41]Rastogi S,Dwivedi U N.Down regulation of lignin biosynthesis in transgenic leucaena leucocephala harboring O methyltransferase gene[J].BiotechnologyProgress,2006,22(3):609-616.
[42]刘晓晶.RNA干扰抑制的肉桂酰辅酶A还原酶和咖啡酸转移酶还原酶对丹参木质素沉积及水溶性次生代谢物影响[D].西安:陕西师范大学,2010.
[43]Li X,Chen W,Zhao Y,et al.Downregulation of caffeoyl-coa O-methyltransferase(ccoaomt)by rna interference leads to reduced lignin production in maize straw[J].Genetics and Molecular Biology,2013,36(4):540-546.
[44]Wagner A,Tobimatsu Y,Phillips L,et al.CCoAOMT suppression modifies lignin composition in pinus radiata[J].The Plant Journal,2011,67(1):119-129.
[45]倪志勇,吕萌,马文静,等.棉花咖啡酰辅酶A-O-甲基转移酶基因的克隆及表达[J].西北植物学报,2009,29(10):1946-1953.
[46]Rogers L A,Dubos C,Surman C,et al.Comparison of lignin deposition in three ectopic lignification mutants[J].New Phytologist,2005,168(1):123.
[47]M M,D O,R S.Isolation of a cdna and a genomic clone encoding cinnamate 4-hydroxylase fromarabidopsis and its expression manner in planta[J].Plant Physiology,1997,113(3):755-763.
[48]Sablowski R W,Moyano E,Culianez-macia F A,et al.A flower-specific MYBprotein activates transcription ofphenylpropanoid biosynthetic genes[J].EmboJournal,1994,13(1):37-128.
[49]Omer S,Kumar S,Khan B M.Over-expression of a subgroup 4 R2R3 Type MYB transcription factor gene from leucaena leucocephala reduces lignin content in transgenic tobacco[J].Plant Cell Reports,2013,32(1):161-171.
[50]Karpinska B,Karlsson M,Srivastava M,et al.MYB transcription factors are differentially expressed and regulated during secondary vascular tissue development in hybrid aspen[J].Plant Molecular Biology,2004,56(2):255-270.
[51]Tamagnone L,Merida A,Parr A,et al.The Am MYB308 and Am-MYB330 transcription factors from antirrhinum regulate phenylpropanoid and lignin biosynthesis in transgenic tobacco[J].The Plant Cell,1998,10(2):135-154.
[52]曹丹琴,杨健,关晓弯,等.石榴种皮木质素合成相关转录因子基因PgMYB的克隆与表达[J].西北植物学报,2015,35(1):23-29.
[53]邢国芳,张雁明,张魏斌,等.植物NAC转录因子的研究进展[J].山西农业科学,2012,40(4):409-411,423.
[54]Mitsuda N,Seki M,Shinozaki K,et al.The NAC transcription factors NST1 and NST2 of arabidopsis regulate secondary wall thickenings and are required for anther dehiscence[J].The Plant Cell,2005,17(11):2993-3006.
[55]Zhong R,Lee C,Ye Z.Functional characterization of poplar wood-associated NACdomain transcription factors[J].Plant Physiology,2010,152(2):1044-1055.
[56]Yan L,Xu C,Kang Y,et al.The heterologous expression in Arabidopsis thaliana of sorghum transcription factor SbbHLH1 downregulates lignin synthesis[J].Journal of Experimental Botany,2013,64(10):3021-3032.
[57]王进.亚麻(Linum usitatissimum)木质素合成关键酶基因的克隆及表达分析[D].北京:中国农业科学院,2009.
[58]Hang J,Wan R,Yan C,et al.Structural basis of pre-mRNA splicing[J].Science,2015,349:1191-1198.
[59]Yan C,Hang J,Wan R,et al.Structure of a yeast spliceosome at 3.6-angstromresolution[J].Science,2015,349:1182-1191.
[60]孟志刚,王艳玲,孟钊红,等.利用CRISPR-Cas9系统定向诱变棉花精氨酸酶基因[C]//2015年棉花学会论文集.昌吉:中国棉花学会,2015.
Research Progress on Synthesis and Regulation of Plant Lignin
DINGXiao,CAOCairong,LI Pengbo,WUCuicui,CAOMeilian,YANGLiuliu
(Shanxi KeyLaboratoryofCotton GermplasmResources Utilization and Molecular Design Breeding,Institute ofCotton,Shanxi AcademyofAgricultural Sciences,Yuncheng044000,China)
Lignin is an important component of secondary cell wall in vascular plants and has important biological functions.The lignin distributes in machinery organization and conducting tissue in plant cell wall,which not only increases cell wall strength,improves the cell wall impermeability and the mechanical strength of the stalk,but also plays an important role in terms of resistant cells.The advanced researches on types,synthetic regulation and control plant lignin from the source by transgenic technology were reviewed.With the development of transgenic technology,it was expected to change the composition of plant lignin by more and more effective way.
lignin;synthesis and regulation;genetic engineering
Q943.2
A
1002-2481(2016)09-1406-06
10.3969/j.issn.1002-2481.2016.09.43
2016-03-16
山西省农业科学院院育种项目(Yyzjc1502);山西省财政支农项目(2015ZYZX-06);山西省农业科学院重点攻关项目(YGG1635)
丁霄(1986-),男,山西运城人,助理研究员,硕士,主要从事棉花分子育种研究工作。李朋波为通信作者。
