1,8-萘二甲酰亚胺衍生物NA-17对肝癌细胞株HepG2的体外抗肿瘤作用研究
2017-01-05吴亦明
吴亦明
(1. 广西师范大学生命科学学院,广西桂林541006;2. 广西师范大学化学与药学学院,广西桂林541004)
1,8-萘二甲酰亚胺衍生物NA-17对肝癌细胞株HepG2的体外抗肿瘤作用研究
吴亦明
1,李亮萍2,曾淑兰2,李晓红2,周祖平1,彭 艳2
(1. 广西师范大学生命科学学院,广西桂林541006;2. 广西师范大学化学与药学学院,广西桂林541004)
本文对1,8-萘二甲酰亚胺衍生物NA-17(N-(3,4-亚甲二氧苯乙基)-4-(3-N,N-二甲氨基)丙胺基-1,8-萘二甲酰亚胺)在肝癌细胞中的抗肿瘤活性进行了研究。对多种肿瘤细胞的抗肿瘤活性筛选表明NA-17对肿瘤细胞具有一定的选择性,其中对肝癌细胞(HepG2)有较好的抑制效果,但对正常肝细胞(HL-7702)毒性较低。初步的机制研究显示,NA-17通过诱发HepG2细胞发生早期凋亡杀死HepG2细胞,但对细胞周期无明显影响,进一步的分子机制研究表明NA-17通过下调抗凋亡蛋白Bcl-2、Bcl-xL的表达,同时上调凋亡蛋白Bak的表达,从而诱导HepG2细胞发生细胞凋亡。
NA-17;细胞凋亡;HepG2;选择性抑制;抗肿瘤活性
0 引言
癌症恶性程度高、易转移、复发率高、治愈率低,已经成为威胁人类健康的头号杀手[1]。目前,寻找积极有效的癌症治疗方法已经成为科研工作者的研究重点,特别是研发高效、低毒的抗癌药物尤为重要[2]。肝癌是我国最为常见且致死率很高的恶性肿瘤。肝癌早期症状不明显或无症状,当出现临床症状时已是晚期,因此防治形势十分严峻。现阶段治疗肝癌的主要手段存在明显不足,临床用药对于肝癌的治疗作用不尽如人意,药效较低,且伴随着较高的毒副作用。因此,研发特异性针对肝癌细胞的高效、低毒抗肿瘤药物十分重要。
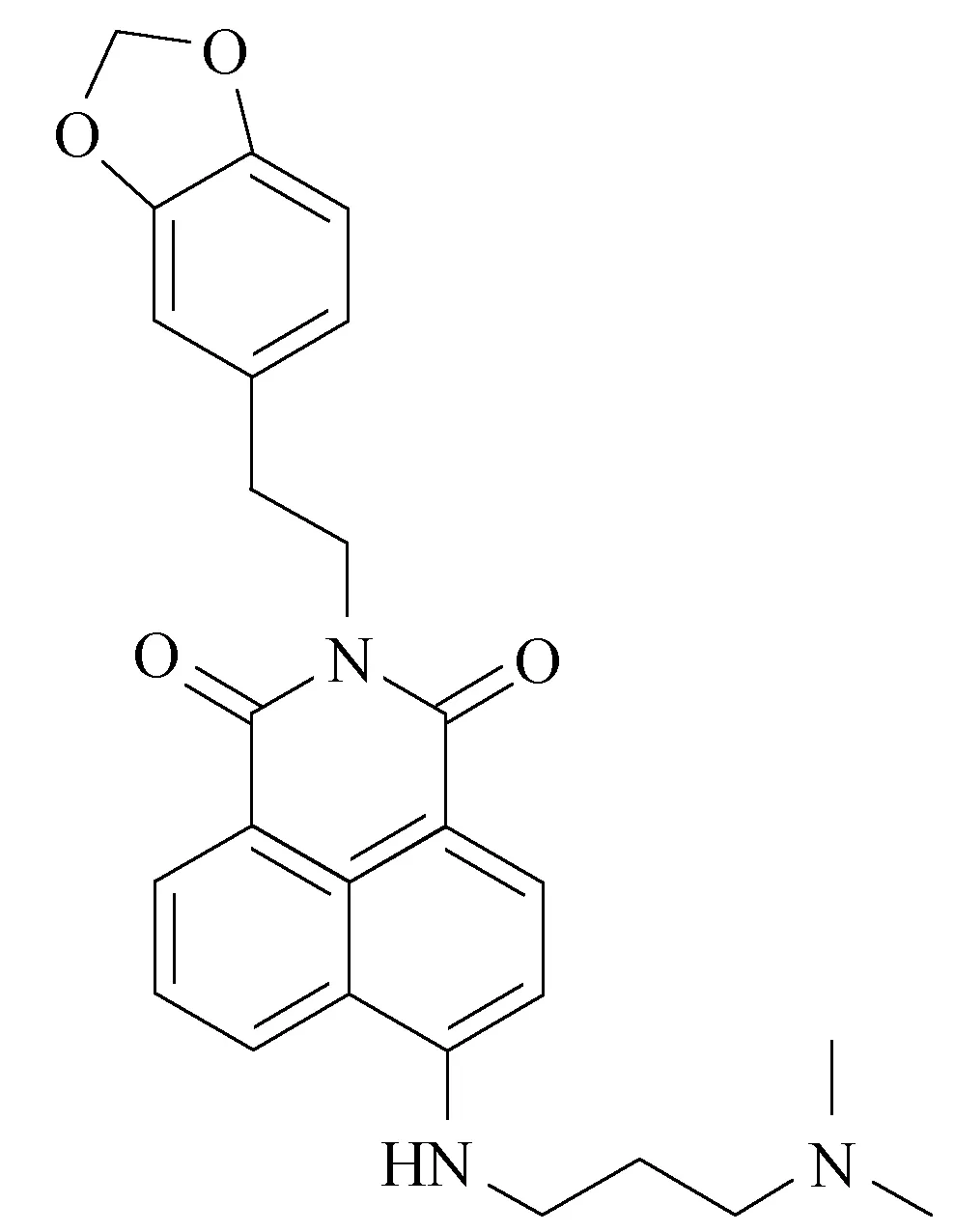
图1 NA-17结构式Fig.1 The structure of NA-17
萘酰亚胺类衍生物具有特殊的平面刚性结构[3],使其拥有较强的嵌入DNA的能力,在抗肿瘤研发领域备受关注。美国的Lee及Tarasova研究小组成功合成了pyrrolobenzodiazepine[4]、polyamide hairpin、咪唑并吖啶和萘二甲酰亚胺的复合物,经检测都表现出很好的抗肿瘤活性。安萘菲特、米托萘胺、依利萘法德和双萘法德这几种萘酰亚胺类衍生物已经进入临床研究[5],由此可见萘二甲酰亚胺类衍生物的抗肿瘤活性研究前景良好[6]。
本文研究一种新合成的1,8-萘二甲酰亚胺衍生物NA-17[7](N-(3,4-亚甲二氧苯乙基)-4-(3-N,N-二甲氨基)丙胺基-1,8-萘二甲酰亚胺)(如图1)对肝癌细胞HepG2的增殖抑制作用及其作用机制,为其进一步研究提供理论基础。
1 实验方法
1.1 实验仪器及试剂
FACS Aria Ⅱ流式细胞仪(BD公司);M1000多功能酶标仪(Tecan公司);114台式离心机(Sigma公司);TH4-200倒置显微镜(OLYMPUS);QL-901振荡器(海门其林贝尔);3111 CO2培养箱(Thermo);ZHJH-C1112B超净工作台(CLEAN BENCH);MLS-3020高压灭菌锅(AUTD CLAVE);IS4000R化学发光成像系统(Kodak);TS-100水平脱色摇床(ORBITAL);LSM710共聚焦倒置显微镜(ZEISS);DYCZ-24DN电泳仪(北京六一仪器厂)。
DMEM培养基(Hyclone公司);胎牛血清(Gibco公司);EDTA-胰蛋白酶、噻唑蓝(MTT)、RNAase A(Sigma公司);PI染料、BCA蛋白浓度测定试剂盒、Hoechst 33258(碧云天);二甲基亚砜(DMSO)(分析纯)(西陇化工)。其他试剂均为国产分析纯。
1.2 细胞培养和传代
HepG2细胞用含有体积分数10%胎牛血清的DMEM培养液,置于37 ℃,体积分数5%的CO2培养箱中培养1~2 d,用EDTA-胰蛋白酶消化传代,选取对数生长期的细胞进行实验。
1.3 MTT实验
取对数生长期的细胞,每孔180 μL (1×105个/mL) 细胞悬浮液接种于96孔板,置于37 ℃,体积分数5%的CO2培养箱中培养,待细胞完全贴壁后开始加药。用含有体积分数10%胎牛血清的DMEM培养液将NA-17原液稀释成多个不同的浓度。实验设置空白对照组和给药组,空白组中加入体积分数10%胎牛血清的DMEM培养液和细胞,以及体积分数1%的DMSO;给药组中加入NA-17稀释液。加样完毕将96孔板置于培养箱中培养48 h后,加入20 μL MTT溶液继续培养4 h后,移除上清,每孔加入100 μL DMSO,震荡5~8 min,在酶标仪上检测490 nm吸光值。利用公式计算肿瘤细胞生长抑制率,并通过SPSS软件计算其IC50值,所有实验重复3次后取平均值。
1.4 流式细胞术检测细胞周期分布
取对数生长期的细胞,每孔400 μL(1×105个/mL)细胞接种于6孔板中,置于37 ℃,体积分数5%的CO2培养箱中培养,待细胞完全贴壁后加入不同浓度的NA-17稀释液。实验设4个组:空白对照组、1/2 IC50浓度组、IC50浓度组和3/2 IC50浓度组。培养48 h,胰蛋白酶消化细胞后收集细胞,用冰PBS清洗2次,加入9 mL 体积分数70%冰乙醇和1 mL冰PBS,吹打均匀,-20 ℃固定过夜。2 000 r/min离心5 min,弃上清液,冰PBS清洗细胞1~2次,弃PBS洗液,用0.5 mL的50 mg/L RNase悬浮细胞,置37 ℃水浴30 min后,每组再加入25 μL PI,避光染色5~10 min,上机检测。
1.5 Hoechst染色检测细胞凋亡
取对数生长期的细胞,每孔400 μL(1×105个/mL)细胞接种于6孔板中,置于37 ℃,体积分数5%的CO2培养箱中培养,待细胞完全贴壁后加入不同浓度的NA-17稀释液。实验设4个组:空白对照组、1/2 IC50浓度组、IC50浓度组和3/2 IC50浓度组。培养24 h后,吸尽上清液,每孔加入固定液500 μL,固定10 min。弃固定液,用PBS清洗2次,每孔加入500 μL Hoechst 33258染色液染色5 min。移除染色液,用PBS清洗2次,置于激光扫描共聚焦显微镜下观察细胞染色情况。
1.6 Western blot检测蛋白表达量
取对数生长期的细胞,每孔800 μL(1×106个/mL)细胞接种于70 mm培养皿,置于37 ℃,体积分数5%的CO2培养箱中培养,待细胞完全贴壁后加入不同浓度的NA-17稀释液。检测细胞周期相关蛋白的实验组培养48 h,检测细胞凋亡相关蛋白的实验组培养24 h。用胰蛋白酶消化细胞后,收集细胞,用冰PBS清洗细胞2次,加入200~400 μL 细胞裂解液(RIPA),超声裂解30 min。12 000 r/min,4 ℃离心15 min,小心吸取上清液,移入干净EP管中。用BCA蛋白定量试剂盒测定提取蛋白的浓度后,每管蛋白提取液按4∶1的体积比加入溴酚蓝蛋白上样缓冲液,100 ℃沸水中变性5 min。制作质量分数10% SDS-PEGA凝胶,保证每个泳道中样品总蛋白量均为30 μg,并加入蛋白Marker,浓缩胶80 V恒压电泳50 min;分离胶120 V恒压电泳90 min。依据所需要检测的蛋白质相对分子质量切割凝胶,以三明治结构放置转膜夹,250 mA恒流转膜,转膜时间随蛋白质相对分子质量的不同而改变,相对分子质量越大转膜时间越长。取出PVDF膜后用TBST洗膜2次,每次5 min,放入对应一抗稀释液中,4 ℃孵育过夜。取出PVDF膜用TBST洗膜2次,每次5 min,放入与一抗同源的二抗稀释液中孵育1~2 h。孵育完毕后用TBST清洗PVDF膜2次,每次5 min,配置曝光液,曝光拍照,分析结果。
2 结果
2.1 NA-17对肿瘤细胞增殖的影响
设定给药浓度为1、5、10、20 μmol/L,处理48 h后,通过MTT法测定OD值,并计算NA-17作用不同肿瘤细胞株的抑制率及IC50值。
2.1.1 量效作用关系
检测NA-17在不同给药浓度条件下对肿瘤细胞的抑制率,绘制NA-17对不同肿瘤细胞作用的量效浓度曲线(如图2)。由结果可以看出,随着给药浓度增大,NA-17对HepG2细胞的增殖表现出显著的抑制作用,且呈现出较好的肿瘤选择性。
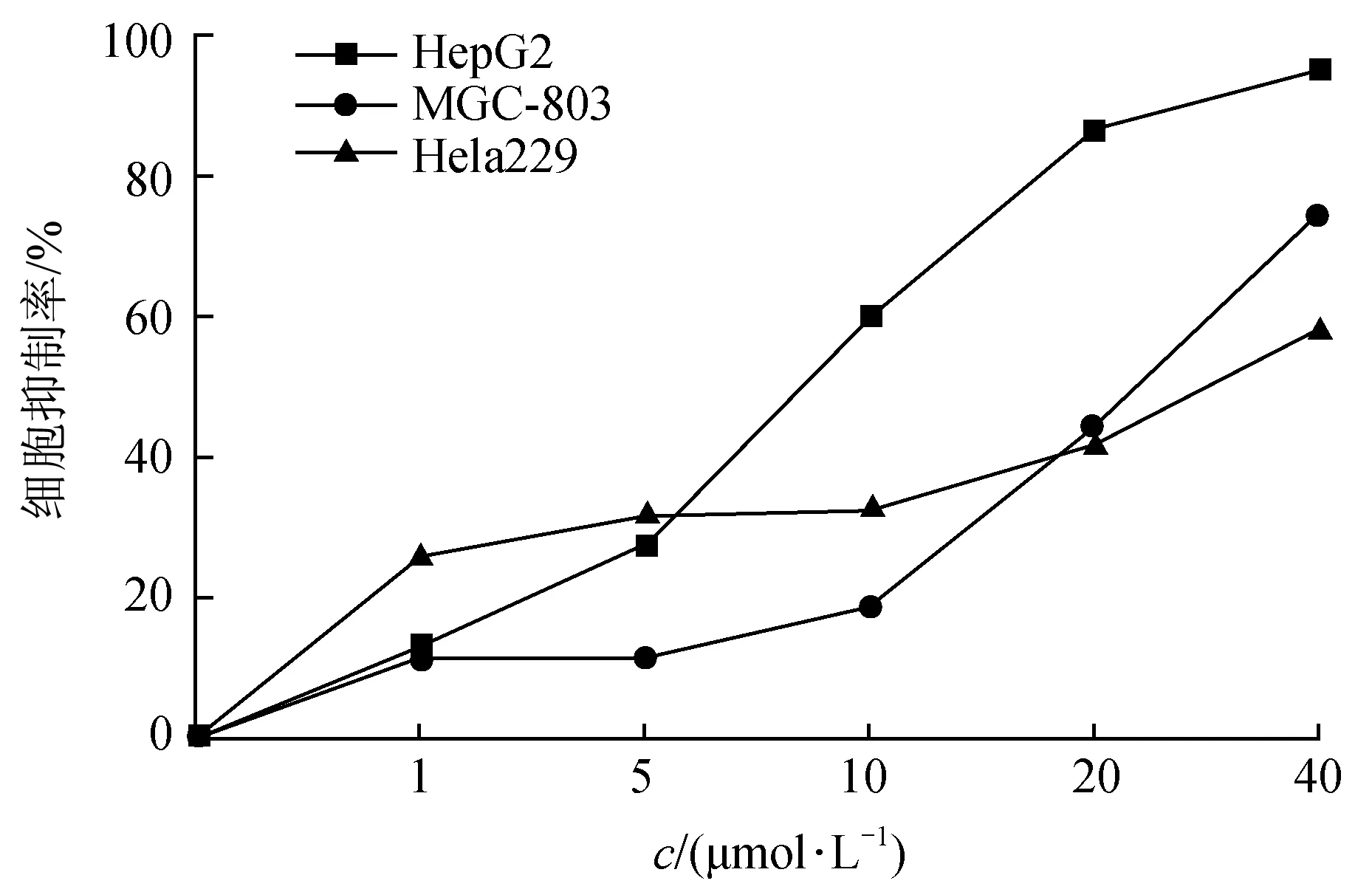
图2 NA-17对不同肿瘤细胞株的抑制率Fig.2 Cell proliferation inhibition effect of NA-17 in different cancer cell lines
2.1.2 NA-17作用肿瘤细胞株的IC50值
对不同的肿瘤细胞株进行筛选,计算对应的IC50值,并用顺铂(CDDP)处理相同细胞株作为对照,比较NA-17与顺铂对同种肿瘤细胞的作用效果差异。如图3所示,NA-17对肝癌细胞HepG2细胞抑制作用(IC50=8.18±0.40 μmol/L)与顺铂的作用基本相当,但对正常肝脏HL-7702细胞的毒性(IC50=26.05±1.56 μmol/L)远小于顺铂的毒性,并展现出明显的肿瘤选择性抑制作用。
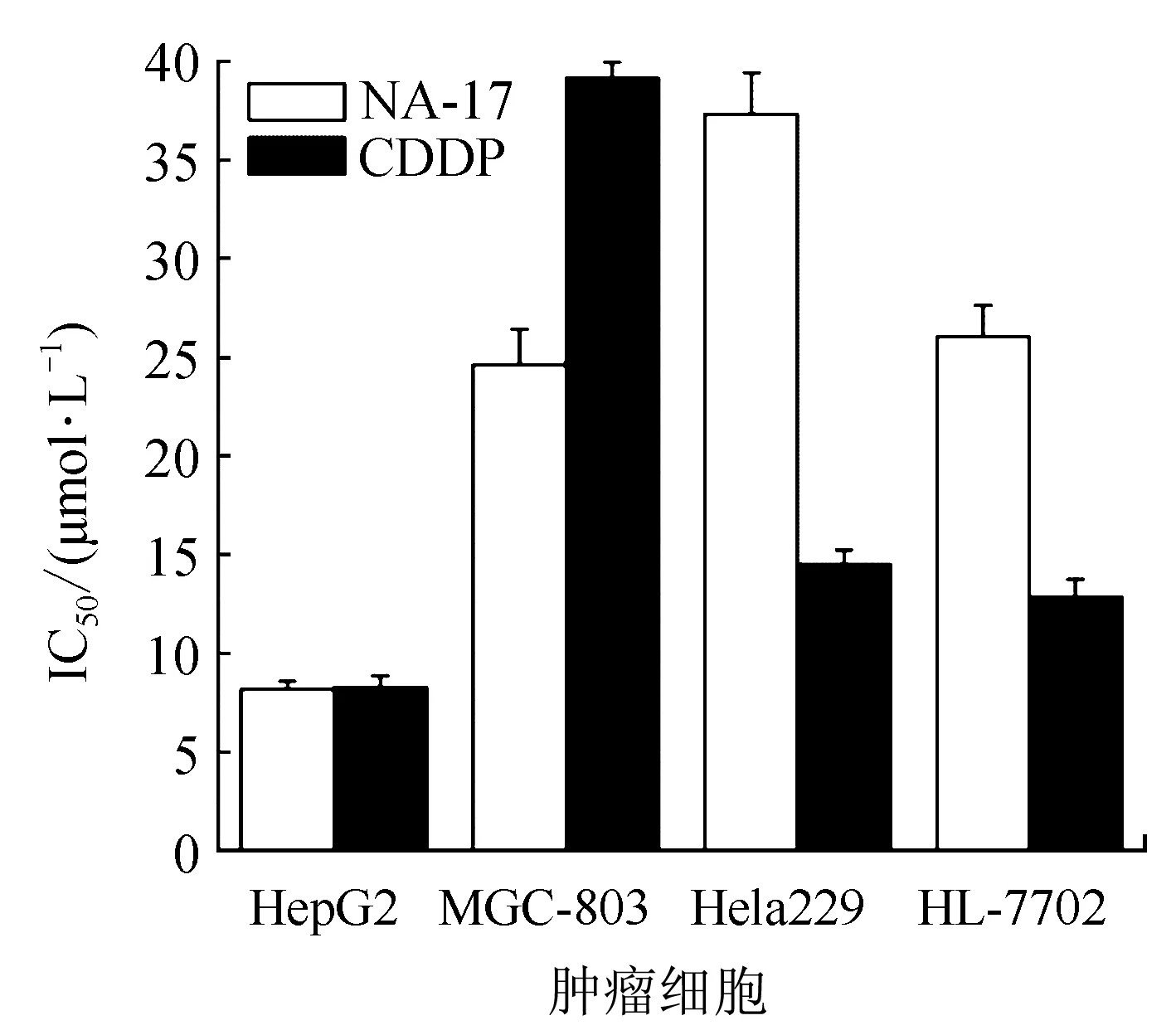
图3 NA-17对不同肿瘤细胞的IC50值Fig.3 IC50 values of NA-17 in different cancer cell lines
2.2 NA-17对HepG2细胞周期的影响
细胞周期是机体调控细胞生长增殖的重要环节,如果细胞周期异常,可能导致细胞生长停滞或死亡。为了研究NA-17对HepG2细胞周期的影响,我们对HepG2细胞用不同浓度的NA-17给药(4、8、12 μmol/L)处理48 h,收集细胞进行流式细胞分析,检测结果如图4、图5。
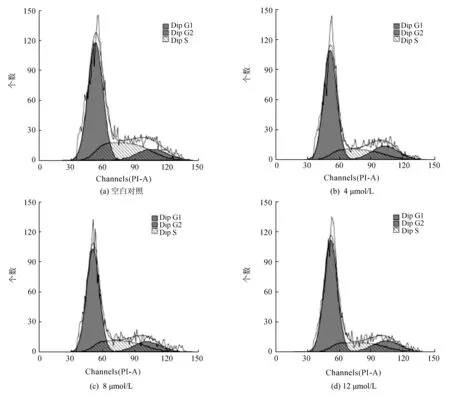
图4 NA-17对HepG2细胞周期影响Fig.4 Effect of NA-17 on cell cycle distribution in HepG2 cells
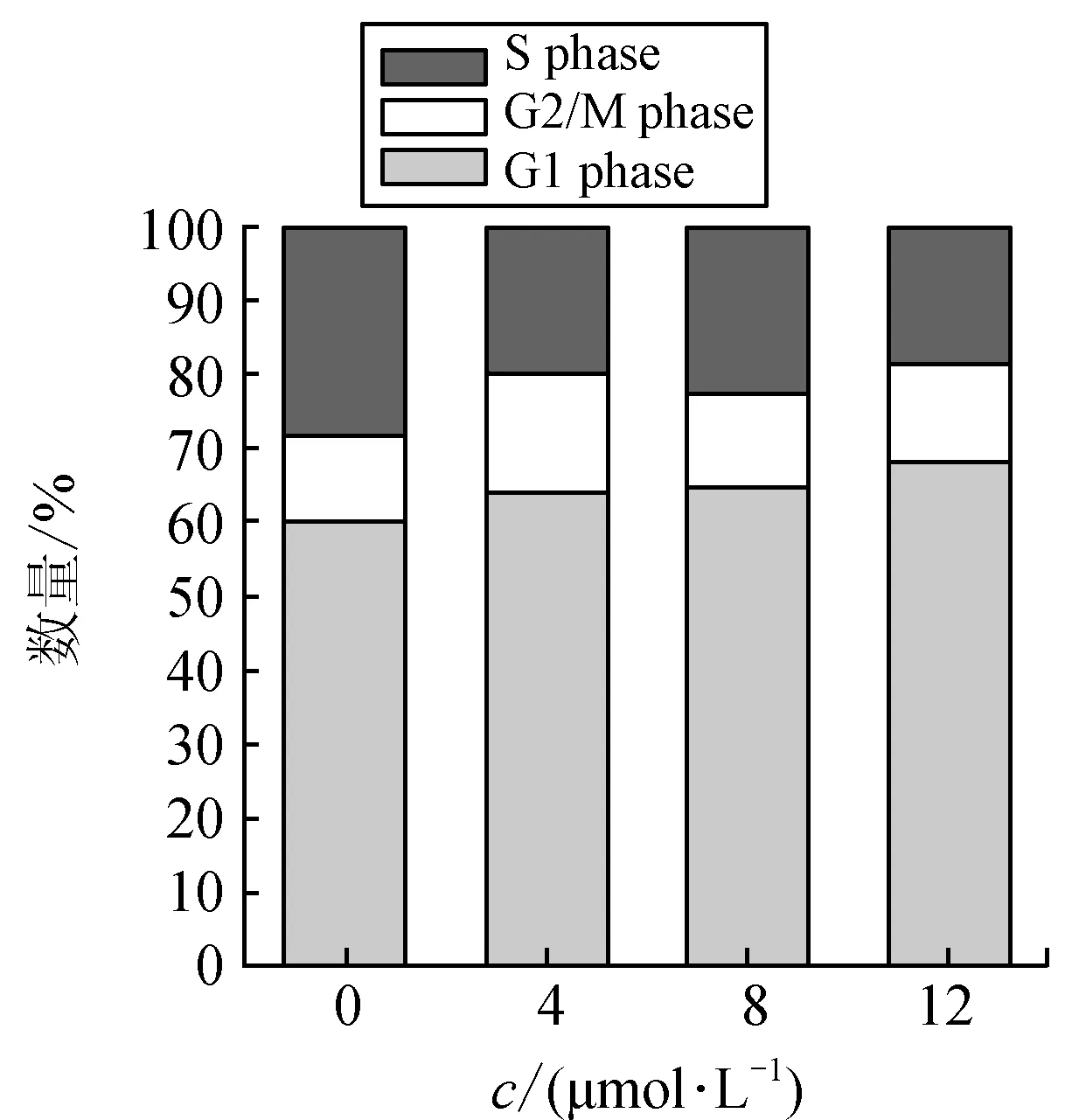
图5 经NA-17处理后HepG2细胞周期变化Fig.5 Change in cell cycly of HepG2 cells afterNA-17 treatment

图6 NA-17对周期调控蛋白表达的影响Fig.6 The effect of NA-17 on cell cycle proteins
由图4和图5可知,随着NA-17给药浓度的增加,HepG2细胞周期中处于各个时期的细胞数量都没有明显的变化(如图5)。这一结果与分子水平的研究结果一致(如图6),经过药物处理后,周期调控的相关蛋白如G1期调控蛋白CDK4/Cyclin D1[8]、S期调控蛋白CDK2/Cyclin A2[9]的表达量都没有明显变化,即NA-17对HepG2细胞周期没有明显影响,可见其不是通过引起细胞周期阻滞的方式发挥抗肿瘤作用的。
2.3 NA-17对HepG2细胞凋亡的影响
细胞凋亡亦称细胞程序性死亡,是由胞内凋亡基因调控,主动、高度有序、可被调控的死亡过程,是维持机体正常的代谢调控所必需的调控过程。凋亡大致分为两大类信号调控机制:外源性细胞凋亡通路(即死亡受体信号通路)和内源性细胞凋亡通路(即线粒体信号通路)[10-12]。为了研究NA-17能否诱导肿瘤细胞发生凋亡,对HepG2细胞用不同给药浓度(4、8、12 μmol/L)处理24 h后,用Hoechst 33258进行染色,使用激光共聚焦显微拍照检测(如图7)。
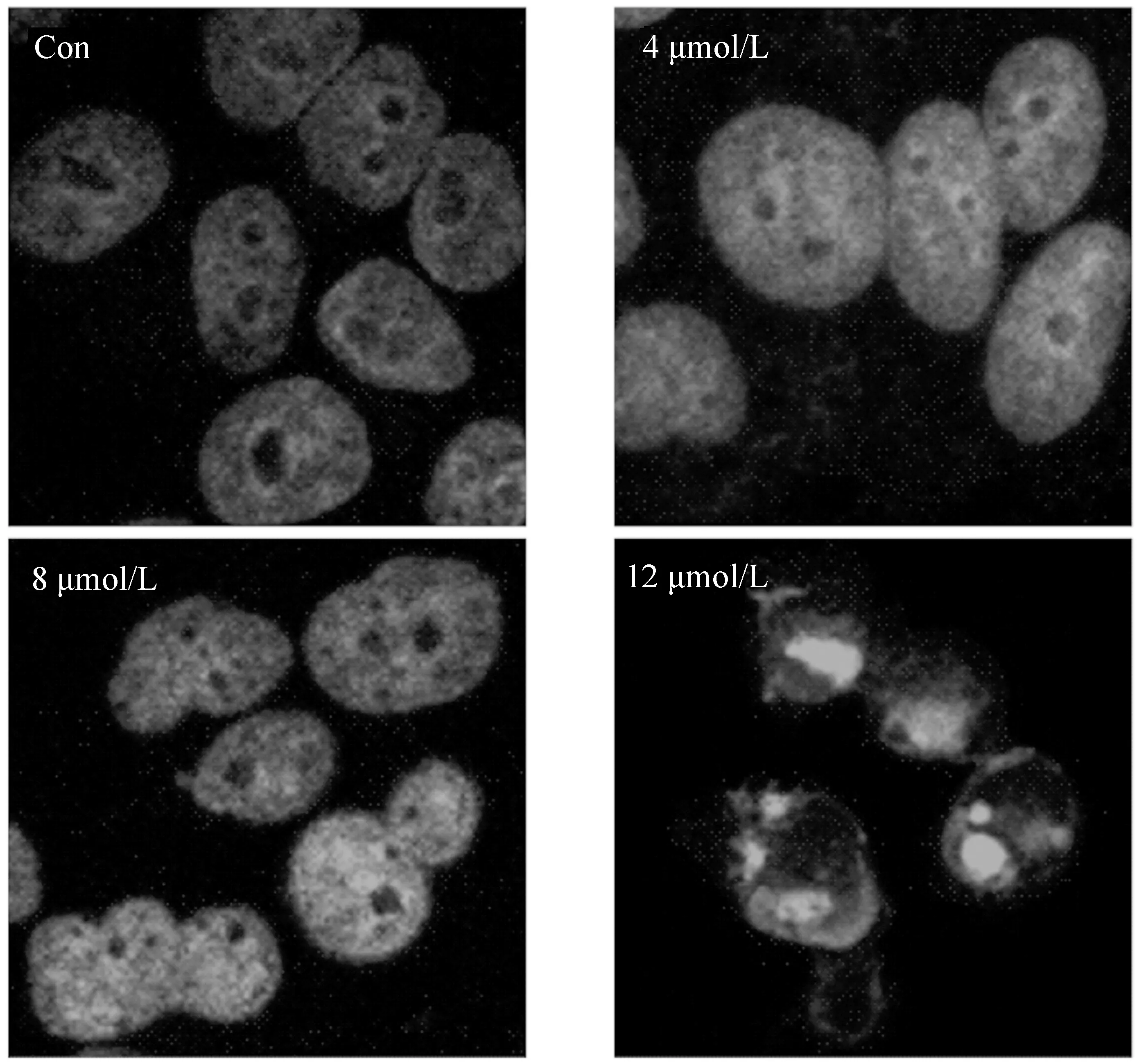
图7 Hoechst 33258染色实验验证细胞凋亡Fig.7 Cell apoptosis identified by Hoechst 33258 staining
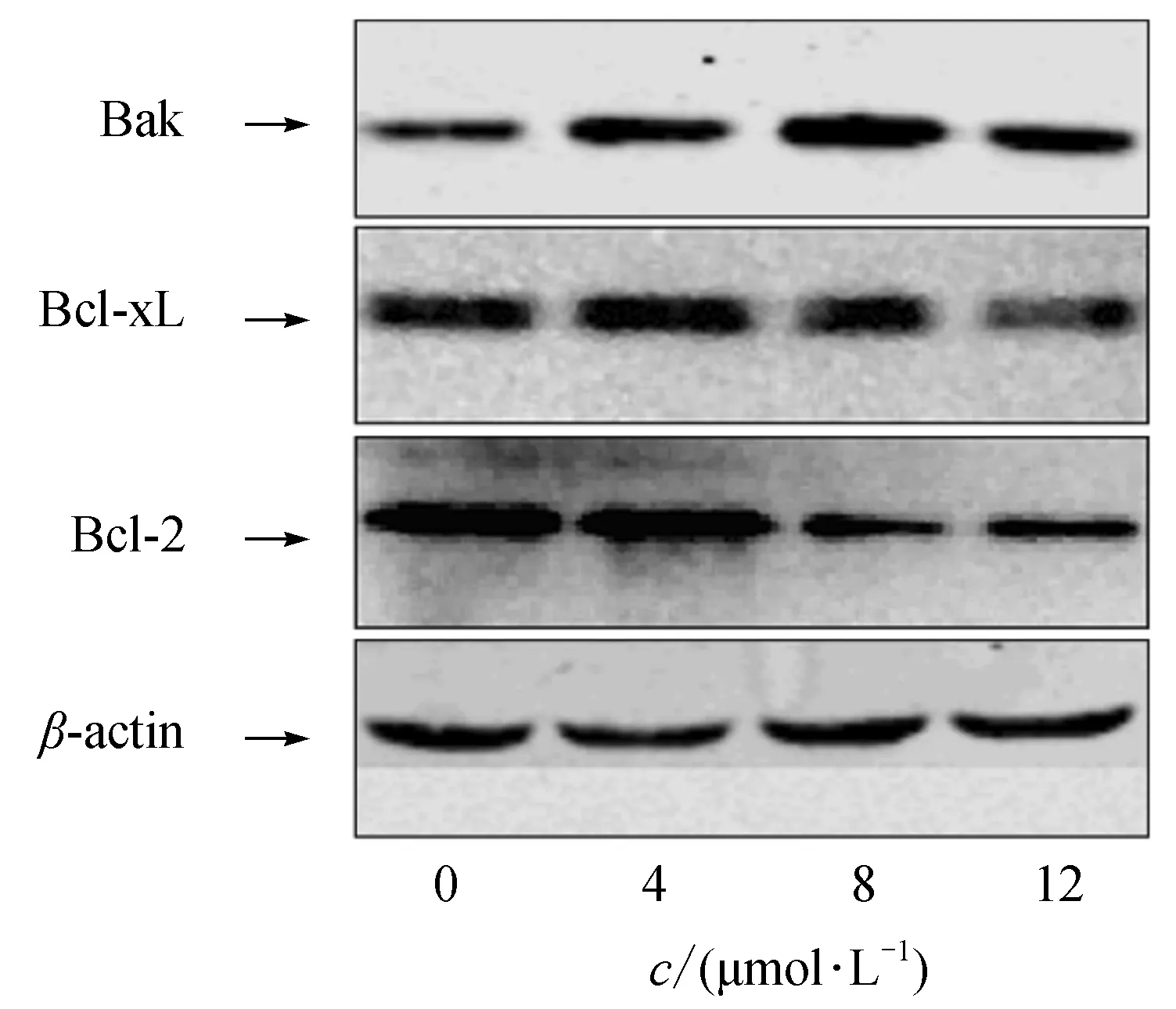
图8 NA-17对Bcl-2家族蛋白表达的影响Fig.8 The effect of NA-17 on expression of Bcl-2 protein family
荧光显微镜下观察到,经Hoechst 33258染色后,空白组HepG2细胞的细胞核内染色质呈正常的蓝色;而经过NA-17处理后的HepG2细胞,随着给药浓度的增加,其细胞核内的染色质出现致密浓染、或碎块化致密浓染的情况愈发明显,说明经过处理后,HepG2细胞的染色质逐渐皱缩碎裂,细胞发生凋亡。因此,证明NA-17能够诱导HepG2细胞发生凋亡。
Western Blot检测结果(如图8)也证实,随着加药浓度的增加,HepG2细胞内抗凋亡蛋白Bcl-2、Bcl-xL表达量呈一定程度的下降趋势,促凋亡蛋白Bak表达量略有上升[13],NA-17诱发HepG2细胞发生内源性细胞凋亡。
3 讨论
本文对1,8-萘二甲酰亚胺衍生物NA-17的生物活性进行了初步研究,结果显示其对肿瘤细胞有较好的抑制作用,尤其是对肝癌细胞(HepG2)有较高的抑制作用,表现出明显的选择性抑制。同时与作为参照的顺铂相比,其对HepG2细胞的抑制作用与顺铂基本相同,但其对肝脏正常细胞(HL-7702)毒性明显小于顺铂,因此有较好的成药前景。为了探究NA-17抑制HepG2细胞的作用机制,我们分别研究了NA-17对细胞周期和细胞凋亡的影响。流式细胞术检测细胞周期实验结果显示,HepG2细胞在经过NA-17处理后,处于G1期、S期、G2期的细胞数量都没有明显的变化,同时Western Blot实验结果显示,关键周期调控蛋白如Cyclin A2、CDK2、Cyclin D1和CDK4的表达量均没有明显的变化,因此NA-17不是通过周期阻滞的方式来体现其抗肿瘤活性。经过Hoechst 33258染色后,随着加药浓度的增加,HepG2细胞细胞核内致密浓染显著增加,说明细胞核内染色质逐渐皱缩碎裂,细胞发生凋亡,因此能够确定NA-17能诱导HepG2细胞发生凋亡。利用Western Blot方法,检测到经过NA-17处理后,抗凋亡蛋白Bcl-2、Bcl-xL的表达量呈现下降的趋势,促凋亡蛋白Bak等的表达量略有上升。这一结果有力地证明了NA-17通过线粒体凋亡通路诱导HepG2细胞发生凋亡,抑制肝癌细胞生长增殖。凋亡通路的下游信号通路众多且相互影响,我们将继续深入研究NA-17对其下游信号调控通路的影响,尽可能全面地阐述NA-17抑制肝癌细胞(HepG2)的作用机制。
[1] 王永川, 魏丽娟, 刘俊田, 等. 发达与发展中国家癌症发病率与死亡率的比较与分析[J]. 中国肿瘤临床, 2012, 39(10): 679-682.
[2] 李爱军, 马森林, 吴孟超. 分子靶向药物在肝癌治疗中的作用[J]. 肝胆胰外科杂志, 2015, 27(3): 255-258.
[3] 齐齐, 孙岳明, 哈涌泉. 1,8-萘酰亚胺类衍生物的结构及紫外-可见吸收光谱[J]. 物理化学学报, 2009, 25(6): 1143-1148.
[4] KAMAL A. Synthesis of novel non-cross-linking pyrrolobenzodiazepines with remarkable DNA binding affinity and potent antitumour activity[J]. Chemical Communications, 2001, 5: 437-438.
[5] 朱虹, 丁健. 萘酰亚胺类化合物作为抗肿瘤药物的研发现状[J]. 中国新药杂志, 2007, 16(10): 742-747.
[6] 王子元, 殷佩浩, 许建华, 等. 新型萘酰亚胺类衍生物8c诱导结肠癌耐药细胞HCT116/L-OHP凋亡作用研究[J]. 中国癌症杂志, 2015(5): 345-351.
[7] ZHANG G, AN Y, LU X, et al. A novel naphthalimide compound restores p53 function in non-small-cell lung cancer by reorganizing the Bak-Bcl-xl complex and triggering transcriptional regulation[J]. Jonrnal of Biological Chemistry, 2015, 291(162):306.
[8] KATAYAMA K, DOBASHI Y, KITAGAWA M, et al. Cdk4/cyclin D1 kinase, a universal and critical regulator of apoptosis[J]. Anticancer Research, 2003, 23(1A): 235-243.
[9] HAGOPIAN J C, KIRTLEY M P, STEVENSON L M, et al. Kinetic basis for activation of CDK2/cyclin A by phosphorylation[J]. Journal of Biological Chemistry, 2001, 276(1): 275-280.
[10] MOREAU A, VILAREM M J, MAUREL P, et al. Xenoreceptors CAR and PXR activation and consequences on lipid metabolism, glucose homeostasis, and inflammatory response[J]. Molecular Pharmaceutics, 2008, 5(1): 35-41.
[11] HURST C H, WAXMAN D J. Environmental phthalate monoesters activate pregnane X receptor-mediated transcription[J]. Toxicology & Applied Pharmacology, 2004, 199(3): 266-274.
[12] GUPTA S, AGRAWAL A, AGRAWAL S, et al. A paradox of immunodeficiency and inflammation in human aging: lessons learned from apoptosis[J]. Immunity & Ageing, 2006, 3(1): 2.
[13] NIEMINEN A I, ESKELINEN V M, HAIKALA H M, et al. Myc-induced AMPK-phospho p53 pathway activates Bak to sensitize mitochondrial apoptosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(20): 1839-1848.
(责任编辑 王龙杰)
The Anti-Tumor Mechanism of 1,8-Naphthalate Formyl Imide Derivative NA-17 in HepG2 Cells
WU Yiming1, LI Liangping2, ZENG Shulan2, LI Xiaohong2, ZHOU Zuping1, PENG Yan2
(1. College of Life Sciences,Guangxi Normal University,Guilin Guangxi 541006,China; 2. College of Chemistry & Pharmaceutical Sciences,Guangxi Normal University,Guilin Guangxi 541004,China)
The antitumor effects of a novel 1,8-naphthalate formyl imide derivative NA-17 in human liver cancer cells was researched. The inhibition effects of NA-17 in various human cancer cell lines showed that NA-17 exhibited highly selective inhibition in human liver cancer cell line HepG2, but with low toxicity to normal hepatic cell HL-7702. Preliminary research indicated that NA-17 induced apoptosis to suppress proliferation in HepG2 cells. Further studies showed that NA-17 induced the increase in the levels of Bak, while the decrease in Bcl-2 and Bcl-xL to trigger cell apoptosis.
NA-17; apoptosis; HepG2; selective inhibition; antineoplastic activity
10.16088/j.issn.1001-6600.2016.03.014
2015-11-24
广西自然科学基金资助项目(2014GXNSFAA118165,2015GXNSFDA139010);教育部创新团队项目(IRT1225);广西医药产业人才小高地资助项目(1309,1312,1507);药用资源化学与药物分子工程省部共建国家重点实验室主任基金资助项目(CMEMR2015-A09,CMEMR2014-A11);广西研究生教育创新计划项目(JGY2015023);八桂学者计划资助项目
彭艳(1968—),女,辽宁锦州人,广西师范大学教授,博士。E-mail: pengyan630@gxnu.edu.cn
文献标志码:A 文章编号:1001-6600(2016)03-0102-07
