UV-B辐射增强对滇杨和川杨生长及生理特性的影响*
2017-01-04杨春勐代微然任健马向丽
杨春勐,代微然,任健,马向丽
(云南农业大学 草业科学系,云南 昆明650201)
UV-B辐射增强对滇杨和川杨生长及生理特性的影响*
杨春勐,代微然,任健,马向丽
(云南农业大学 草业科学系,云南 昆明650201)
在田间利用紫外灯补充紫外线B辐射(UV-B)2.5KJ/(m2·d)和5.0KJ/(m2·d),模拟云贵高原臭氧层被破坏10%、20%后UV-B增加的情况,从形态和生理方面研究不同海拔的滇杨(2 430m)和川杨(3 300m)扦插苗对UV-B增强的响应。结果表明,UV-B增强对滇杨和川杨的芽数量、叶绿素b含量及植株上部的吲哚乙酸(IAA)、玉米核苷(ZR)及脱落酸(ABA)的含量均没有明显影响,显著降低了川杨赤酶素(GA)含量(P<0.05)。2.5KJ/(m2·d)和5.0KJ/(m2·d)UV-B辐射均显著降低了滇杨的植株高度、节间长度、叶绿素a及总叶绿素含量,对过氧化物酶(POD)的活性没有影响;而川杨只在5.0KJ/(m2·d)UV-B辐射下才显著降低了株高和节间长度。可见,对于UV-B辐射增加,来自高海拔的川杨比低海拔的滇杨受的影响小,且通过提高POD活性的方式降低胁迫带来的不利影响,因而表现出了更强的耐性。
滇杨;川杨;UV-B辐射;赤酶素;过氧化物酶;叶绿素含量
20世纪以来,人类活动排放的大量氮氧化合物和氟氯烃类化合物(CFC’s)进入臭氧层后,使得臭氧层减薄,导致到达地球表面的UV-B辐射(280~320nm)增加[1]。尽管UV-B辐射在太阳光中的比例不到5%,但其能量高,能够被核酸、蛋白质及脂类等大分子物质吸收[2],它的增加将对植物的光合作用、生物量及其生态系统的功能等产生潜在的影响[3~4]。植物在生长过程中,光合器官不可避免地暴露在UV-B辐射的照射下,研究发现UV-B增强不仅降低了叶绿素的含量[5],而且损伤了叶绿体结构[6],从而对叶片净光合作用产生不利的影响[7]。Langebartels等[8]指出,UV-B辐射增加诱导了反应性活性氧(Reactive oxygen species,ROS)的形成,造成脂类及蛋白质的氧化。UV-B增强还降低了黄松(Pinusponderosa)、红栎树(Quercusrubra)、毛果杨(Populustrichocarpa)的茎直径和生物量积累,不过受影响的程度与植物种类有关[9]。面对UV-B辐射增强,一些植物可以通过增加单位叶面积重量、提高黄酮类化合物含量[10]或提高抗氧酶活性[11]等方式降低胁迫的影响。
目前,关于UV-B辐射对植物的影响多集中于草本植物,对树木的影响研究相对较少,对杨树的研究更有限。杨树属于杨柳科(Salicaceae)杨属(Populus),是世界上分布最广、适应性最强的树种之一。有研究表明,UV-B辐射增强降低了美洲黑杨(P.deltoidesBartr.ex Marsh)、青杨(P.cathayanaRehder)、康定杨(P.kangdingensisC.Wang et Tung)的植株高度和生物量[12~13]。UV-B辐射强度通常随着海拔的增高而增加[14]。关于高海拔地区生长的杨树和低海拔地区生长的杨树对于UV-B增强的适应性的研究尚较少,而且UV-B辐射对植物的影响研究大多是在温室中进行。由于室内外的光谱成分存在差别,人工补充的UV-A和PAR往往超过自然光,相比而言,田间UV-B辐射与可见光的比例更能反映光谱组成的实际情况[15]。为此,以不同海拔生长的川杨和滇杨的枝条为材料,经UV-B辐射增加后,在田间自然环境中进行实验,了解UV-B增强对植物形态和生理指标的影响,以认识不同海拔生长的杨树对UV-B增强的响应差异。
1 材料与方法
1.1 试验材料与试验设计
1.1.1 试验地概况
试验地点位于云南农业大学教学实习基地(25°22′N,102°02′E),海拔为1 913m,属北亚热带高原季风气候,干湿季分明,年均温14.7℃,年均降水量960~1 100mm,最低降水量702.7mm,最高降水量1 274mm,降水量主要集中于7-9月。试验用土为山地红壤,pH6.7,有机质含量1.74%,有效氮含量116.67mg/kg,速效磷33.11mg/kg,速效钾65.2mg/kg。
1.1.2 材料
供试滇杨采自云南省丽江市拉市海乡(2 430m),川杨采自云南省香格里拉县小中甸镇(3 300m)。2014年2月下旬,将野外采集到的2年生休眠枝条剪成含有2~3个休眠芽的枝条(长度为20cm左右),然后扦插到试验地里。4月初选择健壮、无病虫害、大小、高度及生长势基本一致的扦插苗,移栽到塑料花盆(5L)中,3周后开始UV-B增强试验。
1.1.3 试验设计
试验因素包括树种和UV-B,其中树种有滇杨和川杨两个水平;UV-B有3个水平:对照(不补充UV-B)、2.5KJ/(m2·d)(模拟云贵高原臭氧层衰减10%)、5KJ/(m2·d)(模拟云贵高原臭氧层衰减20%),共有6个处理,每个处理重复4次。试验中将40W紫外灯(北京电光源所提供)悬于植株上方补充UV-B辐射,根据手持式紫外辐照计测定UV-B的强度来调节灯管与植株顶端之间的高度,在2.5、5KJ/(m2·d)处理中,苗木与灯管之间的距离分别是60cm和40cm。对照处理中,在紫外灯外面包裹聚酯膜将UV-B过滤。试验中除雨天外,每天从9:00到17:00开紫外灯8h。试验中每个扦插苗保留1个顶芽,且定期旋转盆的方向,以缩小微环境的影响。UV-B辐射处理的时间是4月到10月,从10月初开始相关指标的测定。
1.2 形态和生理指标测定方法
1.2.1 形态指标
包括株高、节间长度、芽的数量等,其中株高(cm)是指插条新生主枝的长度。
1.2.2 常规生理指标
叶绿素含量 在植株上部第4片叶位置取样(以下相同)。称取0.1g碎叶片,然后加入25mL的N,N-二甲基甲酰胺,放置暗处,浸提24h。在波长647、664.5、674nm下比色,方法参照Inskeep等(1985)[16]。
过氧化物酶(POD) 称取0.2g叶片在6mL提取液〔50mmol/L Na2HPO4-NaH2PO4缓冲溶液pH7.0,1mmol/L EDTA,1%(W/V)不溶性聚乙烯吡咯烷酮〕中研磨成匀浆,在4℃,15 000r/min离心20min,取上清液利用愈创木酚法进行酶活性测定[17]。
激素含量 称取植株顶端的幼嫩组织0.2~1.0g,加2mL样品提取液(80%甲醇,内含1mmol/L二叔丁基对甲苯酚)研磨成匀浆,离心、过柱,在96孔酶标板,加入样品及抗体,与标准品进行比较,采用酶联免疫法进行IAA、GA、ZR、ABA的测定[18]。
1.3 数据处理与统计方法
利用SPSS 19.0软件对试验数据进行两因素和单因素的方差分析(ANOVA),其中两因素分析用于比较UV-B增强的效应(U)、树种的效应(S);在滇杨和川杨处理中分别进行单因素方差分析,若处理间差异显著,则利用S-N-K检验(Student-Newman-Keuls multiple range test)进行处理和对照之间的比较。图表中不同小写字母表示差异显著(P<0.05)。利用Excel 软件进行图的绘制。
2 结果与分析
2.1 UV-B辐射增强对滇杨的影响
从图1可以看出,经过2.5和5KJ/(m2·d)的UV-B处理,滇杨的平均植株高度、平均节间长度较对照明显降低,其中株高下降了29%和51%。但芽的数量没有受到明显影响。
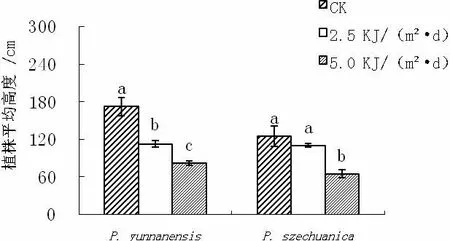
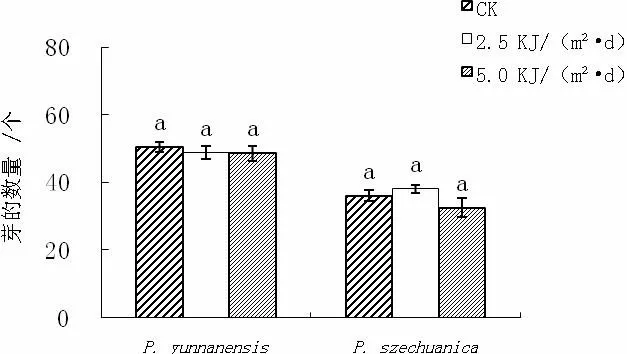
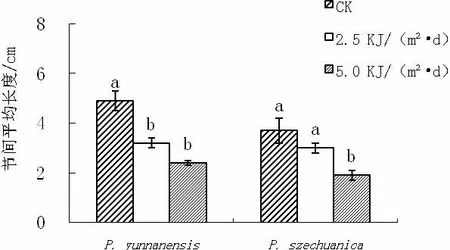
图1 UV-B增强对滇杨和川杨植株平均高度、芽的数量和节间长度的影响
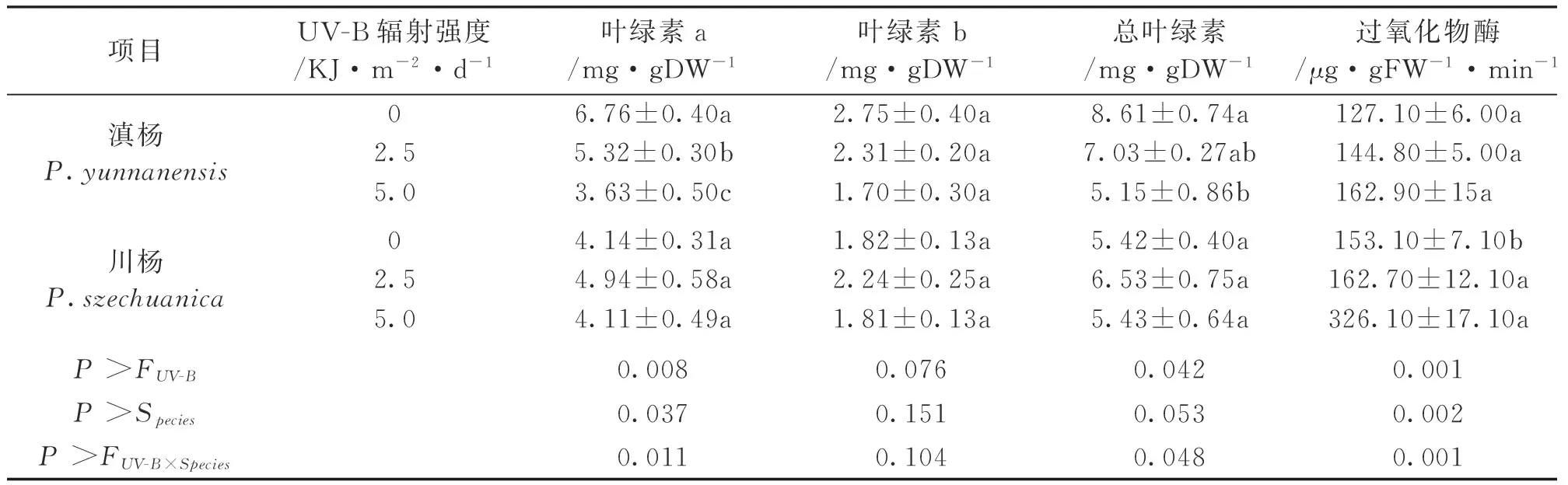
项目UV-B辐射强度/KJ·m-2·d-1叶绿素a/mg·gDW-1叶绿素b/mg·gDW-1总叶绿素/mg·gDW-1过氧化物酶/μg·gFW-1·min-1滇杨P.yunnanensis06.76±0.40a2.75±0.40a8.61±0.74a127.10±6.00a2.55.32±0.30b2.31±0.20a7.03±0.27ab144.80±5.00a5.03.63±0.50c1.70±0.30a5.15±0.86b162.90±15a 川杨P.szechuanica04.14±0.31a1.82±0.13a5.42±0.40a153.10±7.10b2.54.94±0.58a2.24±0.25a6.53±0.75a162.70±12.10a5.04.11±0.49a1.81±0.13a5.43±0.64a326.10±17.10aP>FUV-B0.0080.0760.0420.001P>Species0.0370.1510.0530.002P>FUV-B×Species0.0110.1040.0480.001
注:表中数值系平均数±标准误,以下相同。
由表1可知,UV-B增强明显降低了滇杨叶片中叶绿素a的含量(P<0.05),且降低程度与UV-B辐射强度大小有关。例如5.0KJ/(m2·d)、2.5KJ/(m2·d)的UV-B处理下,叶绿素a分别降低了46%。与叶绿素a相比,UV-B增强对叶绿素b的影响不显著P>0.05)。另外,UV-B辐射增强后叶片的过氧化物酶活性没有发生显著变化(P>0.05)。
2.2 UV-B辐射增强对川杨的影响
从图1可知,UV-B增强对川杨植株芽的数量并没有显著影响,不过对植株高度、节间长度产生了一定的影响,且影响程度与UV-B强度有一定关系。5KJ/(m2·d)的UV-B处理使川杨植株高度、节间长度明显下降(P<0.05),较对照分别下降了48%和49%;而2.5KJ/(m2·d)处理与对照二者的之间差异并不显著(P>0.05)。
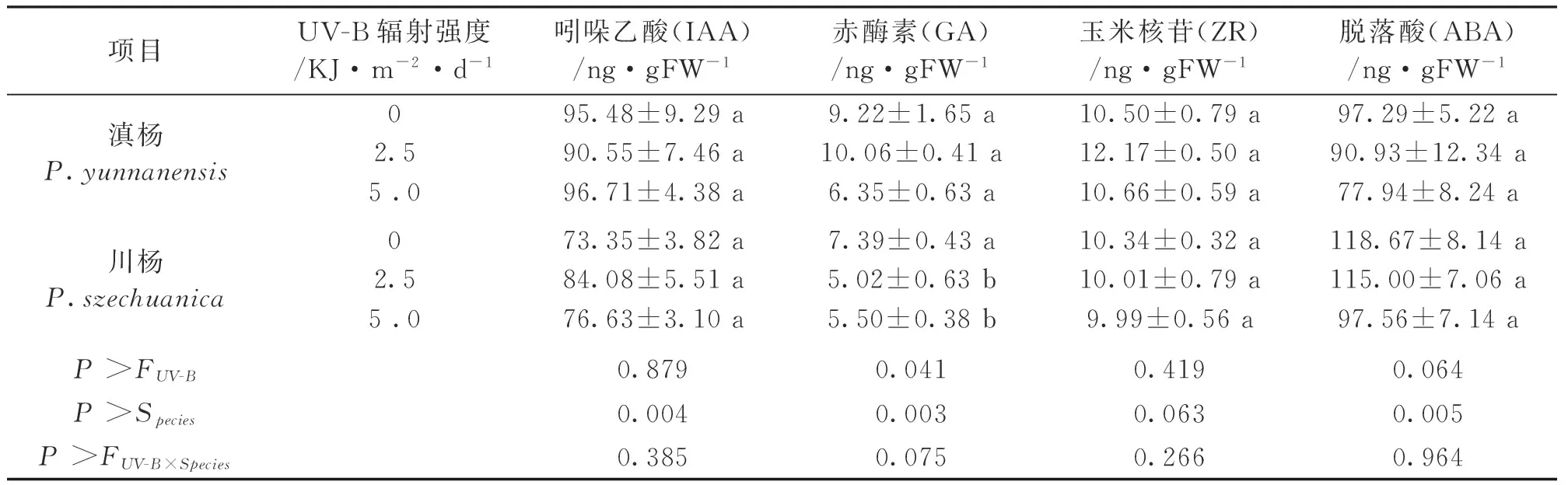
表2 不同UV-B处理下滇杨和川杨吲哚乙酸、赤酶素、玉米核苷、脱落酸含量
从表1来看,与对照相比,无论是2.5KJ/(m2·d)的UV-B处理,还是5KJ/(m2·d)处理对川杨叶绿素a、叶绿素b、总叶绿素含量的影响并不显著(P>0.05),但显著地提高了过氧化物酶的活性(P<0.05)。从表2可以看出,在增强UV-B的作用下,激素的变化与其种类有一定的关系。在两种UV-B辐射处理下,川杨GA的含量显著降低,相比而言,IAA、ZR、ABA含量的变化不明显。
3 结论与讨论
从试验结果来看,臭氧层衰减20%后增加的UV-B辐射〔5KJ/(m2·d)〕对杨树的生长、生理生化的影响更为明显。在5KJ/(m2·d)UV-B辐射处理下,滇杨和川杨的株高和节间长度均显著降低,由于芽的数量没有发生明显变化,因而株高的降低可以归结于节间长度的缩短。有研究表明植物节间长度的变化受到赤霉素(GA)的调控[19],GA含量降低将抑制枝条的伸长[20]。本文中,UV-B增强显著降低了川杨GA的含量(P<0.05),进一步验证了UV-B增强对株高的抑制作用与GA含量有较大的相关性;考虑到树木生长受多种因素的影响,其变化规律还有待进一步研究。脱落酸(ABA)可以增强植物抵御逆境的能力,不过UV-B增强下并没有观察到滇杨和川杨中ABA的显著变化,这一点与青杨、康定杨中的研究结果相一致[21]。
UV-B辐射增强,滇杨与川杨的响应有一定的差异。例如,无论是5.0KJ/(m2·d)UV-B,还是2.5KJ/(m2·d)UV-B都显著地降低了滇杨的株高和节间长度,而川杨只受到5.0KJ/(m2·d)UV-B的影响。同样,UV-B辐射增强显著地降低了滇杨的叶绿素a含量,而川杨的变化不明显。叶绿素是光能吸收、传递、转换的重要色素,UV-B辐射导致叶绿素含量的降低,原因可能是叶绿素合成受阻或类囊体膜受损[22]。据师生波等研究[23],在UV-B辐射增强的情况下高山植物麻花艽(Gentianastraminea)叶绿素受到的影响较小,说明叶绿素的变化趋势与植物对UV-B辐射的耐性有一定的相关性。另外,观察到UV-B增强显著地提高了过氧化酶(POD)在川杨中的活性,且明显高于滇杨(P<0.001);相反,POD在滇杨中的变化不明显。POD是植物抗氧化系统中重要的酶类,在一定程度上阻止功能膜及酶系统的破坏,与过氧化氢酶(CAT)共同作用将H2O2维护在一个较低的水平[24]。据Mackerness[25]研究,抗氧化酶活性增强有助于清除UV-B增强产生的活性氧,从而减少对蛋白质、脂类的氧化作用。因此,与滇杨相比,川杨叶片中POD活性的增加有利于减轻活性氧带来的氧化作用,维护细胞正常的功能。
对于UV-B增强,滇杨和川杨在响应上的差别,可能与二者原产地的UV-B环境有关。UV-B辐射强度随纬度、海拔等的变化而变化,高海拔的植物长期适应于高的UV-B环境[14]。试验中,川杨来自于高海拔地区(3 300m),适应于当地的高的UV-B辐射环境之中,因而对于UV-B辐射增强表现出了较强的耐性。不过,当UV-B强度增加到一定程度时,例如臭氧层衰减20%时,川杨的株高、节间长度同样受到抑制,说明这个强度超过了川杨所能忍耐的范围。
总之,在田间环境下,UV-B辐射增强对滇杨和川杨芽的数量、叶绿素b含量及植株顶部的IAA、ZR及ABA的含量均没有产生显著影响,不过显著地降低了川杨GA的含量。对于UV-B辐射增强,来自低海拔的滇杨受到影响较大,相比之下,高海拔的川杨可以通过调节抗氧化酶的活性等方式来减少UV-B胁迫的不利影响,维持光合色素的稳定性,表现出了较强的耐性。
[1]Anderson J G,Toohey D W,Brune W H.Free radicals within the Antarctic vortex:the role of CFCs in Antarctic ozone loss [J].Science,1991,251:39-46.
[2]Hectors K,Prinsen E,De Coen W,etal.Arabidopsisthalianaplants acclimated to low dose rates of ultraviolet B radiation show specific changes in morphology and gene expression in the absence of stress symptoms [J].New Phytologist,2007,175(2):255-270.
[3]Choudhary K K,Agrawal S B.Effect of elevated ultraviolet-B on four tropical soybean cultivars:quantitative and qualitative aspects with special emphasis on gas exchange,chlorophyll fluorescence,biomass and yield [J].Acta Physiologiae Plantarum,2015,37(1):1-12.
[4]Caldwell M M,Bornman J F,Ballare C L,etal.Terrestrial ecosystem,increased solar ultraviolet radiation and interaction with other climatic change factors [J].Photochemical and Photobiological Sciences,2003,2:29-38.
[5]Agrawal S B,Mishra S.Effects of supplemental ultraviolet-B and cadmium on growth,antioxidants and yield ofPisumsativumL [J].Ecotoxicology and Environmental Safety,2009,72(2):610-618.
[6]Sullivan J H,Rozema J.UV-B effects on terrestrial plant growth and photosynthesis.In:Rozema,J.(Ed.),Stratospheric Ozone Depletion:The Effects of Enhanced UV-B Radiation on Terrestrial Ecosystems [M].Leiden:Backhuys Publishers,1999:39-57.
[7]Zu Y G,Pang H H,Yu J H,etal.Responses in the morphology,physiology and biochemistry ofTaxuschinensisvar.mairei grown under supplementary UV-B radiation[J].Journal of Photochemistry and Photobiology B:Biology,2010, 98:152-158.
[8]Langebartels C,Wohlgemuth H,Kschieschan S,etal.Oxidative burst and cell death in ozone-exposed plants[J].Plant Physiology and Biochemistry,2002,40:567-575.
[9]Bassman J H,Edwards G E,Robberecht R.Photosynthesis and growth in seedlings of five forest tree species with contrasting leaf anatomy subjected to supplemental UV-B radiation [J].Forest Science,2003,49:176-187.
[10]姚银安,杨爱华,徐刚.日光紫外线B辐射对甜荞苯丙烷代谢的影响[J].热带亚热带植物学报,2009,17(2):152-155.
[11]Rajiv D,PratapV S,Jitendra K,etal.Differential physiological and biochemical responses of twoVignaspecies under enhanced UV-B radiation [J].Journal of Radiation Research and Applied Sciences,2015,8(2):173-181.
[12]Bassman J H,Robberecht R,Edwards G E.Effects of enhanced UV-B radiation on growth and gas exchange inPopulusDeltoidesBartr.ex Marsh [J].International Journal of Plant Sciences,2001,162(1):103-110.
[13]Ren J,Yao Y,Yang Y,etal.Growth and physiological responses of two contrasting poplar species to supplemental UV-B radiation [J].Tree Physiology,2006,26(5):665-672.
[14]Turunena M,Latolab K.UV-B radiation and acclimation in timberline plants [J].Environmental Pollution,2005,137(3):390-403.
[15]Sullivan J H.Possible impacts of changes in UV-B radiation on North American trees and forests [J].Environmental Pollution,2005,137(3):380-389.
[16]Inskeep W P,Bloom P R.Extinction coefficients of chlorophyll a and b in N,N-dimethylformamide and 80% acetone [J].Plant Physiology,1985,77(2):483-485.
[17]孙群,胡景江.植物生理学研究技术[M].西安:西北农林科技大学出版社,2006.
[][]
[18]Yang Y M,Xu C N,Wang B M,etal.Effects of plant growth regulators on secondary wall thickening of cotton fibres [J].Plant Growth Regulation,2001,35(3):233-237.
[19]Thomas S G,Sun T P.Update on gibberellin signaling.A tale of the tall and the short [J].Plant Physiology,2004,135(2):668-676.
[20]宋杨,张艳敏,刘金,等.GA含量与其合成酶基因在“长富2号”苹果及其短枝型芽变品种之间的比较分析[J].中国农业科学,2012, 45(13):2668-2675.
[21]Ren J,Dai W R,Xuan Z Y,etal.The effect of drought and enhanced UV-B radiation on growth and physiological traits of two contrasting poplar species [J].Forest Ecology and Management,2007,239:112-119.
[22]Strid A,Chow W S,Anderson J M.UV-B damage and protection at the molecular level in plants [J].Photosynthesis Research,1994,39(3):475-489.
[23]师生波,贲桂贡,赵新全,等.增强UV-B辐射对高山植物麻花艽(Gentianastraminea)净光合速率的影响[J].植物生态学报,2001,25(5):520-524.
[24]杨阳,茹广欣,卢妍妍,等.铬(VI)胁迫对狼尾草幼苗生长特性的影响[J].西部林业科学,2013,42(6):75-81.
[25]Mackerness S A H.Plant responses to ultraviolet-B(UV-B:280-320nm)stress:What are the key regulators? [J].Plant Growth Regulation,2000,32:27-39.
Effects of Enhanced Ultraviolet-B Radiation on Growth and Physiological Characteristics ofPopulusyunnanensisandPopulusszechuanica
YANG Chun-meng,DAI Wei-ran,REN Jian,MA Xiang-li
(Department of Grassland Science,Yunnan Agricultural University,Kunming Yunnan 650201,P.R.China)
In order to understand the effects of enhanced UV-B radiation on the growth and physiological responses ofPopulusyunnanensisandP.szechuanicaat different altitudes of 2 430 m~3 300 m,the 10% and 20% ozone depletion in Yunnan-Guizhou Plateau were simulated by using the UV-B radiation with ultraviolet lamp supplement of 2.5 KJm-2day-1and 5 KJ m-2day-1in the field.The results showed that enhanced UV-B radiation had little effect on bud number,chlorophyll b concentration,and IAA,ZR and ABA concentration in upper plants of two tested species whereas GA concentration was significantly reduced(P<0.05).Plant height,internode length,and chlorophyll a and total chlorophyll concentration ofP.yunnanensiswere significantly reduced by both 2.5 KJ m-2day-1and 5 KJ m-2day-1treatments,whereas little effect was observed in the Peroxidase activity(POD).In contrast,forP.szechuanica,plant height and internodes length were only significantly decreased by 5 KJ m-2day-1UV-B radiations.This study indicated thatP.szechuanicaoriginating from high altitude was less affected by enhanced UV-B radiation thanP.yunnanensisfrom low altitude;moreover,stress could be reduced through increase of POD activity inP.szechuanica.Therefore,P.szechuanicashowed a greater tolerance to enhanced UV-B radiation.
Populusyunnanensis;P.szechuanica;UV-B radiation;GA;POD;chlorophyll content
10.16473/j.cnki.xblykx1972.2016.06.014
2015-12-28
国家自然科学基金项目“不同海拔梯度的滇杨对模拟增温和UV-B辐射增强的响应”(31260167)资助。
杨春勐(1989-),男,硕士生,主要从事树木生理生态研究。E-mail:yangchunmeng1989@163.com
简介:任健(1971-),男,副教授,博士,主要从事气候变化对植物生理生态的影响研究。E-mail:renjian172@126.com
S 792.11
A
1672-8246(2016)06-0079-06
