无糖基化修饰GLP-1-Fc(N126A)在酵母中的表达、纯化
2017-01-04乔晓芳王春艳顾宝华田庆南1
乔晓芳, 王春艳, 顾宝华 , 田庆南1,
(1.郑州大学 药学院 河南 郑州 450001; 2.安阳市城乡一体化示范区食品药品监督管理中心 河南 安阳 455000; 3.郑州大学 生命科学学院 河南 郑州 450001)
无糖基化修饰GLP-1-Fc(N126A)在酵母中的表达、纯化
乔晓芳1,2, 王春艳3, 顾宝华3, 田庆南1,3
(1.郑州大学 药学院 河南 郑州 450001; 2.安阳市城乡一体化示范区食品药品监督管理中心 河南 安阳 455000; 3.郑州大学 生命科学学院 河南 郑州 450001)
胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)是一种肠促胰岛素激素,具有很好的综合降糖效果,但其在血浆中的半衰期只有短暂几分钟,限制了GLP-1在临床方面的应用.为延长GLP-1的半衰期,合成了GLP-1-Fc融合基因,将N-糖基化作用的受体天冬酰胺突变为丙氨酸,构建了无糖基化修饰的GLP-1-Fc(N126A)融合表达载体,利用酵母表达系统成功表达了GLP-1-Fc(N126A)融合蛋白,并利用rProteinA获得了高纯度融合蛋白.
胰高血糖素样肽-1; Fc融合蛋白; 酵母表达
0 引言
胰高血糖素样肽-1(glucagon-like peptid-1, GLP-1)是由直肠、结肠和远端回肠的L细胞分泌、由前胰升血糖素衍生的一种多肽激素[1].GLP-1的肠促胰岛素作用依赖于血浆中的葡萄糖浓度,在高血糖的情况下,可促进胰岛素的分泌.因此,GLP-1在II 型糖尿病的治疗中具有重要的价值[2].但是,GLP-1在血浆中极易被降解,半衰期较短,仅有3~5 min[3-4],严重限制了GLP-1在临床方面的应用.因此,利用基因工程的方法构建能延长GLP-1半衰期的GLP-1类似物是解决这一问题的良好方法.本研究将GLP-1与Fc片段融合,以延长GLP-1的半衰期[5-6].
目前,人们常用的蛋白表达系统有大肠杆菌表达系统、哺乳动物表达系统和酵母表达系统.酵母菌表达系统作为真核表达系统,具备了原核生物快速繁殖、易于培养的特点,同时能够分泌表达,完成蛋白质修饰[7-8].但是,在酵母表达修饰系统中,糖基化修饰能引起免疫原性,降低半衰期,因此如何利用酵母表达系统获得无糖基化的融合蛋白是进一步优化GLP-1表达的难点.
本研究通过构建GLP-Fc融合表达载体,利用毕赤酵母GS115表达系统,获得了GLP-Fc融合表达蛋白,并通过突变N-糖基化位点N126,进一步获得无糖基化修饰融合蛋白,为获得半衰期长、免疫原性低、生产成本低的GLP-1融合蛋白提供了一种有效途径.
1 材料与方法
1.1 材料
菌株:PPIC3.5k质粒、大肠杆菌XL-10、毕赤酵母GS115、GS115-DT-6,均由本实验室提供和保存.
1.2 试剂
rTaq酶、25 mmol/L dNTPs、T4 DNA连接酶、DL2000DNA分子量marker、DL5000DNA分子量marker;限制性内切酶(NotI、BamHI)为NEB公司产品;pfuDNA聚合酶购自上海生工公司;GoldView TM核酸染料购自Biorule;质粒小提试剂盒、DNA纯化试剂盒、琼脂糖凝胶DNA回收试剂盒购自天根生物有限公司;无缝克隆试剂盒购自上海近岸科技有限公司.
1.3 实验方法
1.3.1 质粒表达载体的构建 GLP-1-Fc基因由上海生工生物工程有限公司合成,在基因的5’端添加XhoI的酶切位点,3’端添加TAA终止密码子和NotI酶切位点.利用重叠延伸PCR,构建aF-GLP-1-Fc基因片段.分别利用BamHI-HF和NotI-HF双酶切pPIC3.5k质粒及目的基因,并进行纯化回收.经T4 DNA连接酶连接后,转化大肠杆菌XL-10,经菌落PCR验证后,抽提质粒进行基因测序.
1.3.2 GLP-1-Fc(N126A)的构建 突变体表达载体构建主要采用QuikChange 定点突变技术.以Ala的密码子序列为中心、设计上下游引物.对合成引物进行磷酸化,利用磷酸化后引物进行QuikChange PCR,经DpnI 酶切后转化XL-10.挑选菌落进行菌落PCR验证,并提取质粒进行序列分析.
1.3.3 GLP-1-Fc(N126A)的表达SaCI单酶切重组质粒pPIC3.5k-aF-GLP-1-Fc,对质粒进行线性化.利用乙醇沉淀法纯化线性化后的质粒.通过电转化转入毕赤酵母GS115中,经菌落PCR验证后,挑取阳性菌落接种于BMGY培养液中220 rpm、29 ℃培养约24 h.24 h培养结束后,向培养基中添加100%甲醇至其终浓度为0.5%,开始蛋白的诱导表达.加入浓度为0.5%的甲醇诱导6 d.取样的菌液按照12 000 rpm离心10 mim后,将上清和沉淀分开,保存至-20 ℃冰箱中.
1.3.4 GLP-1-Fc(N126A)的分离纯化 HiTrap rProtein A FF预装柱及KTAprimeTMPLUS蛋白纯化系统对融合蛋白进行亲和层析.结合缓冲液采用20 mmol/L磷酸钠(pH 7.0)缓冲液,洗脱液采用0.1 mol/L柠檬酸钠(pH 3.0)缓冲液.
1.3.5 Western blot检测目的蛋白 将纯化获得的目的蛋白进行SDS-PAGE电泳,待电泳结束后,取出凝胶,参照蛋白marker,切下目的蛋白应在部分,做好标记后放在1×电转液中浸泡5 min.经转膜、封闭后,按1∶8 000用封闭液稀释羊抗人IgG Fc(HRP)抗体,将NC膜转入其中,放在脱色摇床上室温孵育2 h.将NC膜取出洗膜30 min后,在暗室内,按照ECL试剂盒说明书取A液与B液各1 mL在EP管中充分混匀后,均匀加到NC膜上,孵育1.5 min,曝光并保存图片.
2 结果
2.1 aF-GLP-1-Fc表达载体的构建、鉴定
提取含有已经优化过的信号肽的酵母基因组,PCR获得信号肽aF,并对PCR产物进行纯化,纯化的DNA片段大小为288 bp;目的基因GLP-1-Fc由生工生物公司合成,基因大小为914 bp.通过重叠延伸PCR的方法构建目的基因aF- GLP-1-Fc,片段大小为1 202 bp.利用BamHI-HF和NotI-HF双酶切pPIC3.5k质粒及目的基因片段,并通过T4连接酶将目的基因连入表达载体.重组质粒利用BamHI-HF和NotI-HF双酶切鉴定(如图1),大小正确,同时,DNA测序结果分析读码框正确、未发生移码.
2.2 GLP-1-Fc(N126A)的构建
N-糖基化的第一步是将14C的核心寡聚糖添加到新形成的多肽链的天冬酰胺受体上,其特征氨基酸的序列为Asn-X-Ser/Thr.通过分析GLP-1-Fc序列,第126位天冬氨酸为融合蛋白N-糖基化位点.因此,本研究为获取无糖基化修饰蛋白,构建了GLP-1-Fc(N126A)突变体(如图2).突变体构建采用QuikChange 定点突变技术,引物磷酸化后,通过QuikChange PCR,转化XL-10,经酶切验证、测序分析后挑取阳性克隆进行后续培养、蛋白纯化.
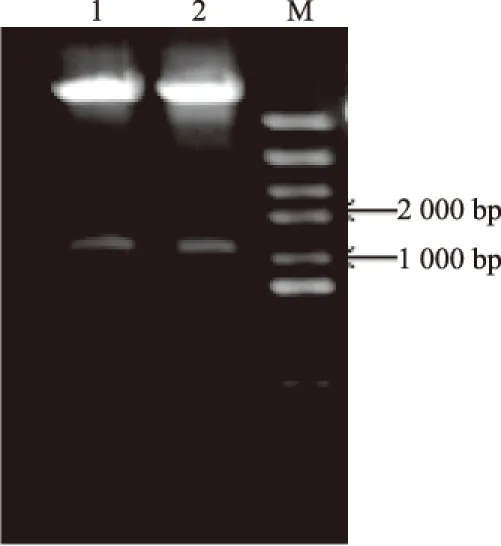
M:DL5000;1~2:提取的阳性质粒
图1 af-GLP-1-Fc重组质粒的双酶切鉴定
Fig.1 The double digests analysis of af-GLP-1-Fc construction

A:QuikChange PCR;B:aF-GLP-1-Fc与aF-GLP-1-Fc(N126A)序列比对
2.3 GLP-1-Fc(N126A)的诱导表达
将含有GLP-1-Fc(N126A)表达载体电转化毕赤酵母.以BMGY作为培养液经甲醇诱导6天后取上清,SDS-PAGE检测,30~40 kD处含有诱导蛋白表达条带(如图3).为了进一步确认融合蛋白的表达,利用抗Fc抗体对上清液进行Western blot实验检测,ECL显色进一步确认表达蛋白中含有Fc片段(如图4).

图3 SDS-PAGE电泳检测GLP-1-Fc(N126A)融合蛋白的表达Fig.3 SDS-PAGE analysis the expression of GLP-1-Fc(N126A) fusion protein
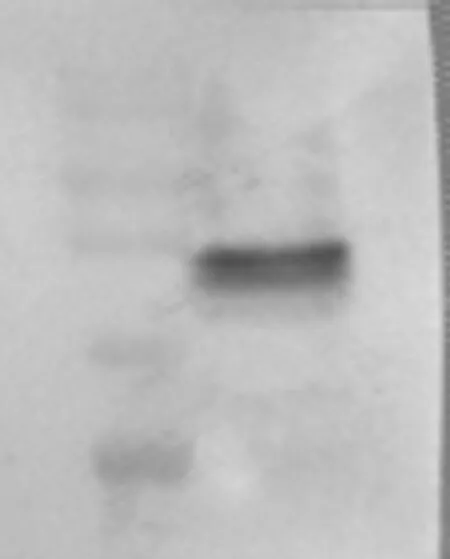
图4 Western blot检测GLP-1-Fc(N126A)融合蛋白的表达Fig.4 Western blot analysis of the GLP-1-Fc(N126A) fusion protein expression
2.4 GLP-1-Fc(N126A)的表达和纯化
rProtein A亲和层析柱能够特异结合Fc片段蛋白,如图5所示,利用rProtein A亲和层析柱进行一次纯化即可获得单一的洗脱峰(473.5 mL).将洗脱峰进行SDS-PAGE检测,GLP-1-Fc(N126A)融合蛋白纯度为80%(如图6).

图5 rProtein A亲和层析纯化GLP-1-Fc(N126A)融合蛋白色谱图 Fig.5 Affinity chromatography of GLP-1-Fc(N126A)with rProtin A

图6 SDS-PAGE检测GLP-1-Fc(N126A)的纯化结果Fig.6 SDS-PAGE analysis the expression of GLP-1-Fc(N126A) fusion protein
3 讨论
近几年,II型糖尿病发病率急剧提高,医学及分子生物学领域越来越关注II型糖尿病的治疗,使其成为科研工作者研究的热点问题.GLP-1具有促进胰岛素分泌、抑制胰高血糖素合成、减退食欲、减少食物吸收等作用,在降血糖的同时还可以降低体重、副作用不明显,所以其在治疗II型糖尿病方面存在巨大潜力[9-11].
本研究将GLP-1与人的Ig4蛋白基因进行融合,并构建酵母表达载体(如图1所示),通过增加融合蛋白的分子量,降低肾脏清除融合蛋白的速率,并利用Fc的循环受体(ecycling receptors,FcRn)使得重组蛋白能循环利用,进一步延长重组蛋白在血浆中的作用,从而延长融合蛋白的半衰期.美国FDA已经批准上市的融合蛋白GLP-1-Fc采用细胞表达系统,生产成本高,本研究选择易于大规模培养、能够进行分泌表达的毕赤酵母作为表达系统,首先从发酵条件上极大程度减少了生产成本.此外,酵母表达系统存在糖基化修饰,容易表达糖蛋白进而缩短半衰期、增加免疫原性[12-13],通过对融合蛋白序列分析发现,GLP-1-Fc仅存在N126一个N-糖基化位点.为减少糖基化修饰的影响,本研究进一步将N126位点天冬氨酸成突变为了丙氨酸(如图2所示),通过改变N-糖基化的特征序列避免N-糖基化的形成,进一步减少了免疫原性.融合蛋白在酵母中经甲醇诱导6天后在发酵上清中存在显著过表达条带(如图3所示),表明融合蛋白胞外表达成功,简化了胞内表达蛋白纯化所需步骤.发酵上清在液相色谱经ProteinA纯化中仅出现单一峰,仅经一步纯化即可获得高纯度产物(如图5、6),所需纯化工艺简单,适合工业化生产.综上所述,本研究从表达和纯化两方面减少了GLP-1-Fc生产成本,为国内GLP-1的新药研发打下了基础.
[1] WASADA T. Glucagon-like peptide-1 (GLP-1)[J]. Nippon Rinsho, 2004,62(6):1175-1180.
[2] CHAVANIEU A. Structural requirements of the N-terminal region of GLP-1-(7-37)-NH2 for receptor interaction and cAMP production[J].European journal of medicinal chemistry, 2004,39(6), 473-480.
[3] ROLIN B. The major glucagon-like peptide-1 metabolite, GLP-l-(9-36)-amide, does not affect glucose or insulin levels in mice[J]. Eur Pharmacol, 2004,494(2/3):283-288.
[4] HOLST J. Treatment of type II diabetes mellitus with agonists of the GLP-1 receptor or DPP-IV inhibitors[J]. Expert opinion on emerging drugs,2004,9(1):155-166.
[5] 王圣钧, 郁慧丽, 翟琳, 等.人GLP-l-IgG Fc融合蛋白在毕赤酵母中的高效表达[J]. 生物技术, 2011,21(4):29-33.
[6] AZIZ A. Exendin-4, a GLP-1 receptor agonist, interacts with proteins and their products of digestion to suppress food intake in rats[J]. Journal of nutrition, 2003,133(7):2326-2330.
[7] OZES O, KLEIN S. A comparison of interferon Con1 with natural recombinant interferons-alpha: anti-viral anti-proliferative and natural killer-inducing activities[J]. Interferon Res, 1992,12(1):55-59.
[8] KOYAMA A, ADACHI A. Comparison of an antiviral activity of recombinant consensus interferon with recombinant interferon-alpha-2b[J]. Microbes infect, 1999,13(1):1071-1073.
[9] KJELLIS L. The influence of GLP-1 on glucose stimulated insulin secretion: effects on β-cell sensitivity in type II and nondiabetic subjects[J]. Diabetes, 2003, 52(2):380-386.
[10] ALESSIO D. Glucagon-like peptide-1: evolution of an incretin into a treatment for diabetes[J]. Physiol Endocrinnol Metab, 2004,286(6):882-890.
[11] MEIER J. Intravenous glucagon-like peptide 1 normalizes bloodglucose after major surgery in patients with type II diabetes [J]. Crit Care Med, 2004,32(3):848-851.
[12] NOFFZ S. Hetero-oligomeric interactions between early glycosyltransferases of the dolichol cycle[J]. Glycobiology, 2009, 19(5):472-478.
[13] LU J, TAKAHASHI T, OHOKA A, et al. Alg14 organizes the formation of a multiglycosyltransferase complex involved in initiation of lipid-linked oligosaccharide biosynthesis[J]. Glycobiology, 2012, 22(4):504-516.
(责任编辑:王浩毅)
Expression and Purification of Non-glycosylated Glp-1-Fc(N126A)
Fusion Protein in Yeast Expression System
QIAO Xiaofang1,2, WANG Chunyan3, GU Baohua3, TIAN Qingnan1,3
(1.DepartmentofPharmacy,ZhengzhouUniversity,Zhengzhou450001,China; 2.CenterofAnyangHigh-
TechZoneFoodandDrugAdministration,Anyang455000,China; 3.SchoolofLifeScience,Zhengzhou
University,Zhengzhou450001,China)
Glucagon-like peptide-1(GLP-1) is a kind of ducdenin, which has good and comprehensive hypoglycemic effect.The GLP-1 was easy to be degraded in plasma. To prolong the half-life of GLP-1, the GLP-1-Fc(N126A) was constructed through mutant N-glycosylation asparagine receptor into alanine. The GLP-1-Fc(N126A) fusion protein was obtained by yest expression system, and was purified by rProteinA.
glucagon-like peptide-1(GLP-1); Fc fusion protein; yeast expression
2016-09-27
国家自然科学基金青年科学基金资助项目(31601867);中国博士后基金特别资助项目(2016T90674).
乔晓芳(1977—),女,河南安阳人,主管药师,主要从事生物医药研究,E-mail:ayqiaoxiaofang@163.com;通讯作者:田庆南(1986—),男,河南商丘人,讲师,主要从事生物医药研究,E-mail:tqn127@163.com.
乔晓芳,顾宝华,田庆南.无糖基化修饰GLP-1-Fc(N126A)在酵母中的表达、纯化[J] .郑州大学学报(理学版),2016,48(4):86-89.
Q784;Q786;Q789
A
1671-6841(2016)04-0086-04
10.13705/j.issn.1671-6841.2016697
