微波促进钛合金内固定骨折术后骨愈合的实验研究
2016-12-30叶冬梅白跃宏
叶冬梅,陈 琛,白跃宏,沈 梅
(1. 大连大学附属中山医院 康复医学科,辽宁 大连 116001;2. 大连大学医学院 解剖学教研室,辽宁 大连 116001;3. 上海交通大学附属第六人民医院 康复医学科,上海 200233)
微波促进钛合金内固定骨折术后骨愈合的实验研究
叶冬梅1,陈 琛2,白跃宏3,沈 梅1
(1. 大连大学附属中山医院 康复医学科,辽宁 大连 116001;2. 大连大学医学院 解剖学教研室,辽宁 大连 116001;3. 上海交通大学附属第六人民医院 康复医学科,上海 200233)
目的 探讨钛合金内固定骨折术后微波治疗的安全性及其对骨愈合的影响。方法 选31只新西兰大白兔,建立兔股骨干骨折钛合金植入模型。动物建模术后3 d,取15只模型动物,根据微波照射功率不同分为:20 W组、40 W组及60 W组,每组5只。采用实时温度测量方法测定不同剂量各组微波照射时钛合金,钛合金周围肌肉组织及对照侧肌肉组织温度变化,确定动物模型的治疗剂量。将另16只模型动物随机分成实验组(连续波型照射),对照组(模拟治疗),每组8只。对兔股骨骨折钛合金植入模型给予30 d治疗剂量的微波照射。采用X线平片射线相对密度定期评价骨折愈合。治疗结束处死动物,观察HE染色及电镜下组织形态,检测组织中caspase-3,caspase-9 mRNA及蛋白表达,评价钛合金周围组织热损伤。结果 动物模型的治疗剂量为25 W 10 min。实验组与对照组相比,植入物毗邻肌肉、神经组织及骨组织无明显的形态学变化,两组骨骼肌caspase-3,caspase-9 mRNA及蛋白表达差异不显著(均P>0.05)。X线平片结果表明照射第10天两组骨折愈合差异明显(P=0.03),而第30天两组差异不显著(P=0.12)。骨组织病理学评分结果表明微波治疗可促进骨折愈合。结论 小剂量微波治疗不会对钛合金植入物周围组织造成不可逆热损伤且可有效促进钛合金内固定术后骨折愈合。
微波;钛合金;内固定物;骨折愈合;热损伤
据统计,全球约有5%~10%的骨折患者会进展为骨折延迟愈合甚至骨不连[1]。近年来,一些促进骨折愈合的非侵入性治疗方法不断出现。医用微波是频率为300 M~300 GHz的电磁波,可产生深部的热效应,通过易化疼痛阈、促进坏死组织吸收、减轻局部水肿等机制减轻疼痛是许多疾病常用的辅助治疗方法[2]。有研究表明,微波治疗可促使更快更高密度的骨质沉积,加速骨愈合。而对于内固定金属骨折,微波反射、折射、散射的物理特性可诱导金属表面涡电流而引起焦耳热,将会导致金属周围温度升高甚至局部组织热损伤。物理治疗学中一直将照射区域内存在金属植入物(金属板、螺钉、内固定针)列为微波治疗的禁忌证。然而由于缺乏大量可靠的实验证据这一问题一直存在争议[3]。
钛和钛合金是目前应用最广的骨折内固定材料。由于钛是顺磁性金属且具有相对低的磁导率及电导率,因而在电磁场中吸收射频能量较少。既往体外研究发现,在射频电磁场中钛合金温度升高较钴铬合金、不锈钢低[4]。因此,本研究在骨折钛合金内固定动物模型体内通过实时温度测量确定微波照射的安全治疗剂量,并进一步利用动物模型对该微波治疗剂量进行30天的随机对照实验,以验证其可否导致钛合金周围组织热损伤,同时验证该微波剂量对骨折愈合的影响,从而对微波应用于钛合金内固定术后的可行性及安全性进行实验验证。
1 材料和方法
1.1 兔股骨干骨折钛合金植入模型的建立
选用新西兰大白兔31只,体重2.0~3.2 kg。30 mg/kg戊巴比妥钠耳缘静脉注射麻醉成功后,常规消毒、铺巾。以各兔的右后肢为实验对象,在兔右侧股后部切口进入,钝性分离股外侧肌及股二头肌,充分显露股骨。将“一”字型七孔掌骨钛合金内固定板(4.60 cm×0.42 cm)及钛合金螺钉(LCP,T-plate 2.4,Synthes Company,USA)固定于股骨中段外侧。取线锯在钢板中央对应股骨干处造一个3 mm骨缺损,清洗后缝合伤口。术后3 d连续给予青霉素肌内注射(80万单位)以预防感染。
1.2 微波照射区域温度测量
动物建模术后3 d,取15只模型动物,根据微波照射功率不同分为:20 W组、40 W组及60 W组,每组5只。模型动物予以15 mg/kg戊巴比妥钠静脉注射麻醉。微波2450 MHz连续波型照射30 min。微波探头垂直照射手术切口,距离切口10 cm。照射功率分别给予20 W、40 W及60 W,实验开始前,使用瓦特计矫正微波发射器的输出功率。传感器垂直插入肌肉直至探头垂直接触钛合金植入物表面,测量记录钛合金植入物的温度变化;探头垂直于钛合金板的中间孔上方5 mm处,测钛合金毗邻组织温度变化。照射后休息1 h,使动物体温恢复正常,再测量模型动物左后肢(对照肢体)肌组织的温度。对照肢体温度测量位置与实验组相同。实验时, 室内温度保持在24 ℃。
1.3 微波治疗
将16只模型动物随机分成实验组、对照组,每组8只。根据之前微波照射区域温度测量实验结果,得到的最适时间和功率,给予实验组动物右后肢微波连续波型照射。对照组动物右后肢给予不开启微波仪的模拟治疗。实验开始前,使用瓦特计矫正微波发射器的输出功率。
1.4 X线评价骨折愈合
分别在微波治疗第10天、30天拍摄股骨正位X线平片以评价骨折愈合。摄片机输出电压为55 KV,电流0.3 mA,曝光时间3 s。光学密度评价使用同一光源。应用光学密度计测量摄片光密度。
1.5 组织病理学评价
分别在治疗第10天、30天处死动物,各组随机处死动物4只,取骨缺损周围骨组织,9%甲酸脱钙液中脱钙5 d,福尔马林液中固定48 h,骨组织切片及HE染色。由3名病理医师独立对骨组织病理切片骨折愈合情况进行评分。评分标准按照文献评分方法。在25倍光学显微镜下进行相关参数测量和计算:(1)骨小梁相对体积:切片骨小梁/整体切片组织体积;(2)骨小梁厚度=骨小梁宽度/1.2(1.2:切片厚度矫正系数);(3)骨小梁分离度=骨小梁厚度×[(100/骨小梁相对体积)-1];(4)骨小梁节点率=3个或者3个以上骨小梁的交点/无交点骨小梁数。
1.6 透射电镜检测肌组织、神经组织形态学
术后10 d、30 d处死动物,取钛合金表面骨骼肌组织及毗邻坐骨神经。固定、脱水、包埋、切片,用3%醋酸铀—枸櫞酸铅双重染色30 min,透射电镜下拍照。
1.7 Realtime-PCR检测
用Trizol (Invitrogen)裂解细胞提取总RNA,利用ReverTra Ace qPCR RT Kit试剂盒将1 μg RNA逆转录为cDNA,然后利用SYBR Green Realtime PCR Master试剂盒进行RT-PCR,以β-actin为内参,每组实验重复3次。以2-ΔΔCt计算目的基因的相对表达水平。RT-PCR引物信息见表1。

表1 RT-PCR引物序列
1.8 Western blot检测凋亡
考虑如图1所示的Internet下双渠道闭环供应链网络动态模型,这里制造商不仅通过传统的实体分销渠道,即制造商通过零售商卖货给消费者,还通过电子商务渠道直接销售商品给消费者,这两个渠道同时满足消费者的总体需求。这里考虑的逆向物流部分包括消费者的无缺陷退货和回收再制造。无缺陷退货可以作为新商品再次直接销售,消费者通过原销售渠道进行退货;废旧商品可通过双回收渠道进行回收,作为原材料通过再制造生产出新的商品。
将200 mg组织加入0.2 mL蛋白裂解液裂解30 min,4 ℃、3000 r/min离心20 min,取上清。BSA法测定总蛋白浓度,取等质量总蛋白(30 μg),95 ℃变性10 min,经10%SDS-PAGE电泳分离蛋白质后在Bio-Rad湿转电泳槽中恒压100 V转膜70 min,5%脱脂奶粉中室温封闭1 h,一抗4 ℃摇床过夜(caspase-3抗体1∶4000稀释,caspase-9抗体1∶2000稀释),TBS洗膜3次,每次5 min,二抗室温摇床2 h,TBS洗膜3次,每次5 min,ECL显影。以β-actin作为内参。
1.9 统计学方法
数据采用SPSS19.0forWindows(SPSS,Inc.,Chicago,IL,USA)软件进行分析。计量资料用均数±标准差(mean±SD)表示。使用Student’st检验分析两组间差异,连续变量的多组间比较采用方差分析。P<0.05(双侧)为差异具有显著性意义。
2 结 果
2.1 钛合金及其毗邻肌肉温度变化
微波照射30 min后,20 W、40 W、60 W组钛合金表面温度分别升高(2.2±0.2)℃,(5.7±0.5)℃,(10.3±0.5)℃,三组间比较,差异有显著性意义(P<0.01)。20 W组在24 min点,40 W组在照射24~30 min及60 W组在照射的15~18 min、25~30 min时段,实验侧钛合金表面温度高于毗邻肌组织温度,差异有显著性意义(P<0.05)。见图1。
微波照射30 min后,20 W组对照侧肢体与实验侧肢体峰值温度分别为(37.9±0.1)°C和(37.9±0.2)°C;40 W组对照侧肢体与实验侧峰值温度分别为(40.6±0.5)°C和(40.8±0.4)°C,两组内对照侧和实验侧肢体肌峰值温度差异均不显著(P>0.05)。60 W组对照侧和实验侧肢体肌组织温度分别升高(6.1±0.5)°C和(9.2±0.3)°C,两者比较差异有显著性意义(P<0.01)。60 W组对照侧和实验侧肢体峰值温度分别为(42.1±0.2)°C和(46.5±0.3)°C,差异显著(P<0.01)。见图1。
结合以上实验结果与临床微波治疗参数,在后续为期30 d的连续微波照射研究中,本研究采用25 W 10 min 条件进行后续研究。
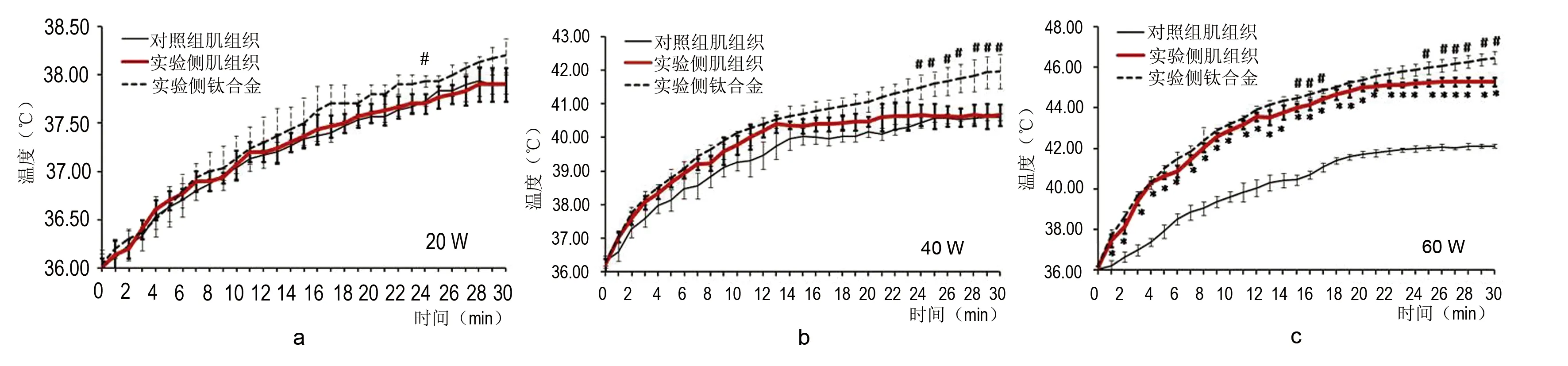
图1 钛合金及毗邻肌组织温度变化Fig 1 The temperature of titanium alloy and muscle tissues adjacent to the implantsa: 20 W组; b: 40 W组; c: 60 W组。#:实验侧钛合金表面温度与毗邻肌组织温度差异有显著性意义,P< 0.05;*:对照侧与实验侧肢体温度差异有显著性意义,P<0.05
2.2 微波对钛合金周围组织热损伤的形态学检测
病理学结果显示,实验组偶见肌细胞肿胀,但未见炎症细胞浸润、肌细胞坏死等改变,对照组钛合金毗邻骨骼肌组织形态学未见明显异常(图2a、c)。电镜检测,实验组可见肌细胞的线粒体肿胀、嵴脱落、呈空泡样变,肌节明暗带可见但肌丝模糊。而对照组肌细胞明暗带清晰,线粒体发达,未见异常改变(图2b、d)。
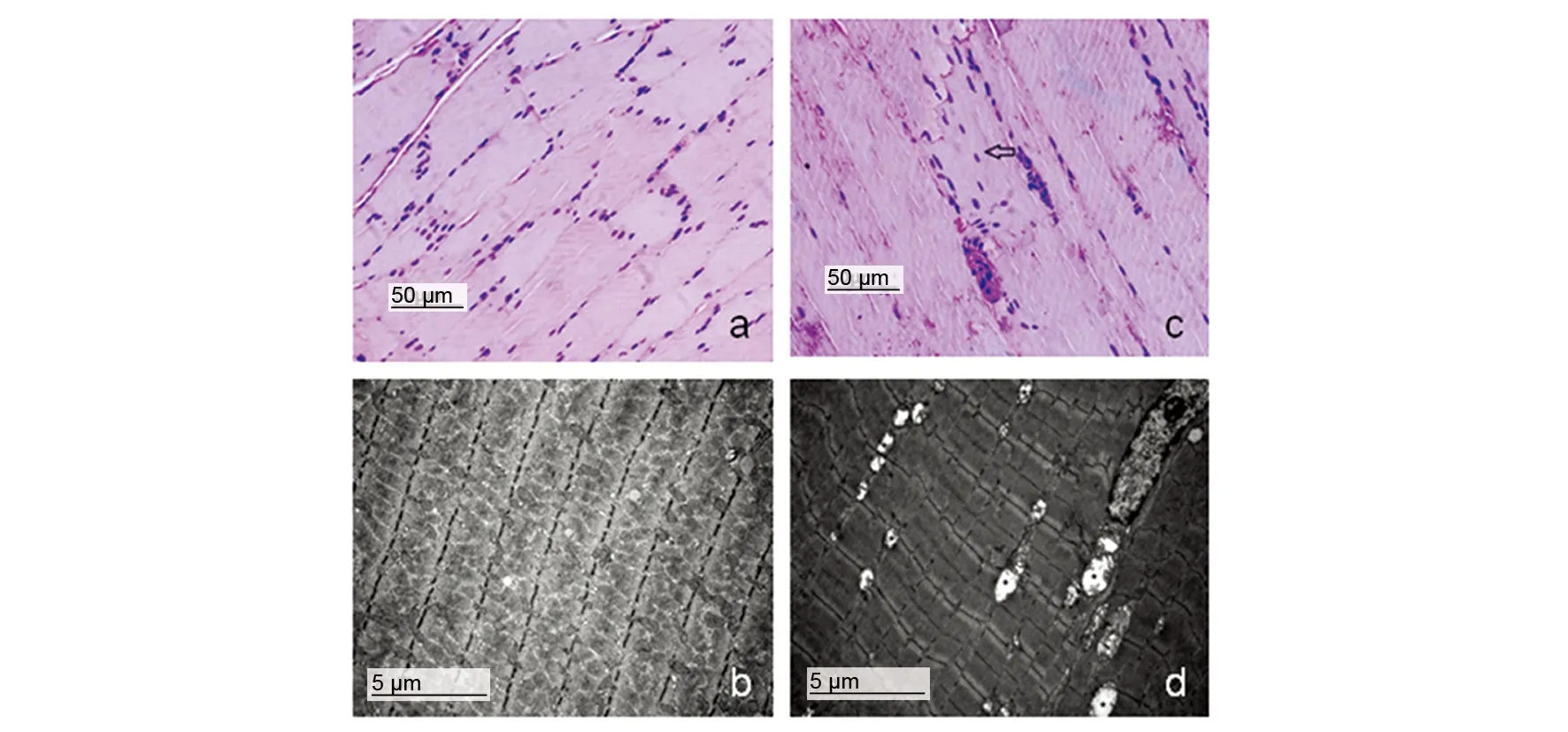
图2 钛合金毗邻骨骼肌组织病理学检测Fig 2 Pathological analysis of thigh muscle tissues adjacent to implantsa:对照组钛合金植入物毗邻肌组织HE染色,形态未见明显异常。200×,比例尺:50 μm;b:对照组肌细胞电镜检测,未见异常。5000×,比例尺:5 μm。c:实验组钛合金植入物毗邻骨骼肌组织HE染色,可见肌细胞肿胀(黑色空心箭头示),200×,比例尺:50 μm。d:实验组电镜检测,可见肌细胞的线粒体肿胀、嵴脱落(黑色星号示)。5000×,比例尺:5 μm
钛合金毗邻坐骨神经组织病理学结果显示,对照组与实验组均未见坐骨神经组织炎细胞浸润、轴索断裂、髓鞘水肿、结构紊乱等形态学异常改变。电镜检测,两组均可见轴索、髓鞘及施旺细胞结构清晰,均未见肿胀、变形等形态异常。见图3。
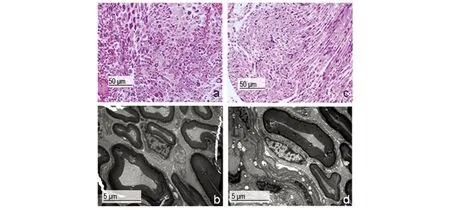
图3 钛合金毗邻神经组织病理学检测Fig 3 Pathological analysis of nervous tissue adjacent to implantsa:对照组钛合金植入物毗邻坐骨神经组织HE染色,形态未见明显异常。200×,比例尺:50 μm;b:对照组坐骨神经电镜检测,未见异常。5000×,比例尺:5 μm。c:实验组钛合金植入物毗邻坐骨神经组织HE染色,200×,比例尺:50 μm。d:实验组电镜检测,可见轴索、髓鞘及施旺细胞结构清晰,形态均无异常。5000×,比例尺:5 μm
照射30 d后,取下钛合金内固定,取骨组织常规石蜡包埋切片后行HE染色,检测结果显示对照组、实验组骨板及骨髓均未见组织坏死、碳化等形态异常,实验组骨髓腔内钉孔周围可见纤维组织增生。见图4。
2.3 肌细胞凋亡检测
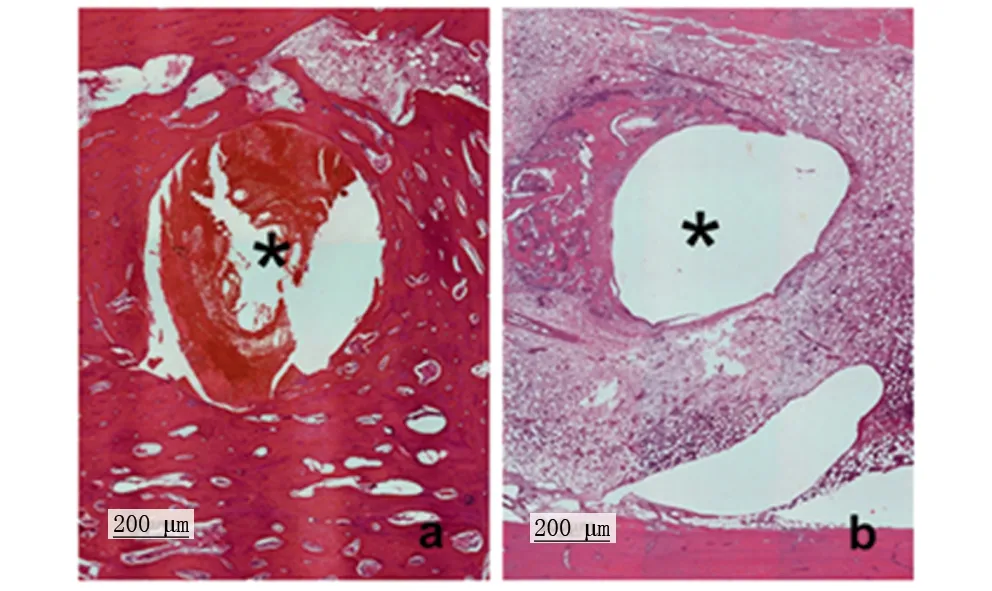
图4 钛合金螺钉周围骨组织病理切片HE染色Fig 4 Pathological analysis of bone tissue adjacent to titanium alloy screwa: 对照组;未见异常。b: 实验组;骨板及骨髓均未见炎细胞浸润、组织坏死、碳化等形态异常,骨髓腔内钉孔周围可见纤维组织增生。黑色星号:钛合金钉孔。200×,比例尺:200 μm
实验组caspase-3 mRNA水平在10 d、30 d均高于对照组,但差异不显著(P=0.14,P=0.70)。caspase-9 mRNA水平在10 d、30 d亦无显著性差异(P=0.11,P=0.57)。见图5。采用western blot检测caspase-3,caspase-9蛋白表达,对照组与实验组在术后10 d(P=0.36,P=0.46)、术后30 d(P=0.31,P=0.94)均无显著差异。见图6。
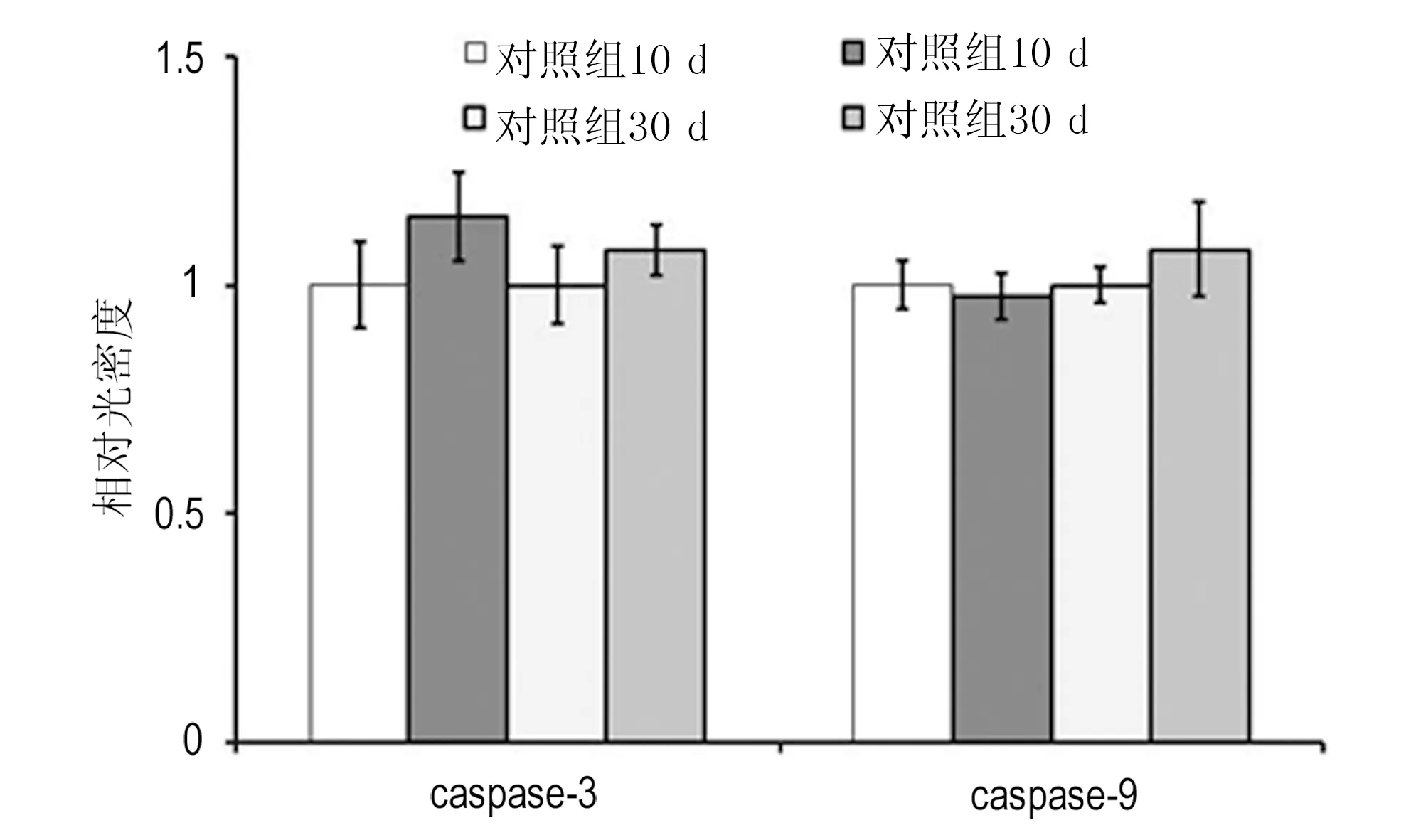
图5 钛合金周围肌细胞caspase-3,caspase-9mRNA表达Fig 5 Relative mRNA transcriptional levels of caspase-3, caspase-9 in muscle cell adjacent to implants
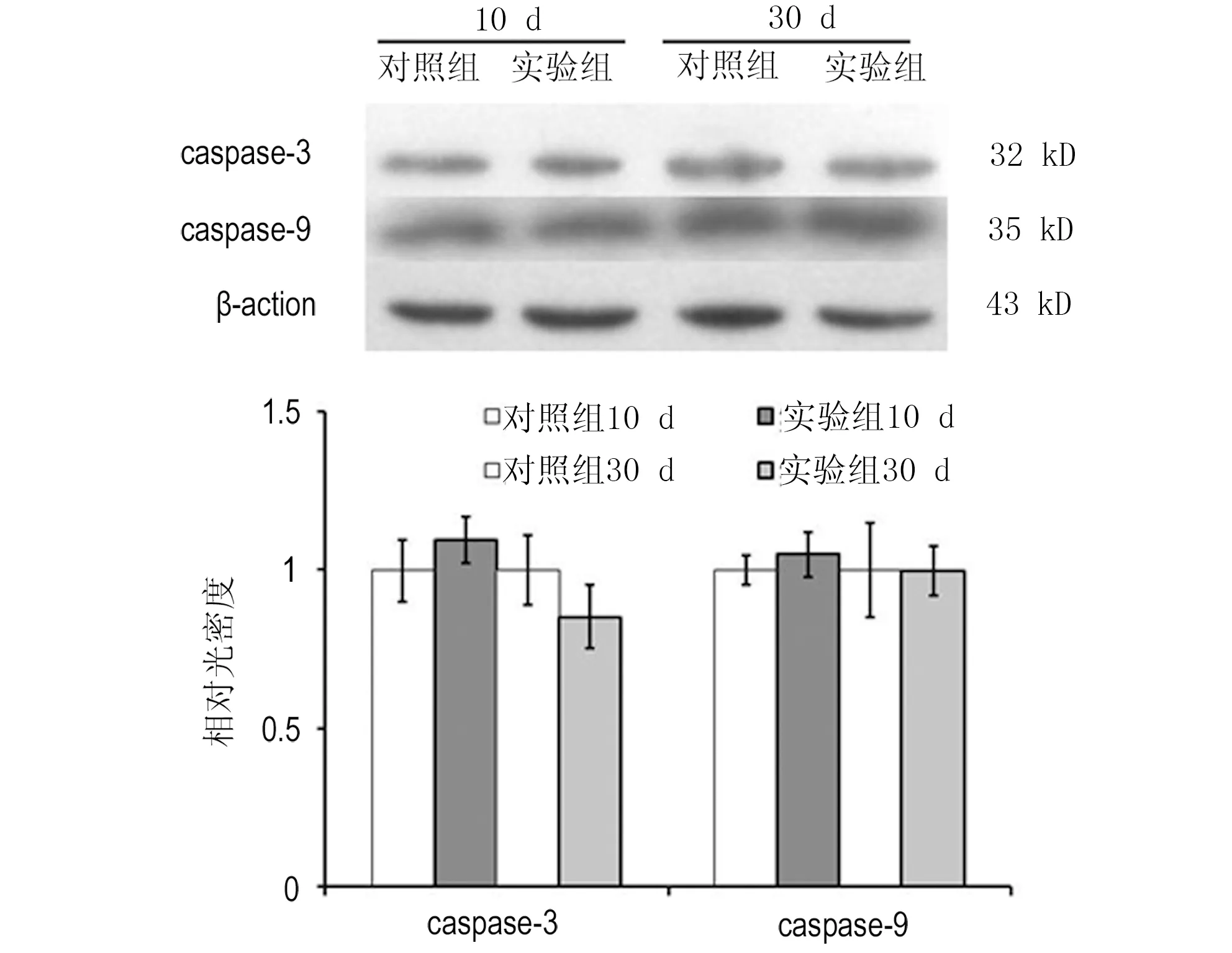
图6 钛合金周围肌细胞caspase-3,caspase-9蛋白表达Fig 6 Expression of caspase-3, caspase-9 in muscle cell adjacent to implants
2.4 钛合金内固定术后行微波照射对骨折愈合的影响
照射第10天实验组射线现对密度为(0.89±0.05),与对照组(0.94±0.03)相比差异有显著性意义(P=0.03)。而第30天实验组与对照组骨缺损均愈合良好,两组间差异不显著(P=0.12)。见图7。
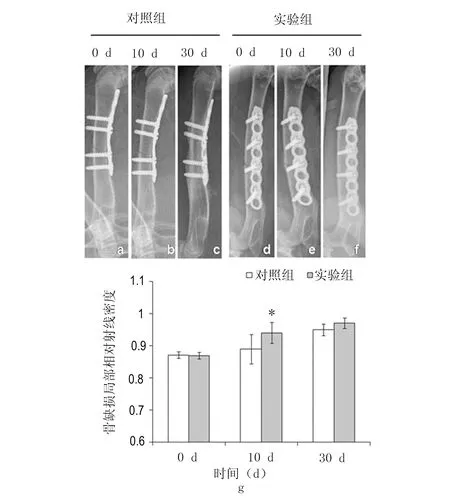
图7 兔股骨骨缺损X线摄片分析Fig 7 Radiographs of rabbit femur and the radiographs analysisa-f:兔股骨骨缺损X线股骨正位平片;箭头所指为骨缺损线。g:兔股骨骨缺损10 d、30 d X线摄片分析;*与对照组比较,P<0.05
骨组织病理学切片结果表明,治疗后10 d实验组骨膜反应明显,骨痂增生显著,骨小梁相对体积、骨小梁厚度及多交点骨小梁数目高于对照组。30 d对照组与实验组均表现较好的骨缺损愈合。骨缺损愈合评分表明,10 d后对照组评分(1.75±0.50),实验组评分为(2.75±0.50),两者差异具有统计学意义(P=0.03,图8);30 d后对照组评分(6.43±0.69),实验组评分为(7.08±0.52),两者差异具有统计学意义(P=0.04)。对骨缺损区域组织计算学结果显示,治疗后10 d,实验组骨小梁相对体积、骨小梁厚度及骨小梁节点率均显著高于对照组(P<0.05或P<0.01)。术后30 d,实验组骨小梁相对体积、骨小梁节点率显著高于对照组(P<0.05)。见表2。
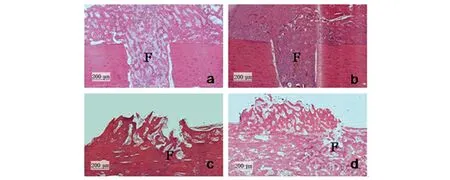
图8 骨缺损病理切片HE染色Fig 8 HE staining and pathological analysis of bone defectiona:对照组治疗10 d。b:实验组组治疗10 d;骨膜反应明显,骨痂增生显著。c:对照组治疗30 d。d: 实验组治疗30 d。F:骨缺损,200×,比例尺:200 μm

表2 骨折愈合评分
1)与对照组比较,P<0.05;2)与对照组比较,P<0.01
3 讨 论
3.1 微波的安全性
微波电疗可使照射局部产生深部热达到治疗效果。然而,为确保患者安全,有必要控制照射局部温度。既往研究表明,微波高热治疗中人体组织温度达到45 ℃时间不应超过30 min[5]。测温实验结果表明,小功率微波照射温度不会引起钛合金周围组织热损伤。组织学研究结果表明,采用小功率微波(25 W),10 min/d,30 d的治疗方案钛合金周围组织并未出现明显的形态学异常改变,仅偶见肌细胞水肿。考虑可能是线粒体受损阻滞了线粒体ATP/ADP交换[6-7],而线粒体肿胀是典型的线粒体应激的特征性表现。曾有研究报道,在暴露温度达到40 ℃时细胞线粒体即可出现肿胀,但这一形态学改变是可逆的,当温度恢复正常后,线粒体形态也随即恢复正常。虽然组织未出现热损伤的形态学变化,但一些酶对温度相当敏感。已有报道高热可诱导体内细胞发生广泛凋亡[8],为了进一步研究微波是否造成细胞分子水平的不可逆损伤笔者进行了凋亡的检测。
Caspase是一组存在于细胞质参与细胞凋亡的蛋白酶,研究发现,微波(2856 MHz,0.03 W/cm2,15 min)照射神经细胞可诱导caspase-3依赖的线粒体途径的凋亡[8-9]。有研究指出微波可导致胰腺癌细胞发生线粒体依赖的凋亡。本研究显示实验组骨骼肌细胞的超微结构出现线粒体肿胀、嵴脱落等形态异常表现,因此笔者对骨骼肌细胞中caspase-3,caspase-9的表达水平做了进一步检测发现小功率短疗程微波治疗未引起钛合金毗邻骨骼肌细胞中caspase-3,caspase-9表达显著升高,表明小功率短疗程微波治疗没有引起骨骼肌细胞线粒体介导的凋亡增加,一定程度上在分子水平证实了微波应用于钛合金内固定术后并未发生肌细胞的严重热损伤表现。但对于非线粒体途径凋亡及其机制本研究并未涉及,有待进一步探讨。
3.2 短疗程小功率微波对骨缺损愈合的治疗作用
已有多项研究证明微波热疗对骨折的愈合有促进作用。有研究采用微波热疗系统在体内及体外研究中验证了热疗可通过交变电磁场活化极性分子,分子运动撞击生热促进骨基质沉积[10]。有研究发现,0.5 W/cm2连续波型微波可促进兔骨折愈合[11]。考虑到钛合金内固定材料的存在及骨组织特别是骨皮质血流较少热耗散能力较差,有可能在热疗中受到损害的特点,本研究采用的微波探头有效治疗面积138.9 cm2,微波功率约为0.2 W/cm2,病理学结果证实微波照射未对钛合金毗邻骨组织及骨髓造成不良影响。影像学及病理学结果均表明该功率可有效促进钛合金内固定术后兔股骨骨折的愈合,股骨平片显示术后10 d骨愈合情况明显优于对照组。Olchowik等[12]曾报道过类似的结果,低功率微波对骨折愈合促进作用表现在骨折修复早期,然而机制尚不明确。本研究分析原因如下:其一,微波重要的生物学效应是加快局部血液流动从而增加氧和营养物质的代谢而促进骨修复;其次,多个研究证实微波治疗可以促进水肿消退,而这一过程正发生在骨修复早期;再次,微波可能提高局部生长因子如TGF-β、FGF、PDGF等的表达,这些分子均已被证实在骨折愈合早期起重要的作用[13]。更多针对高频电加速骨折愈合机制的研究表明,超短波治疗可显著上调骨细胞BMP-2表达,无热量照射15 d,超短波组BMP-2 mRNA表达量为对照组的2.74倍[14]。还有研究发现超短波电疗增加骨痂中VEGF的表达,促进骨痂中血管的形成加快骨折愈合[15]。
目前,微波对骨折愈合的影响及相关机制仍知之甚少。还有许多亟待解决的问题,如采取体外和体内实验对比钛合金内固定材料的面积对微波照射组织温度及热损伤的影响及其机制,增加安全性评价的指标,优化微波照射参数,制定符合各种内固定术后的理疗方案,全面评价微波理疗对骨伤尤其是钛合金内固定术后的安全性及疗效,对临床更具指导意义。
[1] Mills LA, Simpson AH. In vivo models of bone repair[J]. J Bone Joint Surg Br, 2012, 94(7): 865-874.
[2] Lubner MG, Brace CL, Hinshaw JL, et al. Microwave tumor ablation: mechanism of action, clinical results, and devices[J]. J Vasc Interv Radiol, 2010, 21(8 Suppl): S192-S203.
[3] Wu Z, Kumon R E, Laughner J I, et al. Electrophysiological Changes Correlated with Temperature Increases Induced by High-Intensity Focused Ultrasound Ablation[J]. Ultras Med Biol, 2015, 41(2): 432-448.
[4] Liu Q, Cao Q, Zhao X, et al. Insights into size-dominant magnetic microwave absorption properties of CoNi microflowers via off-axis electron holography[J]. ACS Appl Mater Interfaces, 2015, 7(7): 4233-4240.
[5] Sazgarnia A, Naghavi N, Mehdizadeh H, et al. Investigation of thermal distribution for pulsed laser radiation in cancer treatment with nanoparticle-mediated hyperthermia[J]. J Therm Biol, 2015, 47: 32-41.
[6] Rabini A, Piazzini DB, Tancredi G, et al. Deep heating therapy via microwave diathermy relieves pain and improves physical function in patients with knee osteoarthritis: a double-blind randomized clinical trial[J]. Eur J Phys Rehabil Med, 2012, 48(4): 549-559.
[7] Di Cesare A, Giombini A, Dragoni S, et al. Calcific tendinopathy of the rotator cuff. Conservative management with 434 Mhz local microwave diathermy (hyperthermia): a case study[J]. Disabil Rehabil, 2008, 30(20-22): 1578-1583.
[8] Zhu W, Zhang W, Wang H, et al. Apoptosis induced by microwave radiation in pancreatic cancer JF305 cells[J]. Can J Physiol Pharmacol, 2014, 92(4): 324-329.
[9] Zuo H, Lin T, Wang D, et al. Neural cell apoptosis induced by microwave exposure through mitochondria-dependent caspase-3 pathway[J]. Int J Med Sci, 2014, 11(5): 426-435.
[10] Muranaka H, Horiguchi T, Ueda Y, et al. Evaluation of RF heating due to various implants during MR procedures[J]. Magn Reson Med Sci, 2011, 10(1): 11-19.
[11] Chang WH, Sun JS, Chang SP, et al. Study of thermal effects of ultrasound stimulation on fracture healing[J]. Bioelectromagnetics, 2002, 23(4): 256-263.
[12] Olchowik G, Gaweda R, Blacha J. [The influence of microwave monochromatic radiation on bone fracture union in rabbits][J]. Chirurgia narzadów ruchu i ortopedia polska, 1992(4): 297-300.
[13] Chalidis B, Sachinis N, Assiotis A, et al. Stimulation of bone formation and fracture healing with pulsed electromagnetic fields: biologic responses and clinical implications[J]. Int J Immunopathol Pharmacol, 2011, 24(1 Suppl 2): 17-20.
[14] 孙强三, 袁俊英, 王道清, 等. 超短波对兔激素性股骨头缺血性坏死骨组织BMP-2 mRNA的影响[J]. 中华物理医学与康复杂志, 2008, 30(5): 304-307.
[15] Pang CJ, Tong L, Ji LL, et al. Synergistic effects of ultrashort wave and bone marrow stromal cells on nerve regeneration with acellular nerve allografts[J]. Synapse, 2013, 67(10): 637-647.
Treatment effect of microwave on fracture with titanium alloy internal fixation
YE Dong-mei1, CHEN Chen2, BAI Yue-hong3, SHEN Mei1
(1.DepartmentofRehabilitation,AffiliatedZhongshanHospitalofDalianUniversity,Dalian116001,China;2.DepartmentofAnatomy,MedicalCollegeofDalianUniversity,Dalian116001,China;3.DepartmentofRehabilitation,AffiliatedSixthPeople'sHospitalofShanghaiJiaoTongUniversity,Shanghai200233,China)
Objective To study effect of microwave treatment on fracture healing with titanium alloy internal fixation. Methods Titanium alloy internal fixation systems were implanted in rabbits withthigh bone fracture.Temperature changes of muscle tissues around implants were measured during the irradiation for seeking a reasonable dose. Then rabbits in treatment group began to receive microwave treatment 3 days after operation. Normalized radiographic density of the fracture gap was measured. All of the animals were killed after 10 and 30 days microwave treatment, and then histological examinations were performed on the harvested muscles, nerves and bone tissues. The expression of caspase-3,-9 was analyzed by real time-PCR and western blot.Results No abnormal morphological changes were shown in nerve and bone around the implants of microwave treatment group. But some reversible damages were observed occasionally in muscles, including swelling myocytes with light microscopy and mitochondrial swelling with transmission electron microscopy. The expression of caspase-3,caspase-9 didn’t rise significantly (bothP>0.05). Radiographic assessments showed that fracture healing was accelerated especially on the 10th day of the microwave treatment (P=0.03), while no significant difference on the 30th day (P=0.12).Conclusion Low power microwave treatment would be helpful in the healing of fractures with titanium alloy internal fixation.
microwave;titanium alloy;implants;fracture healing;thermal injury
国家自然科学基金项目(81601982)
叶冬梅(1980-),女,辽宁大连人,主治医师。E-mail: shuiyan_1980@163.com
�� 著
10.11724/jdmu.2016.06.02
R683.42
A
1671-7295(2016)06-0526-07
叶冬梅,陈琛,白跃宏,等.微波促进钛合金内固定骨折术后骨愈合的实验研究[J].大连医科大学学报,2016,38(6):526-532.
2016-08-23;
2016-11-06)
