英国患者用药可及性方案实施经验及对我国的启示
2016-12-30崔鹏磊
常 峰 崔鹏磊 夏 强
中国药科大学国际医药商学院 江苏南京 211198
·药物政策·
英国患者用药可及性方案实施经验及对我国的启示
常 峰*崔鹏磊 夏 强
中国药科大学国际医药商学院 江苏南京 211198
风险分担协议在提高患者对药品的可及性、降低药品成本效果的不确定性和控制医保基金财务风险等方面取得了显著成效,受到各国政府或保险人的广泛关注。本文系统梳理了英国患者用药可及性方案,包括方案的起源、分类、应用流程、实施效果等。指出我国已基本具备了实施风险分担协议的条件,但仍需进一步明确风险分担协议实施主体,构建风险分担协议标准化流程,同时加强卫生技术评估在卫生资源配置中的应用,以逐步推进风险分担协议的实施等建议,以期完善我国药品谈判制度,提高药品谈判的科学性和效率。
风险分担协议; 患者用药可及性方案; 卫生技术评估; 价格谈判
2016年1月12日,国务院发布了《关于整合城乡居民基本医疗保险制度的意见》(国发〔2016〕3号),指出应建立健全医保经办机构与医疗机构及药品供应商的谈判协商机制和风险分担机制,形成合理的医保支付标准。[1]随着我国全覆盖、保基本、多层次、可持续的医疗保障体系的深入推进,山东青岛、江苏、江西、浙江、湖南等省市陆续开展了特药、特材谈判工作,并与药品供应商签订风险分担协议(risk-sharing agreements,RSA),在提高患者对药品的可及性、维持财政预算平衡和鼓励新药研发等方面做出了积极探索。RSA在国际上应用也较为广泛,在英国,RSA即为患者用药可及性方案(patient access schemes,PAS),由于PAS在英格兰、威尔士实施时间较长且运作和管理机制较为成熟,因此本文将重点分析英格兰、威尔士的PAS,以期构建我国风险分担协议标准化流程,完善我国药品谈判制度。
1 PAS概述
1.1 PAS起源
英国PAS最早可追溯至2002年。2002年1月,英国国家卫生与服务优化研究院(National Institute for Health and Care Excellence,NICE)发布了利用β-干扰素和醋酸格拉替雷治疗多发性硬化(multiple sclerosis,MS)的技术评价指南,由于该治疗手段的长期成本效果存在不确定性,NICE做出了不推荐临床使用的决定。但为了保证患者能够在国家卫生服务体系(NHS)中使用该药品,同时确保其成本效果,英国卫生部(Department of Health, DH)与英国神经病学家协会、MS信托机构、MS社会团体以及β-干扰素和醋酸格拉替雷厂商共同协商,于2002年2月发起了MS风险分担协议。协议规定NHS将会补偿药品费用,但需要进行至少10年的队列研究并收集至少5 000名患者的疾病进展情况,来监控药品的成本效果。同时规定每增加一个质量调整生命年(Quality-Adjusted Life Year,QALY)的费用阈值为36 000英镑,如果药品实际费用超过该阈值,则厂商必须降价。[2-3]
2007年2月,英国公平交易办公室(Office of Fair Trading,OFT)研究指出,当前英国药品价格调控计划(Pharmaceutical Price Regulation Scheme,PPRS)框架下许多品牌药价格过高,与类似临床疗效的替代药品相比,价差可能高达10倍,导致现行药价未能充分体现药品价值,影响了NHS资源配置效率。因此OFT提出英国应考虑实施价值定价机制(value-based pricing,VBP)[4],由政府和厂商在对药品临床价值进行科学评估的基础上进行费用谈判[5]。同时NICE在制定推荐意见时,也面临着该如何科学评估药品价值,保证药品物有所值的问题。在此背景下,DH和英国制药行业协会协商2009版PPRS时,开始实施患者用药可及性方案,旨在帮助患者早日获得NICE原本评估为不符合成本效果的药品。[6]这标志着PAS正式成为未获得NICE正面评价、成本效果具有不确定性的药品获得NHS补偿的方式。
在英国必须由厂商率先提出PAS申请。当前NICE主要依据QALY来评估药品价值,其阈值设定为20 000~30 000英镑。一般而言,当NICE认为药品每增加1个QALY就要增加30 000英镑以上费用时,厂商通常就需要提出PAS申请。而对于某些延长临终寿命的治疗方式,可适当提高阈值,适用情况需满足以下全部条件:(1)患者预期寿命通常少于24个月;(2)与NHS现行治疗方式相比,有足够的证据显示该治疗方式至少可延长3个月寿命;(3)该治疗方式必须经批准上市,且适用于少部分患者人群。[7]
1.2 PAS分类
2009版PPRS将PAS划分为两种类型:以财务为基础(financially-based)和以结局为基础(outcome-based)的方案。如图1所示。其中证明价值是指厂商与NICE达成协议,当厂商收集的新证据足以证明药品的成本效果时,可提高药品价格。预期价值是指如果依据新证据再次评估药品,发现新证据并不支持现有价格时,厂商将面临还款或降价的风险。风险分担是指需要测量患者报告结局和临床结局,基于测量的结局,厂商和NHS可选择价格调整和/或现金转移的方式来分担风险。厂商可结合使用不同类型的方案。2014年,DH与英国制药工业协会开始实施新版PPRS,并对PAS内容进行修改,将其划分为简单折扣方案(simple discount schemes)和复杂方案(complex schemes)。其中简单折扣方案需保证不会对NHS造成显著的、持续的、额外的负担。该方案下,厂商可选择改变药品目录价格或者向NHS提供折扣或固定价格(低于目录价格)。复杂方案则包括其它所有类型的PAS,例如还款、剂量上限、部分药品免费、以结局为基础的方案等。

图1 2009版PPRS中PAS分类
2 PAS应用流程
PAS应用流程重点包括以下五个方面:(1)前期讨论。厂商向DH提交PAS前,事先与DH讨论草案内容,DH往往会针对草案内容提供建议,然后由厂商决定是否提交PAS以及提交何种类型的PAS。(2)厂商向DH提交计划书模板。模板分为两类:简单折扣方案模板和标准方案模板(适用于其它所有类型的PAS)。(3)患者用药可及性方案联络单位(Patient Access Scheme Liaison Unit,PASLU)审查PAS的可行性,并向DH提供指导建议。(4)NICE进行技术评价并发布指南。(5)NHS实施并与DH、NICE共同监测PAS(图2)。
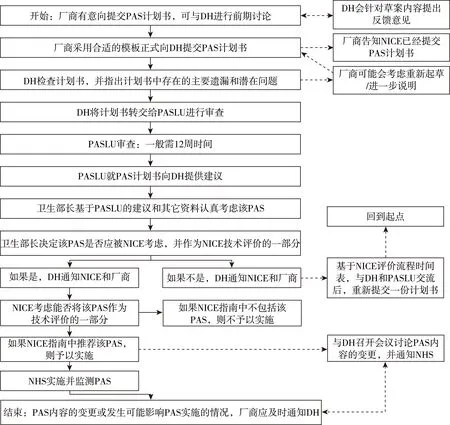
图2 PAS应用流程
2.1 实施PAS的关键性原则
(1)PAS计划书需要首先由DH与厂商进行讨论并原则上达成一致;(2)PAS必须尊重NICE向NHS提供独立评估和评价证据(针对某干预措施)的角色;(3)NHS实施PAS的所有成本都应包含于评价委员会需要考量的成本之中;(4)PAS在临床应用中应具备稳健、合理、适当和可监测的特性;(5)对NHS而言,任何PAS在运作过程中都应是可管理的,没有过于复杂的监测、不成比例的额外费用和过多的繁文缛节;(6)PAS应具有明确的实施期限和终止标准;(7)PAS运作过程中对各方当事人造成的累积行政负担应是可管理的;(8)实施PAS时应考虑优先级问题,比如可以解决先前未能满足的需要或者能够让更多患者获益的方案;(9)PAS资金流应与NHS和地方行政部门现有的资金流相一致;(10)任何PAS计划书必须咨询NHS。
2.2 厂商提出PAS的背景与时间
厂商首先需要明确提交PAS的必要性和恰当性(图3)。对于复杂方案,厂商可以在NICE技术评价开始前提出PAS,也可以在评价结束时,收到任何申诉及NICE发布最终指南后提出PAS。评价开始阶段是指厂商向NICE提交证据时提出PAS,这意味着提交给DH的PAS计划书必须在向NICE提交证据之前进行,以保证DH在第一次评价委员会会议之前有足够的时间考虑该PAS,并保证证据审查团队或评估团队有足够的时间审查该方案,如果NICE没有收到DH的正式通知,评价委员会则不能考虑该PAS。同时在指南发布16周内,厂商仍可提交PAS,当DH转交给NICE某PAS后,NICE启动快速审查机制对其进行优先审评。如果时间超过16周,NICE则采用标准审查程序考虑PAS。对于简单折扣方案,厂商还可以在技术评价流程中发布评价咨询文件或最终评价决定后提出PAS。[9]
2.3 PASLU审查流程
NICE在卫生技术评估中心下设有PASLU,负责审查PAS计划书的可行性,PASLU流程并不是NICE技术评价流程的一部分。PASLU流程包括3个阶段:(1)厂商启动PAS并提交资料。(2)PASLU审查证据并制定建议草案。PASLU在收到厂商的PAS计划书后,会依据模板要求,检查计划书的完整性。如果计划书不完整,PASLU会要求厂商做进一步说明;如果计划书完整,PASLU则会审查计划书并制定建议草案。然后PASLU将建议草案转交给厂商,厂商将在5天内检查建议草案中是否存在实质性错误(数据错误、引用不恰当、文字表述不清楚等)。(3)组织专家小组会议考虑建议草案,并向DH提交最终建议。PASLU将选择临床、药学、NHS和病患专家,与专家小组共同举行会议考虑PAS计划书的可行性(图4)。[10]
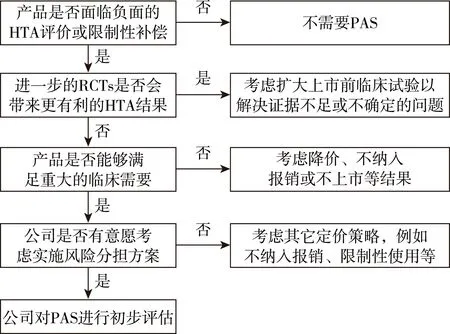
图3 厂商提出PAS的背景
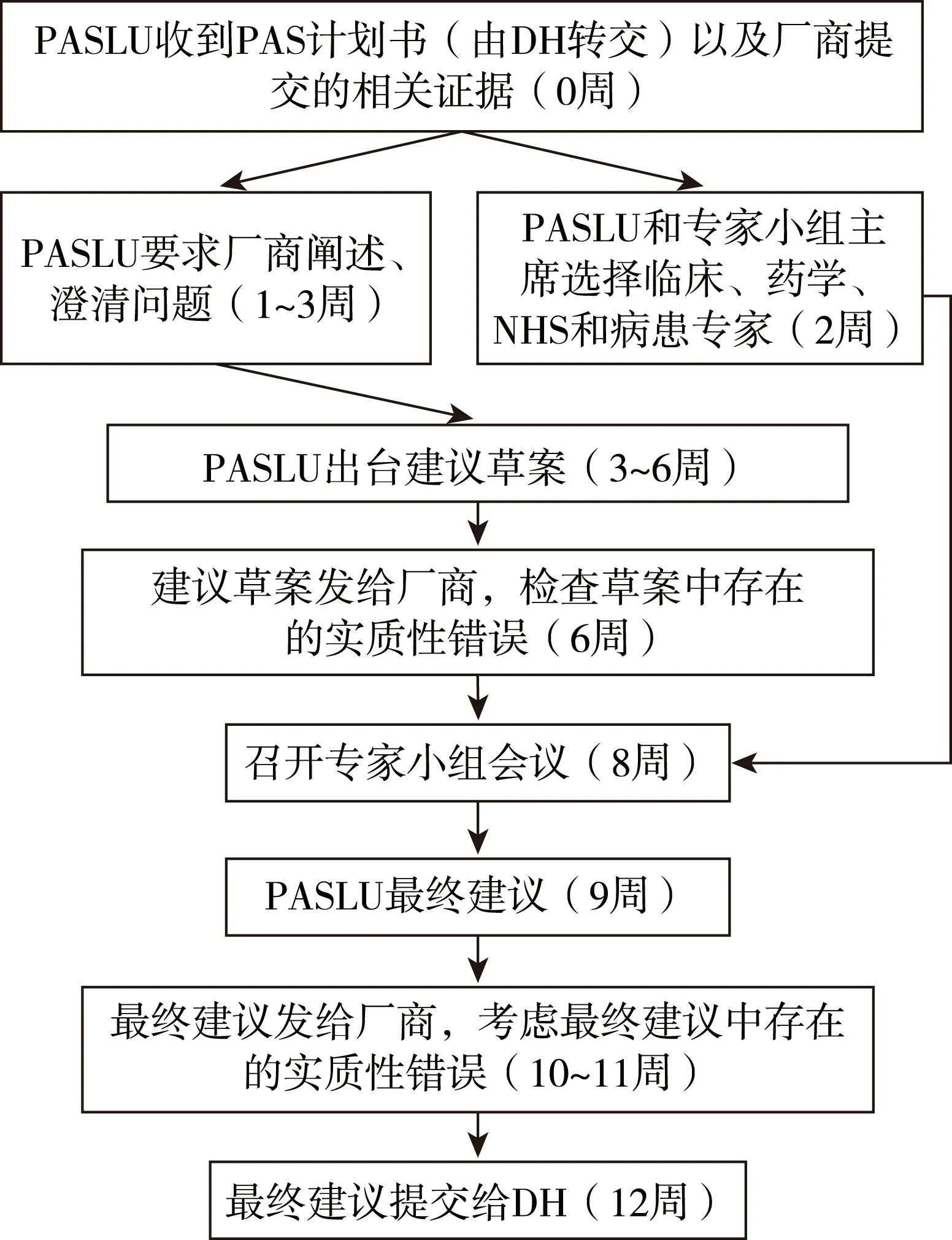
图4 PASLU审查流程
2.4 NICE技术评价流程
NICE只有在收到DH的正式通知后才能评价PAS。基于厂商提出PAS计划书的时间节点不同,NICE技术评价流程有所差异。首先由证据审查团队或评估团队审查PAS计划书并提交报告。然后评价委员会基于PAS计划书进行讨论制定最初的推荐意见(技术评价前提交PAS)或者考虑是否需要修正最初的推荐意见或已发布的评价指南(技术评价期间或结束后提交PAS),委员会委员主要来自NHS、患者及照护者团体、学术界和医药产业界。技术评价流程如图5所示,其中评价咨询文件是指评价委员会向NICE提交的暂定建议,只有当评价委员会不推荐使用或限制性使用某项技术时,才会发布此文件。然后征询各方主体意见,其中顾问和评论员在四周内对评价咨询文件进行评论,该文件也会在NICE网站上进行公布,供公众进行评论。最终评价决定是指评价委员对所有的评论进行讨论,并向NICE提供最终建议。NICE会将最终评价决定发给顾问,由其在限定时间内提出书面申诉。如果没有必须处理或申诉理由不成立,NICE将发布最终指南。[9]
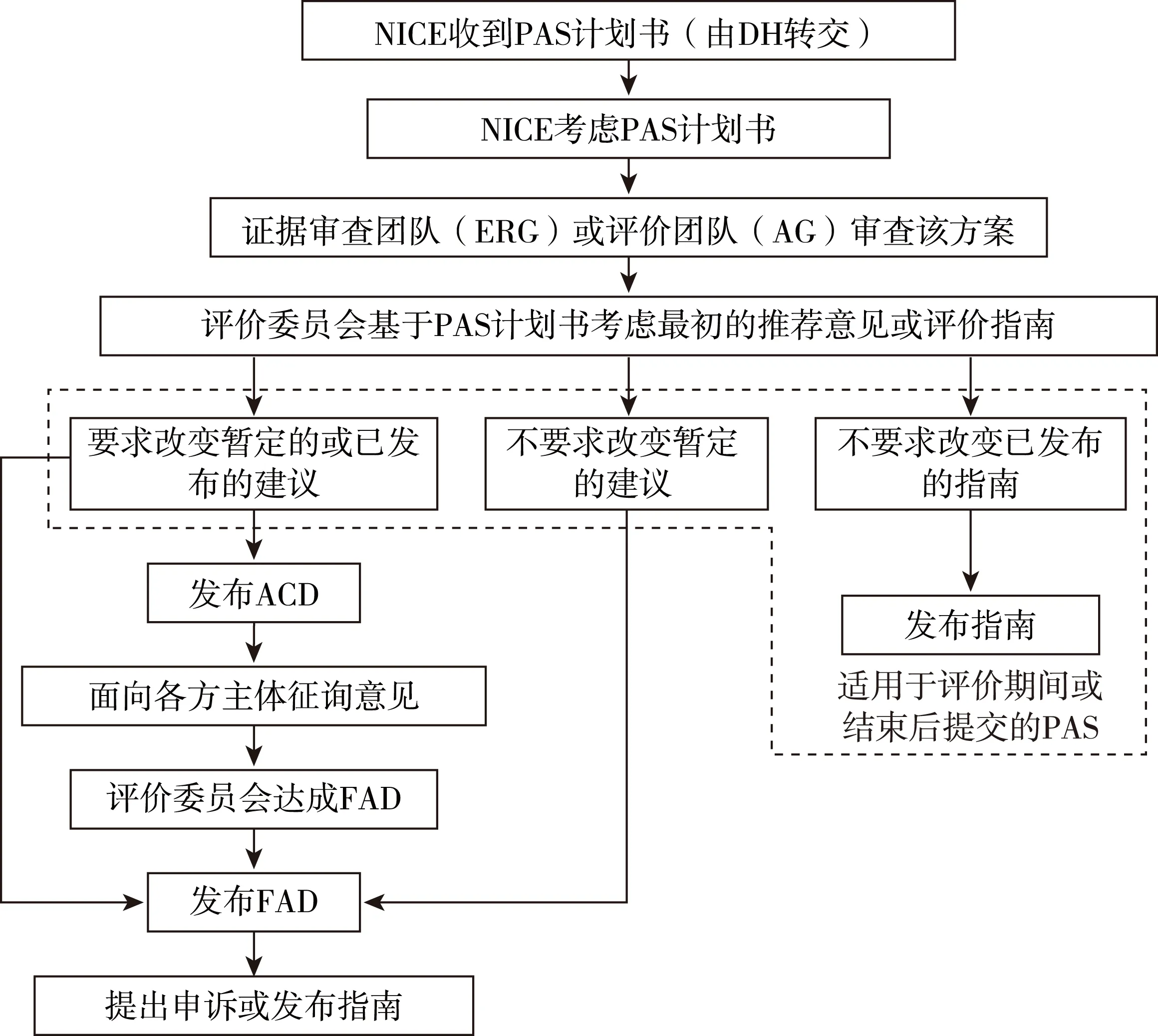
图5 NICE技术评价流程
2.5 后续监测与透明度问题
PAS实施后,DH、NICE和NHS三者会对PAS进行周期性监测,监控PAS运作过程可能出现的问题,如管理成本增加、药品健康效益降低等。一旦发现问题,厂商和NHS应快速查明原因,并与DH商讨,然后由NICE制定解决方案。同时技术评价指南中规定了NICE重新审查指南的日期,对于指南中包括PAS的案例,NICE将会在必要时重新审查PAS的运作情况,并考虑是否对PAS进行修订以简化和提高PAS运作能力。其中任何变动都需要与DH进行讨论并得到DH同意后方可执行。关于PAS的透明度,尽管这类方案在全球皆具有保密性,但公众仍可获知NICE技术评价指南中的PAS内容。DH的基本立场是所有运作的PAS都应是透明的,但简单折扣方案的折扣率不对外公布。
3 PAS实施效果分析
PAS不会影响厂商的目录价格,因此可以避免国际市场的药价连锁反应。厂商为了加速产品获得补偿,提高销售量,有动机与政府或保险人签订PAS。但当前以结局为基础的方案由于实施过程较为复杂,严重影响了药品在临床上的应用情况。如2002年提出的MS风险分担协议,直到2005年4月才招募到队列研究所需的患者(5 610人),共有72个试验中心参与其中。[2]Boggild M等学者通过历史性队列研究方法对2002年5月—2005年4月参与风险分担协议的MS患者的残疾进展状况进行研究,发现实际的临床结局比模型预期值和对照组的临床结局更加糟糕,然而英国官方并没有启动降价机制,理由是在没有进一步追踪和分析的情况下重新定价为时尚早,原因包括评分者存在主观性、遗失数据造成潜在偏差、历史性队列研究可能忽视了疾病的进展情况等,因此有待于进一步研究才能明确MS风险分担协议的长期成本效果。[11-12]同时该方案还存在监测周期长、管理成本高、患者用药依从性差的问题,虽然厂商报告在临床试验中有90%的患者具有依从性,但实际只有70%~80%。[13]
2009年英国癌症网络药师论坛通过问卷调查的形式对2007年7月—2009年7月131个NHS Trusts运作的4项癌症用药PAS进行数据收集。其中37(28%)个NHS Trusts进行了回复,回收有效问卷61份。结果显示各NHS Trust对复杂方案的理解与执行有限,以西妥昔单抗为例,45份问卷中只有15%能够说明其所属的Trusts在执行该PAS。[14]由于以结局为基础的PAS的复杂性、执行的困难度,英格兰、威尔士逐渐倾向于使用以折扣为主的PAS。DH与ABPI同样认为简单折扣方案应是最简单的也是首选的PAS,因为该方案给NHS和厂商带来的负担最低。而以结局为基础的方案,由于其在设计和测量结局方面的复杂性,实施和监测方案的成本较高,会给NHS和厂商带来繁重的行政工作,因此认为该方案应适用于特例案件而非普遍情况。[6]
4 讨论与建议
风险分担协议是政府、保险人与厂商基于药品、医疗器械或诊断试剂等医疗技术的不确定性和预算约束等原因签订的协议,旨在提高患者对新医疗技术的可及性、降低新医疗技术成本效果的不确定性、控制医保基金财务风险和鼓励医药企业研发创新,该协议对于保险人、厂商、患者等利益相关者而言,是一种多方共赢的方案。我国部分地区在开展特药、特材谈判工作时,对RSA的应用进行了积极的探索,主要表现为价量协议、买赠计划两种形式。如青岛市2012年开始试行大病医疗救助制度,由市社会保险经办机构与特药、特材供应商进行谈判,并通过流行病学数据、医保人群基数和基因检测阳性率等指标来确定药品年度人数限额,超过限额的人员则由厂商承担责任。[15]江西省医保经办机构与某国际药企针对治疗乳腺癌的赫赛汀进行谈判并签订协议,规定全省使用人数为700人及以下时,医保结算价为20 281元;多于700人时,医保结算价降为20 028元,同时买6支赠8支。浙江省则成立大病保险特殊用药工作领导小组、专家评审小组和谈判小组与厂商进行谈判,其中协议甲磺酸伊马替尼片(格列卫)的价格为每盒10 800元,同时患者连续购买3个月后,赠送9个月。但我国RSA尚未全面付诸执行且运作和管理体系尚不成熟,还有待参考国外成熟经验,进一步完善。
4.1 明确风险分担协议实施主体,构建风险分担协议标准化流程
英国构建了完备高效的PAS组织架构和应用流程,保证了PAS的顺利实施。组织架构中涉及DH、PASLU、NICE、NHS四个部门。应用流程包括前期讨论、提交计划书模板、审查、评估、反馈、发布指南、后期监测、复审等事项,同时邀请临床、药学、NHS、病患专家、公众以及顾问和评论员参与其中,通过各方协商参与,提高了RSA的科学性和适应性。在我国实施RSA时,首先应明确实施主体,鉴于RSA是药品谈判的重要组成部分,而我国药品谈判涉及专利、独家品种采购谈判和特药、特材医保准入谈判,不同谈判形式下参与主体各异,造成职能部门冗杂,谈判结果互不适应的窘境。因此建议融合两种谈判制度,由卫生计生、医保部门协同组织谈判,衔接药品采购和医保制度,保证信息互通有无。无论是国家级谈判还是省级谈判,对于谈判成功的药品直接纳入医保目录和省增补目录,或单独制定高值药品目录,谈判形成采购价格和医保支付标准,创新我国药品谈判制度,同步改革我国医保目录周期性调整机制。在构建标准化流程方面,应事先明确计划书模板的内容和形式,以提高审查和评估的可操作性、规范性和精简性。成立卫生技术评估研究机构负责审查、评估、复审RSA,收集、分析反馈意见,并在保证机密性和透明度两者平衡的基础上发布技术评价报告。卫生计生、医保部门则负责监测方案的运作情况,对于不满足预期效果的药品,启动降价、折扣、还款响应机制。同时保证政府、厂商、医疗机构、行业团体、专家、患者代表等主体多方参与,形成风险分担协议标准化流程。
4.2 加强HTA在卫生资源配置中的应用,以逐步推进风险分担协议的实施
当前我国实施的RSA主要针对治疗重大(罕见)疾病临床必需、疗效显著、价格昂贵且难以用其他治疗方案替代的非医保药品和特殊医用材料,并在临床遴选药品、专家评审、谈判协商过程中均将药品疗效、经济性纳入考量标准。由此可见,HTA是RSA应用过程中的关键性手段,但我国尚未成立专业的HTA机构,HTA在我国卫生资源配置中的应用仍然任重道远。因此近期可扩大特药谈判试点省份,继续探索实施以财务为基础的RSA。中长期应以药品谈判为契机,由相关部委主导,通过多部门、多学科合作,成立由临床、药学、流行病学、药物经济学等专家组成的国家级HTA研究机构,负责评估药品疗效和经济性。并由厂商提交HTA资料,包括:(1)产品资料:药品临床疗效、可替代药品、国际市场价格等;(2)经济性资料:药品成本效果分析、预算影响分析等;(3)疾病资料:流行病学数据、疾病严重程度、潜在患者数量等,以提高HTA在药品谈判中的应用程度,并逐渐扩展到医疗器械、诊断技术、手术操作的遴选和推广上,以及制定医保目录、规范医师用药、指导临床合理用药和指导新药研发等领域。随着HTA理论与实践经验的不断成熟,可探索对于成本效果具有不确定性、无替代药品但为延长患者寿命所必需的药品,实施以结局为基础的RSA,同步考虑在医疗器械和诊断试剂间实施RSA。通过从广度和深度两个维度逐步推广RSA,以解决财政预算有限而医疗服务需求无限的现实矛盾,最优化我国医疗卫生资源配置。
[1] 国务院. 国务院关于整合城乡居民基本医疗保险制度的意见[EB/OL]. (2016-01-12)[2016- 01- 17].http://www. gov.cn/zhengce/content/2016-01/12/content_10582.htm
[2] Barham L Achieving market access in the UK with a little help from Patient Access Schemes[EB/OL].(2014-07-17)[2016-01- 17].http://www.pharmaphorum.com/articles/achieving-market-access-in-the-uk-with-a-little-help-from-patient-access-schemes
[3] Palace J, Bregenzer T, Tremlett H, et al. UK multiple sclerosis risk-sharing scheme: a new natural history dataset and an improved Markov model[J]. BMJ open, 2014, 4(1): e004073.
[4] Office of Fair Trading. The Pharmaceutical Price Regulation Scheme: An OFT market study[R]. 2007.
[5] 茅鸯对, 常峰. 英国药品价值定价机制研究[J]. 上海医药, 2013, 34(19): 32-35.
[6] Department of Health. Pharmaceutical price regulation scheme 2014[EB/OL]. (2013-12-03)[2016-05- 17].https://www.gov. uk/government/uploads/system/uploads/attachment_data/file/282523/Pharmaceutical_Price_Regulation.pdf
[7] NICE. Appraising life-extending, end of life treatments[EB/OL]. (2009-07-01)[2016-01- 17].https://www. nice.org.uk/guidance/gid-tag387/resources/appraising-life-extending-end-of-life-treatments-paper2
[8] Department of Health.Hints and tips for companies considering a Patient Access Scheme (PAS) proposal in England [EB/OL]. https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/217037/PAS-Good-Practice-Guidance.pdf
[9] NICE. Guide to the processes of technology appraisal [EB/OL]. (2014-09-01)[2016-01-17].https://www.nice. org.uk/article/pmg19/chapter/5-Patient-access-schemes-and- flexible-pricing
[10] NICE. Process for advising on the feasibility of implementing a patient access scheme[EB/OL]. (2009-10-28)[2016-01- 17].https://www.nice.org.uk/Media/Default/About/what-we-do/PASLU/PASLU-process-guide.pdf
[11] Boggild M, Palace J, Barton P, et al. Multiple sclerosis risk sharing scheme: two year results of clinical cohort study with historical comparator[J]. BMJ, 2009, 339: b4677.
[12] Raftery J. Multiple sclerosis risk sharing scheme: a costly failure[J]. BMJ, 2010, 340: 1282-1284
[13] Neumann P J, Chambers J D, Simon F, et al. Risk-sharing arrangements that link payment for drugs to health outcomes are proving hard to implement[J]. Health Affairs, 2011, 30(12): 2329-2337.
[14] Cancer Network Pharmacist Forum. A Report into the Uptake of Patient Access Schemes in the NHS[R]. 2009.
[15] 贺小林,梁鸿,刘军帅. 青岛市高值药品救助政策的实践与创新[J]. 中国医疗保险, 2014, 7(8): 36-38.
(编辑 赵晓娟)
The implementing experience of patient access schemes in UK and its implication for China
CHANGFeng,CUIPeng-lei,XIAQiang
SchoolofInternationalPharmaceuticalBusiness,ChinaPharmaceuticalUniversity,NanjingJiangsu211198,China
The Risk-sharing agreements have achieved remarkable success in improving patients’ access to drugs, lowering the uncertainty of the drugs cost-effectiveness, financial risk control and other aspects of medical insurance fund, so they have attracted widespread attention by the concerned governments and insurers. This paper systematically reviewed the patient access schemes in UK from several aspects, including the origin of the program, classification, application processes and the implementation effects as well. The results of the research indicated that China has basically met the conditions for implementation of the risk-sharing agreements. In order to gradually promote the risk-sharing agreements implementation, this paper suggests that China should clarify the main root of risk-sharing agreements implementation, establish risk-sharing agreements standardization process and strengthen the application of health technology assessment in health resources allocation to improve the Chinese medicines bargaining system more scientifically and efficiently.
Risk-sharing agreements; Patient access schemes; Health technology assessment; Price negotiation
江苏省普通高校研究生科研创新计划资助项目(SJZZ15_0081)作者简介:常峰,男(1972年—),副教授,主要研究方向为药品价格、医疗保障和医药流通规制。E-mail:cpucf@163.com
崔鹏磊。E-mail:cuipenglei1991@163.com
R197
A
10.3969/j.issn.1674-2982.2016.07.010
2016-01-19
2016-04-05
