微孔板法筛选α-葡萄糖苷酶抑制剂的条件优化
2016-12-29王红月
王红月
陈 中1
简旭凤2
(1. 华南理工大学食品工程与科学学院,广东 广州 510640;2. 安利日用品公司,广东 广州 510730)
微孔板法筛选α-葡萄糖苷酶抑制剂的条件优化
王红月1
陈 中1
简旭凤2
(1. 华南理工大学食品工程与科学学院,广东 广州 510640;2. 安利日用品公司,广东 广州 510730)
研究以微孔板检测法为基础,对α-葡萄糖苷酶抑制剂的抑制能力进行检测,以达到有效筛选适宜浓度的α-葡萄糖苷酶抑制剂用于制备降血糖类功能性食品的目的。试验针对酶浓度、检测波长、蔗糖底物浓度及酶反应时间进行反应条件优化。结果表明:试验中所用批次酶的最适浓度范围为2.0~3.0 mg/mL;在405,450,492,520,630 nm 5种波长条件下,520 nm和492 nm波长检测信号最强;蔗糖底物浓度的合适范围应为20~40 mmol/L;适宜的酶反应时间范围为20~30 min。
α-葡萄糖苷酶抑制剂;血糖;微孔板法
糖尿病是一种终身慢性疾病,临床上除了药物治疗手段外,饮食治疗也是糖尿病的一种基本食疗方法。近年来国内外利用天然产物和膳食防治糖尿病及其并发症已成为研究热点[1]。天然α-葡萄糖苷酶抑制剂在糖尿病饮食疗法中有重要作用,可用于功能性食品中,有效预防、控制糖尿病的产生与发展。开发含天然α-葡萄糖苷酶抑制剂的降血糖功能性食品及降糖功能性食品配料具有广泛的应用前景。
α-葡萄糖苷酶主要分布于小肠刷状缘膜上皮细胞,在代谢中是水解碳水化合物的关键酶,它能从低聚糖类底物的非还原端切开α-1,4-糖苷键,从而释放出葡萄糖,葡萄糖再经小肠吸收进入血液,导致机体血糖水平的上升[2-3]。它参与了人体对碳水化合物的消化吸收、糖蛋白和糖脂的加工,与许多因代谢紊乱失调而引起的疾病(如糖尿病[4])、免疫反应[5-6]、神经细胞的分化[7]、肿瘤的转移以及病毒和细菌的感染[8]有密切关系。
α-葡萄糖苷酶抑制剂能竞争性地抑制α-葡萄糖苷酶,在碳水化合物消化的最后一步抑制双糖降解为单糖,从而延缓碳水化合物在肠道的消化,减缓来自双糖、低聚糖及多糖水解产生的葡萄糖的吸收,可以有效推迟并减轻糖尿病人餐后血糖水平升高的时间及进程[9-10]。
1966年在链霉素的代谢物中,首次发现了野尻霉素(nojirimycin)[11],在后续的研究[12]中,又发现了由链霉菌、芽孢杆菌和枯草杆菌产生的1-脱氧野尻霉素(1-deoxyrijimycin,DNJ),并在相关的研究[13]中显示,DNJ对α-葡萄糖苷酶有强烈的抑制作用。DNJ是一种含氮生物碱,在桑属植物中的含量较高[14],其结构与D-葡萄糖类似,两者不同之处是:在六元环中,DNJ的氮原子取代了D-葡萄糖氧原子,由于它们结构上的相似性,DNJ能够和D-葡萄糖竞争与α-葡萄糖苷酶发生作用,是这类酶的强竞争性抑制剂[15]。
微孔板检测技术由于方法简单,使用灵活且具有高通量性而在生物化学以及细胞生物学中得到了广泛的应用。这种检测方法能快速检测大量样品小样本量的抑制剂的存在,可以加快α-葡萄糖苷酶抑制剂的筛选和研发步伐。学者在α-葡萄糖苷酶抑制剂的筛选模型方面进行了大量的研究工作。其中酶-抑制剂筛选模型大多以4-硝基酚-α-D-吡喃葡萄糖苷(PNPG)为底物,但由于PNPG为麦芽糖类似物,所以只能筛选到对麦芽糖酶有抑制作用的抑制剂,有一定的局限性[16]。本筛选模型以蔗糖为底物,也可将底物更换为淀粉或蔗糖,可以针对不同的底物进行定向筛选。本研究拟以96孔微孔板检测技术为基础,以DNJ为标准参考物,以蔗糖为水解底物,测定α-葡萄糖苷酶在抑制剂存在的情况下水解蔗糖所产生的葡萄糖量。加入与葡萄糖特异性结合的显色试剂,通过酶标仪测定96孔试验板中的在一定检测波长下的吸光度,算出葡萄糖的具体含量,从而计算出α-葡萄糖苷酶抑制剂的抑制能力。同时针对不同的酶浓度、检测波长、底物浓度、及酶反应时间对该反应进行最佳反应条件的摸索,这种方式可以应用到不同底物的酶-底物筛选模型,为α-葡萄糖苷酶抑制剂的定向筛选提供更多种类的筛选形式。
1 材料与方法
1.1 试验试剂
小鼠肠干粉(Rat Intestinal Acetone,RIA):美国Sigma公司;
蔗糖:≥99.9%,上海阿拉丁生化科技股份有限公司;
葡萄糖分析试剂(Glucose Assay Reagent,GAR):日本Wako公司;
DNJ标准粉末:美国Chromdex公司;
磷酸二氢钾、磷酸氢二钠、碳酸钠、氢氧化钠、盐酸:分析纯,广州市化学试剂厂;
试验用水为去离子水。
1.2 试验设备
分析天平:AB304S/FACT型,美国Mettler Toledo公司;
离心机:H-28型,日本Kokusan公司;
酶标仪:MK3型,美国Thermo Fisher Scientific公司;
恒温培养箱:307型,美国Thermo Fisher Scientific公司;
真空烘箱:273800型,美国Hot Pack公司;
pH计:PH744型,瑞士Metrohm技术公司;
手动单道移液枪:100-1000μL型,德国Eppendorf公司;
手动单道移液枪:10-100μL型,德国Eppendorf公司;
8通道移液枪,Transferpette-8型,德国Eppendorf公司;
96孔微孔板(平底),9018型,美国Corning公司
1.3 试剂配制
(1) Enzyme Assay Buffer(以下简称Buffer):pH 7.0。分别配制50 mmol磷酸二氢钾溶液与50 mmol磷酸氢二钠溶液。在1 L烧杯中混合600 mL磷酸氢二钠(50 mmol)和300 mL磷酸二氢钾(50 mmol),用1 mol/L NaOH或1 mol/L HCl调pH至7.0(精确至0.02)。
(2) DNJ溶液:DEOXYNOJIRIMYCIN(SH),8 mg/mL。可以按12 μL/离心管的体积分装,于-20 ℃冰箱保存1年。
(3) Ymin溶液:40 μg/mL。
(4) 酶溶液(Enzyme Solution):1.0,2.0,3.0,4.0,5.0,6.0 mg/mL,使用前配制。
(5) 蔗糖溶液(底物):10,20,40,60,80,100 mmol/L,使用前配制。
(6) Glucose Assay Reagent (GAR):Wako Chemicals USA.In.,根据Glucose Kit说明书制备显色剂。
1.4 试验方法
1.4.1 酶反应浓度的确定 取一块浅孔分析平板,按表1配制不同酶浓度的反应体系,每孔加入20 mmol/L的蔗糖溶液60 μL,加入6种不同浓度(1.0,2.0,3.0,4.0,5.0,6.0 mg/mL)的酶溶液各30 μL,以30 μL H2O(即Ymax)和30 μL DNJ(40 μg/mL,即Ymin)作为样品加入反应体系,比较在没有抑制剂下(Ymax)和在最大浓度抑制剂下(Ymin)酶反应的差异。每个反应组合做3个平行和3个不加酶的对照。加完所有试剂后,用膜封好微孔板,于37 ℃孵育25 min。去除封膜,用排枪吸120 μL的Glucose Assay Reagent 至所有的孔。用膜封好微孔板,37 ℃孵育5 min。在520 nm波长下检测吸光度。计算出每孔的ODnet(加酶反应吸光度读数减去无酶反应的吸光度读数),以ODnet为纵坐标,酶溶液终浓度为横坐标,分别作出不同酶浓度下的ODnet变化曲线,观察酶浓度对抑制反应的变化规律。
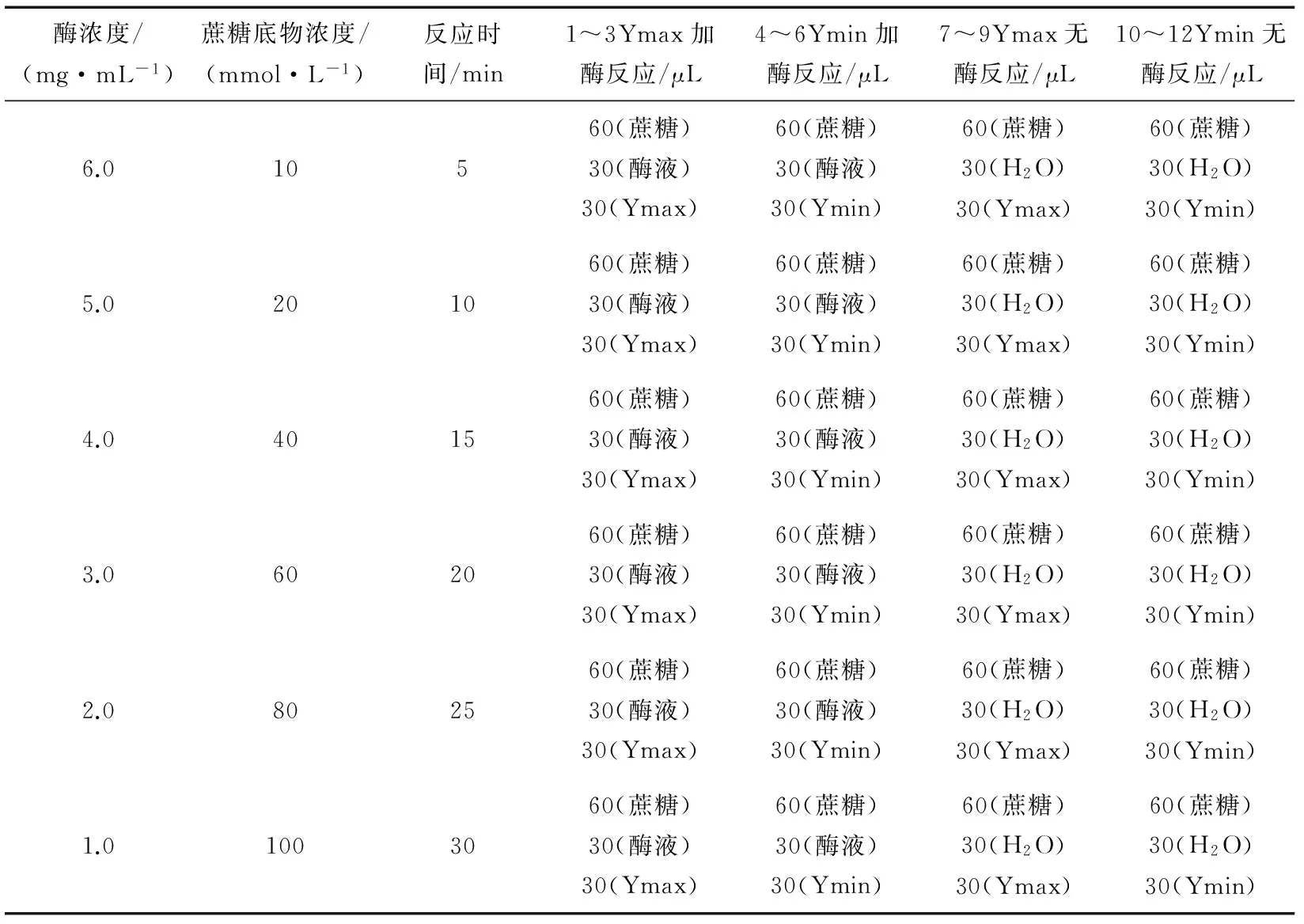
表1 不同酶浓度下的反应体系Table 1 Reactionsystemin different enzyme concentration
1.4.2 检测波长的确定 按表1配制的不同酶浓度的分析平板,分别在405,450,492,520,630 nm 5个波长下检测吸光度。计算出每个反应组合的Ymax ODnet均值和Ymin ODnet,以吸光度为纵坐标,酶溶液终浓度为横坐标,分别作出不同检测波长下和不同酶浓度下的均值差变化曲线,观察信号最强的检测波长。
1.4.3 底物浓度的确定 取一块浅孔分析平板,按表1配制不同蔗糖底物浓度的反应体系,分别加入60 μL不同稀释倍数(10,20,40,60,80,100 mmol/L)的蔗糖底物溶液,1~6列分别加入3.0 mg/mL左右的酶溶液各30 μL,7~12列分别加入30 μL同体积水溶液。以30 μL H2O(即Ymax)和30 μL DNJ(40 μg/mL,即Ymin)作为样品加入反应体系,比较在没有抑制剂下(Ymax)和在最大浓度抑制剂下(Ymin)不同蔗糖底物浓度的差异。每个反应组合做3个平行和3个不加酶的对照。加完所有试剂后,用膜封好微孔板,于37 ℃孵育25 min。去除封膜,用排枪吸120 μL的Glucose Assay Reagent 至所有的孔。用膜封好微孔板,37 ℃孵育5 min。在520 nm波长下检测吸光度。计算出每孔的ODnet(加酶反应吸光度读数减去无酶反应的吸光度读数),以吸光度为纵坐标,不同浓度蔗糖底物溶液为横坐标,分别作出不同酶浓度下的Ymax ODnet与Ymin ODnet的变化曲线,观察酶浓度对抑制反应的变化规律。
1.4.4 酶反应时间的确定 取一块浅孔分析平板,按表1配制不同时间的反应体系。反应时间分别为5,10,15,20,25,30 min,分别加入60 μL 20 mmol/L的蔗糖底物溶液,其中1~6列分别加入3.0 mg/mL左右的酶溶液各30 μL,7~12列分别加入30 μL同体积水溶液。以30 μL H2O(即Ymax)和30 μL DNJ(40 μg/mL,即Ymin)作为样品加入反应体系,比较在没有抑制剂下(Ymax)和在最大浓度抑制剂下(Ymin)不同反应时间的差异。每个反应组合做3个平行和3个不加酶的对照。加完所有试剂后,用膜封好微孔板,于37 ℃孵育25 min。去除封膜,用排枪吸120 μL的Glucose Assay Reagent 至所有的孔。用膜封好微孔板,37 ℃孵育5 min。在520 nm波长下检测吸光度。计算出每孔的ODnet(加酶反应吸光度读数减去无酶反应的吸光度读数),以吸光度为纵坐标,不同时间为横坐标,分别作出不同反应时间下的Ymax ODnet与Ymin ODnet变化曲线,观察反应时间对抑制反应的变化规律。
2 结果与讨论
2.1 最佳酶浓度
由图1可知,在520 nm检测波长下,Ymax ODnet和Ymin ODnet均随着酶浓度的降低而降低。其中,酶浓度达到2.0~3.0 mg/mL时的吸光度最能满足微孔板法对酶活性的要求(Ymax ODnet为0.190~0.280。Ymax ODnet低于0.190时,微孔板显色整体较弱,酶解反应抑制曲线梯度不明显;高于0.280时,微孔板整体显色过强,酶解反应抑制曲线梯度同样不明显),所以在520 nm检测波长下,酶浓度合适范围应为2.0~3.0 mg/mL。
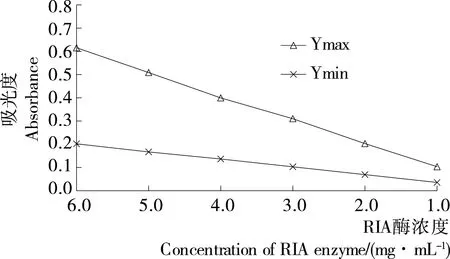
图1 不同酶浓度下Ymax ODnet均值与Ymin ODnet 均值的变化曲线Figure 1 Curve of Ymax ODnet and Ymin ODnet in different enzyme concentration system
2.2 最佳检测波长
由图2可知,在405,450,492,520,630 nm 5种检测波长下,检测吸光度。520 nm和492 nm波长下检测信号最强,两者强度相当,且检测强度均随着酶浓度的降低而降低。
2.3 最佳底物浓度
由图3可知,在520 nm检测波长下,Ymax ODnet和Ymin ODnet均随着蔗糖底物浓度的升高而升高。其中,蔗糖底物浓度达到20~40 mmol/L时的吸光度最能满足微孔板法对酶活性的要求(Ymax ODnet为0.190~0.280。当Ymax ODnet低于0.190时,微孔板显色整体较弱,酶解反应抑制曲线梯度不明显;高于0.280时,微孔板整体显色过强,酶解反应抑制曲线梯度同样不明显),所以在520 nm检测波长下,蔗糖底物浓度合适范围应为20~40 mmol/L。
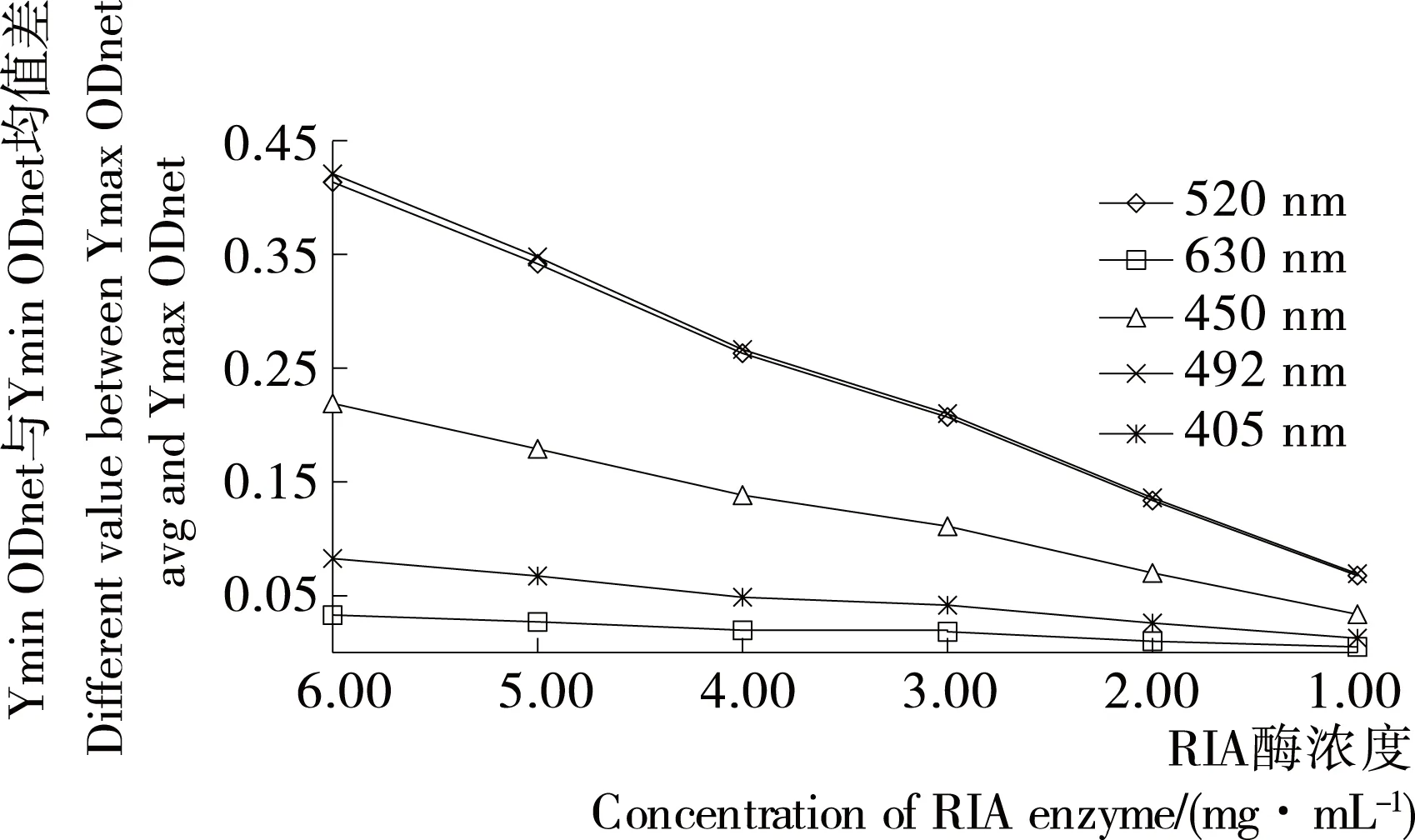
图2 不同波长与酶浓度下Ymax ODnet均值与 Ymin ODnet均值差的变化曲线Figure 2 The difference value curves in different wavelengths and enzyme concentration
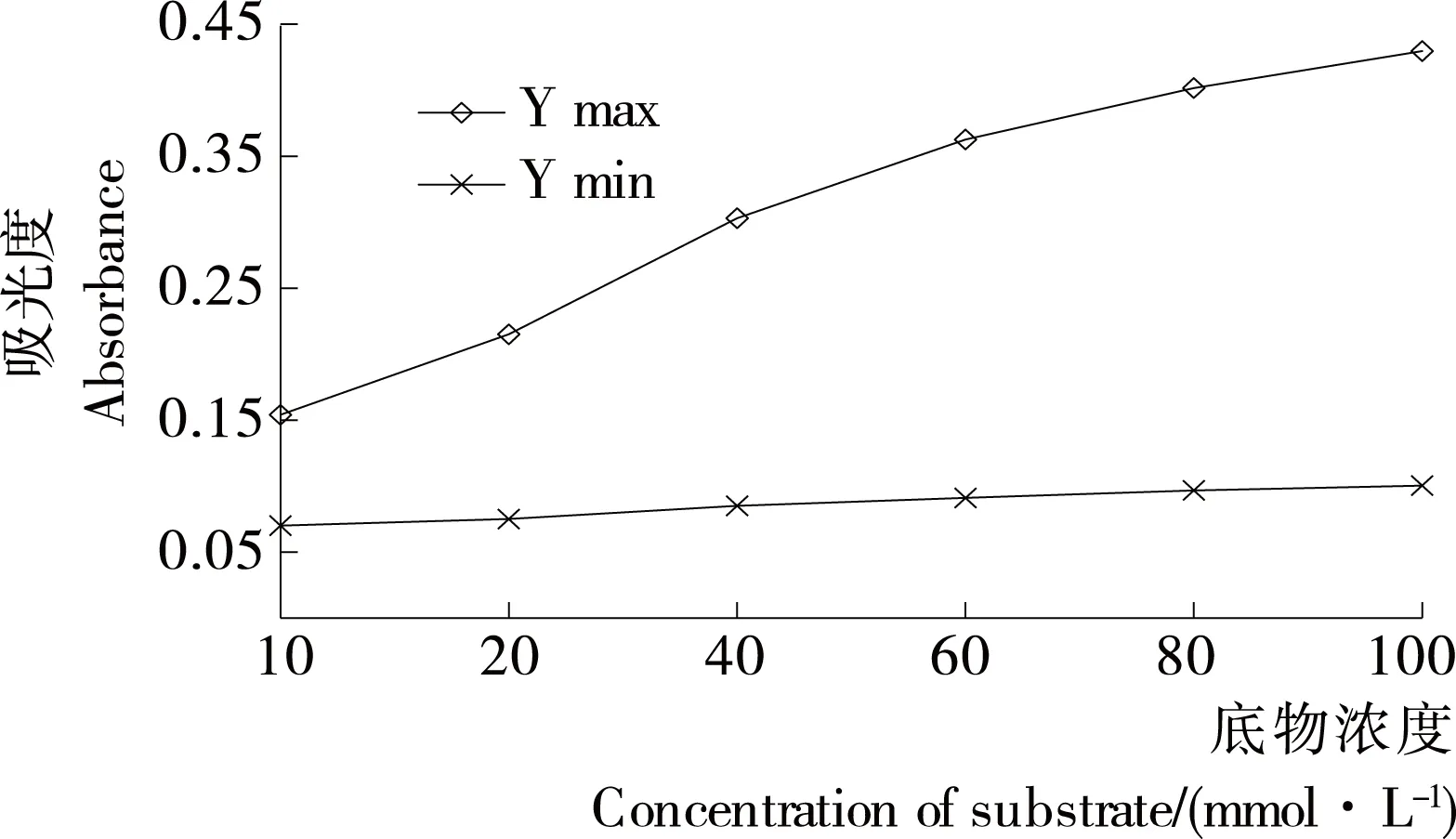
图3 不同蔗糖底物浓度下Ymax ODnet与Ymin ODnet 的变化曲线
Figure 3 The curve of Ymax ODnet and Ymin ODnet in different substrate concentration system
2.4 最佳酶反应时间
由图4可知,在520 nm检测波长下,Ymax ODnet和Ymin ODnet均随着反应时间的增加而升高。其中,反应时间达到20~30 min时吸光度最能满足微孔板法对酶活性的要求(Ymax ODnet为0.190~0.280),所以在520 nm检测波长下,反应时间的合适范围应为20~30 min。
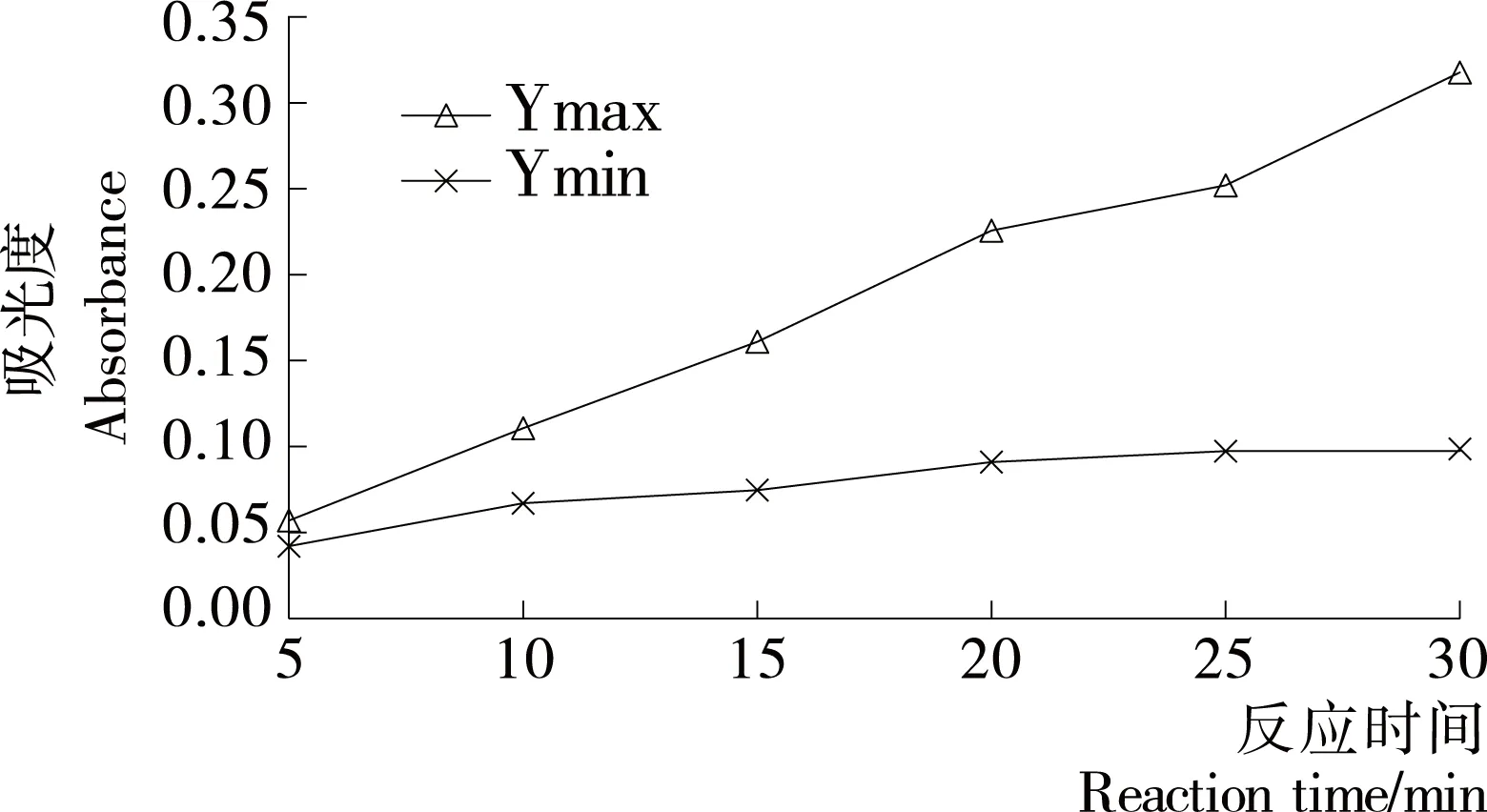
图4 不同反应时间下Ymax ODnet与Ymin ODnet 的变化曲线
Figure 4 The curve of Ymax ODnet and Ymin ODnet in different reaction time system
3 结论
本研究以96孔微孔板检测技术为基础,以DNJ为标准参考物,蔗糖为水解底物,测定α-葡萄糖苷酶抑制剂的抑制能力。研究影响抑制反应关键的4个因素——酶浓度、检测波长、底物浓度、及反应时间的影响,得到更稳定的α-葡萄糖苷酶抑制剂检测方案:在520 nm检测波长下,最佳的酶反应浓度为2.0~3.0 mg/mL;在405,450,492,520,630 nm 5种检测波长下,520 nm和492 nm波长下检测信号最强;在520 nm检测波长下,蔗糖底物浓度合适范围为20~40 mmol/L;在520 nm检测波长下,酶反应的最佳时间应为20~30 min。不过,该试验以是以体外检测为主,而α-葡萄糖苷酶抑制剂在体内的吸收及发挥抑制作用的情况有待进一步研究。
[1] 毛清黎, 孟志清, 杨新河, 等. 茶叶儿茶素对糖尿病小白鼠血糖及组织抗氧化活性的影响[J]. 食品与机械, 2009, 25(5): 63-67.
[2] 李玉萍, 白冰, 叶军,等. α-葡萄糖苷酶抑制剂的制备和活性研究进展[J]. 食品科学, 2008, 29(9): 617-620.
[3] 岳振峰, 陈小霞, 彭志英.α-葡萄糖苷酶研究现状及进展[J]. 食品与发酵工业, 2000, 26(3): 63-67.
[4] HORII S, FUKASE H, MATSUO T, et al. ChemInform Abstract synthesis andα-D-glucosidase inhibitory activity ofN-substituted valiolamine derivatives as potential oral antidiabetic agents[J]. Journal of Medicinal Chemistry, 1986, 29(6): 1 038-1 046.
[5] CHEN Xiao-long, FAN Yong-xian. Properties and production of valienamine and its related analogues[J]. Chemical Reviews, 2003, 103(5): 1 955-1 977.
[6] ASANO N, NASH R J, MOLYNEUX R J, et al. Sugar-mimic glycosidase inhibitors: Natural occurrence, biological activity and prospects for therapeutic application[J]. Terahedron:Asymmetry, 2000, 11: 1 645-1 651.
[7] PILI R, CHANG J, PARTIS R A, et al. The alpha-glucosidase I inhibitor castanospermine alters endothelial cell glycosylation, prevents angiogenesis, and inhibits tumor growth[J]. Cancer Research, 1995, 55(13): 2 920-2 926.
[8] PILI R, CHANG J, MUHLHAUSER J, et al. Adenovirus-mediated gene transfer of fibroblast growth factor-1: Angiogenesis and tumorigenicity in nude mice[J]. International Journal of Cancer, 1997, 73(2): 258-263.
[9] 张冉, 刘泉, 申竹芳, 等. 应用α-葡萄糖苷酶抑制剂高通量筛选模型筛选降血糖中药[J]. 中国药学杂志, 2007, 42(10): 740-743.
[10] 林玉桓, 王栩林, 王颖, 等. 34种中药对α-葡萄糖苷酶活性的抑制作用[J]. 大连工业大学学报, 2004, 23(4): 270-272.
[11] INOUYE S, TSURUOKA T, NIDA T. The structure of nojirimycin, a piperidinose sugar antibiotic[J]. Journal of Antibiotics, 1966, 19(6): 288-292.
[12] 朱运平, 李秀婷, 李里特. 天然α-葡萄糖苷酶抑制剂来源及应用研究现状[J]. 中国食品学报, 2011, 11(4): 154-160.
[13] 顾觉奋, 陈紫娟.α-葡萄糖苷酶抑制剂的研究及应用[J]. 药学进展, 2009, 33(2): 62-67.
[14] 盛琳波, 焦锋, 苏超, 等. 桑树1-脱氧野尻霉素及其衍生物的药理作用和药代动力学研究进展[J]. 蚕业科学, 2013(5): 1 011-1 015.
[15] 王端好. 1-脱氧野尻霉素制备及应用研究进展[J]. 广东化工, 2013, 40(4): 69-70.
[16] 吴酬飞, 许杨, 李燕萍.α-葡萄糖苷酶抑制剂筛选模型的研究进展[J]. 国际药学研究杂志, 2008, 35(1): 9-12.
Optimization of a microplate bioassay method of filtering alpha-glucosidase inhibitors
WANG Hong-yue1
CHENZhong1
JIANXu-feng2
(1.SchoolofFoodScienceandEngineering,SouthChinaUniversityofTechnology,Guangzhou,Guangdong510640,China; 2.AmwayChinaCo.Ltd,Guangzhou,Guangdong510730,China)
The half inhibitory concentration (IC50) of alpha glucosidase inhibitors was detected based on a microplate assay method in this study in order to find the effective inhibitors for preparing hypoglycemic functional food. The reaction conditions were optimized by the four aspects, i.e., the enzyme concentration, the detection wavelength, the substrate concentration and the reaction time. The results showed that the optimum enzyme concentration ranged from 2.0 mg/mL to 3.0 mg/mL, and waves 520 nm and 492 nm were optimum among the five waves, 405, 450, 492, 520, 630 nm. Moreover, the suitable substrate concentration of sucrose ranged from 20 mmol/L to 40 mmol/L, and the appropriate reaction time was about 20~30 min.
alpha glucosidase inhibitors; blood glucose; microplate bioassay
王红月(1984—),女,安利中国日用品有限公司工程师,硕士。E-mail: why-1648@163.com
2016-07-25
10.13652/j.issn.1003-5788.2016.11.003
