R.B1L型及 R.CL型糖苷酶对豆浆异黄酮构型的影响及风味的改善
2016-12-29周炜杰
周炜杰
夏 蓉3
朱崇阳1,2
裴 静4
陶汇源3
程永强1,2
(1. 植物源功能食品北京市重点实验室,北京 100083;2. 中国农业大学食品科学与营养工程学院,北京 100083;3. 镇江恒顺生物工程有限公司,江苏 镇江 212000;4. 英联酶制剂贸易(上海)有限公司,上海 200050)
R.B1L型及 R.CL型糖苷酶对豆浆异黄酮构型的影响及风味的改善
周炜杰1,2
夏 蓉3
朱崇阳1,2
裴 静4
陶汇源3
程永强1,2
(1. 植物源功能食品北京市重点实验室,北京 100083;2. 中国农业大学食品科学与营养工程学院,北京 100083;3. 镇江恒顺生物工程有限公司,江苏 镇江 212000;4. 英联酶制剂贸易(上海)有限公司,上海 200050)
为获得更高含量的大豆异黄酮苷元,同时改善豆浆的风味,采用糖苷酶(R.B1L型和R.CL型)对豆浆进行处理,而后通过高效液相色谱和气质联用技术分别检测大豆异黄酮和风味化合物。结果表明,豆浆中的大豆异黄酮苷元总量增加了7.289 μg/g,比对照组提高了35.7%;豆腥味化合物己醛和2-戊基呋喃减少了10.8%,香气化合物正己醇和反-2-壬烯醛增加了10.88%。说明酶制剂为改善豆浆的品质和风味提供了一种可行的方法。
豆浆;糖苷酶;大豆异黄酮;风味
豆浆是一种老少皆宜的饮品,其营养与保健价值均较高,不论在中国,还是在欧美都深受人们的喜爱[1]。作为一种植物蛋白饮料,豆浆的外观与牛奶相似,且其营养不亚于牛奶。豆浆富含蛋白质和不饱和脂肪酸,且不含胆固醇[2];其氨基酸配比与人体所需相近,易被人体吸收,生物价值较高[3];豆浆富含具有保健功能的卵磷脂、异黄酮,有助于调节人体的生理功能。因此,在动物奶源供给不足的地区,豆浆可以代替牛奶,其廉价高营养的特性能够满足对蛋白质需求量较大以及对牛奶过敏、患有乳糖不耐症的人群[4]。
大豆异黄酮是大豆生长过程中形成的一种次级代谢产物,是大豆和豆浆中主要的生理活性成分[5]。研究[6]发现,大豆异黄酮可以预防甚至缓解多种慢性疾病,包括更年期综合征、骨质疏松等。目前发现大豆异黄酮共有12种,主要有两种存在形式:糖苷型和苷元型,其中豆浆中含量较高的有6种,分别为大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素、染料木苷元。大豆籽粒中异黄酮的比例约为:大豆苷30%~50%,染料木苷50%~60%。植物中的异黄酮大部分以β-葡萄糖苷的形式存在[7],少量以游离形式存在。然而研究[8]表明,黄酮苷元比黄酮糖苷具有更高的生物利用率,可能是黄酮苷元比黄酮糖苷更容易被人和动物体吸收。高荣海等[8]试验结果表明大豆异黄酮糖苷和苷元都能有效提高小鼠体液免疫功能,但是发现小鼠对大豆异黄酮苷元的吸收效果强于大豆糖苷,说明大豆异黄酮苷元的免疫功能优于大豆异黄酮糖苷。
在西方国家,一直有研究致力于豆浆异味的消除。到目前为止,研究[9]表明豆浆一部分的异味是在加工过程中产生的。Kobayashi等[10]认为大豆豆腥味是由一类复杂化合物产生的,其中2-戊基呋喃呈现一种特殊的青草气味和豆腥味,己醛具有草腥味,它们是造成豆浆异味的典型化合物,而正己醇和反-2-壬烯醛分别呈现水果香、黄瓜香,是豆浆中典型的香味化合物。也有研究[11]表明:皂苷、糖苷型异黄酮等酚类物质具有苦味,被认为是造成豆浆异味的主要不挥发性化合物。因此,减少豆浆中的异味显得十分重要。在此,本文仅对豆浆中己醛、2-戊基呋喃、正己醇和反-2壬烯醛这4种典型风味化合物的变化进行了研究。
ROHAMENT CL(R.CL)是一种β-葡萄糖苷酶(β-D-Glucosidase,EC3.2.1.21),别名龙胆二糖酶、纤维二糖酶(Cellobias,CB或β-G)和苦杏仁苷酶,该酶可以水解β-1,4-糖苷键,能将大豆异黄酮糖苷转化为具有生物学活性的大豆异黄酮苷元。ROHAMENT B1L(R.B1L)是一种果胶纤维素复合酶,应用于豆浆生产工艺当中也可以起到水解β-1,4-糖苷键的作用。糖苷酶用于果汁等饮料中很常见,但加入到豆浆中还鲜有报道。与单一的糖苷酶比较,复合酶可以发挥协同作用,更加高效。因此,本试验拟采用R.B1L和R.CL复合处理豆浆,目的是降低其豆腥味,提高其苷元型大豆异黄酮含量,生产优质豆浆。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
大豆:大型超市;
糖苷酶R.B1L(9 600 PGU/mg)、糖苷酶R.CL(15 000 ECU/g):最适反应温度为55 ℃,建议添加量为0.01%~0.10%,英联酶制剂贸易(上海)有限公司;
大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素、染料木苷元、乙腈、甲醇:色谱纯,美国Sigma公司。
1.1.2 主要仪器设备
高效液相色谱仪:HPLC M20-A型,配备紫外检测器,日本岛津精密科学仪器公司;
色谱柱:CAPCELL PAK C18型,日本资生堂岛津精密科学仪器有限公司;
气质联用仪:450-GC 220-MS型,美国Varian公司;
萃取头:65 μm PDMS/DVB型,美国Sigma公司;
电子天平:YP80001型,上海越平科学仪器有限公司。
1.2 方法
1.2.1 大豆异黄酮含量的测定
(1) HPLC条件:色谱柱:CAPCELL PAK C185 μm,4.6 mm×250 mm;流动相:水相0.1 mL/100 mL冰醋酸,有机相乙腈/甲醇(体积比5∶2);梯度洗脱程序见表1;流速:1.0 mL/min;进样量:10 μL;柱温:40 ℃;二极管阵列检测器(DAD)波长为254 nm[12]。
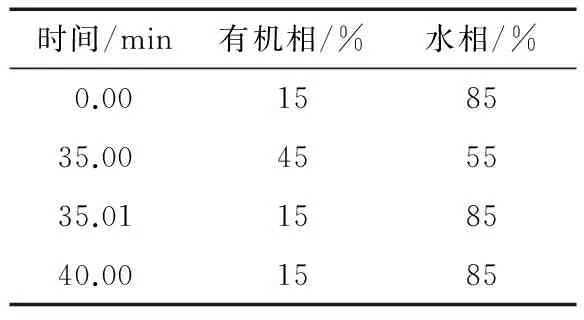
表1 梯度洗脱程序Table 1 Gradient elution program
(2) 豆浆的制备:取100 g大豆,用800 g蒸馏水打浆;使用纱布将豆浆与豆渣分离,用5 min煮沸,然后冷却到室温。每次用于测试的豆浆样品均制备3份。
(3) 酶解:向所得豆浆加入相当于豆浆体积0.01%(0.01 mL/100 mL)的糖苷酶(R.B1L和R.CL体积比1∶1),于55 ℃恒温水浴条件下水解30 min。
(4) 样品前处理:基于殷丽君等[13]提取发酵豆制品中大豆异黄酮的方法,分别称取原豆浆和水解后的豆浆1.0 g,加入80%甲醇2 mL,水浴震荡提取4 h(80 ℃,160 r/min),取上清液,过0.45 μm有机系滤膜,转移至5 mL离心管中,于4 ℃冰箱密封保存待用。
(5) 标准品的配制:分别取1.25 mg大豆苷,0.5 mg黄豆苷,1.25 mg染料木苷,0.8 mg大豆苷元,0.5 mg黄豆黄素和0.25 mg染料木苷元,置于25 mL容量瓶中,用色谱级甲醇配制成母液,超声辅助(300 W,1 h)溶解并用色谱级甲醇定容至刻度,摇匀,再分别稀释2,5,8,10,16倍,4 ℃避光保存,备用。
(6) 定性定量方法:将所测大豆异黄酮标准溶液在设定色谱条件下进样,绘制标准曲线。以保留时间定性,峰面积定量,从而测得样品中相应异黄酮的含量,结果以均值±标准差来表示。
1.2.2 风味物质的检测
(1) 萃取:准确量取8 mL豆浆于萃取瓶中,插入萃取头,在55 ℃下萃取30 min。萃取完成后,拔出萃取头,准备进样。
(2) GC条件:色谱柱为JW DB-5MS石英毛细柱(30 m×0.25 mm,0.25 μm);升温程序:起始温度40 ℃,保持4 min,以6 ℃/min的速率升温到230 ℃,保持5 min;不分流进样;压力33.4 kPa,载气(He) 流速1.0 mL/min。
(3) MS条件:电离方式EI;电子能量70 eV;激活电压350 V;进样口温度250 ℃;离子源温度250 ℃;扫描质量范围m/z:40~400。
(4) 定性方法:使用保留指数(retention index,RI)辅助MS检索进行定性。① MS鉴定:通过计算机谱库对检测到的挥发性化合物进行检索,鉴定结果以匹配度大于80%的为准;② 保留指数鉴定:采用同样的升温程序,以C7~C23正构烷烃为标准,通过保留时间计算样品中各化合物的RI,并进行比较确认[14]。
(5) 定量分析:采用峰面积归一化法计算各组分的相对含量。
1.3 数据处理
所有试验重复3次,采用OriginPro 8 SR3软件对试验数据进行处理分析。
2 结果与分析
2.1 大豆异黄酮的HPLC检测结果
2.1.1 标准曲线的绘制 分别精确吸取1.2中各浓度的标准溶液,进样量10 μL,按1.2中色谱条件进行HPLC检测(图1),计算峰面积。以浓度为横坐标,峰面积为纵坐标,绘制标准曲线,结果见表2。
2.1.2 样品异黄酮测定结果 采用表1的梯度洗脱程序,可在40 min内实现6种大豆异黄酮的分离与鉴定,结果见图2、3。
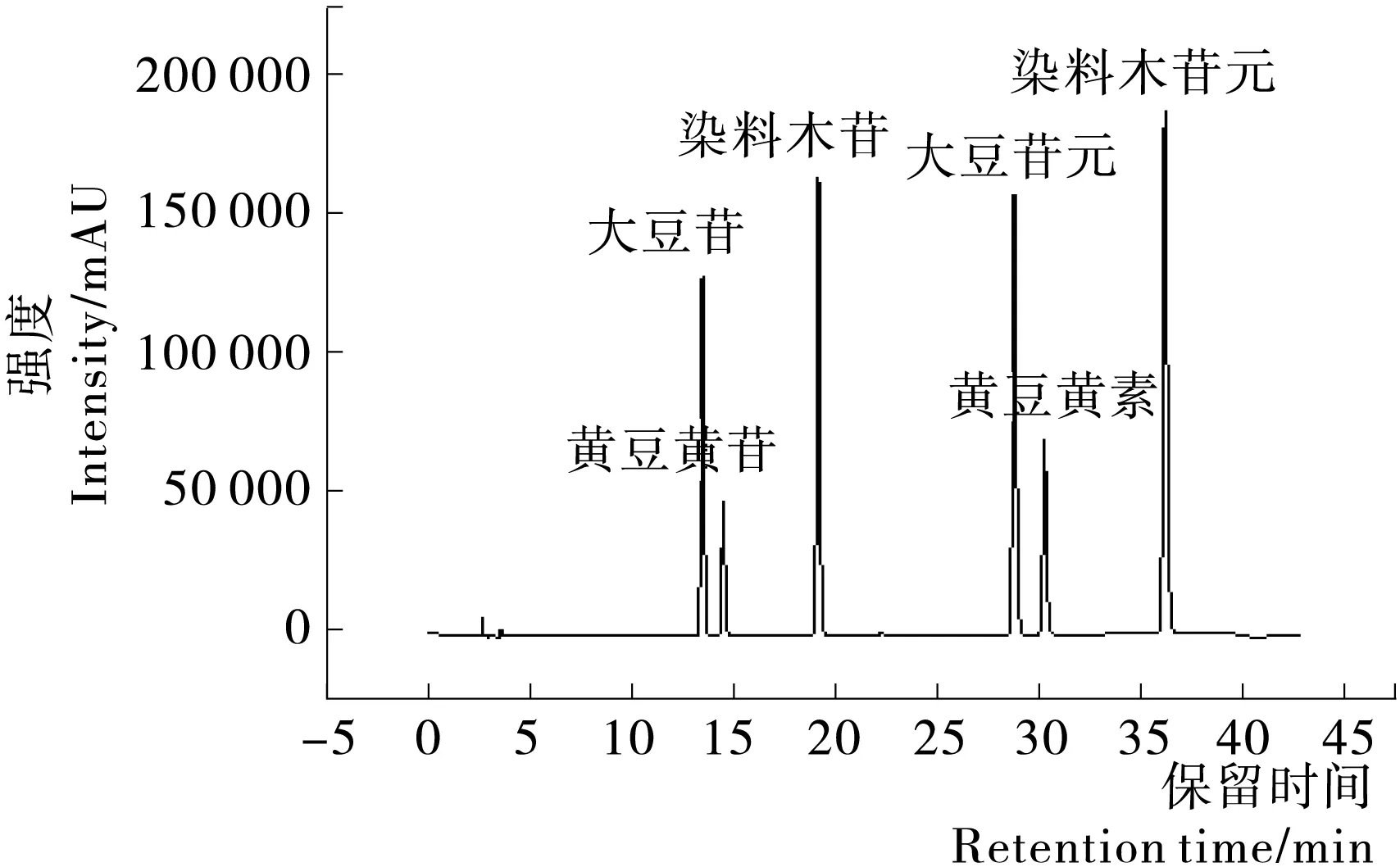
图1 大豆异黄酮标样色谱图Figure 1 Chromatograms of soybean isoflavones standard sample表2 大豆异黄酮含量的线性关系Table 2 Linear relationship of soybean isoflavones content
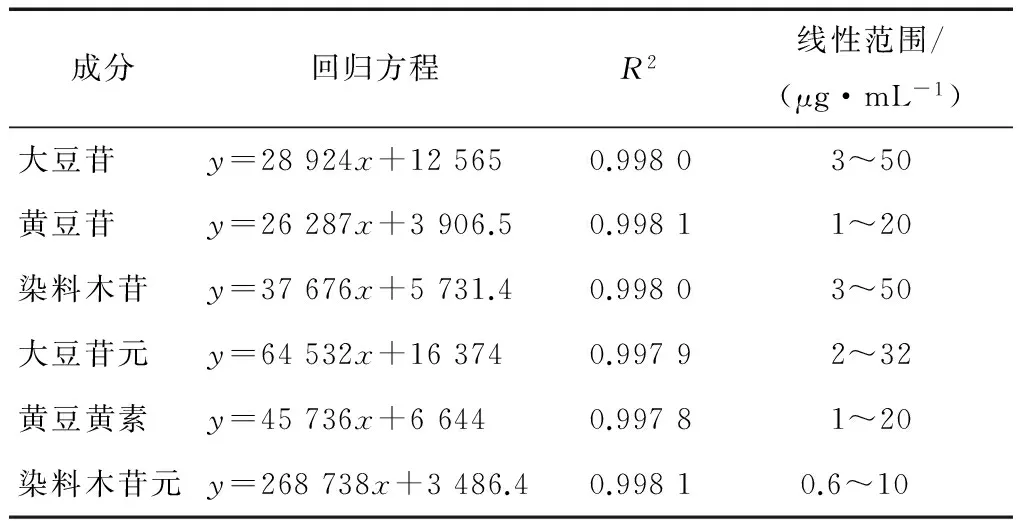
成分回归方程R2线性范围/(μg·mL-1)大豆苷y=28924x+125650.99803~50黄豆苷y=26287x+3906.50.99811~20染料木苷y=37676x+5731.40.99803~50大豆苷元y=64532x+163740.99792~32黄豆黄素y=45736x+66440.99781~20染料木苷元y=268738x+3486.40.99810.6~10
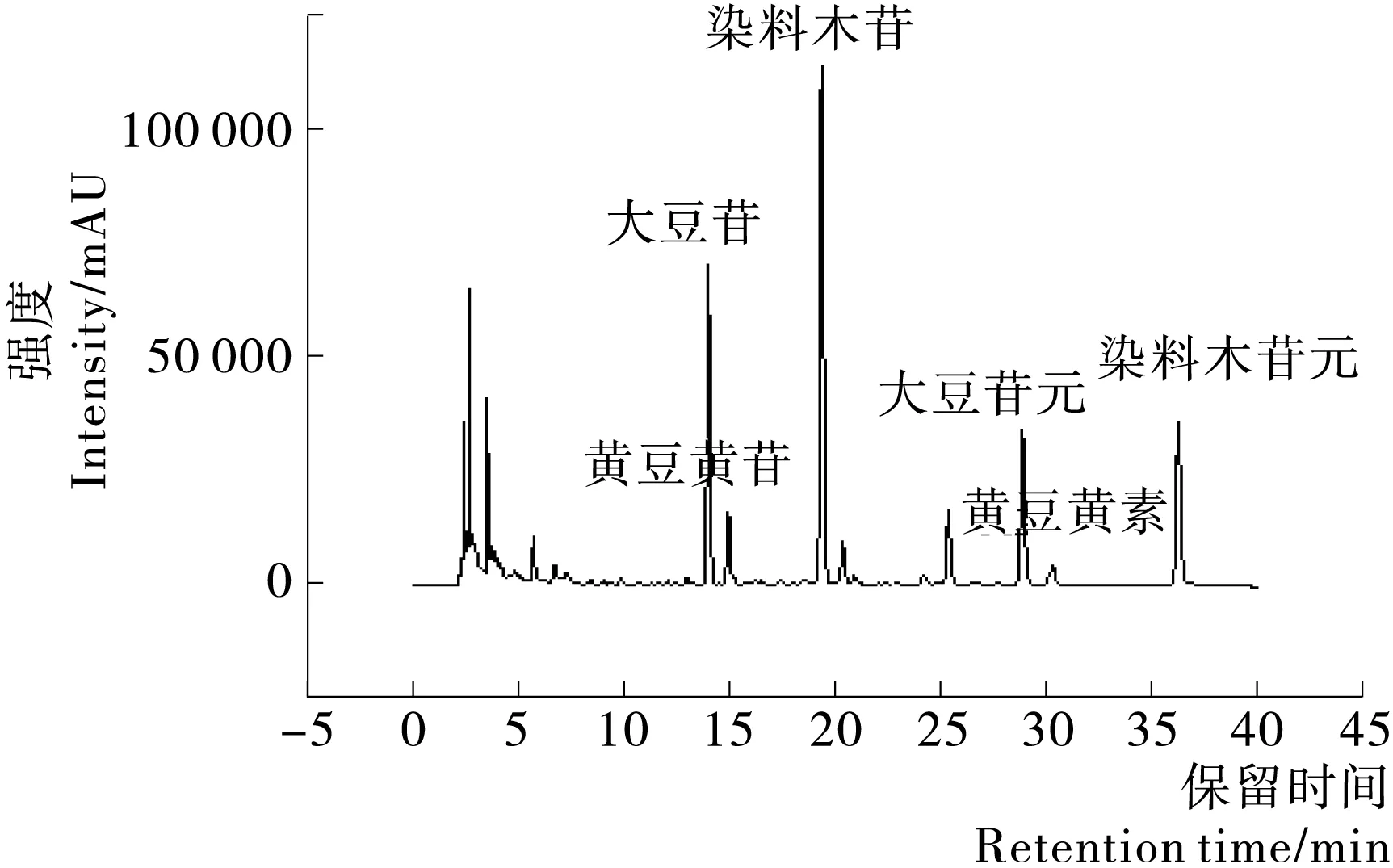
图2 对照组豆浆异黄酮色谱图Figure 2 Chromatograms of soya-bean milk isoflavones from the control group
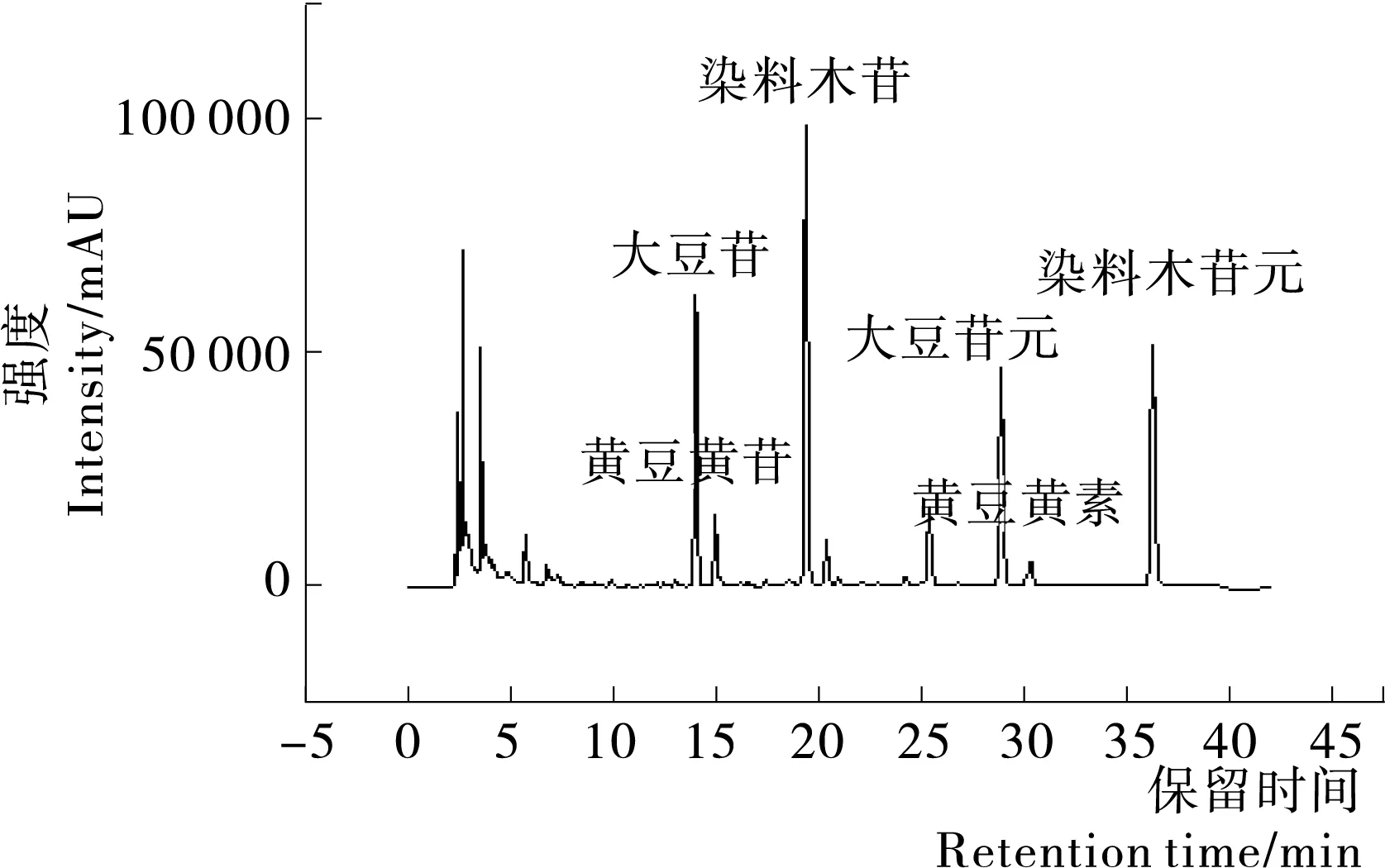
图3 酶解组豆浆异黄酮色谱图Figure 3 Chromatograms of soya-bean milk isoflavones from the enzymatic hydrolysis group
由表3可知,对照组与酶解组豆浆中各种大豆异黄酮的含量差异较明显。经过糖苷酶处理后,豆浆中的糖苷型大豆异黄酮:大豆苷和染料木苷的含量明显减少;对应的苷元型异黄酮:大豆苷元和染料木苷元分别增加了4.95 μg/g和1.686 μg/g;由于豆浆中黄豆黄苷的含量非常低,所以它下降的幅度不是很明显,但是黄豆黄素的含量仍然得到了提高。酶解组豆浆中的大豆异黄酮苷元总量增加了7.289 μg/g,比对照组提高了35.7%,此结果与文献[15]基本一致,充分说明了酶处理可以增加苷元型大豆异黄酮的含量。
2.2 GC—MS检测风味化合物的结果
由表4可知,以豆浆中2-戊基呋喃、己醛、正己醇和反-2-壬烯醛这4种典型风味化合物作为研究对象,结果发现,经过糖苷酶处理后的豆浆中豆腥味化合物己醛和2-戊基呋喃总共减少了10.8%,香气化合物正己醇和反-2-壬烯醛总共增加了10.88%。这与发酵豆乳中微生物引起的风味变化机理相似,其实风味化合物主要是生化反应的副产物,豆乳发酵过程中的风味变化主要依赖于微生物分泌的酶[16]。由于酶的作用,促进了一些大分子化合物向小分子正常转化,抑制了副产物的产生。因此,糖苷酶作用于豆浆,可能产生了新的风味物质,同时破坏了发酵过程中异味物质的生成。
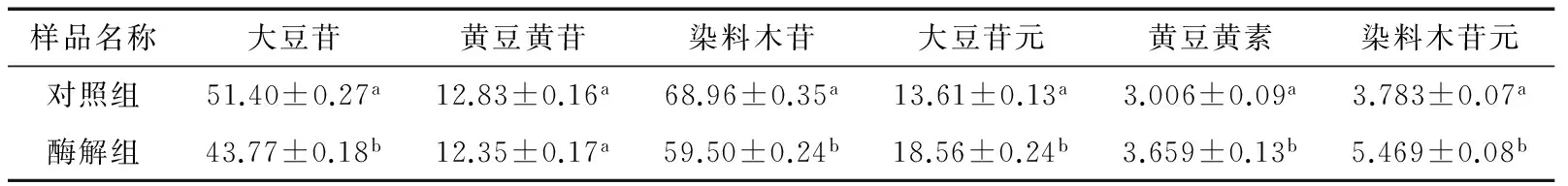
表3 豆浆异黄酮含量†Table 3 Thecontent of soymilk isoflavones μg/g
† 同列肩标不同小写字母表示差异显著(P<0.05)。

表4 豆浆风味化合物含量†Table 4 The content of soymilk flavor compounds %
† 同列肩标不同小写字母表示差异显著(P<0.05)。
3 结论
本研究采用了两种糖苷酶(R.B1L型和R.CL型)对豆浆进行处理,将糖苷型大豆异黄酮转化为苷元型大豆异黄酮,从而增加了大豆异黄酮苷元的含量;此外,发现糖苷酶的加入改善了豆浆的风味与口感。
与前人的研究[10]相比,本试验的独特之处在于豆浆中糖苷酶的加入,并取得了理想的效果:降低了豆腥味化合物己醛和2-戊基呋喃的含量,提高了豆香味化合物正己醇和反-2-壬烯醛的含量,同时获得了高含量的苷元型大豆异黄酮,说明本试验采用的R.B1L型和R.CL型糖苷酶确实发挥了一定的功效,有利于豆浆行业扩大市场效益。但糖苷酶改善豆浆风味的作用机理还有待进一步的深入探究。
[1] POLISELI-SCOPEL F H, HEM(A)NDEZ-HERRERO M, GUAMIS B, et al. Characteristics of soymilk pasteurized by ultra high pressure homogenization (UHPH)[J]. Innovative Food Science and Emerging Technologies, 2013, 20(10): 73-80.
[2] CHOU Cheng-chun, HOU Jen-wan. Growth of bifidobacteria in soymilk and their survival in the fermented soymilk drink during storage[J]. International Journal of Food Microbiology, 2000, 56(2): 113-121.
[3] 石彦国, 任莉. 大豆制品工艺学[M]. 北京: 中国轻工业出版社, 1993: 70.
[4] 吕玉翠. 豆浆和大豆浓缩蛋白乳的热处理对其品质的影响[D]. 无锡: 江南大学, 2013: 34-36.
[5] 范红艳, 顾饶胜, 王艳春, 等. 大豆异黄酮抗衰老作用研究[J]. 中草药, 2010, 41(9): 2 054-2 057.
[6] 崔洪斌. 大豆异黄酮活性研究与应用[M]. 北京: 科学出版社, 2005: 170-178.
[7] CHIEN Hsiang-lin, HUANG Hui-yu, CHOU Cheng-chun. Transformation of isoflavone phytoestrogens during the fermentation of soymilk with lactic acid bacteria and bifidobacteria[J]. Food Microbiology, 2006(23): 772-778.
[8] 高荣海, 赵秀红, 郑艳, 等. 大豆异黄酮糖苷和苷元免疫功能研究[J]. 粮油与油脂, 2008(7): 43-44.
[9] POLISELI-SCOPEL F H, HEMANDEZ-HERRERO M, GUAMIS B, et al. Sterilization and aseptic packaging of soymilk treated by ultra high pressure homogenization[J]. Innovative Food Science and Emerging Technologies, 2014, 22(4): 81-88.
[10] KOBAYASHI A, TSUDA Y, HIRATA N, et al. Aroma constituents of soybean【Glycine max (L.) Merril.】milk lacking lipoxygenase isoenzymes[J]. Journal of Agricultural and Food Chemistry, 1995, 43(9): 2 449-2 452.
[11] MATSUURA M, OBATA A, FUKUSHIMA D. Objectionable flavor of soy milk developed during the soaking of soybeans and its control[J]. Journal of Food Science, 1989, 54(3): 602-605.
[12] 刘肖南, 马艳莉. 高效液相色谱法测定六种大豆异黄酮及雌马酚的含量[J]. 中国食物与营养, 2012, 18(9): 58-61.
[13] 殷丽君, 李里特, 李再贵, 等. 采用HPLC技术快速检测发酵大豆制品中异黄酮的含量[J]. 食品科学, 2002, 23(2): 100-103.
[14] VANDENDOOL H, KRATZ P D. A generalization of the retention index system including linear temperature programmed gas-liquid partition chromatography[J]. Journal of Chromatography A, 1963, 11(2): 463-471.
[15] WANG Meng-fan, GUO Jian, WEI Qi, et al. An effective and green method for the extraction and purification of aglycone isoflavones from soybean[J]. Food Science and Biotechnology, 2013, 22(3): 705-712.
[16] 田三德, 王东, 张焕民. 纯大豆发酵豆乳的风味物质与微观结构的初探[J]. 中国酿造, 2004(6): 8-9.
Effects of glycosidase(R.B1L and R.CL) on configuration of isoflavones and improvement of flavor in soybean milk
ZHOU Wei-jie1,2
XIARong3
ZHUChong-yang1,2
PEIJing4
TAOHui-yuan3
CHENGYong-qiang1,2
(1.BeijingKeyLaboratoryofFunctionalFoodfromPlantResources,Beijing100083,China;2.CollegeofFoodScience&NutritionalEngineering,ChinaAgriculturalUniversity,Beijing100083,China;3.ZhenjiangHengshunBiologicalEngineeringCo.,LTD,Zhenjiang,Jiangsu212000,China;4.ActisEnzymesTrading(Shanghai)Co.,LTD,Shanghai200050,China)
In order to obtain a higher content of soybean isoflavone glycosides and improve the flavor of soybean milk, two kinds of glycosidase (R.B1L and R.CL) were used in soybean milk processing, then the soybean isoflavones and lavor compounds were detected by high performance liquid chromatography (HPLC) and gas chromatography-mass spectrometry technique(GC/MS) respectively. The results showed that the amount of soybean isoflavone aglycones increased 7.289 μg/g, which was 35.7% higher than the control group. While, the bean flavor compounds of hexanal and 2-amyl furan decreased 10.8%, and the aroma compounds of hexyl alcohol and anti-2-nonene aldehyde increased 10.88%. It indicates that the glycosidase can provide a good method for improving the quality and flavor of soybean milk.
soybean milk; glycosidase; soybean isoflavones; flavor
农业科技成果转化资金项目(编号:2014C10000308);江苏省重点研发计划项目(编号:BE2015346);“十二五”科技支撑计划项目(编号:2014BAD04B06)
周炜杰,男,中国农业大学在读硕士研究生。
程永强(1972—),男,中国农业大学教授,博士。 E-mail:chengyq@cau.edu.cn
2016—08—09
10.13652/j.issn.1003-5788.2016.11.001
