立方体纳米Cu2O表面热力学函数的粒度及温度效应
2016-12-29汤焕丰黄在银
汤焕丰 黄在银,2,* 肖 明
(1广西民族大学化学化工学院,南宁530006;2广西高校食品安全与药物分析化学重点实验室,南宁530006)
立方体纳米Cu2O表面热力学函数的粒度及温度效应
汤焕丰1黄在银1,2,*肖 明1
(1广西民族大学化学化工学院,南宁530006;2广西高校食品安全与药物分析化学重点实验室,南宁530006)
液相还原法合成了4种粒度在40-120 nm的立方体纳米氧化亚铜(Cu2O)。利用X射线衍射仪(XRD)、显微拉曼光谱仪和场发射扫描电子显微镜(FE-SEM)对纳米Cu2O的物相组成及形貌结构进行了表征。采用原位微热量技术实时获取纳米/块体Cu2O与HNO3反应过程的热动力学信息,结合热化学循环及动力学过渡态理论计算得到纳米Cu2O的表面热力学函数。在薛永强等建立的无内孔球形纳米颗粒的热力学模型基础上,发展了立方体纳米颗粒的热力学模型。最后由理论结合实验结果分析了粒度和温度对表面热力学函数的影响规律及原因。结果表明,摩尔表面Gibbs自由能、摩尔表面焓和摩尔表面熵均随粒度减小而增大,且与粒度的倒数呈线性关系,这与立方体热力学模型规律一致;随着温度的升高,摩尔表面焓和摩尔表面熵均增大,摩尔表面Gibbs自由能则减小。本文不仅丰富和发展了纳米热力学基本理论,还为纳米材料表面热力学研究及应用提供了方法和思路。
表面热力学函数;原位微热量技术;热力学模型;粒度效应;温度效应;立方体纳米Cu2O
Key Words:Surface thermodynamic function;In-situ microcalorimetry;Thermodynamic model; Particle size effect;Temperature effect;Cubic nano-cuprous oxide
1 引言
表面热力学函数,包括Gibbs自由能、焓、熵等,是纳米材料产生表面效应的热力学特性,更是纳米材料产生表面构效关系的直观反映,极大地影响纳米粒子多相反应过程的热力学1,2、动力学3及电化学4、催化5、生物抗菌6、传感7等过程。纳米材料表面Gibbs自由能、表面焓、表面熵是联系表面原子结构、电子结构和几何结构的综合体现,表面结构的调控实质就是调控表面能。因此,研究其粒度及温度效应能为纳米催化提供热力学原理和技术方法,能更好理解纳米表面反应的本质。然而,目前关于Cu2O的研究多围绕在尺寸的精准调控及催化性能的改进等8,9,尚缺乏表面热力学函数的粒度及温度效应的深入研究。
减小粒度至纳米尺度,可以显著增大表面能,从而增强反应活性10。2016年Science最新报道Hutchings团队11利用Pd-Sn高效催化生产H2O2,发现其高催化活性与粒度密切相关。最近,Jamshidian等12由密度泛函理论及连续介质理论证实表面能随粒度减小而减小。Range等13发现当粒度d<20 nm时,表面能效应随着粒度减小急剧增大,例如d= 0.9 nm时,表面能增大87%。上述研究的表面能多是理想模型的计算结果,相对于存在大量原子阶梯和不饱和键的真实表面差异较大。因此,发展一种普适的实验方法获取表面能是当前纳米表面科学亟待解决的关键问题。原位微热量技术14,15是一种能实时在线监测体系热动力学变化过程并结合热动力学原理及动力学过渡状态理论获取表面能的实验方法,具有高精度、高灵敏度,快速准确地获取体系变化过程的热力学和动力学精细信息的独特优势,广泛应用于纳米材料生长、反应、吸附、溶解过程热动力学研究及表面能测定,具有普适性和科学性。
本文采用原位微热量技术获取Cu2O与HNO3反应过程热动力学参数,结合化学热化学循环及热力学基本理论,计算获得立方体纳米Cu2O的表面热力学函数,并建立热力学模型讨论了粒度及温度对纳米Cu2O摩尔表面Gibbs自由能、摩尔表面焓和摩尔表面熵的影响规律及原因。
2 实验部分
2.1试剂与仪器
CuSO4·5H2O(纯度≥99.0%),NaOH(纯度≥96.0%)购于国药集团化学试剂有限公司;柠檬酸三钠(纯度≥99.0%),抗坏血酸(纯度≥99.7%),HNO3(纯度为65%-68%)均购于广东西陇化工股份有限公司;块体Cu2O(纯度≥99.0%)购于阿拉丁试剂有限公司;不同粒度纳米Cu2O为实验室自主合成。
微量电子天平(XS3DU,瑞士梅特勒-托利多国际股份有限公司);手动移液器(Research plus,德国艾本德股份公司);X射线衍射仪(XRD,Ultima IV,日本理学株式会社);显微拉曼光谱仪(Raman,InVia,英国雷尼绍公司);场发射扫描电子显微镜(FE-SEM,SUPRA 55 Sapphire,德国卡尔蔡司公司);微热量仪(RD 496-CK 2000,绵阳中物热分析仪器有限公司)。
2.2不同粒度立方体纳米Cu2O的制备
量取200 mL去离子水和一定量的柠檬酸三钠于烧杯中,在30°C水浴池以恒定速率搅拌20 min;快速注入0.5 mL、1.2 mol·L-1CuSO4,反应5 min后,滴加0.5 mL、4.8 mol·L-1NaOH,继续反应5 min,滴加0.5 mL、1.2 mol·L-1抗坏血酸,反应30 min得到橙红色沉淀;静置后,分别用去离子水和无水乙醇离心洗涤3次,通N2保存于无水乙醇中。其中0.3,0.6,0.9和1.2 mol·L-1柠檬酸三钠分别对应平均粒度为42,55,67和116 nm的立方体Cu2O。
2.3Cu2O微热量实验
微量电子天平准确称取1.500 mg纳米/块体Cu2O置于15 mL样品池,然后使用移液器手动移取1.0 mL、2.0 mol·L-1的HNO3溶液于小玻璃管中。设定微热量仪参数,分别恒温至298.15、308.15和318.15 K。待基线平稳后捅破小玻璃管,使Cu2O和HNO3混合发生反应,得到反应过程的原位热谱曲线。经计算可获得不同粒度纳米Cu2O的表面热力学函数。
3 结果与讨论
3.1Cu2O的表征
图1(a)的XRD图谱显示产物所有的衍射峰均与氧化亚铜面心立方晶系Cu2O(JPCDS卡片No. 05-0667)相对应,各衍射峰强度较强,峰宽较窄且未见其他杂质峰,表明它们结晶度良好,晶体较纯。图1(b)产物的拉曼特征峰均与文献报道的Cu2O相符16,17,没有出现CuO的特征峰18。其中,112 cm-1拉曼位移属于Γ-振动模式,150和632
12cm-1处的振动属于Γ-
红外活性模式,218和304
15cm-1归属为二阶倍频2Γ-振动模式,而414和506
12cm-1则分属于四阶倍频4Γ-
振动模式和Γ+双声子模
1225式19,20。218 cm-1处峰型尖锐表明纳米Cu2O结晶度好,并佐证了XRD结果。由图2(a-d)纳米Cu2O的SEM图可看出,该Cu2O为不同纳米尺寸下的立方体形貌,其形貌规则,表面光滑和棱角分明。粒度分布直方图显示纳米Cu2O分布集中且粒度均匀,通过Nano Measurer对纳米Cu2O的电镜图进行统计,其平均粒度依次为(42±6)、(55±7)、(67± 8)和(116±17)nm。
3.2立方体纳米Cu2O热力学理论模型
在恒温恒压下,各相中物质的量不变时,根据文献21-23推导的无内孔球形纳米颗粒热力学模型,可以得摩尔表面Gibbs自由能为:
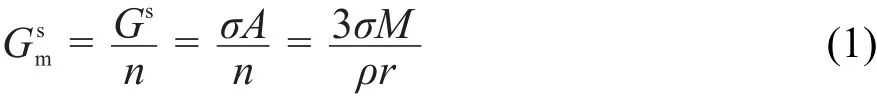
式中,Gs为表面Gibbs自由能,n、σ、A、M、ρ和r分别为纳米颗粒的物质的量、表面张力、表面积、摩尔质量、密度和颗粒半径。
对于立方体纳米颗粒,其总面积和总物质的量分别为:
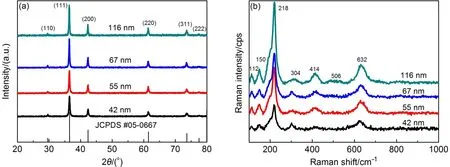
图1 不同粒度纳米氧化亚铜的(a)XRD图谱和(b)拉曼光谱Fig.1 (a)XRD patterns and(b)Raman spectra of nano-Cu2O with different sizes
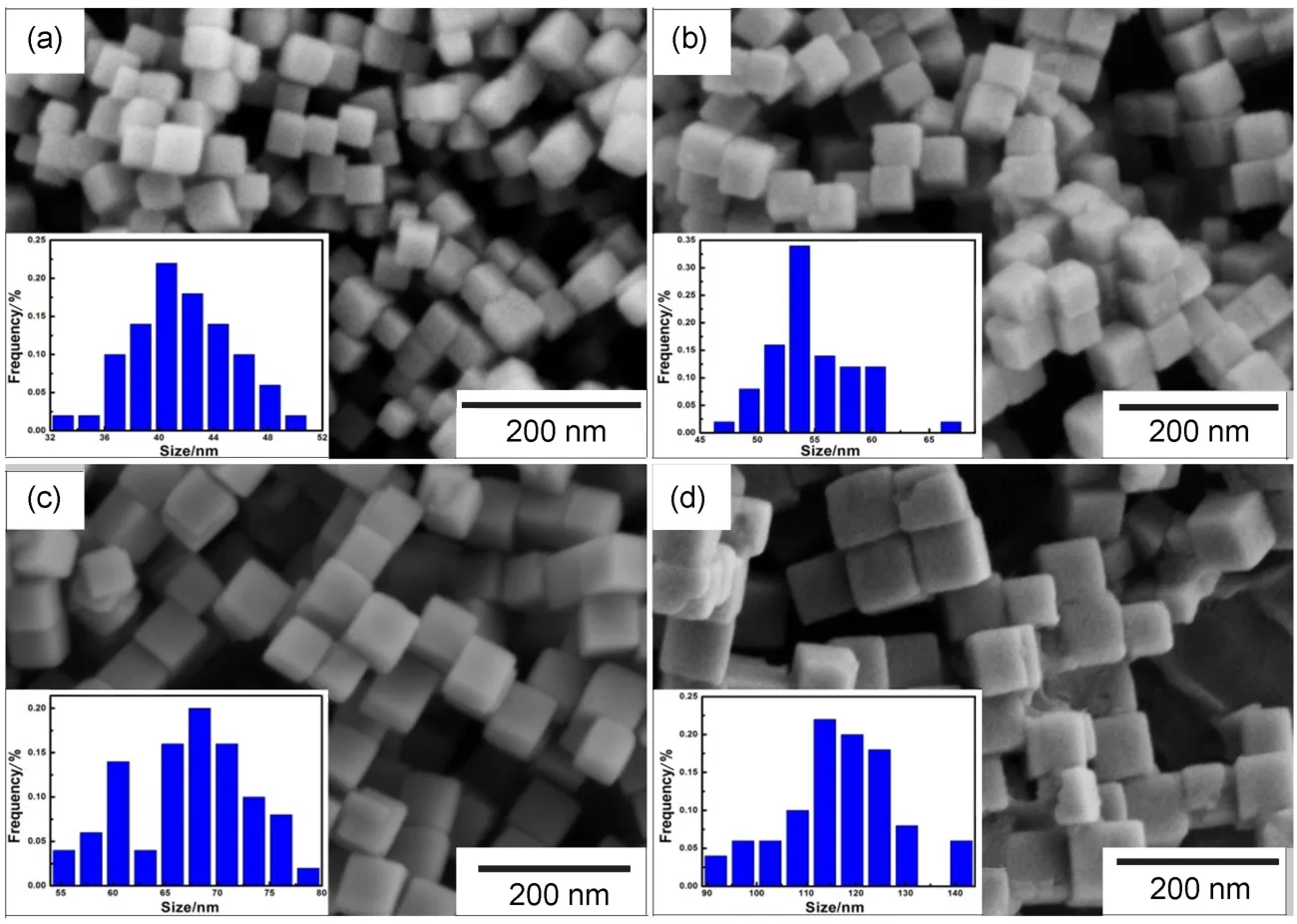
图2 不同粒度纳米氧化亚铜的SEM图谱和粒径分布直方图Fig.2 SEM image and the distribution histograms of nano-Cu2O with different sizes

式中,N、V和l分别为纳米颗粒的颗粒数、单个颗粒的体积和边长。
将式(2)和(3)代入式(1),即可得到立方体纳米颗粒的摩尔表面Gibbs自由能为:

由于化学反应过程粒度发生改变,其偏摩尔表面Gibbs自由能不等于摩尔表面Gibbs自由能。所以,对于立方体纳米颗粒,其偏摩尔表面Gibbs自由能表达式为:
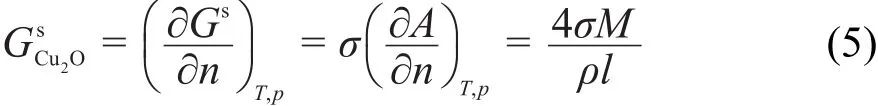
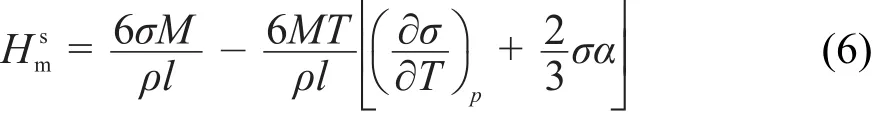
式中,α为等压体积膨胀系数。
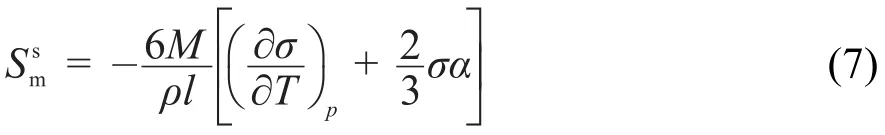
当纳米颗粒的粒径大于10 nm时,表面张力可近似为常数24。由式(4)可知,摩尔表面Gibbs自由能随着粒度的减小而增大;对于固体颗粒α的数值很小,温度不是很高时可以忽略,又因为普通固体物质,所以,式(6)中摩尔表面焓随着粒度的减小而增大;同理,由式(7)可知,摩尔表面熵随着粒度的减小而增大。
3.3立方体纳米Cu2O表面热力学函数的获取
纳米体系化学反应的摩尔Gibbs函数及摩尔焓由体相和表面相两部分组成,而块体化学反应的摩尔Gibbs函数及摩尔焓几乎只有体相部分,因此纳米与块体体系的差值就是表面热力学函数。根据文献25,26,结合图3的热化学循环及过渡态理论,可获得纳米的摩尔表面焓,偏摩尔表面Gibbs自由能及摩尔表面熵(Ssm)计算公式为:
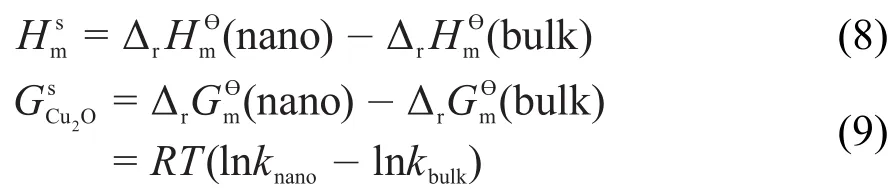
式中,knano和kbulk分别为纳米和块体Cu2O的反应速率常数,T为温度,ΔrHӨm为摩尔反应焓。
根据《物理化学中的量、单位和符号》27规定,采用过渡态理论由速率常数得到的是而非。但由式(4)及(5)可知,和Gsm之间有明确的关系且二者之比为2:3。
故由式(9)及二者的关系,可得纳米Cu2O的摩尔表面Gibbs自由能为:
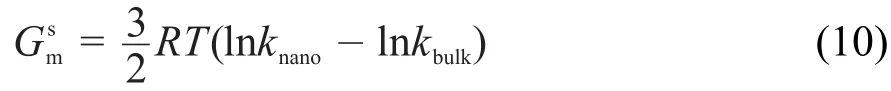
由(8)及(10)可得纳米Cu2O的摩尔表面熵为:

3.4粒度及温度对纳米Cu2O表面热力学函数的影响
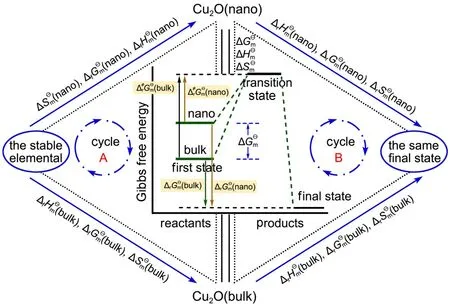
图3 纳米与块体Cu2O的热化学循环及过渡态理论Fig.3 Thermochemical cycle and transition state theory of nano-and bulk Cu2O
ΔrHmӨ(nano)和ΔrHmӨ(bulk)数值由微热量仪直接测得,将高胜利等28报道的等温等压不可逆反应的热动力学方程进行线性回归,可求得反应速率常数k值,平均三次实验的测量值见表1。
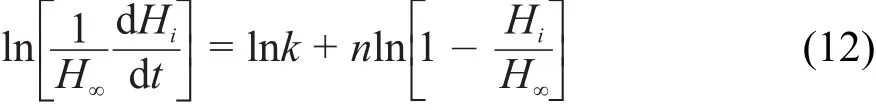
式中,H∞为整个反应过程的焓变,Hi为反应时间t时的瞬时焓变;dHi/dt为热焓变化率。
将表1中反应速率常数k代入式(10),可得不同温度下的立方体Cu2O纳米反应体系的摩尔表面Gibbs自由能(Gms),结合式(8)和(11)得相应的摩尔表面焓(Hms)和摩尔表面熵(Sms)(见表2),相应的关系曲线见图4(a-c)。
纳米材料与块体材料的本质区别在其表面相的高比表面能。如图4(a-c)所示,同一温度下,立方体纳米Cu2O反应体系的均随着粒度的减小而增大且与粒度的倒数成线性关系,这不仅与文献26,27,29报道的规律一致,还与式(4)、(6)和(7)建立的立方体热力学模型吻合。因为氧化亚铜超细化至纳米尺度后,比表面积急剧增加,表面相的活性原子密度随之增加,于是表面原子间相互作用力增强,其表面吸附和活化能力增强,亦即增大了纳米Cu2O的;但由于原子受力不均匀和存在大量活跃的悬挂键,导致表面相的势能增大,表面原子的混乱度随之增大,因此,增大。
同一粒度下,Cu2O纳米反应体系的均随着温度升高而增大,则减小。当温度升高时,纳米粒子热运动加剧,表面原子间及表面与内部原子间的间距增大,使它们之间相互作用力减弱,因此表面张力减小,即减小;但是热运动加快了分子间的碰撞,粒子动能、势能均增大,体系的混乱度增加,因此和增大。
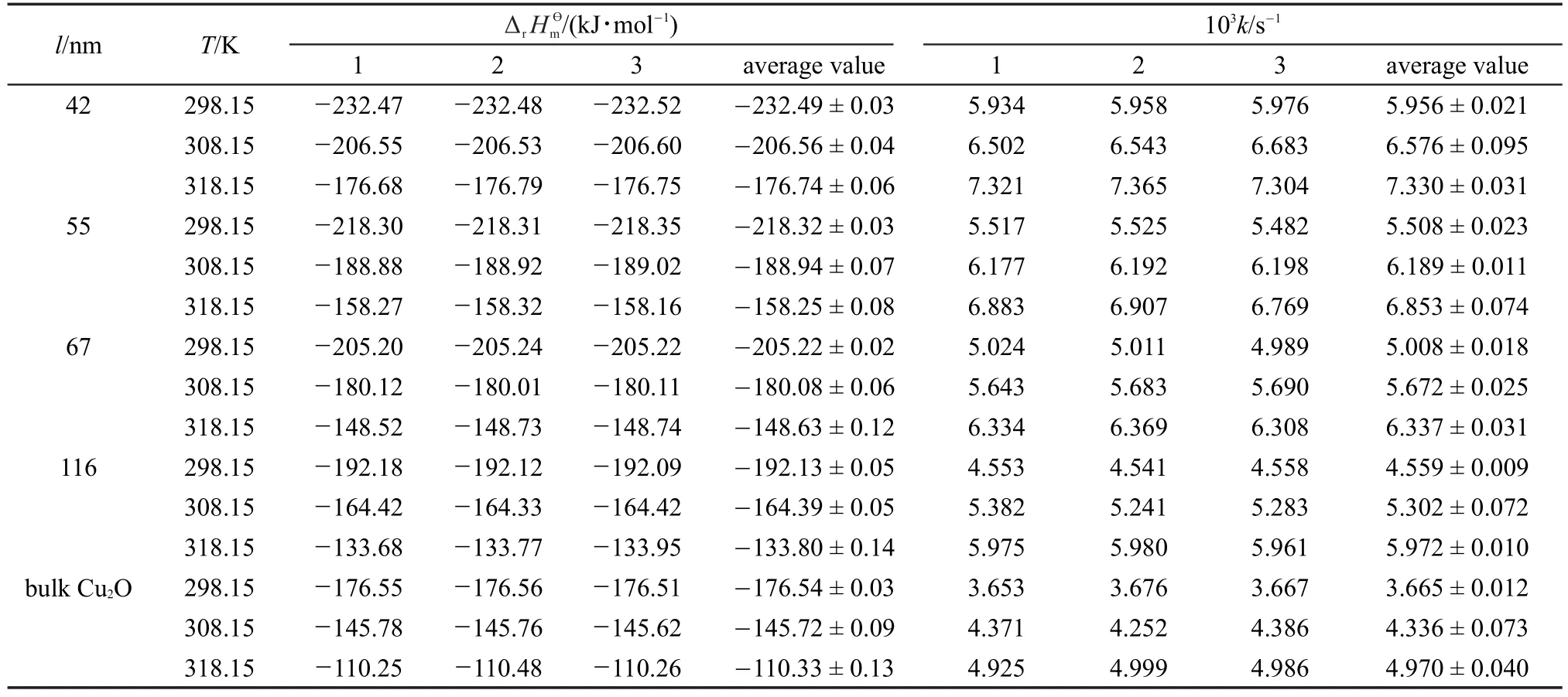
表1 不同粒度和温度下纳米/块体Cu2O与HNO3反应体系的速率常数k和反应焓ΔrHmӨTable 1 Rate constants(k)and reaction enthalpies(ΔrHmӨ)of nano-and bulk Cu2O(s)in HNO3(aq)at different particle sizes and temperatures
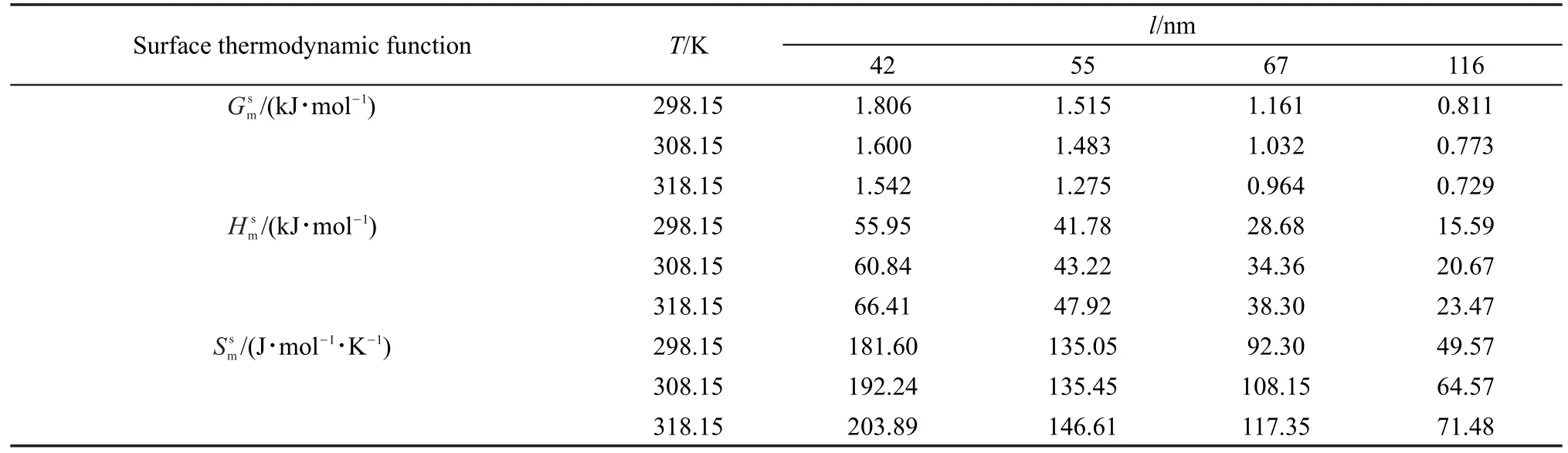
表2 不同粒度和温度下立方体纳米Cu2O的表面热力学函数Table 2 Surface thermodynamical functions of cubic nano-Cu2O(s)at different particle sizes and temperatures
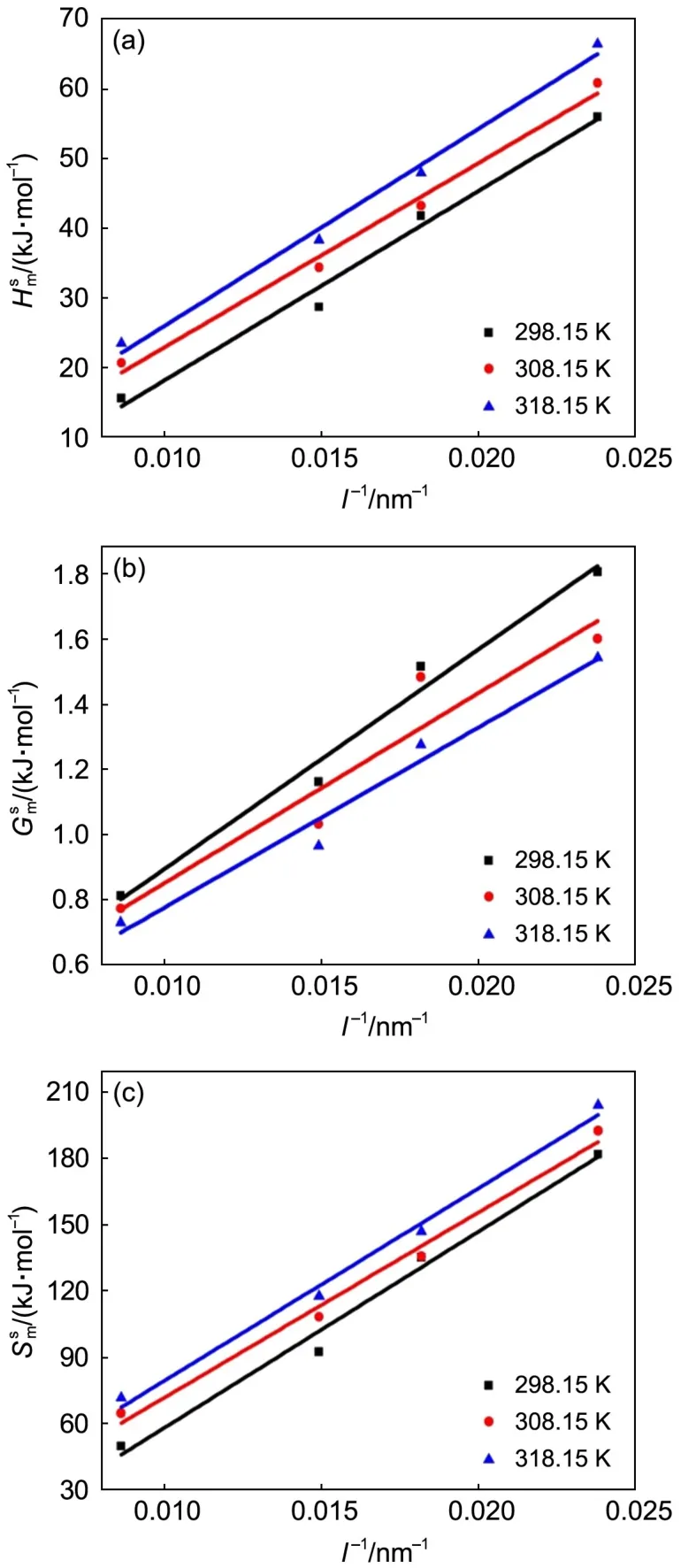
图4 不同温度下纳米Cu2O表面热力学函数与粒度的倒数的关系曲线Fig.4 Relationships between surface thermodynamical functions and the reciprocal of particle sizes(l-1)of nano-Cu2O for different temperatures(T)
4 结论
综上所述,本文采用原位微热量技术获取了Cu2O与HNO3反应过程的热力学精细信息,基于纳米与块体Cu2O表面相的差别,结合热化学循环、热动力学原理及过渡态理论计算获得立方体纳米Cu2O的表面热力学函数。由建立的立方体热力学模型结合实验结果讨论了粒度及温度对表面热力学函数的影响规律。结果表明,摩尔表面Gibbs自由能,摩尔表面焓和摩尔表面熵均随着粒度的减小而增大,不仅与粒度的倒数成线性关系,且与立方体热力学模型规律吻合;随着温度的升高,摩尔表面焓和摩尔表面熵增大,摩尔表面Gibbs自由能则减小。本文有望为纳米材料表面热力学函数的获取及其粒度和温度效应的研究提供新的思路和方法。
(1) Wen,Y.Z.;Xue,Y.Q.;Cui,Z.X.;Wang,Y.J.Chem. Thermodyn.2015,80,112.doi:10.1016/j.jct.2014.08.013
(2) Lai,W.P.;Xue,Y.Q.;Lian,P.;Ge,Z.X.;Wang,B.Z.;Zhang, Z.Z.Acta Phys.-Chim.Sin.2007,23(4),508.[来蔚鹏,薛永强,廉 鹏,葛忠学,王伯周,张志忠.物理化学学报,2007,23 (4),508.]doi:10.3866/PKU.WHXB20070411
(3) Lee,S.;Liang,C.W.;Martin,L.W.ACS Nano 2011,5(5), 3736.doi:10.1021/nn2001933
(4) Yang,Y.F.;Xue,Y.Q.;Cui,Z.X.;Zhao,M.Z.Electrochim. Acta 2014,136,565.doi:10.1016/j.electacta.2014.05.067
(5) Chakravarty,A.;Bhowmik,K.;Mukherjee,A.;De,G.Langmuir 2015,31(18),5210.doi:10.1021/acs.langmuir.5b00970
(6) Pang,H.;Gao,F.;Lu,Q.Y.Chem.Commun.2009,9,1076. doi:10.1039/B816670F
(7) Zhu,H.T.;Wang,J.X.;Xu,G.Y.Cryst.Growth.Des.2008,9 (1),633.doi:10.1021/cg801006g
(8) Song,J.H.;Rodenbough,P.P.;Xu,W.Q.;Senanayake,S.D.; Chan,S.W.J.Phys.Chem.C 2015,119(31),17667. doi:10.1021/acs.jpcc.5b04121
(9) Tsai,Y.H.;Chanda,K.;Chu,Y.T.;Chiu,C.Y.;Huang,M. H.Nanoscale 2014,6(15),8704.doi:10.1039/C4NR02076F
(10) Kuang,Q.;Wang,X.;Jiang,Z.Y.;Zhao,X.X.;Zheng,L.S. Acc.Chem.Res.2013,47(2),308.doi:10.1021/ar400092x
(11) Freakley,S.J.;He,Q.;Harrhy,J.H.;Lu,L.;Crole,D.A.; Morgan,D.J.;Ntainjua,E.N.;Edwards,J.K.;Carley,A.F.; Borisevich,A.Y.;Kiely,C.J.;Hutchings,G.J.Science 2016, 351(6276),965.doi:10.1126/science.aad5705
(12) Jamshidian,M.;Thamburaja,P.;Rabczuk,T.Phys.Chem. Chem.Phys.2015,17(38),25494.doi:10.1039/C5CP04375A
(13) Range,S.;Bernardes,C.E.S.;Simoes,R.G.;Epple,M.; Piedade,M.M.J.Phys.Chem.C 2015,119(8),4387. doi:10.1021/jp5124772
(14) Hu,R.Z.;Zhao,F.Q.;Gao,H.X.;Song,J.R.Fundamentals and Applications of Calorimetry;Science Press:Beijing,2011; pp 1-10.[胡荣祖,赵凤起,高红旭,宋纪蓉.量热学基础与应用.北京:科学出版社,2011:1-10.]
(15) Rychlý,R.;Pekarek,V.J.Chem.Thermodyn.1977,9(4),391. doi:10.1016/0021-9614(77)90060-X
(16) Pan,L.;Zou,J.J.;Zhang,T.R.;Wang,S.B.;Wang,L.;Zhang, X.W.J.Phys.Chem.C 2013,118(30),16335.doi:10.1021/ jp408056k
(17) Li,C.;Li,Y.B.;Delaunay,J.J.ACS Appl.Mater.Interfaces 2013,6(1),480.doi:10.1021/am404527q
(18) Wu,L.L.;Tsui,L.K.;Swami,N.;Zangari,G.J.Phys.Chem.C 2010,114(26),11551.doi:10.1021/jp103437y
(19) Solache-Carranco,H.;Juarez-Díaz,G.;Esparza-García,A.; Biseo-García,M.;Galvan-Arellano,M.;Martínez-Juárez,J.; Romero-Paredes,G.;Pea-Sierra,R.J.Lumin.2009,129(12), 1483.doi:10.1016/j.jlumin.2009.02.033
(20) Sun,D.;Yin,P.G.;Guo,L.Acta Phys.-Chim.Sin.2011,27(6), 1543.[孙 都,殷鹏刚,郭 林.物理化学学报,2011,27(6), 1543.]doi:10.3866/PKU.WHXB20110619
(21) Fu,Q.S.;Cui,Z.X.;Xue,Y.Q.Eur.Phys.J.Plus 2015,130 (10),212.doi:10.1140/epjp/i2015-15212-4
(22) Wang,S.S.Study on the Size Effect of Nanoparticles on the Surface Thermodynamic Properties by Solubility Method.M.S. Dissertation,Taiyuan University of Technology,Taiyuan,2015. [王珊珊.溶解度法研究粒度对纳米颗粒表面热力学性质的影响[D].太原:太原理工大学,2015.]
(23) Guo,S.H.The Effect of Particle Size and Shape on the Thermodynamic Properties:a Theoretical Study and Quantum Chemistry Calculation.M.S.Dissertation,Taiyuan University of Technology,Taiyuan,2015.[郭少辉.粒度和形貌对纳米颗粒热力学性质影响的理论研究和量化计算[D].太原:太原理工大学,2015.]
(24) Xue,Y.Q.;Yang,X.C.;Cui,Z.X.;Lai,W.P.J.Phys.Chem.B 2011,115(1),109.doi:10.1021/jp1084313
(25) Li,X.X.;Huang,Z.Y.;Zhong,L.Y.;Wang,T.H.;Tan,X.C. Chin.Sci.Bull.2014,59(25),2490.[李星星,黄在银,钟莲云,王腾辉,谭学才.科学通报,2014,59(25),2490.]doi:10.1360/ N972014-00332
(26) Fan,G.C.;Ma,Z.;Huang,Z.Y.;Tan,X.C.;Yao,X.C.Chem. J.Chin.Univ.2014,35(5),1007.[范高超,马 昭,黄在银,谭学才,姚先超.高等学校化学学报,2014,35(5),1007.] doi:10.7503/cjcu20140062
(27) International Union of Pure andApplied Chemistry.Chemistry Quantities,Units and Symbols in Physical Chemistry;Scientific and Technical Documentation Press:Beijing,1991;pp 56-57; translated by Qi,D.Y.,Jin,Z.D.,Zhuang,Y.L.[国际纯粹化学与应用化学联合会.物理化学中的量,单位和符号,漆德瑶,金宗德,庄云龙,译.北京:科学技术文献出版社,1991:56-57.]
(28) Gao,S.L.;Chen,S.P.;Hu,R.Z.;Li,H.Y.;Shi,Q.Z.Chin.J. Inorg.Chem.2002,18(4),362.[高胜利,陈三平,胡荣祖,李焕勇,史启祯.无机化学学报,2002,18(4),362.]
(29) Piloyan,G.O.;Bortnikov,N.S.;Boeva,N.M.J.Mod.Phys. 2013,4(7),16.doi:10.4236/jmp.2013.47A2003
Effects of Particle Size and Temperature on Surface Thermodynamic Functions of Cubic Nano-Cu2O
TANG Huan-Feng1HUANG Zai-Yin1,2,*XIAO Ming1
(1College of Chemistry and Chemical Engineering,Guangxi University for Nationalities,Nanning 530006,P.R.China;2Guangxi Colleges and Universities Key Laboratory of Food Safety and Pharmaceutical Analytical Chemistry,Nanning 530006,P.R.China)
Cubic nano-cuprous oxides,with four types of particle sizes ranging from 40 to 120 nm,were synthesized via a liquid-phase reduction method.The composition,morphology and structure of the nano-Cu2O particles were characterized by X-ray diffractometry(XRD),Raman microscopy and field emission scanning electronic microscopy(FE-SEM).In-situ microcalorimetry was used to obtain thermodynamic information about the reaction between HNO3and bulk Cu2O or nano-Cu2O.The surface thermodynamic functions of cubic nano-Cu2O were calculated by a combination of thermodynamic principle and kinetic transition state theory.We develop a thermodynamic model for the cubic nanoparticles based on the thermodynamic model of spherical nanoparticles without bore developed by XUE Yong-Qiang et al.The particle size and temperature effects of surface thermodynamic functions are discussed by comparing the theoretical model with the experimental results.The molar surface Gibbs free energy,molar surface enthalpy and molar surface entropy increased with decreasing particle sizes.Linear trends were found between the reciprocal of particle size and surface thermodynamic functions,which agreed well with the theoretical model for a cube.The molar surface enthalpy and molar surface entropy were increased with rising temperature,whereas the molar surface Gibbs free energy decreased.This work not only enriches and develops the basic theory of nano-thermodynamics,but also provides a novel method and idea for investigating surface thermodynamic functions of nanomaterials and their applications.
O642
10.3866/PKU.WHXB201608084
Received:July 14,2016;Revised:August 4,2016;Published online:August 8,2016.
*Corresponding author.Email:huangzaiyin@163.com;Tel:+86-771-3267010.
The project was supported by the National Natural Science Foundation of China(21273050,21573048).
国家自然科学基金(21273050,21573048)资助项目
