CFTR对肺腺癌细胞Calu-3迁移影响的研究
2016-12-29李亚秋苏晓薇黄孙卉许冬明郝嘉南郝利铭
李亚秋,苏晓薇,黄孙卉,许冬明,郝嘉南,郝利铭
(1.吉林医药学院解剖教研室,吉林 吉林 132013;2.吉林大学基础医学院,吉林 长春 130021)
CFTR对肺腺癌细胞Calu-3迁移影响的研究
李亚秋1,苏晓薇2,黄孙卉1,许冬明1,郝嘉南1,郝利铭2
(1.吉林医药学院解剖教研室,吉林 吉林 132013;2.吉林大学基础医学院,吉林 长春 130021)
采用常规培养肺腺癌细胞Calu-3的方法,利用MTT和CCK-8法确定囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)的激活剂(Genistein)和抑制剂(CFTRinh-172)的最适浓度,用CFTR激活剂和抑制剂的最佳浓度分别处理Calu-3细胞,然后采用划痕实验观测了培养48 h后Calu-3细胞迁移的差异.结果表明:MTT法检测激活剂的最佳浓度为25 μmol/L;CCK-8法检测抑制剂的最佳浓度为10 μmol/L;划痕实验检测得出25 μmol/L 激活剂组细胞迁移数量((74.2±5.79)个)与对照组细胞迁移数量((134.1±10.04)个)相比具有显著性差异(P=0.00<0.01);10 μmol/L 抑制剂组细胞迁移数量((148.3±17.70)个)与对照组细胞迁移数量((134.1±10.04)个)相比无显著性差异(P=0.27>0.05).激活剂通过促进CFTR氯离子通道的开放,抑制了肺腺癌肿瘤细胞Calu-3的迁移.
CFTR;Calu-3细胞;迁移
目前,肿瘤的治疗主要采取手术治疗、化学治疗、放射治疗和生物治疗等方式.每一种肿瘤的治疗都有不同的治疗模式.对于肺腺癌来说,早期肺腺癌首选手术治疗[1].然而,大多数患者在肺癌发现时,已经是肺癌的晚期或中晚期,丧失了手术的机会,因此,会选择化学治疗,但化疗药物使用一段时间后会使肿瘤细胞产生一定的耐药性;同时,这些抗癌药物还具有很大的毒副作用,它们对正常的细胞也有毒害作用.因此,人们又开始探讨免疫疗法和其他新的有效治疗靶点[2].目前,已有许多晚期的非小细胞癌患者受益于基于自身体内肿瘤可识别分子特征的个体免疫疗法[2].随着研究的逐渐深入,特殊分子靶向给药的方式将逐渐成为肺癌治疗的最主要手段,这就需要对治疗有效的靶点进行深入的筛选和研究[3].有报道称,囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)参与肿瘤的发展,其突变可能影响某些肿瘤的发生和发展[4-11].肺腺癌是肺癌的主要类型之一,CFTR在肺腺癌细胞有不同程度的表达,而CFTR对肺腺癌细胞的迁移和发展是否有影响尚未见研究报道.因此,本研究采用肺腺癌上皮细胞株Calu-3,通过添加CFTR特异性抑制剂和CFTR激活剂,分别制作出抑制和激活CFTR基因的细胞模型;采用划痕实验检测细胞的迁移水平,进而探讨了CFTR是否能够影响肺腺癌细胞的迁移,以为肺腺癌的治疗提供一些新的线索.
1 材料和方法
1.1 细胞系及培养条件
Calu-3为高表达CFTR的肺腺癌细胞系,由北京大学医学部药理学系李学军教授赠与.细胞培养条件为:37℃,5% CO2,DMEM培养液(Hyclone公司),10%胎牛血清(四季青公司),1%青链霉素混合液.
1.2 MTT测试
设置调零组、对照组、激活剂组.激活剂的浓度分别为:0,6.25,12.5,25,50,100,200,300,400 μmol/L,共9个浓度处理,每个浓度设5个复孔.调整细胞密度至10 000个/孔,置于细胞培养箱中孵育过夜.弃掉培养液,加入新的培养液(在激活剂组中加入不同浓度的激活剂).培养时间分别为24,48和72 h.先加20 μL MTT,置于细胞培养箱中孵育4 h,然后加150 μL DMSO,室温震荡10 min.将96孔板放入酶标仪(TECAN SUNRISE,奥地利)测量D(490).采用下列公式计算抑制率或增殖率:抑制率或增殖率=((实验组D(λ)值-调零组D(λ)值)-(对照组D(λ)值-调零组D(λ)值))/(对照组D(λ)值-调零组D(λ)值).同时,采用IC50软件计算MTT和CCK-8的IC50值.
1.3 CCK-8测试
细胞培养与MTT方法相同,设置抑制剂的浓度分别为:0,1.25,2.5,5,10,20,40,60,80 μmol/L,共9个浓度处理.培养时间分别为24,48和72 h.加入10 μL CCK-8/孔,放于CO2细胞培养箱中孵育1~4 h后,用酶标仪测试D(450).增殖率或抑制率采用1.2的公式计算.
1.4 划痕实验
调整Calu-3细胞浓度至200 000个/孔,铺至24孔板中,分为CFTRinh172组、激活剂组、对照组、腺苷酸环化酶激活剂(Forskolin)+激活剂/抑制剂组、腺苷酸环化酶激活剂组共6组,放于CO2细胞培养箱中培养.待细胞铺满孔底,用消毒和灭菌后的10 μL移液器枪头与直尺划痕,每个组设3个复孔.每24 h换一次培养液,培养液内加不同浓度的激活剂和抑制剂.观察培养24,48和72 h三个时间段内Calu-3细胞向划痕中迁移的情况并显微摄影.采用B.J.Allan等的方法[12]计算每张照片已迁入划痕中的细胞数量,并运用SPSS17.0软件进行统计学分析.
2 实验结果
2.1 MTT结果
加入激活剂,培养Calu-3细胞24,48和72 h后,根据所测的D(λ)值计算出激活剂对Calu-3细胞的抑制率,结果表明随着激活剂浓度的增高,细胞的抑制率增加(见图1).采用IC50软件计算激活剂作用时间为48 h的半数致死浓度(IC50值 )约为25 μmol/L.
2.2 CCK-8结果
加入抑制剂,培养Calu-3细胞24,48和72 h后,根据所测得D(λ)值计算出CFTRinh172对Calu-3细胞作用的增殖率,结果表明随着抑制剂浓度的增高,细胞的增殖率呈现曲线型波动(见图2).从结果可以看,细胞培养48 h所显示的增殖率与细胞培养所见的趋势吻合,因此,划痕实验的时间点确定为培养48 h,抑制剂的适宜浓度为10 μmol/L.
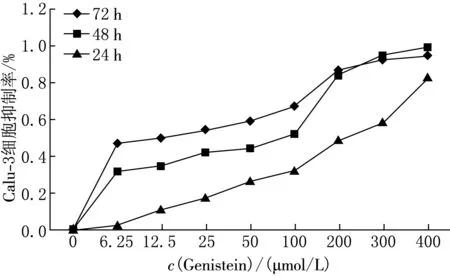
图1 MTT法测试激活剂影响 Calu-3细胞抑制率实验结果
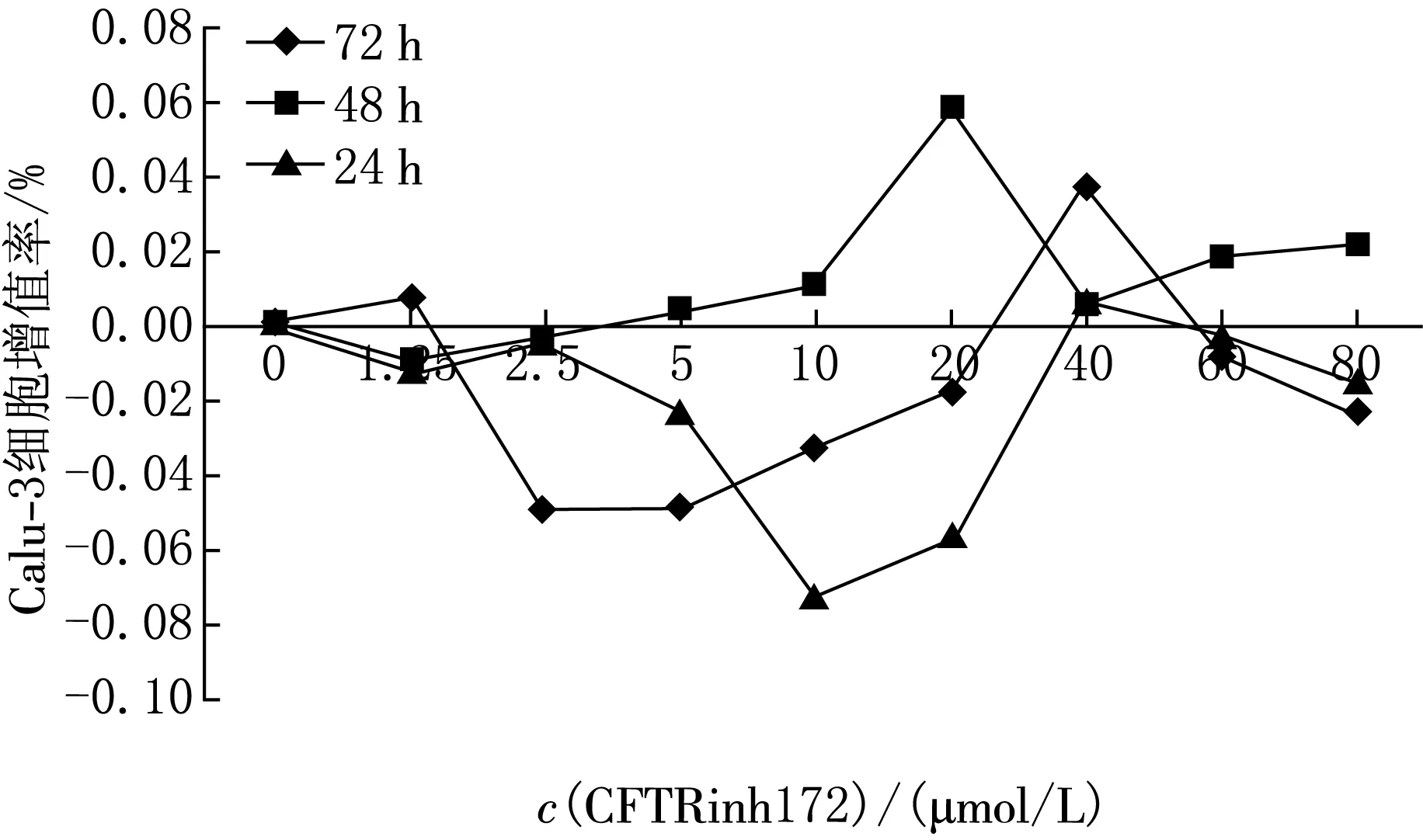
图2 CCK8法测试抑制剂影响Calu-3细胞增殖率实验结果
2.3 细胞迁移的测试结果
划痕实验分为空白对照组(A549肺腺癌细胞组)和Calu-3实验组.
A549组作为CFTR的空白对照组,分为A549对照、A549激活剂组、A549抑制剂组,培养时间分为24 h和48 h.划痕后24 h,25 μmol/L A549激活剂组的细胞迁移数量为(132.3±4.16)个(见图3a),与A549对照组细胞迁移数量((133.6±1.10)个)(见图3A)相比无显著性差异(P=0.75>0.05)(见表1);10 μmol/L A549抑制剂组的细胞迁移数量为(138.9±3.190)个(见图3aa),与A549空白对照组细胞迁移数量((133.6±1.10)个)相比无显著性差异(P=0.056>0.05)(见表1).划痕后48 h,细胞移满整个划痕.
Calu-3实验组中包括Calu-3对照组、Calu-3激活剂组、Calu-3抑制剂组、腺苷酸环化酶激活剂(Forskolin)组.划痕后48 h,25 μmol/L Calu-3激活剂组细胞迁移数量为(74.2±5.79个)(见图3b),与其对照组细胞迁移数量((134.1±10.04)个)(见图3B)相比差异显著(P=0.00<0.01)(见表2);10 μmol/L Calu-3抑制剂组的细胞迁移数量为(148.3±17.70)个(见图3bb),与其对照组细胞迁移数量((134.1±10.04)个)(见图3B)相比无显著差异(P=0.27>0.05)(见表2).
腺苷酸环化酶激活剂+激活剂 25 μmol/L组细胞迁移数量为(71.8±6.36)个(见图3c),与25 μmol/L 激活剂组的细胞迁移数量((74.2±5.79)个)(见图3b)相比无显著差异(P=0.70>0.05)(见表3);腺苷酸环化酶激活剂+10 μmol/L抑制剂组细胞迁移数量为(127.5±15.88)个(见图3cc),与10 μmol/L抑制剂48 h组细胞迁移数量((148.3±17.70)个)(见图3bb)相比无显著差异(P=0.20>0.05).
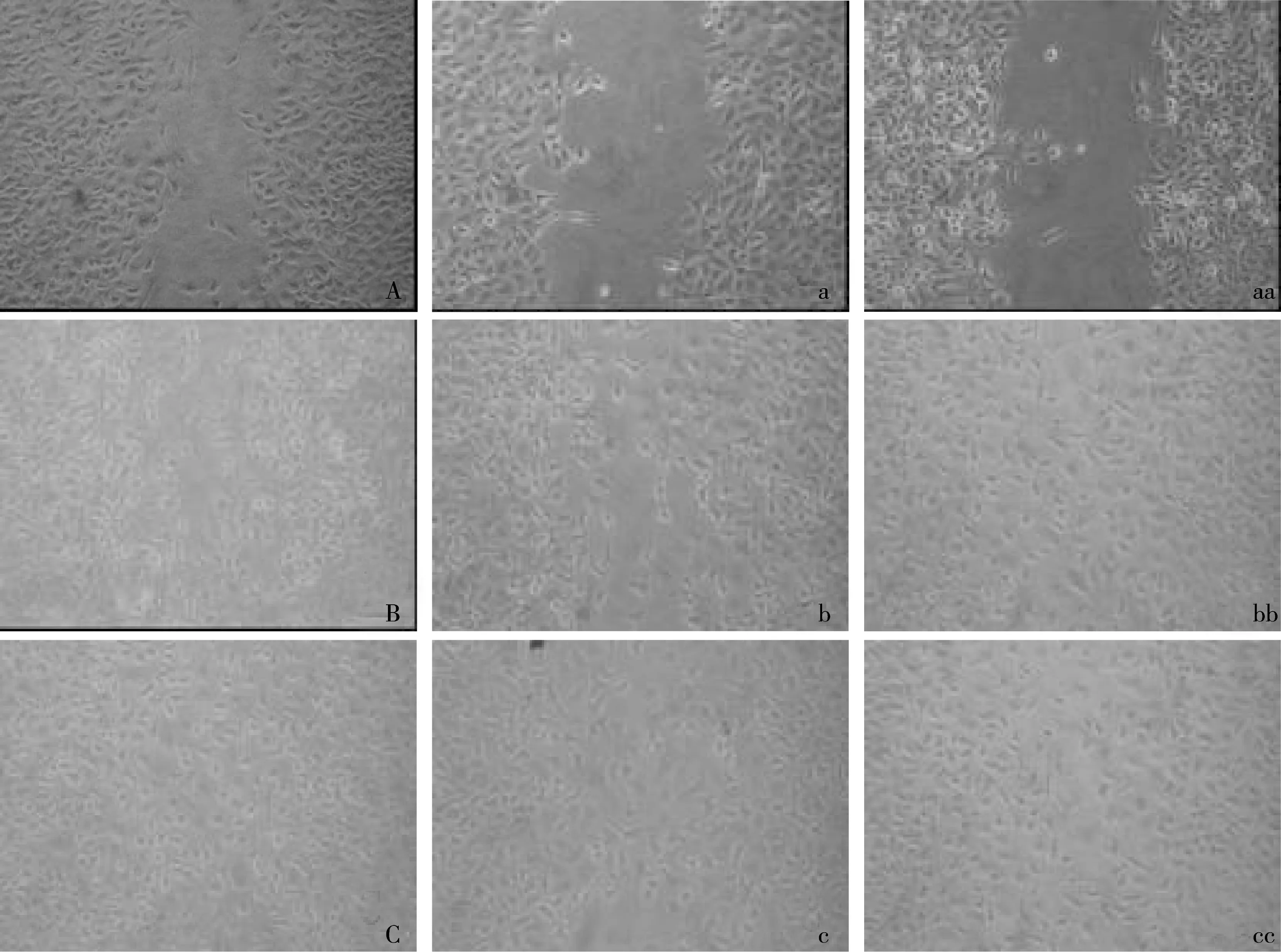
A:A549 对照24 h,a:A549激活剂 25 μmol/L 24 h,aa:A549 抑制剂10 μmol/L 24 h;B:对照48 h,b:激活剂25 μmol/L 48 h,bb:抑制剂10 μmol/L 48 h;C:Forskolin 48 h,c:Forskolin+激活剂25 μmol/L 48 h,cc:Forskolin+抑制剂10 μmol/L 48 h.

指标迁移数量激活剂组对照组132.3±4.16133.6±1.10抑制剂组对照组138.9±3.19133.6±1.10P0.750.056

表2 激活剂、抑制剂对Calu-3细胞迁移的影响(48 h)
**表示P<0.01,两组之间差异显著.

表3 加入激活剂或抑制剂后腺苷酸环化酶激活剂对Calu-3细胞迁移的影响(48 h)
3 讨论
本实验中采用的细胞系为高表达CFTR基因的Calu-3肺腺癌细胞,遗传背景清楚.在通常情况下,细胞的CFTR氯离子通道很少开放,通过添加激活剂,使该通道大量开放,相当于CFTR高表达;添加CFTR特异性抑制剂,使CFTR氯离子通道特异性关闭,相当于CFTR低表达.这样,就制作了相对意义上的肺腺癌上皮细胞CFTR高表达和低表达的细胞模型,进而利用该细胞模型从功能上确定CFTR是否对肺腺癌细胞迁移有影响.
划痕实验是常用的测试细胞迁移的方法.实验中,通过设立空白对照组(A549虽然是肺腺癌细胞,但无CFTR表达)、阴性对照组、激活剂组和抑制剂组来证明CFTR参与肺腺癌细胞的迁移和肿瘤的发展.
为了证明激活剂和抑制剂是针对CFTR 氯离子通道的激活剂和抑制剂,实验中首先采用A549细胞作为对照.在其培养液中添加CFTR激活剂和抑制剂后,细胞的迁移数量(分别为(132.3±4.163)个,(138.9±3.190)个)与其对照组细胞迁移数量((133.6±1.101)个)相比差异均不显著(P>0.05).该结果表明,激活剂和抑制剂是针对CFTR的激活剂和抑制剂.
有文献报道,在肿瘤的发展过程中,功能障碍的CFTR可能促进肿瘤细胞上皮功能的丢失而成为迁移和侵袭的细胞[13];CFTR高表达能够抑制乳腺癌细胞的转移[14].本实验中,25 μmol/L 激活剂组的细胞迁移数量((74.2±5.79)个)与其对照组细胞迁移数量((134.1±10.04)个)相比差异显著(P<0.01),该结果表明,添加CFTR激活剂使氯离子通道开放,能够抑制肺腺癌细胞的迁移.抑制剂组的细胞迁移数量((148.3±17.70个)与阴性对照组细胞迁移数量((134.1±10.04)个)比较,差异不显著(P>0.05),该结果表明,抑制剂不能抑制Calu-3细胞的迁移.CFTR是腺苷酸环化酶(cAMP)依赖的氯离子通道,正常情况下,细胞有少量的cAMP,能够保障该通道的生理功能.Forskolin是腺苷酸环化酶激活剂,在实验中加入该试剂可以大幅度提高cAMP的含量,保障CFTR在激活剂的作用下正常开放.为了证明上述实验结果是否是由cAMP数量变化而引起的异常,实验中设置了添加和不添加Forskolin实验来进一步说明CFTR对Calu-3细胞迁移的影响,实验结果显示,添加和不添加Forskolin两组细胞的迁移数量无显著性差异(P>0.05),从而证明细胞自身产生的cAMP能够保证细胞的迁移.另外,从理论上说,当氯离子通道关闭后,细胞的迁移速度应该加快.但是,我们的实验结果显示,CFTR氯离子通道被关闭后,细胞的迁移速度没有受到明显的影响.已有的研究证明,Calu-3细胞除了CFTR外,还表达CLC氯离子通道,而抑制剂仅关闭CFTR氯离子通道,对CLC氯离子通道转运氯离子没有影响,从而导致添加抑制剂后 Calu-3细胞的迁移没有受到影响.综上所述,添加CFTR抑制剂和添加CFTR激活剂使Calu-3细胞迁移具有显著的差异.这一结果提示,CFTR可能是肿瘤细胞迁移的一个靶点.
[1] TAKAYUKI F UKUIT,ETSUYA MITSUDOMI.Small peripheral lung adenocarcinoma:clinicopathological features and surgical treatment[J].Surg Today,2010,40:191-198.
[2] ANABELLA LLANOS,MARIANA SAVIGNANO,GABRIELA CINAT.Maintenance treatment with chemotherapy and immunotherapy in non-small cell lung cancer:a case report[J].Frontiers in Oncology,2012,10(2):1-6.
[3] RAMON ANDRADE DE MELLO,DNIA SOFIA MARQUES,RUI MEDEIROS,et al.Epidermal growth factor receptor and K-Ras innon-small cell lung cancer-molecular pathways involved and targeted therapies[J].World J Clin Oncol,2011,11(2):367-376.
[4] XUE PENG,ZHAO WU,LEI YU,et al.Overexpression of cystic fibrosis transmembrane conductance regulator(CFTR) is associated with human cervical cancer malignancy progression and prognosis[J].Gynecologic Oncology,2012,125:470-476.
[5] IN-HWAN OH,CHANGMO OH,TAI-YOUNG YOON.Association of CFTR gene polymorphisms with papillary thyroid cancer[J].ONCOLOGY LETTERS,2012(3):455-461.
[6] KIM JUNG-AE,KANG YOUNG SHIN,LEE SUN HEE,et al.Role of pertussis toxin-sensitive G-proteins in intracellular Ca2+release and apoptosis induced by inhibiting cystic fibrosis transmembrane conductance regulator(CFTR) Cl-channels in HepG2 human hepatoblastoma cells[J].Journal of Cellular Biochemistry,2001,81:93-101.
[7] LIU WEN,LU MIN,LIU BAOGANG,et al.Inhibition of Ca2+-activated Cl-channel ANO1/TMEM16A expression suppresses tumor growth and invasiveness in human prostate carcinoma[J].Cancer Letters,2012,326:41-51.
[8] ROBERT R MCWILLIAMS,GLORIA M PETERSEN,KARI G RABE,et al.Cystic fibrosis transmembrane conductance regulator(CFTR)gene mutations and risk for pancreatic adenocarcinoma[J].Cancer,2010,116(1):203-209.
[9] ANIL MEHTA.Cystic fibrosis as a bowel cancer syndrome and the potential role of CK2[J].Mol Cell Biochem,2008,316:169-175.
[10] JI WOONGSON,KIM YOUNGJIN,HYUNMIN CHO,et al.Promoter hypermethylation of the CFTR gene and clinical / pathological features associated with non-small cell lung cancer [J].Respirology,2011(6):1203-1209.
[11] LI YAFEI,SUN ZHIFU,WU YANHONG,et al.Cystic fibrosis transmembrane conductance regulator gene mutation and lung cancer risk[J].Lung Cancer,2010,70:14-21.
[12] ALLAN B J,IZUTSUK T,RAMSEY B W,et al.Cyclic nucleotide responses in control and cystic fibrosis labial glands[J].American Journal of Physiology,1990,258:1320-1326.
[13] FARIA D,SCHREIBER R,KUNZELMANN K.CFTR is activated through stimulation of purinergic P2Y2 receptors[J].Pflugers Archiv,2009,457:1373-1380.
[14] ZHANG W,PENMATSA H,REN A,et al.Functional regulation of cystic fibrosis transmembrane con-ductance regulator-containing macromolecular complexes:a small-mole-cule inhibitor approach[J].Biochemical Journal,2011,435:451-462.
(责任编辑:方 林)
The migration role of CFTR in Calu-3 cell line of lung adenocarcinoma
LI Ya-qiu1,SU Xiao-wei2,HUANG Sun-hui1,XU Dong-ming1,HAO Jia-nan1,HAO Li-ming2
(1.Department of Anatomy,Jilin Medical College,Jilin 132013,China;2.School of Basic Medical Sciences,Jilin University,Changchun 130021,China)
Calu-3 were cultured by conventional method in this paper,and the optimal concentrations of activator and inhibitor of cystic fibrosis transmembrane conductance regulator were determined by MTT and CCK-8 method,the optimal concentrations of the CFTR activator(Genistein) and inhibitor(CFTRinh-172) were added to the cell,detected the migration of cultured Calu3 cells by scratch test in 48 h.The following results were obtained:The optimal concentrations of activator were 25 μmol/L.The optimal concentrations of inhibitor were 10 μmol/L.The results of scratch tests showed that there was significant difference(P=0.00<0.01) between the number of cell migration of activator(25 μmol/L) group(74.2±5.79) and the number of cell migration of control group(134.1±10.04).There was no significant difference(P=0.27>0.05) between the number of cell migration of inhibitor(10 μmol/L) group and the number of cell migration of control group(134.1±10.04).Activator(Genistein) inhibited the migration of lung adenocarcinoma cells by making the CFTR chloride ion channels open.
CFTR;Calu-3 cell;migration
1000-1832(2016)04-0116-05
10.16163/j.cnki.22-1123/n.2016.04.025
2016-04-11
吉林省科技发展计划项目(20100920).
李亚秋(1988—),女,硕士,助教;通讯作者:郝利铭(1964—),男,博士,教授,主要从事人体解剖与组织胚胎学研究.
Q 279 [学科代码] 180·2110
A
