胃肠道间质瘤影像表现及免疫组化分析
2016-12-29孙雪莲
孙雪莲
(辽宁省沈阳市第二中医医院放射科,辽宁 沈阳 110101)
胃肠道间质瘤影像表现及免疫组化分析
孙雪莲
(辽宁省沈阳市第二中医医院放射科,辽宁 沈阳 110101)
目的:分析胃肠道间质瘤(gastro intestinal stromal tumors,GIST)的CT及MRI表现特征,探讨其诊断价值。方法:回顾性分析21例经术后病理及免疫组化证实为GIST患者的临床及影像学资料。21例中,8例行MRI检查,13例行MSCT检查。结果:单发17例,其中发生于胃6例,小肠、结肠11例;胃肠道及系膜多发4例。肿块呈类圆形或分叶状,CT示肿块密度不均,以坏死、囊变多见,静脉期强化较动脉期明显。MRI表现为平扫病灶T1WI呈低或稍低信号,信号欠均匀,T2WI呈混杂信号影,病灶边缘可见长T1、短T2信号包膜;增强扫描呈不均匀显著强化。本组DOG1阳性20例,CD117阳性19例,CD34阳性17例。结论:CT及MRI检查可明确GIST的诊断,显示肿块大小及与其周围组织结构关系,结合免疫组化DOG1、CD117和CD34等弥漫性阳性表达,可成为术前评估及术后随访或疗效评估的有效手段。
胃肠道间质肿瘤;体层摄影术,X线计算机;磁共振成像;免疫组织化学
胃肠道间质瘤(gastro intestinal stromal tumors,GIST)是消化道最常见的间叶组织源性肿瘤[1]。以往GIST常归类于平滑肌及神经源性肿瘤,但随着免疫组织化学及分子生物学的发展,重新被定义为发生于胃肠道、网膜及肠系膜上,以瘤细胞过度表达CD117和CD34为特点的间叶性肿瘤[2]。GIST无绝对的良性表现,而是根据生物学行为进行危险度分级,可发生于任何年龄,人群总发病率为14.5/100万[3]。现回顾性分析我院2008年1月至2013年12月21例经术后病理及免疫组化证实为GIST的临床及影像学资料,总结影像学特征,了解免疫组化及生物学行为,以提高对本病认识及诊断水平。
1 资料与方法
1.1 一般资料本组21例,男15例,女6例;年龄33~67岁,平均50岁。临床多表现为腹痛、腹部包块、便血等。8例行MRI检查,13例行MSCT检查。1.2仪器与方法
1.2.1 影像检查CT扫描采用Siemens 16排CT,检查前12h禁食,检查前30min口服清水500~600mL,检查前再口服500 mL,充盈胃肠道。常规仰卧位,扫描范围从膈顶至耻骨联合水平,平扫后行全腹3期增强扫描,高压注射器经肘静脉注射对比剂碘海醇80~100 mL,流率3.0 mL/s,动脉期延迟25~30 s,静脉期延迟65~70 s,延迟期90 s。扫描层厚5 mm,重建层厚2 mm。将数据传入工作站进行后处理。
MRI扫描采用GE公司1.5 T超导型MRI扫描仪,腹盆腔相控线圈,行FSE T1WI和T2WI,以及T1WI、T2WI加脂肪抑制轴位、冠状位扫描;之后经肘静脉注射Gd-DTPA 20 mL后行FS T1WI动脉期及静脉期扫描。
所得影像资料由高年资影像学医师阅片,分析肿瘤的部位、大小、形态、密度及周围组织关系、有无转移、强化方式等。
1.2.2 免疫组化方法21例标本常规HE染色,光镜观察。免疫组化均采用Envision法,检测DOG1、CD117、CD34、SMA、S-100等各项指标。
1.3 肿瘤危险程度判定根据Fletcher原则判定肿瘤危险程度[4]:直径<2 cm,核分裂数<5个/50 HPF提示危险度极低;直径2~5 cm,核分裂数<5个/50 HPF提示低度危险;直径<5 cm,核分裂数6~10个/50 HPF或5~10 cm,核分裂数<5个/50 HPF则为中度危险;直径>5 cm且核分裂数>5个/50 HPF或直径>10 cm或核分裂数>10个/50 HPF视为高度危险组。
2 结果
本组21例,单发17例,其中发生于胃6例,小肠、结肠11例;胃肠道及系膜多发4例。
2.1 CT表现13例病灶均呈软组织密度影,类圆形或分叶状。6例体积较小,最大径<5 cm,边界清楚,密度均匀,增强扫描呈均匀强化;7例体积较大,病变不规则,最大径>5 cm,边界清楚2例,边界不清5例,邻近肠管受挤压,密度不均匀,增强扫描肿块实性部分中度或明显强化(图1),静脉期持续强化,强化程度明显高于动脉期,见无强化的坏死、囊变区。3例为小肠及肠系膜多发病灶。3例见肠系膜种植性转移;2例肝脏见转移病灶。
2.2 MRI表现8例病灶呈类圆形分叶状肿块。1例体积较小,最大径<5 cm;7例体积较大,最大径>5 cm。平扫病灶T1WI、T2WI信号不均匀(图2),T1WI呈低或稍低信号影,部分出现斑片状、絮状短T1信号影,T2WI呈高或稍高信号。病灶边缘可见低信号包膜。增强扫描呈不均匀强化,延迟期强化更明显。3例肝脏转移。
2.3 免疫组织化学特征本组21例中,DOG1阳性表达率95.2%(20/21),CD117阳性表达率90.5%(19/ 21),CD34阳性表达率81.0%(17/21),SMA阳性表达率14.3%(3/21),S-100阳性表达率9.5%(2/21)。
3 讨论
GIST起源于胃肠道Cajal细胞或向ICC分化的幼稚间充质细胞[4]。组织学上主要由梭形细胞或上皮细胞组成,免疫表型上常有CD117、CD34阳性表达[6]。本组中DOG1阳性率95.2%,高于CD117阳性率90.5%。DOG1基因是最新应用于基因表达于GIST的基因,是一敏感性、特异性较高的标志物。Espinosa等[7-10]研究表明,DOG1具有更高的敏感性和特异性抗体,与CD117和CD34相比较总体敏感性要高。目前GIST的诊断仍依靠组织形态学及免疫组化检测。本组DOG1阳性20例,CD117阳性19例,CD34阳性17例。Kima等[11]报道,36例直径≤5 cm的肿瘤患者中,未发现有别于良性GIST的CT征象,但其中仍有28%为恶性。良性GIST偶尔也发生复发和转移,虽较大肿瘤及高核分裂象常提示恶性间质瘤,但较小肿瘤和低核分裂象并不完全预示良性生物学特性。
GIST主要与消化道平滑肌肿瘤、胃肠道神经源性肿瘤鉴别[12]。平滑肌肿瘤多见于食管,多向腔内生长,出血、坏死及囊变较少见,恶性者可见出血、坏死、囊变等。间质瘤以胃肠道多见,多向腔外生长,也可向腔内生长,多为恶性,坏死、囊变多见。GIST大多CD117和CD34弥漫性阳性表达,SMA不表达或局灶性表达,而平滑肌瘤或肉瘤CD117和CD34阴性表达,SMA弥漫性阳性表达。胃肠道神经鞘瘤S-100弥漫性阳性表达,CD117和CD34阴性表达,而GIST中仅少部分患者有S-100表达。
GIST的MSCT及MRI表现具有一定特征性,以外生性肿块多见,较大肿瘤易出现坏死、囊变、出血,增强扫描后呈均匀或不均匀明显强化,以静脉期及延迟期强化明显,钙化少见,这是GIST的显著特征,但无特异性[13-14]。MRI能显示肿瘤有无出血,较清楚地显示肿块与周围组织的关系、有无组织结构直接浸润、有无器官转移等,对治疗方案的选择及预后评估有重要意义。联合免疫组织化学,特别是在与其他胃肠道肿瘤鉴别困难时,CD117、CD34的阳性表达,可弥补CT与MRI的不足。

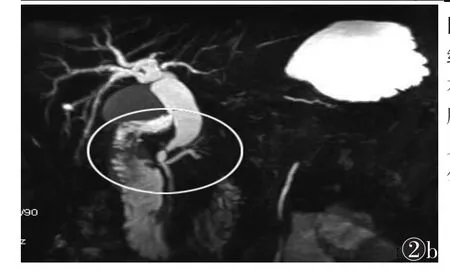
图1 女,65岁,下腹疼痛6个月,小肠多发间质瘤图1aCT平扫示右下腹部见一软组织肿块,边界清楚;左下腹部见一囊实混合性肿块,形态不规则图1b增强扫描示右下腹部肿块明显不均匀强化,左下腹部肿块实性部分明显强化图2男,61岁,右上腹部不适,十二指肠降段间质瘤图2aMRI T2压脂序列示十二指肠降段壁明显增厚,见不规则形稍长T2信号影,边界欠清图2b增强扫描静脉期十二指肠降段肿物明显均匀强化
[1]Downs-Kelly E,Rubin BP.Gasteointestinal stromal tumors:Molecular mechanisms and targeted therapies[J].Patholog Res Int,2011:708596.
[2]Fletcher CD,Berman JJ,Corless C,et a1.Diagnosis of gastrointestinalstromal tumors:A consensus approach[J].Hum Pathol,2002,10121:459-465.
[3]顾雪梅,盛剑秋,孙曦.腔外型胃肠间质瘤的螺旋CT诊断价值[J].医学影像学杂志,2008,18(9):1029-1032.
[4]Fletcher CD,Berman JJ,Corless C,et al.Diagnosis of gastrointestinal stromal tumors:A consensus approach[J].Human Pathol,2002,33:459-465.
[5]Corless,Barnett CM,Heinrich MC.Gastrointestinal stromal tumors:origin and molecular oncology[J].Nat Rev cancer,2011,11:865-878.
[6]赵文娣,祁义军,王岳军,等.胃肠道间质瘤临床病理及免疫组化表达的分析[J].安徽医科大学学报,2012,47(4):454-457.
[7]Espinosa I,Lee CH,Kim MK,et al.A novel monoclonal antibody against DOG1 is a sensitive and specific marker for gastrointestinal stromal tumors[J].Am J Surg Pathol,2008,32:210-218.
[8]Miettinen M,Wang ZF,Lasota J.DOG1 antibody in the differential diagnosis of gastrointestinal stromal tumors:a study of 1840 cases[J].Am J Surg Pathol,2009,33:1401-1408.
[9]Ardeleanu C,Arsene D,Hinescu M,et al.Pancreatic expression of DOG1:a novel gastrointestinal stromal tumor(GIST)biomarker[J].Appl Immunohistochem Mol Morphol,2009,17:413-418.
[10]Liegl B,Hornick JL,Corless CL,et al.Monoclonal antibody DOG1.1 shows higher sensitivity than KIT in the diagnosis of gastrointestinal stromal tumors,including unusual subtypes[J]. Am J Surg Pathol,2009,33:437-446.
[11]Kima HC,Leea JM,Kima KW,et al.Gastrointesinal stromal tumors of the stomach:CT findings and prediction of malignancy[J].AJR Am J Roentgenol,2004,183:893-898.
[12]吴俊,王大勇,赵改萍,等.经腹超声和MSCT对胃肠间质瘤诊断价值的比较研究[J].中国中西医结合影像学杂志,2015,13(6):633-635,639.
[13]王一飞,殷保兵,马金保.胃肠道间质瘤诊治进展[J].国外医学:外科学分册,2004,31(3):176-179.
[14]周健春,傅引弟.螺旋CT对小肠间质类肿瘤的诊断价值[J].中国CT和MRI杂志,2004,3(1):41-43.
2015-07-30)
10.3969/j.issn.1672-0512.2016.02.027
孙雪莲,E-mail:915832805@qq.com。
