新型1,1-二氧代苯并异噻唑化合物的合成
2016-12-27翟娇娇江健安冀亚飞
翟娇娇,江健安,冀亚飞
·研究论文·
新型1,1-二氧代苯并异噻唑化合物的合成
翟娇娇,江健安*,冀亚飞*
(华东理工大学 药学院,上海 200237)
以Pd(OAc)2为催化剂,PhI(OAc)2为氧化剂,脂肪酸为溶剂,于100 ℃首次实现了1,1-二氧代苯并异噻唑导向的C(sp3)—H和C(sp2)—H活化/酰氧基化或羟基化反应,合成了10个新型的1,1-二氧代苯并异噻唑类化合物,其结构经1H NMR,13C NMR和HR-MS(ESI)[或 HR-MS(EI)]表征。
钯催化;1,1-二氧代苯并异噻唑;C(sp3)—H活化;C(sp2)—H活化;酰氧基化;羟基化;合成
1,1-二氧代苯并异噻唑化合物具有多种生物活性,可以作为潜在的丙型肝炎病毒NS5b抑制剂[1]、激酶抑制剂[2]、蛋白质法尼基转移酶(PFT)抑制剂[3],同时也是构建多样性杂环化合物的重要合成子[4-6]。因此,该类化合物的合成具有重要意义。相比传统的方法,以1,1-二氧代苯并异噻唑为定位基团,过渡金属催化的C—H活化/官能化是合成此类化合物的最佳途径。然而,1,1-二氧代苯并异噻唑(硫酰基降低了氮原子的电子密度,使其与过渡金属的配位能力较弱,成为弱的定位基)导向的C—H活化/官能化研究较少,仅仅局限于C(sp2)—H活化/烯基化反应[7-10]。
本文尝试以定位能力较弱的1,1-二氧代苯并异噻唑为定位基,对尚未报道的C(sp3)—H活化/酰氧基化反应展开探索,发展了Pd(OAc)2-PhI(OAc)2的催化氧化体系,以1,1-二氧代3-叔丁基苯并异噻唑(1a)为底物在不同的脂肪酸溶剂中于100 ℃反应24 h,高效合成了5个新型的1,1-二氧代苯并异噻唑类化合物(2a~2e),收率 78%~89%(Scheme 1)。这种高效的反应体系被扩展到C(sp2)—H活化/酰氧基化反应中,以1,1-二氧代3-苯基苯并异噻唑(3a)为反应底物,不同酸为溶剂,以74%~86%的收率高效合成了1,1-二氧代3-(2-酰氧基或羟基取代的苯基)苯并异噻唑化合物(4a~4c,Scheme 2);以1,1-二氧代3-芳基苯并异噻唑(3d和3e)为反应底物,三氟乙酸为溶剂,分别以85%和76%的收率高效合成了1,1-二氧代3-(2-羟基取代的芳基)苯并异噻唑化合物(4d和4e,Scheme 2)。2a~2e和4a~4e为新化合物,其结构经1H NMR,13C NMR和HR-MS(ESI)或[HR-MS(EI)]表征。首次实现了1,1-二氧代苯并异噻唑导向的芳基C(sp2)—H活化/酰氧基化或羟基化反应。
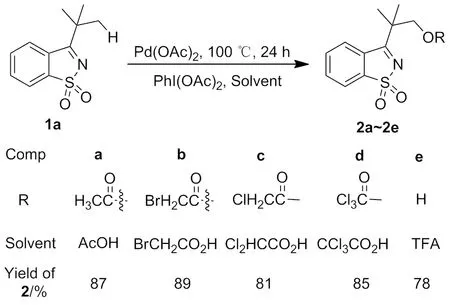
Scheme 1

Scheme 2
1 实验部分
1.1 仪器与试剂
XT4A型显微熔点仪(温度未校正);Bruker AVANCE 400型核磁共振仪(CDCl3为溶剂,TMS为内标);QSTAR Pulsar I LC/TOF型和MSLC/TOP MS型质谱仪。
1a和3a,3d和3e按文献[11-12]方法合成;硅胶200~300目,青岛海洋化工厂;GF254硅胶板,烟台江友硅胶开发有限公司;Pd(OAc)2和PhI(OAc)2,萨恩化学技术(上海)有限公司;其余所用试剂均为化学纯或分析纯。
1.2 合成
(1) 2a~2e和4a~4e的合成(以2a为例)
在反应瓶中依次加入1a 111.5 mg(0.5 mmol)、醋酸钯11.3 mg(0.05 mmol)、二醋酸碘苯322.0 mg(1.0 mmol)和乙酸2 mL,升温至100 ℃,反应24 h。冷却至室温,缓慢加入饱和碳酸氢钠溶液15 mL,调至pH 8~9,用二氯甲烷(3×20 mL)萃取,合并有机层,用水(3×60 mL)洗涤,分液,有机层用无水硫酸钠干燥,过滤,滤液浓缩,所得粗产物经硅胶柱层析(洗脱剂:A=乙酸乙酯/石油醚=1/15,V/V)纯化得2a。
用类似方法合成2b~2e和4a~4e。
2a:白色固体,收率87%,m.p.128~130 ℃;1H NMRδ:1.56(s,6H,CH3),2.03(s,3H,CH3),4.43(s,2H,OCH2),7.69~7.76(m,2H,ArH),7.91~7.96(m,2H,ArH);13C NMRδ:20.7,23.7 (2C),42.3,69.9,123.0,126.1,129.6,133.2,133.7,140.9,170.7,178.2;HR-MS(ESI)m/z:Calcd for C13H15NO4SNa{[M+Na]+}304.061 9,found 304.061 4。
2b:白色固体,收率89%,m.p.82~84 ℃;1H NMRδ:1.60(s,6H,CH3),3.82(s,2H,BrCH2),4.52(s,2H,OCH2),7.27~7.75(m,2H,ArH),7.91~7.95(m,2H,ArH);13C NMRδ:23.5 (2C),25.3,42.2,71.3,123.0,126.1,129.4,133.3,133.7,140.9,167.0,177.7;HR-MS(ESI)m/z:Calcd for C13H14NO4SBrNa{[M+Na]+}381.972 5,found 381.972 0。
2c:黄色油状液体,收率81%;1H NMRδ:1.62(s,6H,CH3),4.60(s,2H,OCH2),5.95(s,1H,CHCl2),7.71~7.78(m,2H,ArH),7.90~7.98(m,2H,ArH);13C NMRδ:23.3,29.7,42.2,64.0,72.3,123.1,126.0,129.2,133.4,133.8,140.8,164.2,177.4;HR-MS(ESI)m/z:Calcd for C13H13NO4SCl2Na{[M+Na]+}371.984 0,found 371.983 5。
2d:黄色油状液体,收率85%;1H NMRδ:1.66(s,6H,CH3),4.67(s,2H,OCH2),7.74~7.78(m,2H,ArH),7.92~7.98(m,2H,ArH);13C NMRδ:14.1,23.2,29.7,42.2,74.0,123.1,126.0,129.1,133.5,133.8,140.8,161.6,177.1;HR-MS(ESI)m/z:Calcd for C13H13NO4SCl3{[M+H]+}383.963 1,found 383.963 0。
2e:黄色油状液体,收率78%;1H NMRδ:1.17(s,6H,CH3),3.44(d,J=4.8 Hz,2H,OCH2),5.18(s,1H,OH),7.39(d,J=7.6 Hz,1H,ArH),7.56(t,J=7.6 Hz,1H,ArH),7.61(t,J=7.6 Hz,1H,ArH),7.93(d,J=7.6 Hz,1H,ArH);13C NMRδ:22.4 (2C),48.9,51.8,125.3,129.4,130.4,133.0,136.0,138.3,206.9;HR-MS(EI)m/z:Calcd for C11H13NO3S[M+]239.061 6,found 239.061 5。
4a:黄色固体,收率74%,m.p.104~106 ℃;1H NMRδ:2.20(s,3H,CH3),7.33~7.36(m,1H,ArH),7.44~7.49(m,1H,ArH),7.63~7.74(m,4H,ArH),7.75~7.80(m,1H,ArH),7.99(d,J=7.6 Hz,1H,ArH);13C NMRδ:20.8,122.9,123.4,124.0,126.1,126.3,129.9,130.8,133.4,133.6,133.8,140.1,148.9,169.0,169.3;HR-MS(EI)m/z:Calcd for C15H11NO4S[M+]301.040 9,found 301.040 7。
4b:黄色油状液体,收率86%;1H NMRδ:1.71 (d,J=6.8 Hz,3H,CH3),4.53(q,J=6.8 Hz,1H,CHCl),7.39(d,J=7.2 Hz,1H,ArH),7.50(t,J=7.2 Hz,1H,ArH),7.62~7.80(m,5H,ArH),7.97(d,J=7.2 Hz,1H,ArH);13C NMRδ:21.0,52.2,122.9,123.2,123.7,126.5,126.7,130.1,130.7,133.6,133.8,134.0,140.0,148.4,168.2,168.7;HR-MS(EI)m/z:Calcd for C16H12NO4SCl[M+]349.017 6,found 349.017 3。
4c:黄色固体,收率82%,m.p.128~130 ℃;1H NMRδ:7.07~7.20(m,2H,ArH),7.56~7.61(m,1H,ArH),7.77~7.85(m,2H,ArH),8.02~8.05(m,2H,ArH),8.15~8.18(m,1H,ArH),10.39(s,1H,OH);13C NMRδ:114.6,119.2,120.1,123.2,127.6,130.4,130.6,133.8 (2C),136.5,139.5,161.1,169.0;HR-MS(EI)m/z:Calcd for C13H9NO3S[M+]259.030 3,found 259.030 4。
4d:黄色固体,收率85%,m.p.182~184 ℃;1H NMRδ:2.43 (s,3H,CH3),6.89~6.92(m,1H,ArH),7.00(s,1H,ArH),7.76~7.84(m,2H,ArH),7.95(d,J=7,6 Hz,1H,ArH),8.02~8.05(m,1H,ArH),8.16~8.19(m,1H,ArH),10.58(s,1H,OH);13C NMRδ:22.1,112.1,119.4,121.6,123.1,127.6,130.2,130.8,133.7 (2C),139.5,148.7,161.5,168.6;HR-MS(EI)m/z:Calcd for C14H11NO3S[M+]273.046 0,found 273.045 9。
4e:黄色油状液体,收率76%;1H NMRδ:2.41(s,3H,CH3),7.09(d,J=8.4 Hz,1H,ArH),7.40(d,J=8.4 Hz,1H,ArH),7.79~7.85(m,3H,ArH),8.04(d,J=7.2 Hz,1H,ArH),8.17(d,J=7.2 Hz,1H,ArH),10.20(s,1H,OH);13C NMRδ:20.7,114.3,119.1,123.2,127.7,129.4,129.9,130.7,133.7 (2C),137.6,139.6,159.1,168.9;HR-MS(EI)m/z:Calcd for C14H11NO3S[M+]273.046 0,found 273.045 9。
2 结果与讨论
2.1 反应条件优化
为了寻找1,1-二氧代苯并异噻唑类化合物的最佳合成条件,以合成2a为例,考察催化剂和氧化剂对2a收率的影响。
(1) 催化剂和氧化剂
1a 0.5 mmol,其余反应条件同1.2(1),考察催化剂和氧化剂对2a收率的影响,结果见表1。由表1可见,以PhI(OAc)2为氧化剂,2a的分离收率达到87%(No.1),其他的氧化剂效果较差(No.1~6)。当使用其他的催化剂,如(PPh3)2PdCl2、[C(CH3)3P]2Pd、[Pd(allyl)Cl]2、PdCl2、PdCl2(dppf)和[RhCpCl2]2,反应效果均不如Pd(OAc)2(No.7~12)。随后,我们对催化剂的用量进行研究,发现Pd(OAc)2的用量为0.08 eq.时,2a的收率降低至78%(No.13),Pd(OAc)2的用量为0.15 eq.时,2a的收率没有提高(No.14)。当PhI(OAc)2的用量为1.5 eq.或3.0 eq.时,反应收率均降低,说明氧化剂的增加或减少都会给反应带来负面影响。
综上所述,合成2a的最佳反应条件为:Pd(OAc)2用量为0.1 eq.,PhI(OAc)2用量为2.0 eq.,乙酸为溶剂,于100 ℃反应24 h,收率可达87%。
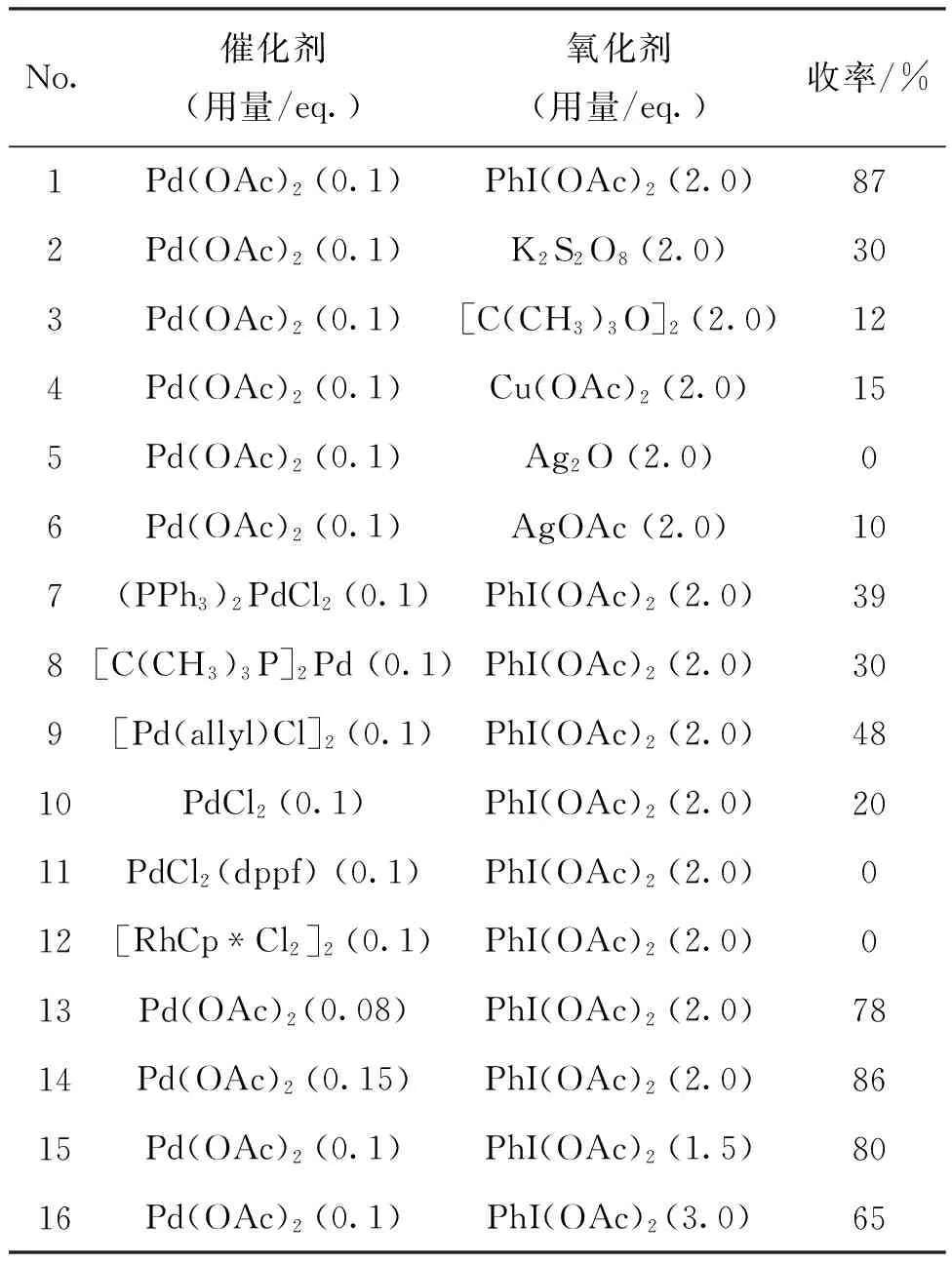
表1 催化剂和氧化剂对收率的影响*
*1a 0.5 mmol,其余反应条件同1.2(1)。
2.2 底物拓展
在最佳反应条件下进行底物拓展(Scheme 1)。可以看出,以1a为底物,乙酸、溴乙酸、二氯乙酸、三氯乙酸为溶剂,合成了酰氧基化产物 2a~2d,收率81~89%;以三氟乙酸为溶剂,三氟乙酰氧基化产物在三氟乙酸的强酸性条件下原位发生分解,合成了羟基化产物2e,收率78%。由Scheme 2可见,3a分别在乙酸、2-氯丙酸中反应,得到了酰氧基化产物4a和4b,收率分别为74%和86%;以三氟乙酸为溶剂时,3a、3d和3e,分别转化为相应的羟基化产物4c、4d和4e,收率为76%~85%。说明该反应具有很好的底物适用性。
2.3 反应机理
以2a的合成为例阐述反应机理(Scheme 3):(1)底物1a与Pd(OAc)2通过环钯化反应,生成环状的二价钯A,实现了定向的C(sp3)—H活化;(2)A与PhI(OAc)2经氧化加成生成环状的四价钯B;(3)B经还原消除构建C—O键生成2a,同时释放出Pd(OAc)2。

Scheme 3
以Pd(OAc)2为催化剂,PhI(OAc)2为氧化剂,脂肪酸为溶剂,反应温度为100 ℃,合成了10个新型的1,1-二氧代苯并异噻唑类化合物(2a~2e和4a~4e)。合成2a的最佳反应条件为:Pd(OAc)2用量为0.1 eq.,PhI(OAc)2用量为2.0 eq.,乙酸为溶剂,于100 ℃反应24 h,收率可达87%。首次实现了1,1-二氧代苯并异噻唑导向的C(sp3)—H和C(sp2)—H活化/酰氧基化或羟基化反应。
[1] Hendricks R T,Spencer S R,Blake J F,etal.3-Hydroxyisoquinolines as inhibitors of HCV NS5b RNA-dependent RNA polymerase [J].Bioorg Med Chem Lett,2009,19(2):410-414.
[2] Elsayed M S A,EI-Araby M E,Serya R A T,etal.Structure-based design and synthesis of novel pseudosaccharine derivatives as antiproliferative agents and kinase inhibitors [J].Eur J Med Chem,2013,61:122-131.
[3] Clerici F,Gelmi M L,Yokoyama K,etal.Isothiazole dioxides:Synthesis and inhibition of trypanosoma brucei protein farnesyltransferase [J].Bioorg Med Chem Lett,2002,12(16):2217-2220.
[4] Nishira T,Noishiki A,Tsui G C,etal.Asymmetric synthesis of (triaryl) methylamines by rhodium-catalyzed addition of arylboroxines to cyclicN-sulfonyl ketimines [J].J Am Chem Soc,2012,134(11):5056-5059.
[5] Yang G,Zhang W.A palladium-catalyzed enantioselective addition of arylboronic to cyclic ketimines [J].Angew Chem Int Ed,2013,52(29):7540-7544.
[6] Feng X,Zhou Z,Ma C,etal.Trienamines derived from interrupted cyclic 2,5-dienones:Remote C=C bond activation for asymmetric inverse-electron-demand Aza-Diels-Alder reaction [J].Angew Chem Int Ed,2013,52(52):14173-14176.
[7] Nishimura T,Ebe Y,Hayashi T.Iridium-catalyzed [3+2] annulation of cyclicN-sulfonyl ketimines with 1,3-dienesviaC—H activation [J].J Am Chem Soc,2013,135(6):2092-2095.
[8] Dong L,Qu C H,Huang J R,etal.Rhodium-catalyzed spirocyclic sultam synthesis by [3+2] annulation with cyclicN-sulfonyl ketimines and alkynes [J].Chem Eur J,2013,19(49):16537-16540.
[9] Zhang Q R,Huang J R,Zhang W,etal.Highly functionalized pyridines synthesis fromN-sulfonyl ketimines and alkynes using the N—S Bond as an internal oxidant [J].Org Lett,2014,16(6):1684-1687.
[10] Wang N J,Mei S T,Shuai L,etal.Aerobic oxidative C—H olefination of cyclicN-sulfonyl ketimines catalyzed by a Rhodium catalyst [J].Org Lett,2014,16(11):3040-3043.
[11] Oppolzer W,Kingma A J,Pillai S K.Enantiomerically pure isoxazolines via addition of nitrile oxides to chiralN-acryloyl toluene-2,a-sultams [J].Tetrahedron Lett,1991,32(37):4893-4896.
[12] Ahn K H,Ham C,Kim S,etal.Practical synthesis of chiral sultam auxiliaries:3-Substituted-1,2-benzisothiazoline 1,1-dioxides [J].J Org Chem,1997,62(20):7047-7048.
Synthesis of Novel Benzo[d]isothiazole 1,1-Dioxide Compounds
ZHAI Jiao-jiao,JIANG Jian-an*,JI Ya-fei*
(School of Pharmacy,East China University of Science and Technology,Shanghai 200237,China)
Ten novel benzo[d]isothiazole 1,1-dioxides were synthesized in aliphatic acids at 100 ℃viaPd(OAc)2-catalyzed C(sp3)—H and C(sp2)—H activation/acyloxylation or hydroxylation,using PhI(OAc)2as oxidant.The structures were characterized by1H NMR,13C NMR and HR-MS(ESI)[or HR-MS(EI)].
palladium-catalysis;benzo[d]isothiazole 1,1-dioxide;C(sp3)—H activation;C(sp2)—H activation;acyloxylation;hydroxylation;synthesis
2016-03-21;
2016-09-20
国家自然科学基金资助项目(21176074,21476074);博士点基金资助项目(20130074110009)
翟娇娇(1987-),女,汉族,安徽淮北人,博士研究生,主要从事杂环化合物的合成与应用研究。 E-mail:zhaijiaojiao438571@163.com
江健安,博士,E-mail:jjajxah@163.com;冀亚飞,教授,Tel.021-64253314,E-mail:jyf@ecust.edu.cn
O626.25;O621.3
A
10.15952/j.cnki.cjsc.1005-1511.2016.12.16079
