补阳还五汤联合依达拉奉对脑缺血再灌注损伤后神经细胞凋亡的影响
2016-12-24钟芳芳吴承龙孙新芳章燕幸
钟芳芳 吴承龙 孙新芳 章燕幸
补阳还五汤联合依达拉奉对脑缺血再灌注损伤后神经细胞凋亡的影响
钟芳芳 吴承龙 孙新芳 章燕幸
目的 研究补阳还五汤联合依达拉奉对小鼠脑缺血再灌注损伤后神经细胞凋亡及Bcl-2、Bax和Caspase-3表达的影响。方法 将50只小鼠随机分为假手术组、模型组、补阳还五汤组、依达拉奉组和两药联用组,每组10只,其中缺血再灌注后1d和7d各5只。首先制备小鼠大脑中动脉缺血模型,TUNEL法观察神经细胞凋亡指数(AI),免疫组化法观察小鼠大脑皮质神经元Bcl、Bax-2和Caspase-3表达阳性细胞数。结果 与模型组比较,补阳还五汤组、依达拉奉组、两药联用组小鼠脑神经细胞AI值均明显降低(P<0.05),Bcl-2/Bax比值明显升高(P<0.05),Caspase-3表达阳性细胞数明显减少(P<0.05),其中又以两药联用组更为明显(P<0.05)。结论 两药联用能降低脑缺血再灌注损伤后神经细胞的凋亡,降低促凋亡基因Caspase-3的表达,协同发挥脑保护作用。
补阳还五汤 依达拉奉 脑缺血再灌注 细胞凋亡 Caspase-3 Bcl-2/Bax
【 Key words】 Buyang Huanwu decoction Edaravone Cerebral ischemia reperfusion Cellular apoptosis Caspase-3 Bcl-2/Bax
缺血性脑血管病具有高发病率、高病死率和高致残率等特点,其发病机制是一个多环节、多系统反应的结果,而减轻脑缺血半暗带区的神经元凋亡是治疗关键[1]。本研究采用补阳还五汤联合依达拉奉作用于小鼠脑缺血模型,观察两药联用对脑缺血再灌注损伤后神经元细胞凋亡及Caspase-3、Bcl-2和Bax凋亡蛋白表达的影响,以进一步探讨其神经保护作用的机制。
1 材料和方法
1.1 实验动物 8月龄C57BL/6型雄性小鼠,体重25~30g,由上海西普尔必凯实验动物有限公司提供,合格证号:scxk(沪)2008-0016。实验前饲养观察3 d,将造模成功的50只小鼠以随机数字法分成假手术组、模型组、补阳还五汤组、依达拉奉组和两药联用组,每组10只,其中缺血再灌注后1d和7d各5只。
1.2 药品和试剂 依达拉奉注射液(南京先声东元制药有限公司);补阳还五汤(绍兴市人民医院制剂室提供,由黄芪120g、当归6g、川芎3g、地龙3g、赤芍5g、红花3g和桃仁3g组成,水煎、浓缩后生药含量为2.0g/ ml)。氯化三苯基四氮唑(中国医药集团上海化学试剂公司);TUNEL凋亡试剂盒(美国Boehringer Manmbeim公司生产,购自福州迈新生物公司);免疫组化染色试剂盒:Bcl-2(批号20070223),Bax(批号20070223),Caspase-3(批号20070227),均购自武汉博士德生物工程有限公司;DAB试剂盒(购自北京中山试剂公司)。
1.3 小鼠大脑中动脉缺血再灌注模型的建立 参照改良的Longa-Zea线栓法[2]制作小鼠大脑中动脉缺血再灌注模型。缺血90min后,拔出线栓再灌注。假手术组仅分离右侧颈总动脉并离断右颈外动脉,不予栓塞。术后2 h采用神经功能评分验证造模是否成功,即造模动物出现右侧Horner征和左侧以上肢为重的偏瘫作为动物模型成功的判定标准,剔除不符合标准或死亡的动物,并随机补充。造模成功率为90%。
1.4 给药方式 补阳还五汤组于术后2h灌服补阳还五汤,按10ml/kg给药;依达拉奉组于术后2h尾静脉注射依达拉奉,按3mg/kg给药;两药联用组于术后2h分别给予等剂量补阳还五汤灌胃和依达拉奉尾静脉注射;模型组和假手术组均给予等量0.9%氯化钠溶液灌胃和尾静脉注射;首次给药后,每天1次,连续7d。
1.5 标本制作 小鼠在脑缺血再灌注1d和7d后,经10%水合氯醛深度麻醉(600mg/kg),迅速打开胸腔,暴露心脏,剪开右心房,于心尖部剪开左心室,插管至主动脉,快速注入150ml甲醛灌注固定,断头取脑,沿视交叉后缘做冠状切片,常规石蜡包埋,做5μm连续切片用于凋亡与免疫组化检测。
1.6 凋亡细胞检测 采用TUNEL法检测凋亡神经细胞。(1)切片常规脱蜡至水,滴加蛋白酶K室温消化20min;(2)微波修复抗原5min后自然冷却;(3)滴加TUNEL反应液,37℃孵育1h;(4)滴加辣根过氧化物酶标抗荧光素抗体工作液,37℃孵育30min;(5)用DAB显色剂呈色;(6)常规脱水、透明、封片。在光镜下观察,细胞核中有棕黄色颗粒者为阳性细胞。计算凋亡指数(AI),AI=凋亡细胞数/总细胞数×100%。
1.7 免疫组化染色 切片常规脱蜡至水,滴加3% H2O2孵育10min;微波修复抗原10min自然冷却至室温;滴加10%正常山羊血清,室温封闭30min;分别滴加兔抗Bcl-2、兔抗Bax和兔抗Caspase-3抗血清,4℃孵育24h;滴加二抗工作液(山羊抗兔)室温反应15min;滴加辣根酶标记卵白素工作液,室温反应15min;DAB显色剂呈色;梯度脱水、中型树脂封片。在光镜下观察,细胞质有棕黄色颗粒者为阳性细胞;并计算阳性染色神经细胞的数目。
1.8 图像处理 取每只小鼠2张切片,置于光镜下,随机选择梗死灶周边区5个视野,分别分析神经细胞AI、Bcl-2/Bax和Caspase-3阳性细胞百分数。
1.9 统计学处理 使用SPSS17.0统计软件,计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。
2 结果
2.1 各组小鼠脑缺血再灌注1d和7d后神经细胞AI值 脑缺血再灌注1d和7d后,模型组和各用药组神经细胞AI值均高于假手术组(P<0.01)。同一时间点,各用药组神经细胞AI值均明显低于模型组(P<0.05),两药联用组均低于其他用药组(P<0.05),依达拉奉组与补阳还五汤组比较差异无统计学意义(P>0.05),见表1。

表1 各组小鼠脑缺血再灌注1d和7d后的神经细胞AI值
2.2 各组小鼠脑缺血再灌注损伤后Bcl-2/Bax 各组小鼠脑缺血再灌注损伤1d和7d后的Bcl-2/Bax比较,差异均有统计学意义(F=19.90、5.34,均P<0.01),2个时间点均为两药联用组高于其他各组(P<0.05),见表2。
2.3 各组小鼠脑缺血再灌注损伤后神经元Caspase-3的表达 脑缺血再灌注1d和7d后,模型组和各用药组神经元Casepase-3表达均高于假手术组(P<0.01)。同一时间点,各用药组神经元Casepase-3表达均低于模型组(P<0.01),两药联用组低于其他用药组(P<0.05),但依达拉奉组与补阳还五汤组比较差异无统计学意义(P>0.05),见表3。
3 讨论
脑缺血再灌注后神经细胞损伤主要包括坏死和凋亡。缺血中心区细胞迅速坏死,而周边缺血半暗带区发生以凋亡为主的迟发性死亡[3]。因此,抢救半暗带区神经细胞,减少细胞凋亡,能减轻脑缺血再灌注损伤的程度和范围[4]。细胞凋亡受到多基因、多系统调控,Bcl-2、Bax是与神经元凋亡关系密切的调控基因。前者抑制细胞凋亡,后者促进细胞凋亡,Bcl-2与Bax蛋白可形成结合体,过度表达Bax蛋白能促进细胞凋亡,抑制Bcl-2的抗凋亡作用。Bcl-2/Bax比值越低,细胞凋亡率越高[5-7]。此外,Caspase-3是细胞凋亡的敏感指标,被认为是细胞凋亡蛋白酶级联反应最关键的执行者,在各种因素启动的凋亡程序中起最后枢纽作用[8],阻抑Caspase-3表达,对防止脑损伤恶化和改善神经功能具有重要意义。
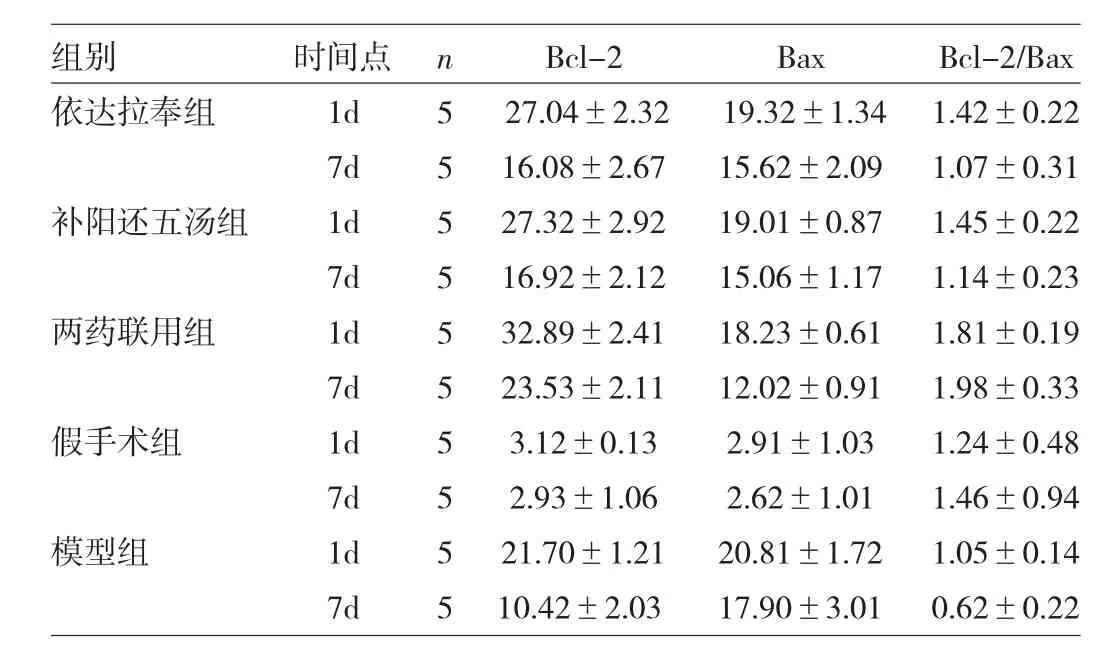
表2 各组小鼠脑缺血再灌注损伤后Bcl-2/Bax
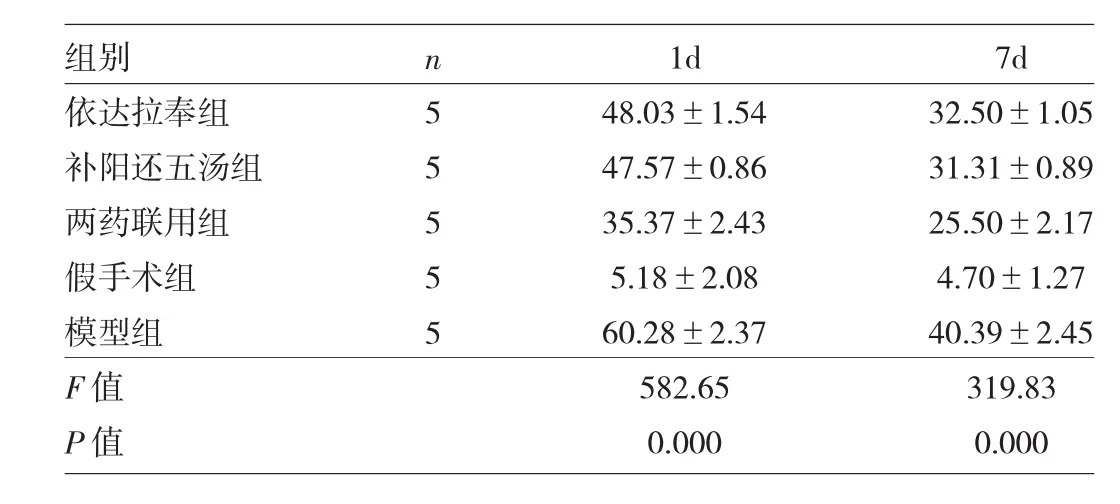
表3 各组小鼠脑缺血再灌注损伤后神经元Caspase-3的表达
补阳还五汤出自清代王清任《医林改错》,是补气、活血、通络的方药,能多环节、多靶点发挥神经保护作用[9-10],减少脑缺血再灌注损伤细胞凋亡[11]。脑缺血再灌注时体内氧自由基大量产生,可引发脂质过氧化反应[12]。ED具有清除自由基和抑制脂质过氧化的作用,可抑制神经、血管内皮细胞的过氧化和迟发性死亡,减轻脑水肿及组织损伤,且促进神经营养因子产生[13-14]。本研究发现,小鼠大脑中动脉缺血再灌注模型组脑组织凋亡细胞明显增多,药物治疗后凋亡细胞明显减少,尤以两药联用组减少最显著,这提示脑缺血再灌注损伤可引起神经细胞凋亡发生,补阳还五汤和依达拉奉对神经细胞凋亡均有抑制作用,两药联用效果尤为显著。
同时,小鼠脑缺血再灌注后缺血区细胞的Bcl-2、Bax和Caspase-3表达明显增多,说明Bcl-2、Bax和Caspase-3的表达参与脑缺血区神经细胞的损伤过程,小鼠脑缺血再灌注后启动了凋亡机制。脑缺血再灌注1d和7d后,各用药组小鼠脑组织细胞内Bcl-2/Bax比值均高于模型组,Caspase-3阳性细胞数少于模型组,尤以两药联用最显著。这表明补阳还五汤与依达拉奉均可增高Bcl-2/Bax比值,抑制凋亡诱导基因Caspase-3的表达,从而抑制神经细胞凋亡,两药联用可协同发挥脑保护作用,效果更佳。
本文从分子水平阐明了两药联用治疗急性缺血性脑血管病的优势,为临床推广应用提供了实验依据,开辟了缺血性脑血管病治疗的新途径。
[1] Amemiya S,Kamiya T,Nito C,et al.Anti-apoptotic and neuroprotective effects of edaravone following transient focal ischemia in rats[J].Eur J Pharmacol,2005,516(2):125-130.
[2] Diener H C,Bogousslavsky J,Brass L M,et a1.Aspirin and clopidogrel compared with clopidogrel alone after recent ischemic stroke or transient ischemic attack in high-risk patient(MATCH): randomised,double-blind,placebo-controlled trial[J].Lancet, 2004,364(9431):331-337.
[3] Candelario-Jalil E.Injury and repair mechanisms in ischemic stroke:considerations for the development of novel neurotherapeutics[J].Curr Opin Investig Drugs,2009,10(7):644-654.
[4] 严莉,于士柱,安同岭,等.大鼠缺血再灌流脑区半胱氨酸蛋白酶-3活化与神经元凋亡的关系[J].中华神经科杂志,2005,38(1):25-29.
[5] Ferrer I,Planas A M.Signaling of cell death and cell survival following focal cerebral ischemia:life and death struggle in the penumbra[J].J NeuropatholExp Neurol,2003,62(4):329-339.
[6] Mc Clintock D S,Santore M T,Lee V Y,et al.Bcl-2 family members and functional electron transport chain regulate oxygen deprivation induced celldeath[J].MolCellBiol,2002,22(1):94-104.
[7] 宋修云,胡金凤,陈乃宏.神经细胞凋亡与脑缺血疾病[J].中国药理学通报,2012,28(3):307-310.
[8] Broughton B R,Reutens D C,Sobey C G.Apoptotic mechanisms after cerebralischemia[J].Stroke,2009,40(5):e331-e339.
[9] 陈冬,杨洁红.补阳还五汤抗脑缺血作用的研究进展[J].中华中医药学刊,2010,28(1):72-74.
[10] Mu Q,Liu P,Hu X,et al.Neuroprotective effects of Buyang Huanwu decoction on cerebral ischemia-induced neuronal damage[J].NeuralRegen Res,2014,9(17):1621-1627.
[11] 邓文祥,潘继兴,黄惠勇.中药对大鼠脑缺血再灌注损伤细胞凋亡机制的研究进展[J].湖南中医药大学学报,2015,35(6):64-68.
[12] 李焰,刘凤丽,程冉冉,等.小鼠脑缺血/再灌注损伤皮质区超氧化物歧化酶、丙二醛、活性氧表达与细胞凋亡的关系及姜黄素的干预作用[J].中国老年学杂志,2015,35(19):5405-5407.
[13] Kapoor S.Neuroprotective effects of edaravone:recent insights [J].J NeurolSci,2013,331(1-2):177.
[14] Okuyama S,Morita M,Sawamoto A,et al.Edaravone enhances brain-derived neurotrophic factor production in the ischemic mouse brain[J].Pharmaceuticals(Basel),2015,8(2):176-185.
(本文编辑:陈丹)
《浙江医学》对作者署名的一般要求
同时具备以下3项条件者方可署名为作者:(1)参与选题和设计或资料的分析与解释者;(2)起草或修改论文中关键性理论或其他主要内容者;(3)能对编辑部的修改意见进行核修,在学术界进行答辩,并最终同意该文发表者。仅参与研究项目资金的获得或收集资料者不能列为作者,仅对科研小组进行一般管理者也不宜列为作者。对文章中的各主要结论,均必须至少有1位作者负责。作者中如有外籍作者,应征得其同意,并在投稿时向编辑部提供相应证明材料。集体署名的文稿,在题名下列出署名单位,于文末列出整理者姓名,并须明确该文的主要负责人,在论文首页脚注通信作者姓名、单位、邮政编码及E-mail地址。通信作者一般只列1位,由投稿者确定。如需注明协作组成员,则于文末参考文献前列出协作组成员的单位及姓名。作者的具体排序应在投稿前即确定,在编排过程中不应再改动,确需改动时必须出示单位证明。
本刊编辑部
Neuroprotective effect of Chinese medicine Buyang Huanwu Decoction combined with edaravone on cerebral ischemia/reperfusion injury in mice
ZHONG Fangfang,WU Chenglong,SUN Xinfang,et al.Department of Neurology,Shaoxing People's Hospital,Shaoxing 312000,China
Objective To investigate the effects of Chinese medicine Buyang Huanwu Decoction(BYHWD)combined with edaravone(ED)on cerebral ischemia/reperfusion injury in mice. Methods Fifty mice were randomly divided into sham operation group,model group,BYHWD group,ED group and BYHWD+ED group.Each group were further randomly divided into 1d and 7d group.The middle cerebral artery occlusion/reperfusion model was established by the improved intraluminal filament technique in mice.The animals were sacrificed on d1 (n=5)and d7 (n=5)after ischemic/reperfusion was induced in each group. Immunohistochemistry method was used to analyze the expression of Bcl,Bax-2 and Caspase-3 protein in neurons,and TUNEL method was used to evaluate the apoptosis of neuron. Results Compared with model group,the apoptosis index was reduced (P<0.05),ratio of Bcl-2/Bax was increased (P<0.05),and Caspase-3-postive cells were decreased (P<0.01)in BYHWD,ED and BYHWD+ED groups,and those in BYHWD+ED group were changed most significantly. Conclusion Chinese medicine Buyang Huanwu decoction has a synergistic effect with edaravone in protection ofthe brain from ischemic/reperfusion injury.
2015-10-14)
浙江省绍兴市公益性技术应用研究计划项目(2013B70076)
312000 绍兴市人民医院神经内科
钟芳芳,E-mail:yangmum@126.com
