甲状腺素对非酒精性脂肪肝大鼠ANGPTL3表达的影响
2016-12-24,,,,
, ,, ,
(1.华润武钢总医院干保中心,湖北 武汉 430080;2.南华大学附属南华医院消化内科;3.隆回县人民医院消化内科)
·基础医学·
甲状腺素对非酒精性脂肪肝大鼠ANGPTL3表达的影响
程静屏1,傅念*2,罗艳云3,马娜2,阳学风2
(1.华润武钢总医院干保中心,湖北 武汉 430080;2.南华大学附属南华医院消化内科;3.隆回县人民医院消化内科)
目的探讨甲状腺激素(TH)对非酒精性脂肪肝(NAFLD)大鼠血管生成素样蛋白3(ANGPTL3)表达的影响,明确TH是否通过ANGPTL3途径影响NAFLD大鼠肝脏脂肪变性。方法健康3周初断乳SD雄性大鼠30只,随机分为5组:正常组、高脂组、甲状腺素预防组、甲状腺素治疗组、吉非罗齐组;所有大鼠除正常组外均以高脂饮食喂养,分别于0、4、8、12周断尾取血,12周末处死大鼠,取肝脏。苏木精-伊红法(HE)染色,进行肝脂肪变性程度评分,采用酶联免疫吸附实验(ELISA法)检测血清ANGPTL3含量,逆转录聚合酶链式反应(RT-PCR)检测肝脏中ANGPTL3 mRNA的表达水平。结果甲状腺素预防组及吉非罗齐组大鼠肝组织脂肪变性程度均低于高脂组及甲状腺素治疗组(P<0.01)。高脂组血清ANGPTL3水平在第8周后出现增高,呈时间依赖性,其肝组织中的ANGPTL3 mRNA表达亦较正常对照组明显升高(P<0.01)。甲状腺预防组大鼠在8、12周均出现血清ANGPTL3浓度降低,并可下调肝脏ANGPTL3 mRNA水平,与高脂组及甲状腺素治疗组相比较,差异均具有统计学意义(P<0.05)。甲状腺素治疗组与吉非罗齐组亦可一定程度下调血清ANGPTL3水平及肝组织中ANGPTL3 mRNA 表达(P<0.05),但其降低的程度少于甲状腺素预防组(P<0.05)。结论NAFLD形成过程中伴有ANGPTL3进行性增高,早期给予小剂量TH可通过ANGPTL3途径而改善NAFLD大鼠肝脂肪变性程度。
非酒精性脂肪肝; 血管生成素样蛋白3; 甲状腺激素
甲状腺激素(thyroid hormones,TH)是人体重要的激素之一,可以促进人体正常的生长发育,在脂代谢和葡萄糖代谢过程中起重要作用,体内血清甲状腺激素水平变化可引起脂代谢及糖代谢改变,与非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)的关系密切[1-3]。
本文作者前期研究发现,早期给予外源性甲状腺素可有效防止NAFLD大鼠肝脏脂肪变性。血管生成素样蛋白3(angiopoietin-like protein 3,ANGPTL3) 是一种主要在肝脏表达的分泌蛋白,与脂质代谢关系密切,可抑制脂蛋白脂肪酶 (lipoprotein lipase,LPL)的活性,减少血液中三酰甘油的清除,并能与脂肪组织直接结合促进脂肪分解[4],有学者将其作为治疗肥胖、代谢综合症的靶标[5-6]。本研究以NAFLD大鼠为研究对象,从生物水平研究TH对NAFLD大鼠ANGPTL3表达的影响,探讨TH是否通过ANGPTL3途径影响NAFLD大鼠肝脏脂肪变性。
1 料材与方法
1.1材料健康3周初断乳SD雄性大鼠30只,购自南华大学实验动物中心,体重53±6 g,动物合格证编号为DK0503-0062。高脂饲料配方:88%普通饲料+2%胆固醇+10%猪油;普通饲料及高脂饲料由南华大学实验动物部制备。甲状腺素片:济南维尔康生化制药有限公司;吉非罗齐胶囊:山东方明药业集团股份有限公司;胆固醇纯品购自上海蓝季试剂公司。TRIzol试剂购自美国Gibco公司;反转录试剂盒、TaqDNA聚合酶、dNTP、DNA marker购自北京康为世纪公司;ELISA试剂盒均购自北京方程生物科技有限公司;引物设计合成由生工生物工程(上海)有限公司完成; T-cadherin一抗购自美国BioWorld公司;DAB显色试剂盒购自北京中杉金桥生物技术有限公司。其他试剂均为国产分析纯品。
1.2方法
1.2.1 动物分组 所有SD大鼠购回后普通饲料喂养1周后,随机分为5组:正常组、高脂组、甲状腺素预防组、甲状腺素治疗组、吉非罗齐组,每组6只。除正常组以普通饲料喂养外,其他各组均以高脂饲料喂养;高脂组:仅以高脂饲料喂养,不加其他干预因素;甲状腺素预防组:高脂喂养第4周后给予甲状腺素片混悬液每天4 mg/kg 灌胃;甲状腺素治疗组:高脂喂养第8周后给予甲状腺素片混悬液每天4 mg/kg灌胃;吉非罗齐组:高脂喂养第4周后给予吉非罗齐混悬液每天150 mg/kg灌胃。所有大鼠均在喂养后0、4、8、12周断尾取血,12周采用10%水合氯醛对大鼠进行腹腔注射麻醉后,处死大鼠,经腹主动脉取血,取肝脏。
1.2.2 标本收集 处死大鼠后,迅速取下肝脏,观察其颜色、质地;剪取肝右叶组织放入去除RNA酶的EP管内,液氮保存。血液标本室温条件下静置15 min,4 ℃离心25 min(3 000 rpm),上清液保存于-80 ℃冰箱。
1.2.3 血清ANGPTL3含量检测 采用ELISA法检测血清ANGPTL3含量,操作步骤严格按照试剂盒说明执行。
1.2.4 肝组织病理学检查 处死大鼠后,分离肝脏,观察大体形态及表面色泽。称重后取肝右叶小块肝组织,常规石蜡包埋、切片,行HE染色,于光镜下观察。脂肪变性程度评分可参照中华医学会非酒精性脂肪性肝病诊疗指南(2010年12月修订)[7]。按肝细胞脂肪变性细胞数占总肝细胞数的百分比计算,共分为4度:F0<5%肝细胞脂肪变性;F15%~33%肝细胞脂肪变性;F2 33%~66%肝细胞脂肪变性;F3 66%~75%肝细胞脂肪变性;F4 75%以上肝细胞脂肪变性。
1.2.5 引物设计 GAPDH:上游引物:5′-caaggtcatccatgacaactttg-3′,下游引物:5′-gtccaccaccctgttgctgtag-3′,退火温度:56 ℃,扩增片段:496 bp;ANGPTL3:上游引物:5′-aaatgggctgtggaaatgtaac-3′,下游引物:5′-tcccttctaactctcgctctgt-3′,退火温度:58 ℃,扩增片段:404 bp。
1.2.6 RT-PCR检测肝脏中ANGPTL3 mRNA的表达水平 处死大鼠后,迅速取下肝脏,观察其颜色、质地;剪取肝右叶组织放入去除RNA酶的EP管内,液氮保存。按TRIzol法抽提肝组织总RNA,以分光光度计测定总RNA量,取总RNA 5 μg在逆转录酶作用下反转录为cDNA,以此为模板,按RT-PCR试剂盒的说明书按标准步骤操作来合成cDNA并扩增产物;产物进行1.0%琼脂糖凝胶电泳,AlphaImager 2200紫外分析仪观察和扫描分析。根据灰度值/GAPDH的比值,对受体mRNA进行半定量分析。
1.3统计学处理实验数据全部采用SPSS15.0统计软件进行分析,所有计量资料采用均数±标准差形式表示,多组比较采用方差分析,采用方差齐性检验查看组间差异,两两比较采用LSD法,以P<0.05为差异有统计学意义。
2 结 果
2.1各组大鼠一般情况观察实验过程中,正常组所有大鼠精神良好,毛发光泽,活跃,反应敏锐,食欲佳。高脂组大鼠随着动物造模时间的延长,毛发渐失去光泽,精神萎靡,反应迟钝,食欲欠佳,甚至有个别大鼠变得易激惹,富于攻击性。12周时,甲状腺素预防组和吉非罗齐组大鼠与高脂组比较,毛发、精神、反应和食欲等方面症状明显减轻;甲状腺素治疗组大鼠毛发渐失去光泽,精神萎靡,反应迟钝。
2.2 12周时各组大鼠脂肪变性程度各组大鼠肝组织脂肪变性程度评分为正常组0.00±0.00,高脂组3.60±0.22;甲状腺素预防组1.80±0.16;甲状腺素治疗组3.50±0.14;吉非罗齐组1.95±0.10。根据HE染色示,所有高脂喂养组大鼠肝组织脂肪变性均较正常组升高,差异具有显著性(F=1361.67,P<0.01);甲状腺素预防组及吉非罗齐组大鼠肝组织脂肪变性程度均低于高脂组及甲状腺素治疗组,均P<0.01。
2.3血清ANGPTL3含量检测结果高脂组血清中的ANGPTL3水平在第8周后开始较正常组明显增高(q=10.076,P<0.01),且呈时间依赖性。甲状腺预防组大鼠在8、12周均出现血清中的ANGPTL3浓度降低,与高脂组及甲状腺素治疗组比较,差异均有显著性(P<0.05)。甲状腺素治疗组与吉非罗齐组亦可在一定程度上下调血清ANGPTL3水平,12周时与高脂组比较差异具有显著性(P<0.05),但其降低的程度少于甲状腺素预防组,12周时甲状腺治疗组与吉非罗齐组之间,血清ANGPTL3水平组间比较差异无显著性(P>0.05)。见表1。
表1各组SD大鼠不同时间点血清ANGPTL3含量的变化(n=6,μg/mL)

组别0周4周8周12周正常组240.24±23.22288.25±25.23419.64±45.23b438.24±46.14b高脂组235.55±21.42309.83±30.29627.04±41.72a712.52±20.66a甲状腺素预防组236.78±30.76325.05±33.07a439.45±21.05bc435.96±35.65bc甲状腺素治疗组245.09±14.93316.89±24.67652.94±32.59a502.49±31.63ab吉非罗齐组247.99±21.47326.77±35.46474.12±32.62ab544.38±39.05ab
与正常组相比,a:P<0.05;与高脂组相比,b:P<0.05;与甲状腺素治疗组比较,c:P<0.05
2.4各组SD大鼠肝脏组织中ANGPTL3 mRNA的表达各组ANGPTL3 mRNA的表达分别为:正常组0.860±0.016;高脂组:0.980±0.047;甲状腺素预防组0.773±0.036;甲状腺素治疗组0.873±0.029;吉非罗齐组0.890±0.029。高脂组大鼠肝组织中的ANGPTL3 mRNA表达较正常对照组明显升高(q=5.139,P<0.05)。甲状腺素预防组、治疗组及吉非罗齐组均可下调SD大鼠肝脏组织中ANGPTL3 mRNA表达,与高脂组比较差异均有显著性(P<0.01),其中甲状腺素预防组下调尤为明显,甲状腺素预防组与甲状腺素治疗组、吉非罗齐组进行组间比较,差异具有统计学意义(P<0.01,图1)。
3 讨 论
传统观念认为,TH强大的分解代谢作用,可使血脂降低,游离脂肪酸明显增高,外周脂肪酸转运至肝脏,引起肝脂沉积,从而导致肝脂肪变性,故不认为对NAFLD的治疗有价值[8]。但本文作者的前期研究发现,早期给予小剂量外源性甲状腺素可有效防止NAFLD大鼠肝脏脂肪变性[9]。临床上甲状腺激素在NAFLD中的利用停滞不前,主要原因在于甲状腺激素在生物体内过多或过少均可敏感的引起机体糖、脂质代谢紊乱,其与NAFLD发病机制不确定、药物剂量的不确定、用药之后可影响NAFLD进程中的哪些具体靶器官及作用途径等问题尚未明确。故甲状腺激素在NAFLD的发生、发展过程中有大量的问题尚等进一步研究。
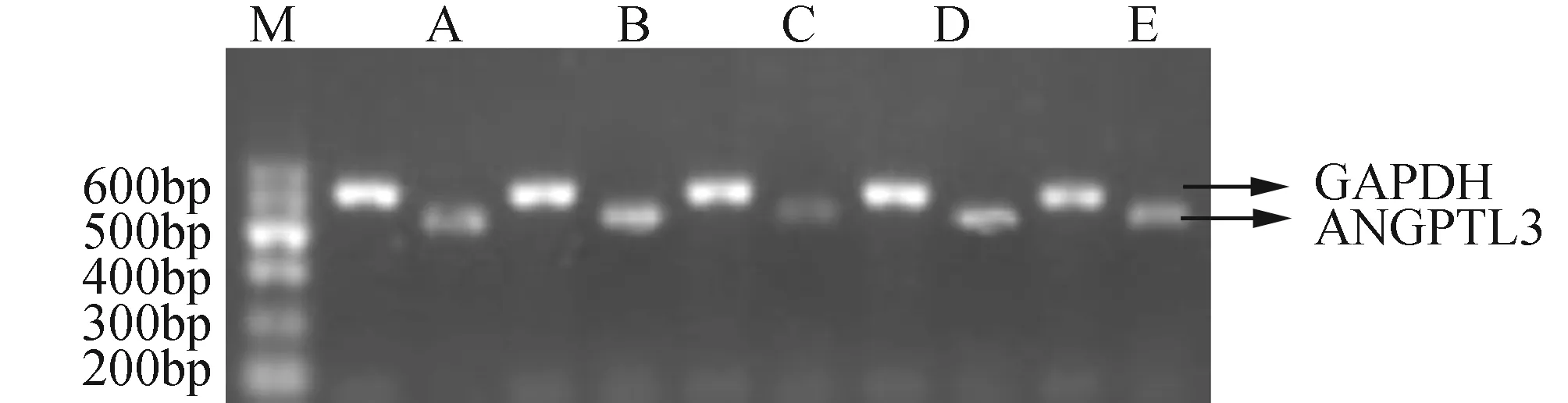
图1 各组SD大鼠肝脏组织中ANGPTL3 mRNA表达电泳图 A:正常组;B:高脂组;C:甲状腺素预防组;D:甲状腺素治疗组;E:吉非罗齐组
既往在Fugier C[10]的研究中发现,甲状腺素可以反向调节ANGPTL3表达,大鼠在给予T3后ANGPTL3 mRNA明显下调,但在甲状腺素受体(THR)缺乏大鼠中ANGPTL3的表达无变化,也就是说T3反向调节ANGPTL3的作用呈甲状腺素受体依赖性。ANGPTL3是1999年Conklin等[11]发现的一种多功能分泌因子,因其具有血管生成素家族的特征性结构而得名,但在功能上与血管生成素家族(Ang)又有明显的不同,没有Ang所具有的特征性钙结合模序,不与血管生成素受体相结合。其由Angptl3编码,约7×103bp,主要在人和鼠的肝脏表达。ANGPTL3具有调节脂质代谢和促进血管生成的作用,尤以调节脂质代谢的作用最为突出[4,12-13]。ANGPTL3可通过抑制LPL的活性,减少血液中三脂酰甘油的清除,提高血浆三脂酰甘油水平,并能与脂肪组织直接结合,激活脂肪细胞的脂解作用,从而导致游离脂肪酸(FFA)和甘油从脂肪细胞释放增多,引起血浆FFA和甘油水平升高,但其对肝脏脂质代谢及沉积的作用及关系研究尚不明确。
本研究中发现在NAFLD发生、发展过程中伴有血清ANGPTL3进行性增高,其肝组织中的ANGPTL3 mRNA表达亦较正常对照组明显升高,ANGPTL3的增高与NAFLD的形成密切相关。在早期给予小剂量外源性甲状腺素可以反向调节ANGPTL3表达,从而改善NAFLD大鼠肝脂肪变性程度,且相比吉非罗齐组,差异具有统计学意义。吉非罗齐是临床上常用的降脂药物,其降血脂的作用机制尚未完全明了,本次研究应用吉非罗齐作为阳性对照,研究结果显示吉非罗齐与甲状腺素预防组改善高脂诱导的SD大鼠肝脏脂肪变性的作用相当,但甲状腺素预防组下调血清ANGPTL3水平及肝组织中的ANGPTL3 mRNA表达的作用优于吉非罗齐组,差异具有统计学意义,证明TH可能是通过ANGPTL3途径而改善NAFLD。
同时发现仅在早期给予小剂量外源性甲状腺素可以下调ANGPTL3,改善NAFLD大鼠肝脂肪变性程度,而在疾病进展到一定阶段后再给予外源性甲状腺素仅可部分下调ANGPTL3,而对NAFLD大鼠肝脂肪变性程度改善不明显。分析原因可能为:(1)TH下调ANGPTL3的作用呈甲状腺素受体依赖性,NAFLD在疾病的中晚期可能存在TH受体抑制;(2)TH药物剂量疗效及毒副作用的平衡点有待进一步研究;(3)TH及ANGPTL3对NAFLD疾病形成的干预可能更强于对于疾病的逆转;故对TH受体、药物剂量、安全性、用药时间点等诸多问题仍需进一步深入研究。
[1] Eshraghian A,Hamidian Jahromi A.Non-alcoholic fatty liver disease and thyroid dysfunction:a systematic review[J].World J Gastroenterol, 2014,20(25):8102-8109.
[2] Vergani L.Lipid lowering effects of iodothyronines:In vivo and in vitro studies on rat liver[J].World J Hepatol, 2014,6(4):169-177.
[3] Torun E,Özgen IT,Gökçe S,et al.Thyroid hormone levels in obese children and adolescents with non-alcoholic fatty liver disease[J].J Clin Res Pediatr Endocrinol, 2014,6(1):34-39.
[4] Robciuc MR,Maranghi M,Lahikainen A,et al.Angptl3 deficiency is associated with increased insulin sensitivity,lipoprotein lipase activity,and decreased serum free fatty acids[J].Arterioscler Thromb Vasc Biol,2013,33(7):1706-1713.
[5] Li Y,Teng C.Angiopoietin-like proteins 3,4 and 8:regulating lipid metabolism and providing new hope for metabolic syndrome[J].J Drug Target,2014,22(8):679-687.
[6] Kadomatsu T,Tabata M,Oike Y.Angiopoietin-like proteins:emerging targets for treatment of obesity and related metabolic diseases[J].FEBS J,2011,278(4):559-564.
[7] The Chinese National Workshop on Fatty Liver and Alcohol&Liver Disease for the Chinese Liver Disease Associcetion.Guidelines for management of nonalcoholic fatty liver disease:an updated and revised edition[J].Chin J Gastroenterol Hepatol,2010,16 (6):483-487.[8] Huang YY,Gusdon AM,Qu S.Cross-talk between the thyroid and liver:a new target for nonalcoholic fatty liver disease treatment[J].World J Gastroenterol, 2013,19(45):8238-8246.
[9] 罗艳云,傅念.甲状腺素对高脂诱导的非酒精性脂肪肝的干预研究[D].衡阳:南华大学,2014.
[10] Fugier C,Tousaint JJ,Prieur X,et al.The lipoprotein lipase inhibitor ANGPTL3 is negatively regulated by thyroid hormone[J].J Biol Chem,2006,281(17):11553-11559.
[11] Conklin D,Gilberts on D,Taft DW,et al.Identificati on of a mammalian angiopoietin-related protein expressed specifically in liver[J].Genomics,1999,62 (3):477-482.
[12] Mattijssen F,Kersten S.Regulation of triglyceride metabolism by Angiopoietin-like proteins[J].Biochim Biophys Acta, 2012,1821(5):782-789.
[13] Romeo S,Yin W,Kozlitina J,et al.Rare loss-of-function mutations in ANGPTL family members contribute to plasma triglyceride levels in humans[J].J Clin Invest, 2009,119(1):70-79.
EffectsofThyroidHormoneontheExpressionofANGPTL3inNonalcoholicFattyLiverinRats
CHENG Jingping,FU Nian,LUO Yanyun,et al
(HuarunWISCOGeneralHospital,Hubei,Wuhan,Hubei430080,China)
ObjectiveTo investigate the effects of TH on the expression of ANGPTL3 of NAFLD rats,and the effect of TH on hepatic steatosis in NAFLD rats by ANGPTL3 pathway.Methods30 SD male rats,were randomly divided into 5 groups:normal control group,high fat group,thyroxine prevention group,treatment group,gemfibrozil group;All rats were fed with high fat diet except the normal group,blood was taken out from the tail of rat at 0,4,8,12 weeks,All of them were killed at the end of 12 weeks,the degree of hepatic steatosis score was observed by HE staining of Liver pathological section.Serum ANGPTL3 content was detected by ELISA method,and the mRNA expression of ANGPTL3 in liver tissue was measured with RT-PCR.ResultsRat liver steatosis degree in thyroxine prevention group and gemfibrozil group was lower than the high fat group and thyroxine treatment(P<0.05).In the high fat group,the serum level of ANGPTL3 was increased at 8W,the expression of ANGPTL3 mRNA in liver tissue was significantly higher than the normal control(P<0.01).Thyroxine prevention group rats showed the decrease in serum concentration of ANGPTL3 at 8 weeks,12 weeks,and lower hepatic ANGPTL3 mRNA level,compared with high cholesterol group,gemfibrozil group and thyroxine treatment groups,was statistically significant(P<0.05).Thyroxine treatment group and gemfibrozil group can also in a certain degree decreasing serum ANGPTL3 level and expression of ANGPTL3 mRNA in liver tissue(P<0.05),but the extent of reduction is less than thyroxine prevention group(P<0.05).ConclusionThe formation process of NAFLD increased with ANGPTL3,ans early administration of small dose of TH hepatic adipose degeneration in NAFLD rats improved through ANGPTL3 pathway.
nonalcoholic fatty liver disease;angiopoietin-like protein 3;thyroid hormones
R575.5
A
10.15972/j.cnki.43-1509/r.2016.01.006
2015-10-23;
2015-12-30
本项目由2012年武汉市卫生计生委科研基金支持(编号WX12B07).
*通讯作者,E-mail:2002funian@163.com.
蒋湘莲)
