二甲双胍联合异羟肟酸对骨肉瘤细胞增殖凋亡的影响
2016-12-24,,,*
,, , *
(1.南华大学附属第一医院临床医学研究所,湖南 衡阳 421001;2.南华大学附属南华医院脊柱外科)
·基础医学·
二甲双胍联合异羟肟酸对骨肉瘤细胞增殖凋亡的影响
申莹莹1,苏小桃2,欧军2,何俊2*
(1.南华大学附属第一医院临床医学研究所,湖南 衡阳 421001;2.南华大学附属南华医院脊柱外科)
目的研究二甲双胍(Met)联合异羟肟酸(SAHA)应用对人骨肉瘤细胞MG-63增殖和凋亡的影响。
方法MTS法分别检测二甲双胍、SAHA和二甲双胍联合SAHA对MG-63细胞生长的抑制作用;平板克隆实验检测二甲双胍联合SAHA对MG-63细胞克隆形成能力的影响;流式细胞仪检测二甲双胍联合SAHA对MG-63细胞凋亡的影响;Western Blot检测联合用药后细胞周期和凋亡相关蛋白的变化。结果二甲双胍和SAHA分别对MG-63细胞生长有抑制作用,二甲双胍联合SAHA应用对MG-63细胞生长的抑制作用更加显著;二甲双胍联合SAHA应用与单药相比能够明显降低MG-63细胞克隆形成率,并且促进细胞凋亡;联合用药后P27,P21,Cyclin D1,Mcl-1,XIAP,Bim,Cytochrome C蛋白发生明显改变。结论二甲双胍联合SAHA应用与单药相比能够显著抑制人骨肉瘤MG-63细胞的增殖,促进其凋亡,可见两药联用对肿瘤细胞的杀伤具有协同性。
二甲双胍; 异羟肟酸; 骨肉瘤; 细胞增殖; 细胞凋亡
骨肉瘤是最常见的恶性骨肿瘤,多发于儿童和青少年[1],因此,长期的化疗影响应予以重视,目前迫切需要一些没有或仅有较少累积毒性的治疗药物给骨肉瘤患者带来福音。二甲双胍(Metformin,Met)在临床中用来降低2型糖尿病患者的血糖水平,然而近几年因其潜在的抗肿瘤作用而引起了人们的极大注意[2-3],其抗肿瘤效应被认为与其降血糖作用无关[4-5]。组蛋白去乙酰化酶抑制剂(Histone deacetylase inhibitor,HDACi)是一类新型抗肿瘤药物,对多种实体瘤及血液系统肿瘤具有显著抗肿瘤作用,而异羟肟酸(suberoylanilide hydroxamic acid,SAHA)则是其中一种非常有效的HDACi[6]。本研究的目的是评估二甲双胍和SAHA在体外对人骨肉瘤细胞株的增殖和凋亡的影响,并评估其协同抗肿瘤作用,初步探讨其联合作用的机制,旨在为这种新型联合化疗模型的临床应用提供理论基础。
1 材料与方法
1.1材料人骨肉瘤细胞株MG63购于中国科学院上海细胞库。RPMI 1640培养液、胎牛血清购于美国Gibco公司,二甲双胍、SAHA、姬姆萨染液购于Sigma-Aldrich公司,MTS购于Promega公司,Annexin V/PI试剂盒购于凯基生物公司,Western Blot一抗均购于santa cruz公司,二抗购于Pierce Biotechnology。
1.2方法
1.2.1 细胞培养 MG63细胞用RPMI1640+10%胎牛血清,培养液含100 U/mL青霉素,100 μg/mL链霉素,于37 ℃,5% CO2饱和湿度条件下培养,实验所用的细胞均处于对数生长期。
1.2.2 MTS法测定细胞增殖 对数生长期细胞接种于96孔板,每孔2×103个细胞。设空白组(仅加培养液)、对照组和药物系列组(单药或同时联合),每组设3个重复孔,每孔容积为100 μL。需等细胞培养24 h足够贴壁后才能进行加药处理,于处理72 h后终止培养。在终止培养前4 h,加MTS每20 μL/孔。用酶标仪读取 490 nm 处吸光度值(A值)。按下列公式计算细胞活力(Cell Viability),细胞活力=(药物处理组A值-空白组A值)/(对照组A值-空白组A值)×100%。实验重复3次。绘制Cell Viability vs 药物浓度曲线。
1.2.3 克隆形成实验 500个细胞种在6 cm培养皿中,贴壁后不同药物处理,一周后培养皿中出现肉眼可见的克隆,培养终止。弃掉培养液,用PBS小心洗两次。20 %甲醇5 mL固定15 min,弃去固定液,加适量姬姆萨染色40 min,然后用流水缓慢洗去染色液,空气干燥。将平皿倒置并叠加一张带网格的透明胶片,用克隆计数仪自动计数。
1.2.4 Annexin V/PI双标记法流式细胞术测定细胞凋亡 细胞用不同药物处理48 h后,用不含EDTA的胰酶消化收集细胞(上清中的细胞也要收集);用PBS洗涤细胞二次(2 000 rpm离心5 min)收集(1~5)×105细胞;加入500 μL的Binding Buffer悬浮细胞;加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide,混匀;室温、避光、反应5~15 min;在1 h内进行流式细胞仪的观察和检测。在双变量流式细胞仪的散点图上,左下象限显示正常细胞,右下象限为早期凋亡细胞,右上象限为晚期凋亡细胞,取右上象限和右下象限的总和(即Annexin V阳性细胞群)计为凋亡细胞。
1.2.5 Western Blot 用细胞裂解液裂解细胞,提取其总蛋白或胞浆蛋白,在聚丙烯酰胺凝胶中电泳。将蛋白转膜至PVDF膜上,5%脱脂奶粉封闭后,加入一抗4 ℃孵育过夜;TBST漂洗后与二抗反应,室温孵育1 h;TBST 漂洗,10 min/次,洗涤3次;加入发光液后显影、定影、拍照。
1.3统计学处理用GraphPad Prism 5.0软件对数据进行分析和t检验,P<0.05为差异有统计学意义。
2 结 果
2.1二甲双胍和SAHA单药使用对MG-63细胞增殖的抑制二甲双胍和SAHA单药处理72 h后,不同的药物浓度对MG-63细胞增殖的抑制作用见图1。实验结果显示,MG-63的细胞活力随着药物浓度的逐渐增加而降低(二甲双胍IC50=7.5 mmol/L,SAHA IC50=0.3 μmol/L)。单独使用二甲双胍或SAHA对骨肉瘤细胞MG-63的增殖均有抑制作用。
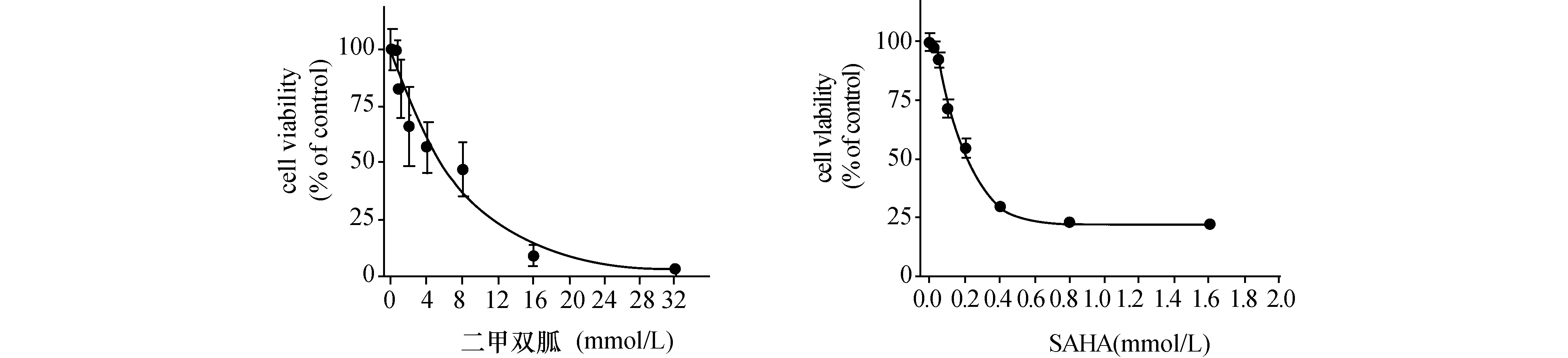
图1 二甲双胍和SAHA单药对MG63细胞增殖的影响
2.2二甲双胍联合SAHA使用对MG-63细胞增殖的影响从实验结果可以看到,单独使用二甲双胍或SAHA对细胞增殖起到了一定的抑制作用,但是当使用1 mmol/L的二甲双胍分别于 0.1 和 0.2 μmol/L的SAHA同时联用时,细胞的增殖明显受到了抑制,远远大于单药使用。联合用药组对细胞增殖的抑制作用与SAHA单药组相比差异具有统计学意义,见图2。
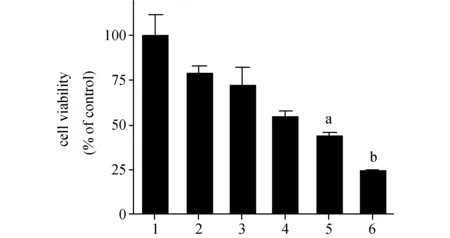
图2 二甲双胍和SAHA联合对MG63细胞增殖的影响 1:control;2:二甲双胍 1 mmol/L;3:SAHA 0.1 μmol/L;4:SAHA 0.2 μmol/L;5:二甲双胍1 mmol/L + SAHA 0.1 μmol/L;6:二甲双胍1 mmol/L + SAHA 0.2 μmol/L.与SAHA 0.1 μmol/L组比较,a:P<0.05;与SAHA 0.2 μmol/L组比较,b:P<0.001
2.3二甲双胍联合SAHA使用对MG-63细胞克隆形成的影响肿瘤细胞的单细胞克隆形成能力不仅体现了肿瘤细胞群体依赖性,而且还反映细胞的长期增殖能力。实验结果显示,与单药使用相比,两药联合使用后细胞克隆形成率明显下降,差异有显著性,见图3。二甲双胍联合SAHA(同时)与单药相比能够有效地抑制骨肉瘤细胞MG-63的克隆形成。
2.4二甲双胍联合SAHA使用对MG-63细胞凋亡的影响促进肿瘤细胞的凋亡是药物治疗肿瘤的另一个重要切入点。药物处理细胞48 h后,进行细胞凋亡的检测。流式细胞分析结果显示,单独使用1 mmol/L二甲双胍能够使得MG-63细胞的凋亡率达到15.24%,单独使用0.1 μmol/L或0.2 μmol/L SAHA能够使得MG-63细胞的凋亡率分别达到25.32%和38.80%。当使用1 mmol/L二甲双胍分别联合0.1 μmol/L和0.2 μmol/L SAHA处理细胞后,细胞凋亡率显著增加,分别为46.17%和60.42%,与单药使用相比差异具有统计学意义,见图4。二甲双胍和SAHA单独使用可以促进肿瘤细胞的凋亡,但是两药同时联用其促凋亡的能力更加明显。
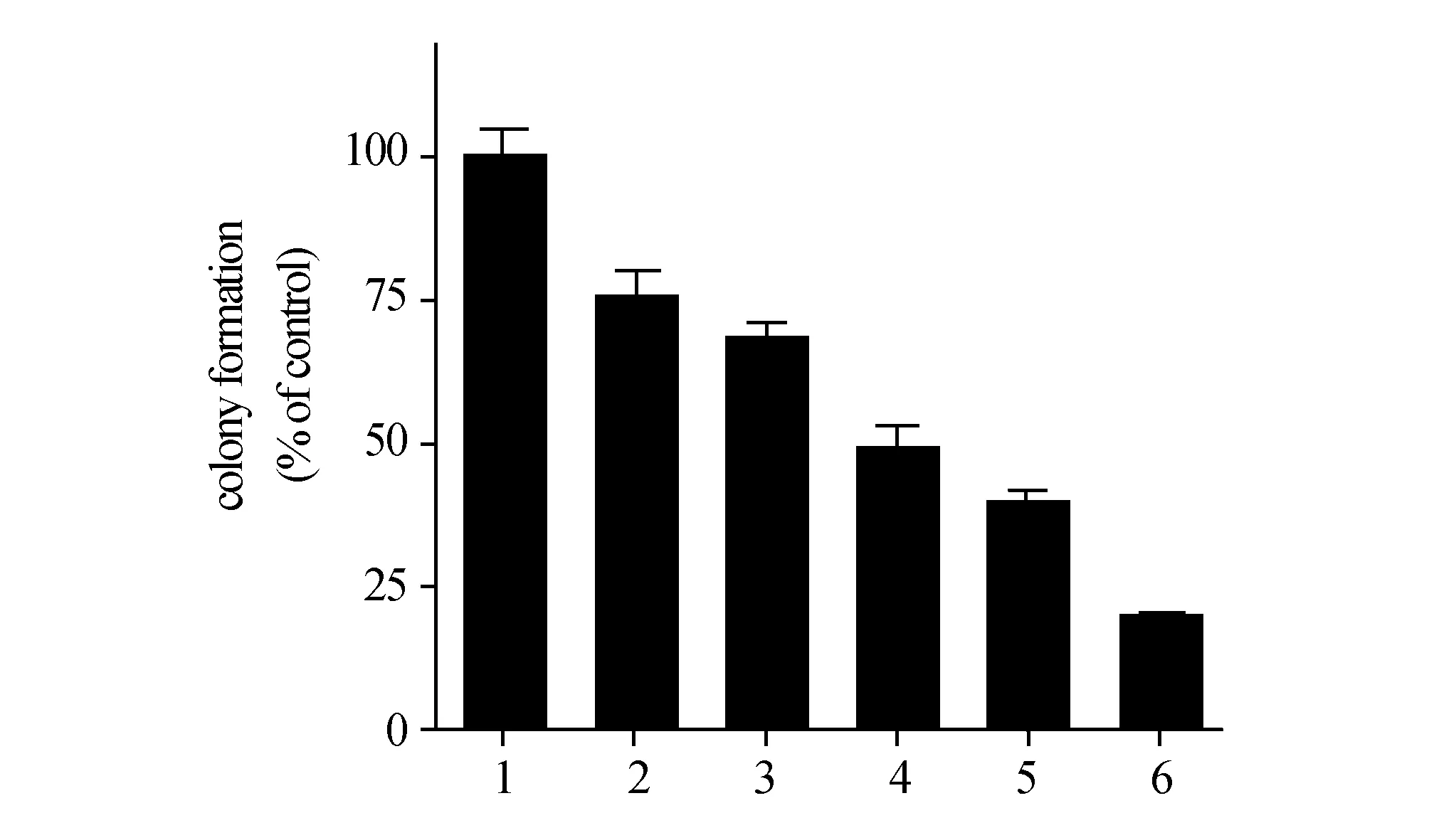
图3 二甲双胍和SAHA联合对MG63细胞克隆形成的影响 1:Control;2:二甲双胍 1 mmol/L;3:SAHA 0.1 μmol/L;4:SAHA 0.2 μmol/L;5:二甲双胍1 mmol/L + SAHA 0.1 μmol/L;6:二甲双胍1 mmol/L + SAHA 0.2 μmol/L.与SAHA 0.1 μmol/L组比较,a:P<0.001;与SAHA 0.2 μmol/L组比较,b:P<0.001
2.5二甲双胍联合SAHA对MG-63细胞的凋亡和周期相关蛋白的改变在药物处理细胞48 h后,分别用digitonin buffer提取胞浆蛋白以及用RIPA提取细胞全蛋白进行Western Blot实验。相对于单纯使用二甲双胍或者SAHA,两药同时联用时PARP切割更明显,代表细胞凋亡明显增加。线粒体是细胞内源性凋亡启动以及调控的主要细胞器,而Cytochrome c (Cyto C)的释放则是细胞早期凋亡的标志物,单药处理时都只有轻微诱导Cytochrome c的释放,而在共同作用的情况下,Cytochrome c的释放量明显增加。见图5。结果从分子水平上表明,SAHA与二甲双胍联用具有协同激活MG63细胞内源性凋亡途径的作用。除了凋亡标志性蛋白的检测外,通过Western Blot实验还验证了两药物对细胞凋亡相关蛋白表达的影响。在降低抑凋亡蛋白Mcl-1与XIAP上,两药有明显的协同作用。在促进促凋亡蛋白Bim的表达上,两药也有一定的协同作用。见图5。
细胞周期蛋白可通过调控细胞周期从而影响细胞的增殖,为了弄清楚两药联用抑制MG63细胞增殖的机制,还检测了细胞周期相关蛋白P27,P21,Cyclin D1的表达变化,结果发现联合后P27,P21上调明显,而Cyclin D1下调明显,见图5,说明细胞周期进程在联合用药后可能受到了阻滞。
3 讨 论
二甲双胍被广泛用于Ⅱ型糖尿病的治疗,它不仅能长期使用,而且还具有少毒性和相对便宜的优点。近几年的研究显示,二甲双胍可以抑制多种肿瘤细胞的增殖[2-3],且二甲双胍可通过激活磷酸腺苷蛋白激酶(Adenosine Monophosphate Activated Protein Kinase,AMPK)信号通路抑制多种肿瘤细胞的生长[7-8]而不依赖于其降血糖作用。组蛋白去乙酰化酶(Histone Deacetylase,HDAC)是一类在表观遗传学层面调控细胞基因表达的酶,当HDAC在一些肿瘤中过表达时,它与致癌因素是密切相关的[9-10],而HDAC抑制剂SAHA可以在微摩尔浓度水平诱导多种肿瘤细胞的凋亡和抑制肿瘤细胞的增殖[11-12]。
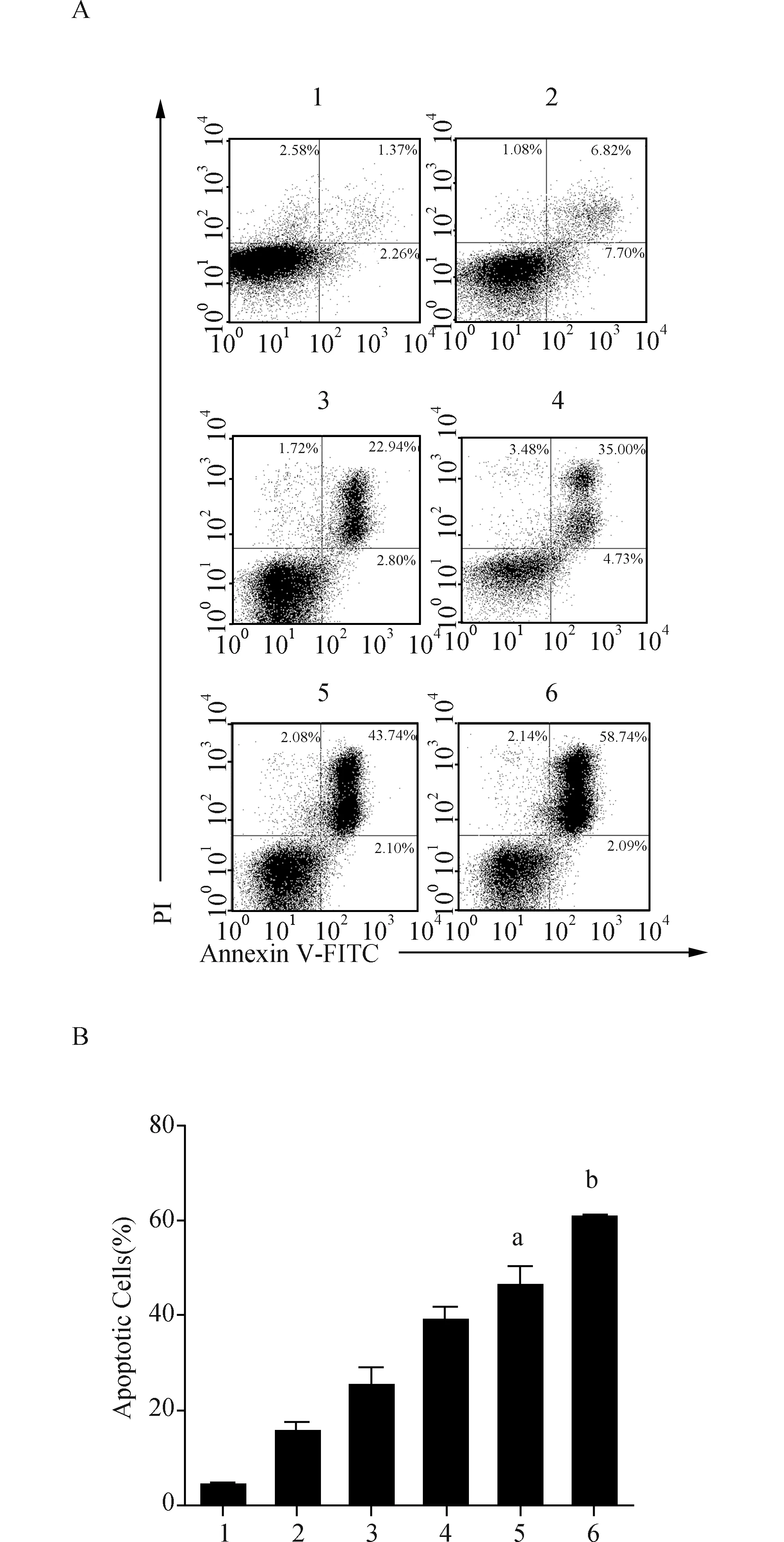
图4 二甲双胍和SAHA联合对MG63细胞凋亡的影响 A:凋亡代表图;B:三次结果统计图.1:Control;2:二甲双胍 1 mmol/L;3:SAHA 0.1 μmol/L;4:SAHA 0.2 μmol/L;5:二甲双胍1 mmol/L + SAHA 0.1 μmol/L;6:二甲双胍1 mmol/L + SAHA 0.2 μmol/L.与SAHA 0.1 μmol/L组比较,a:P<0.01;与SAHA 0.2 μmol/L组比较,b:P<0.001
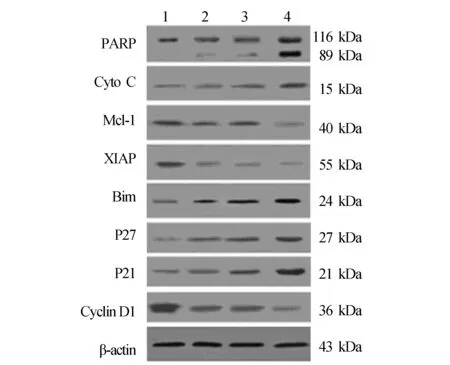
图5 MG63细胞的凋亡和周期相关蛋白的改变 1:Control;2:二甲双胍 1 mmol/L;3:SAHA 0.1 μmol/L;4:二甲双胍1 mmol/L + SAHA 0.1 μmol/L
相对于单个药物治疗的方式,两药联用具有用药剂量小,毒副作用低的优势,并能克服单药耐药性。因此,本研究不仅观察了二甲双胍和SAHA单药对骨肉瘤细胞增殖、克隆形成及凋亡的影响,也探索性的研究了二甲双胍与SAHA同时联合抑制肿瘤的作用。从研究结果可以看出,单独使用二甲双胍和SAHA都可在一定程度上抑制骨肉瘤细胞的增殖、促进其凋亡,但是在同时联合两种药物之后,这种抗肿瘤效应更加明显。这不仅为二甲双胍和SAHA的抗癌效应增加了新的基础研究证据,而且还有望在临床治疗中建立一种新型的毒副作用小、疗效好的联合化疗模型。
在初步探讨联合用药作用机制时,检测了细胞凋亡和周期相关的一些重要蛋白,结果发现Mcl-1,XIAP,Bim,Cyto C等凋亡相关蛋白和P27,P21,Cyclin D1等周期相关蛋白在联合用药时变化明显。由于相对于单个靶分子药物治疗的方式,两药联用具有多靶点的优势,所以推测两药联用可能是通过影响众多的信号通路蛋白的表达来达到抑制细胞增殖,促进细胞凋亡的作用。即二甲双胍与SAHA具有协同作用是因为两药物的联用能同时阻断多种信号通路而导致的,两药共同作用时,细胞凋亡的阈值降低了,达到了协同的效果,但是具体药物的最重要靶点是什么,靶点与靶点之间如何相互作用达到协同作用的,仍需继续深入探讨。目前研究认为二甲双胍的抗肿瘤作用可能与活化AMPK途径抑制肿瘤生长相关[7,8]。AMPK参与体内多种信号传导通路,包括mTOR通路、p53/p21途径、丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)通路及脂肪酸和蛋白代谢相关通路的调控,从而阻断细胞内蛋白合成,引起细胞生长停滞,促进细胞凋亡的发生。因此,二甲双胍有可能通过激活AMPK途径,导致癌细胞得不到足够的细胞信号来分裂而直接发挥抗肿瘤作用[13]。故SAHA与二甲双胍联合作用的机制有可能是通过对AMPK途径的共同激活,不过这一点尚需进一步深入研究。此外,由于本研究中二甲双胍和SAHA的用药浓度都很低,在IC50以下,故此时产生的联合作用可能有细胞毒作用无关。
综上所述,本文发现二甲双胍与SAHA治疗骨肉瘤具有协同治疗效果,并对可能的机制做了初步的探讨,为日后此治疗方法应用于临床治疗提供了前期的研究证据。
[1] Meng Q,Zheng M,Liu H,et al.TRAF6 regulates proliferation,apoptosis,and invasion of osteosarcoma cell[J].Mol Cell Biochem,2012,371(1-2):177-186.
[2] Tomic T,Botton T,Cerezo M,et al.Metformin inhibits melanoma development through autophagy and apoptosis mechanisms[J].Cell Death Dis,2011,1(2):e199.
[3] Ashinuma H,Takiguchi Y,Kitazono S,et al.Antiproliferative action of metformin in human lung cancer cell lines[J].Oncol Rep,2012,28(1):8-14.
[4] Li C1,Liu VW,Chan DW,et al.LY294002 and metformin cooperatively enhance the inhibition of growth and the induction of apoptosis of ovarian cancer cells[J].Int J Gynecol Cancer,2012,22(1):15-22.
[5] Chan DK,Miskimins WK.Metformin and phenethyl isothiocyanate combined treatment in vitro is cytotoxic to ovarian cancer cultures[J].J Ovarian Res,2012,5(1):19.
[6] Marks PA,Miller T,Richon VM.Histone deacetylases[J].Curr Opin Pharmacol,2003,3(4):344-351.
[7] Zakikhani M,Dowling RJ,Sonenberg N,et al.The effects of adiponectin and metformin on prostate and colon neoplasia involve activation of AMP-activated protein kinase[J].Cancer Prev Res (Phila),2008,1(5):369-375.
[8] Rocha GZ,Dias MM,Ropelle ER,et al.Metformin amplifies chemotherapy-induced AMPK activation and antitumoral growth[J].Clin Cancer Res,2011,17(12):3993-4005.
[9] Bajbouj K,Mawrin C,Hartig R,et al.P53-dependent antiproliferative and pro-apoptotic effects of trichostatin A (TSA) in glioblastoma cells[J].J Neurooncol,2012,107(3):503-516.
[10] Cheng DD,Yang QC,Zhang ZC,et al.Antitumor activity of histone deacetylase inhibitor trichostatin A in osteosarcoma cells[J].Asian Pac J Cancer Prev,2012,13(4):1395-1399.
[11] Wu Z,Ma C,Shan Z,et al.Histone deacetylase inhibitors suppress the growth of human osteosarcomas in vitro and in vivo[J].J BUON,2013,18(4):1032-1037.
[12] Shao Y,Gao Z,Marks PA,et al.Apoptotic and autophagic cell death induced by histone deacetylase inhibitors[J].Proc Natl Acad Sci USA,2004,101(52):18030-18035.
[13] 陈兆煜,王连唐,陈雁扬.二甲双胍通过激活腺苷酸活化蛋白激酶(AMPK)的抗肿瘤机制[J].中国肺癌杂志,2013,16(8):427-432.
EffectofCombiningMetforminandSuberoylanilideHydroxamicAcidontheProliferationandApoptosisofOsteosarcomaCells
SHEN Yingying,SU Xiaotao,OU Jun,et al
(InstituteofClinicalMedicine,FirstAffiliatedHospitalofUniversityofSouthChina,
Hengyang,Hunan421001,China)
ObjectiveTo investigate the effect of combining metformin and suberoylanilide hydroxamic acid (SAHA) on the proliferation and apoptosis of human osteosarcoma MG-63 cells.MethodsMG-63 cells were treated with metformin and SAHA for 72 h.The proliferation of MG-63 was tested by MTS assay.The capability of colony formation of MG-63 was assessed by clonogenicity assay.The cell apoptosis was detected by flow cytometry.The cell cycle and apoptosis associated proteins were assessed by Western Blot.ResultsMetformin or SAHA could inhibit the proliferation of MG-63 cells,respectively,and the cell proliferation was inhibited more obviously after combination of theses two drugs.Moreover,combination of two drugs could inhibit colony formation and promote cell apoptosis more significantly.P27,P21,Cyclin D1,Mcl-1,XIAP,Bim,Cytochrome C were significantly changed after the combination therapy.ConclusionCombination of metformin and SAHA could inhibit proliferation and colony formation and promote apoptosis more effectively in MG-63 cells.
metformin; suberoylanilide hydroxamic acid; osteosarcoma; proliferation; apoptosis
R738.1
A
10.15972/j.cnki.43-1509/r.2016.01.003
2015-10-24;
2015-12-28
国家自然科学基金(81502276).
*通讯作者,E-mail:henry200333@126.com.
蒋湘莲)
