苦荞酒中甜菜碱检测方法及抗氧化性研究
2016-12-23董孝元奚邦敏
董孝元,喻 斌,吴 昊,奚邦敏,李 良
(武汉天龙黄鹤楼酒业有限公司,湖北武汉430050)
苦荞酒中甜菜碱检测方法及抗氧化性研究
董孝元,喻斌,吴昊,奚邦敏,李良
(武汉天龙黄鹤楼酒业有限公司,湖北武汉430050)
利用HPLC检测苦荞酒中甜菜碱的含量,并对苦荞酒体外抗氧化活性进行研究。利用HPLC检测甜菜碱的最佳条件为NH2柱,乙腈∶水=90∶10为流动相,流速为0.7m L/m in,检测波长为195 nm,柱温为30℃,运行时间为40min,进样量为20μL,在5.0~200.0mg/L质量浓度范围内线性良好,加标回收率在98.23%~102.56%之间,该方法适用于苦荞酒中的甜菜碱含量检测,方法简单、重复性好。苦荞酒体外抗氧化实验以Vc和BHT为对照,结果表明,苦荞酒清除DPPH、·OH和·O2-的EC50分别为37.29mg/L、66.49mg/L、107.00mg/L,对照品Vc和BHT清除DPPH、·OH和·O2-的EC50是苦荞酒的76%、75%和91%;132%、102%和115%。苦荞酒的清除能力强于BHT,低于Vc,表明苦荞酒有很好的抗氧化能力。
苦荞酒; 甜菜碱; 苦荞黄酮; 抗氧化能力
枸杞属于茄科枸杞属多年生灌木,主要分布在陕西北部黄土高原、宁夏、青海、甘肃、内蒙古、新疆和西藏等地区。藏医以其成熟果实入药,治疗心热病、心脏病,并且药效明显,民间常将枸杞用作滋补强壮、明目及降压药,故常将枸杞与琼珍灵芝、长白山人参、东阿阿胶并称为中药四宝。枸杞富含甜菜碱[1-2],甜菜碱是枸杞中重要的生物活性物质之一,在体内起甲基供体的作用,具有抗脂肪肝[3]、降压和抗肿瘤的作用[4]。
苦荞(Fagopyrum tataricum)属于蓼科(Polygonaceae)荞麦属(Fagopyrum Mill),苦荞麦主要分布于我国云贵高原、西南地区及甘肃、陕西等地[5]。研究表明,苦荞提取物中富含黄酮类物质,黄酮类物质主要是芦丁、槲皮素及其糖苷、山奈酚及其糖苷[6-11],这些物质具有很强的生物活性,能降低血糖[12]、血脂[13]、尿糖,具有抗疲劳、抗衰老、抗炎镇痛[14]、抑制肿瘤细胞的作用[15-16]。目前检测甜菜碱的方法包括酸碱滴定法、凯氏定氮法、紫外分光光度法、高氯酸非水滴定法、HPLC法、离子色谱法。其中HPLC是比较通用的检测方法,在检测的准确性、重复性和操作方便上有满意的结果。但是,由于苦荞酒中具有诸多功效成分,对检测具有极大的干扰,同时目前,采用HPLC检测苦荞酒中甜菜碱的含量未见报道。
本研究以“黄鹤小乔”苦荞酒为供试样品,利用HPLC优化甜菜碱的检测方法,再通过测定1-二苯基-2-三硝基苯肼自由基(DPPH)、羟基自由基(·OH)和超氧阴离子(·O2-)的清除率,评价“黄鹤小乔”苦荞酒的体外抗氧化活性,旨在为“黄鹤小乔”苦荞酒的研究开发利用提供实验数据及理论依据。
1 材料与方法
1.1材料与试剂
“黄鹤小乔”苦荞酒(苦荞酒):武汉天龙黄鹤楼酒业有限公司提供;乙腈(色谱级)j.t.baker;1,1-二苯基-2-三硝基苯肼自由基(DPPH),sigma;Vc,2,6-二叔丁基-4-甲基苯酚(BHT),北京坛墨质检科技有限公司;无水乙醇,FeSO4,H2O2,水杨酸,Tris-HCl缓冲液(pH8.2),邻苯三酚,国药集团化学试剂有限公司。
1.2仪器与设备
Agilent1260液相色谱仪,安捷伦科技(中国)有限公司;ME204型电子分析天平,梅特勒-托利多(中国)有限公司;UV-2700分光光度计,岛津企业管理(中国)有限公司;HH-S型电热恒温水浴锅,上海索普仪器有限公司;DHG-9070A型数显鼓风干燥箱,上海索普仪器有限公司;KQ-250E型超声波仪,昆山市超声仪器有限公司。
1.3实验方法
1.3.1甜菜碱含量的检测与优化
1.3.1.1色谱条件
NH2柱(250mm×4.6mm,5μm);乙腈∶水(90∶10)为流动相,流速为0.7m L/m in,检测波长为195 nm,柱温为30℃,运行时间为40m in,进样量为20μL,理论塔板数不低于5000。
1.3.1.2标准品溶液的制备
精密称取甜菜碱对照品27.0 mg,用90%乙腈水溶液溶解定容至25.00 m L,精密吸取0.5m L、1.0m L、2.0 m L、3.0 m L、4.0m L、5.0m L于10 m L容量瓶中,用90%乙腈水溶液定容至刻度,得到不同浓度的标准品溶液,用0.45μm微孔滤膜过滤后作为对照品溶液备用。
1.3.1.3标准曲线的建立
准确吸取对照品溶液各20μL,HPLC色谱分析,得到各浓度下对照品溶液的色谱峰面积,以浓度为横坐标(X),相对应的色谱峰面积为纵坐标(Y),建立标准曲线,按照信噪比3∶1确定检测限。
标准曲线为Y=6.965X-40.415,R2=0.9999,检出限为5 ppm。
1.3.2苦荞酒的抗氧化研究
1.3.2.1苦荞黄酮含量的测定
参照Hossain[17]的方法,准确称取芦丁标准品50.0mg,以60%vol乙醇溶解,置于100m L容量瓶中,配成500mg/L的芦丁标准溶液,精密吸取标准溶液0.0、1.0m L、2.0m L、3.0m L、4.0m L、5.0m L,分别置于25m L容量瓶中,分别加入1m L的5%NaNO2溶液,混匀,放置6m in,加入1m L的10%A l(NO3)3溶液,混匀,放置6min,加4m L 20%NaOH溶液,定容至25m L,放置15m in,在510 nm处测定吸光度。以芦丁质量浓度为横坐标(X),吸光度为纵坐标(Y),绘制标准曲线,标准方程为Y=0.01057X-0.00577,R2=0.9999,按照标准曲线的方法,测定苦荞酒中总黄酮的含量。
1.3.2.2清除DPPH自由基活性的测定
参考参考文献[18-19]准确称取DPPH标准品12.7mg,用无水乙醇溶解并定容至100m L,配成0.32mmol/L的DPPH储备液,置于冰箱中备用。将4.0m L无水乙醇与4m L各浓度样品加入同一试管中,摇匀,在黑暗中放置30m in,以无水乙醇为空白在517 nm处测定其吸光度A空白;用4m L的无水乙醇与4m L 0.32mmol/L的DPPH溶液加入同一试管中,摇匀,在黑暗中放置30m in,以无水乙醇为空白在517 nm测定其吸光度A对照;另取4m L不同浓度的样品溶液与4m L 0.32mmol/L的DPPH溶液于同一试管中,摇匀,在黑暗中放置30min,以无水乙醇作为空白,在517 nm处测定其吸光度A样品。按下式计算DPPH自由基清除率。
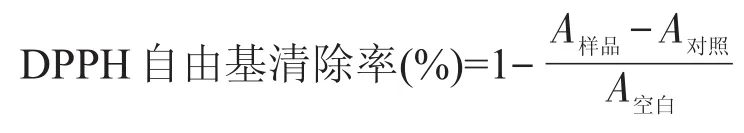
1.3.2.3清除羟基自由基的测定
参考参考文献[20-21]在试管中依次加入2m L 6mmol/L FeSO4溶液,2m L不同浓度的样品溶液,2m L 6mmol/L H2O2溶液,摇匀,静置10m in,再加入2m L 6mmol/L水杨酸溶液,摇匀,静置30m in后于530 nm处测定其吸光度A样品,用蒸馏水代替水杨酸按上述方法测定吸光值为A对照,用蒸馏水代替样品溶液按上述方法测定吸光值为A空白。以下式计算羟基自由基的清除率。
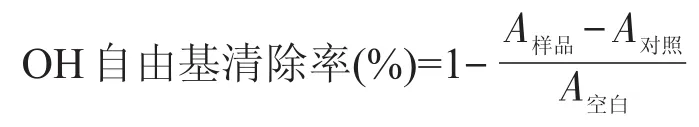
1.3.2.4清除超氧阴离子自由基实验
参考参考文献[22-23]在25℃的恒温水浴锅中,将0.1mol/L pH8.2 Tris-HCl缓冲液和5mmol/L邻苯三酚水浴保温10m in后,取5.9m L pH8.2的Tris-HCl缓冲液,加0.1m L 5mmol/L邻苯三酚,摇匀,在325 nm下立即测定,每隔0.5m in测定依次吸光值(以pH8.2的Tris-HCl缓冲溶液为空白),计算出邻苯三酚的自氧化率,自氧化率控制在0.060~0.065A/m in,至5m in止,将所得吸光值与时间t(m in)进行回归分析,其斜率为V0;加入样品后氧化率测定:取5.7m L pH8.2的Tris-HCl缓冲液,加待测样品0.2m L,0.1m L 5mmol/L邻苯三酚,摇匀,立即按同上步骤测定(以pH8.2的Tris-HCl缓冲液为空白对照)Vs。以下式计算清除超氧阴离子的清除率。
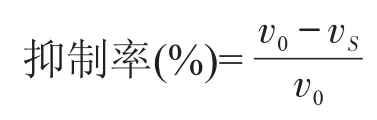
2 结果与分析
2.1色谱条件的优化
本实验采用90%乙腈水溶液作为流动相,在对色谱条件的筛选过程中,随着乙腈浓度的降低,基线信号噪声变强,流速变大时,对氨基柱的损伤程度会增大,最终选择90%乙腈水溶液作为流动相,流速为0.7m L/m in。
2.1.1精密度实验
按照1.3.1.2方法配制的甜菜碱标准溶液在相同条件下,连续进行6次平行实验,考察方法的精密度,根据其峰面积计算精密度,利用spss19.0计算其RSD为2.33%,表明该方法的精密度良好。
2.1.2稳定性实验
按照1.3.1.2方法配制的甜菜碱标准品溶液在相同条件下,室温放置,分别在0、2 h、4 h、8 h、10 h、12 h进样,考察方法的稳定性,根据其峰面积计算稳定性,利用spss19.0计算其RSD为1.23%,表明该方法的稳定性良好。
2.1.3重复性实验
按照1.3.1.2方法配制的同一甜菜碱标准溶液在相同条件下,连续进样6次,根据其峰面积计算重复性,其利用spss19.0其RSD为0.98%,表明该方法的重复性达到分析的要求。
2.1.4加样回收实验
本实验采用加样回收法,按照1.3.1.2方法配制已知浓度甜菜碱样品6份,分别精密加入不同量的甜菜碱标准品含量,按照样品溶液的制备方法处理,在同样色谱条件下测定甜菜碱的含量,其样品的回收率为98.23%~102.56%,表明该方法的准确率较高。
2.2抗氧化实验结果
2.2.1清除DPPH能力的测定结果
苦荞酒、Vc和BHT对DPPH自由基清除效果见图1,利用spss19.0计算苦荞酒的EC50为37.29mg/L,而Vc和BHT的EC50分别为28.34mg/L、49.29mg/L。苦荞酒中抗氧化物质的EC50约是Vc和BHT的0.76倍和1.32倍,表明苦荞酒中抗氧化物质有较大的抗氧化活性。
2.2.2清除羟基自由基能力的测定结果
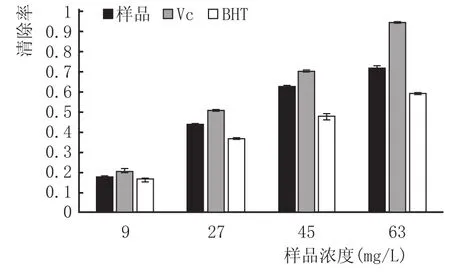
图1 不同浓度的Vc、BHT和苦荞黄酮对DPPH自由基的清除作用
苦荞酒、Vc和BHT对羟基自由基清除效果见图2,利用spss19.0技术计算苦荞酒的EC50为66.49mg/L,而Vc和BHT的EC50分别为49.67mg/L和67.75mg/L。苦荞酒中抗氧化物质的EC50分别是Vc和BHT的0.75倍和1.02倍,表明苦荞酒有很强的清除羟基自由基的能力。
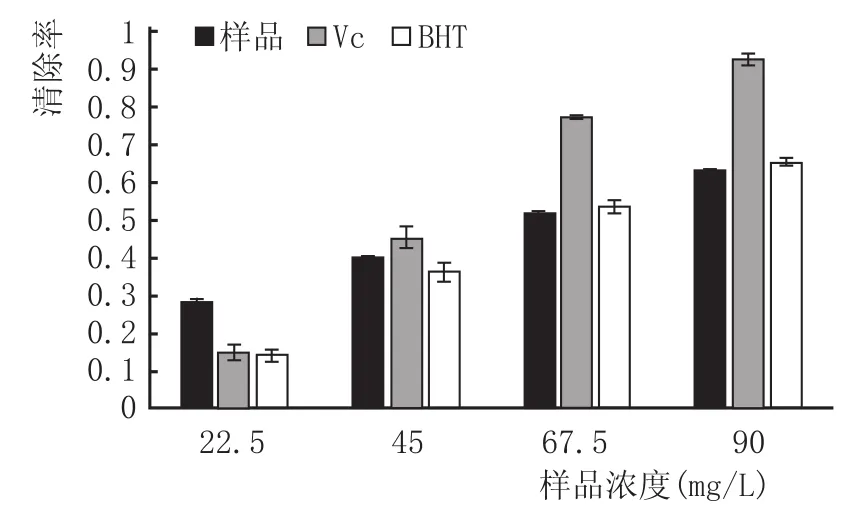
图2 不同浓度的Vc、BHT和苦荞黄酮对·OH的清除作用
2.2.3清除超氧阴离子能力的测定结果
苦荞酒、Vc和BHT对·O2-清除结果见图3,利用spss19.0计算苦荞酒的EC50为107.00mg/L,而Vc和BHT的EC50分别为97.23mg/L和122.62mg/L。苦荞酒中抗氧化物质的EC50分别为Vc和BHT的0.91倍和1.15倍,表明苦荞酒有很强的清除超氧阴离子的能力。

图3 不同浓度的Vc、BHT和苦荞黄酮对超氧阴离子的清除作用
3 结论
通过优化甜菜碱的HPLC的检测方法,得到HPLC液相条件为氨基柱,乙腈∶水(90∶10)为流动相,流速为0.7m L/min。检测波长为195 nm,运行时间为40m in,进样量为20μL。
通过对苦荞酒中抗氧化能力测定表明,苦荞酒具有很强的清除DPPH、羟基自由基和超氧阴离子的能力。
苦荞酒清除DPPH的EC50为37.29mg/L,而Vc和BHT的EC50分别为28.34mg/L、49.29mg/L,苦荞酒中抗氧化物质的EC50约是Vc和BHT的0.76倍和1.32倍。
苦荞酒清除·OH的EC50为66.49mg/L,而Vc和BHT的EC50分别为49.67mg/L和67.75mg/L。苦荞酒中抗氧化物质的EC50分别是Vc和BHT的0.75倍和1.02倍。
苦荞酒清除·O2-的EC50为107.00 mg/L,而Vc和BHT的EC50分别为97.23mg/L和122.62mg/L。苦荞酒中抗氧化物质的EC50分别为Vc和BHT的0.91倍和1.15倍。
苦荞酒的抗氧化能力强于BHT,略低于Vc,表明苦荞酒具有很强的抗氧化能力。
[1]耿丹丹,谭亮,肖远灿,等.离子色谱法测定黑果枸杞中的甜菜碱[J].食品科学,2015,36:145-147.
[2]党军,王瑛,陶燕铎,等.微波法提取枸杞叶甜菜碱工艺的研究[J].氨基酸和生物资源,2011(3):27-29.
[3] 张林.甜菜碱对大鼠离体脂肪组织影响的实验研究[D].兰州:兰州大学,2009.
[4]刘燕燕,曾新安,朱思明,等.甜菜碱的生理功能与药物活性[J].现代食品科技,2008,103(1):96-100.
[5]徐笑宇.高黄酮苦荞资源鉴选与评价利用研究[D].杨凌:西北农林科技大学,2015.
[6]尤玲玲,刘幻幻,李晓雁,等.苦荞黄酮的纯化及抗氧化活性的研究[J].中国粮油学报,2014,29(8):23-27.
[7]徐宝才,肖刚,丁霄霖,等.液质联用分析测定苦荞黄酮[J].食品科学,2003(6):113-117.
[8]Jiang SJ,Liu Q,Xie Y X,etal.Separation of five flavonoids from tartary buckwheat(Fagopyrum tataricum(L.)Gaertn)grainsviaoff-line two dimensionalhigh-speed counter-current chromatography[J].Food Chem istry,2015,186(1):153-159.
[9]LiFH,Zhang X L,Zheng SJ,etal.The composition, antioxidantand antiproliferative capacitiesof phenolic compoundsextracted from tartary buckwheatbran[Fagopyrum tartaricum(L.)Gaerth][J].Journalof Functional Foods,2016, 22:145-155.
[10]Ren Q,Wu CS,Ren Y,etal.Characterization and identification of the chem ical constituents from tartary buckwheat(Fagopyrum tataricumgaertn)by high performance liquid chromatography photodiodearray detector/linear ion trap FTICR hybridmass spectrometry[J]. Food Chem istry,2013,136(3-4):1377-1389.
[11]朱琳,任清,徐笑颖.高速逆流色谱分离纯化苦荞中芦丁、槲皮素[J].食品科学,2014(2):47-50.
[12]王斯慧,黄琬凌,陈庆松,等.芦丁、槲皮素对α-葡萄糖苷酶活性抑制研究[J].中国酿造,2012(1):133-135.
[13]王敏,魏益民,高锦明.苦荞黄酮的抗脂质过氧化和红细胞保护作用研究[J].中国食品学报,2006(1):278-283.
[14] 周小理,成少宁,周一鸣,等.苦荞芽中黄酮类化合物的抑菌作用研究[J].食品工业,2010(2):12-14.
[15]赵强,索有瑞,李天才,等.响应面法优化苦荞皮中总黄酮超声波提取工艺[J].食品科学,2014(16):64-70.
[16]许效群,刘志芳,霍乃蕊,等.苦荞糠皮总黄酮的抗氧化活性及免疫调节活性[J].中国食品学报,2012(6):42-47.
[17]Hossain M A,KalbaniM SA,FarsiSA JA,etal. Comparative study of totalphenolics,flavonoids contentsand evaluation of antioxidantand antimicrobialactivitiesof differentpolarities fruits crudeextractsof Daturametal L[J]. Asian Pacific Journalof TropicalDisease,2014,4(5):378-383.
[18]Grajeda-lglesiasC,Salas E,Barouh N,etal.Antioxidant activity of protocatechuatesevaluated by DPPH,ORAC,and CATmethods[J].Food Chem istry,2016,194(1):749-757.
[19]JabbariM,JabbariA.Antioxidantpotentialand DPPH radical scavenging kineticsofwater-insoluble flavonoid naringenin in aqueous solution ofm icelles[J].Colloidsand SurfacesA: Physicochem icaland Engineering Aspects,2016,489(20):392-399.
[20]Yang ZH,Luo S,WeiZS,etal.Rate constantsof hydroxyl radicaloxidation of polychlorinated biphenyls in thegas phase:A single-descriptorbased QSAR and DFT study[J]. Environmental Pollution,2016,211:157-164.
[21]Chen H S,Diao JJ,LiY Y,etal.The effectivenessof clove extracts in the inhibition of hydroxyl radicaloxidationinduced structuraland rheologicalchanges in porcine myofibrillarprotein[J].MeatScience,2016,11:60-65.
[22]Masuoka N,NiheiK,MaetaA,etal.Inhibitory effectsof cardolsand related compoundson superoxide aniongeneration by xanthine oxidase[J].Food Chem istry,2015, 166(1):270-274.
[23]TsaiYR,Huang L J,Lin H Y,etal.Inhibition of formyl peptide-stimulated superoxide aniongeneration by Fal-002-2 occursmainly through theblockadeof the p21-activated kinaseand protein kinase C signaling pathways in ratneutrophils[J].European Journalof Pharmacology,2013, 701(1-3):114-123.
Detection of Betaine in Tartary BuckwheatW ineand its Antioxidant Activity
DONG Xiaoyuan,YU Bin,WU Hao,XIBangm in and LILiang
(Wuhan Huanghelou Distillery Co.Ltd.,Wuhan,Hubei430050,China)
Betaine content in tartary buckwheatw ine was detected by HPLC.Meanwhile,in vitro antioxidant activity of tartary buckwheat w inewas studied.The optimum detection conditionsof betainewere summed up as follows:NH2column,acetonitrile∶water=90∶10 as themobile phase,flow ing rate was 0.7m L/m in,the detection wavelength was 195 nm,column temperature was at30℃,the operating timewas 40min,sample injection quantity was 20μL.Good linear relation presented between 5.0~200mg/L concentration range,and the adding standard recoverywasbetween 98.23%and 102.56%.Suchmethod was suitable for detecting betaine in tartary buckwheatw ine and ithad the advantages including simple operation andgood repeatability.In in vitro antioxidant experiment,Vc and BHT were used as the control.The results showed that,the EC50values of scavenging DPPH,·OH and·O2-were 37.29mg/L,66.49mg/L,107.00mg/L respectively;in the controlgroupsof Vc/BHT,the EC50valuesof scavenging DPPH,·OH and·O2-were 76%,75%and 91%/132%,102%and 115%of thatof tartary buckwheatw ine.This study proved that,the scavenging capacity of tartary buckwheatw ine is superior to BHT but inferior to Vc,and tartary buckwheatw inehasgood antioxidantactivities.
tartary buckwheatw ine;betaine;buckwheat flavonoid;antioxidantactivity
TS262.3;TS261.7;TS261.4
A
1001-9286(2016)11-0037-04
10.13746/j.njkj.2016251
湖北省武汉市汉阳英才计划。
2016-08-10
董孝元(1988-),男,硕士研究生,研究方向:配制酒研究与开发,Email:h-dongxiaoyuan@gujing.com.cn。
李良(1982-),男,工程师,硕士研究生,研究方向:白酒研究与开发,Email:h-liliang@gujing.com.cn。
优先数字出版时间:2016-10-12;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20161012.1511.017.htm l。
