补肾解毒化瘀方联合CPT化疗方案治疗老年多发性骨髓瘤临床观察
2016-12-23倪海雯姜鹏君孔祥图
倪海雯,姜鹏君,孔祥图
(江苏省中医院血液科,江苏 南京 210029)
补肾解毒化瘀方联合CPT化疗方案治疗老年多发性骨髓瘤临床观察
倪海雯,姜鹏君,孔祥图
(江苏省中医院血液科,江苏 南京 210029)
目的 观察补肾解毒化瘀方联合CPT化疗方案治疗老年多发性骨髓瘤的临床疗效及其对免疫功能的影响。方法 将40例老年多发性骨髓瘤患者随机分为治疗组与对照组,每组20例,两组均采用CPT化疗方案,28 d为1个周期,6个周期评价疗效;治疗组同时加用补肾解毒化瘀方治疗。观察临床疗效、生活质量变化及中医临床症状改善情况,治疗前后分别观察血管内皮生长因子(vascular endothelial growth factor, VEGF)、白细胞介素-6(interleukin-6, IL-6)及调节性T细胞的水平变化情况。结果 治疗组与对照组近期疗效分布差异无统计学意义(P>0.05);治疗组骨痛缓解效果显著优于对照组(P<0.05);治疗组生活质量改善效果优于对照组(P<0.05);中医临床证候改善方面,治疗组优于对照组(P<0.05)。治疗前两组VEGF、IL-6水平差异无统计学意义(P>0.05),治疗3个月及6个月后均显著下降(P<0.05),且治疗组VEGF、IL-6水平较对照组下降显著(P<0.05)。调节性T细胞表达比较,治疗前患者CD4+CD25+、CD4+CD25high、CD4+CD25highCD127low细胞比例均显著升高(P<0.05),但治疗后两组细胞比例均显著下降(P<0.05),且治疗组细胞比例较对照组下降更明显(P<0.05)。结论 补肾解毒化瘀方联合CPT化疗方案治疗多发性骨髓瘤有助于改善患者临床症状,提高免疫功能。
补肾解毒化瘀法;CPT化疗方案;生活质量;多发性骨髓瘤
多发性骨髓瘤是浆细胞的克隆性增生的恶性肿瘤。其发病率约占所有肿瘤的1%,占血液系统恶性肿瘤的10%,是好发于老年人的血液系统肿瘤。目前,通过评估多发性骨髓瘤患者早期遗传学异常进行更细微的预后分层治疗,包括硼替唑米、沙利度胺、雷那度胺等新药的使用,该病的临床疗效已有极大提高,形成了以造血干细胞移植,含有新药的化疗方案,针对信号通路和骨髓微环境的治疗等综合及个体化的治疗模式。但是由于该病发病年龄偏大,发现时多种合并症的存在,限制了上述包括造血干细胞移植、化疗等治疗手段的应用,甚至部分分子遗传学高危的患者存在原发的耐药。硼替唑米、雷那度胺的应用常常因为经济花费大以及神经系统不良反应而受到限制。因此,对于大部分患者来说本病仍然是不可治愈的,严重影响患者的生活质量。江苏省中医院血液科采用中西医结合疗法治疗多发性骨髓瘤,在化疗的同时使用补肾解毒化瘀法为基本大法,拟定基本方,取得了较好的疗效。本研究选取发病年龄大、不宜强烈治疗的患者,采用分组研究的方法,比较单纯化疗、中药联合化疗对患者临床症状和免疫功能的影响。
1 临床资料
1.1 诊断标准
1.1.1 多发性骨髓瘤诊断标准 按照《中国多发性骨髓瘤诊治指南》[1]的诊断标准和分型、分期标准进行诊断。
1.1.2 中医证候诊断标准 参照《中医病证诊断疗效标准》[2]拟定肾虚毒瘀证诊断标准。
1.2 纳入标准 ①符合多发性骨髓瘤的西医诊断标准且年龄在65~80岁之间。②符合中医证候诊断标准。③受试者知情,并签署同意书者。
1.3 排除标准 ①合并有昏迷,或有心脑血管、肝、肾等系统严重并发症。②1个月内接受过其他化疗方案者,或目前正在使用其他化疗。③不能按时完成检查,资料不全,无法判定疗效者。
1.4 病例脱落或中止标准 ①症状尚存、未完成全程观察、自行退出试验者。②出现严重不良反应者。
1.5 一般资料 江苏省中医院血液科2012年3月至2015年3月共收治多发性骨髓瘤老年患者40例。采用随机数字表法将其分为2组,每组20例。治疗组男14例,女6例;年龄65~75岁,平均年龄(70.21±0.65)岁;其中IgA型4例,IgG型9例,轻链型7例;Ⅰ期9例,Ⅱ期7例,Ⅲ期4例。对照组男13例,女7例;年龄64~79岁,平均年龄(69.31±0.82)岁;其中IgA型4例,IgG型8例,轻链型8例;Ⅰ期8例,Ⅱ期7例,Ⅲ期5例。两组性别、年龄、分型、分期比较,差异无统计学意义(性别:χ2=0.114,P=0.736;年龄:t=0.623,P=0.537;分型:χ2=0.425,P=0.809;分期:χ2=3.173,P=0.685),具有可比性。另设10例正常对照,其中男4例,女6例,年龄65~78岁,平均年龄(68.26±0.47)岁。
2 方法
2.1 治疗方法 对照组患者用CPT化疗方案:环磷酰胺50 mg,每日2次,连用7 d,口服;强的松1 mg/kg,口服,连用7 d;沙利度胺150 mg,每晚1次,口服,间歇3周。28 d为1个疗程,连用6个疗程。治疗组患者在CPT化疗方案基础上加服补肾解毒化瘀方药。方剂组成:熟地黄、山茱萸各15 g,补骨脂、菟丝子、太子参、黄芪、半枝莲、三棱、莪术、姜黄、土鳖虫各10 g。随证加减:肾阳虚者加狗脊、续断各10 g,肾阴虚者加女贞子、龟甲各10 g,旱莲草15 g,瘀毒明显者加白毛藤、喜树根、蛇莓各10 g,紫丹参15 g,浮肿明显加茯苓、泽泻各15 g,猪苓12 g,腹胀纳呆者加用苏叶10 g、陈皮6 g。中药煎剂每日1剂,分早晚2次口服,连续服用6个月。
2.2 指标观察方法
2.2.1 临床疗效判定标准 按照《中国多发性骨髓瘤诊治指南》[1]国际骨髓瘤工作组制定临床疗效判定标准。分为严格意义的完全缓解(stringent complete response, sCR)、完全缓解(complete response, CR)、非常好的部分缓解(very good complete response, VGPR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD)。
2.2.2 中医证候疗效评价指标 参照《中药新药临床应用指导原则》[3],主要观察患者肾虚瘀毒证的常见症状,包括倦怠乏力、胁肋或腰骶疼痛、发热、气短、头晕耳鸣、腰膝酸软、舌质淡暗、舌下络脉迂曲、脉沉无力,按轻度、中度、重度分为3级,主症分别计2、4、6分,轻症分别计1、2、3分。中医证候疗效评定按尼莫地平法计算。证候积分下降百分率=[(治疗前积分-治疗后积分)÷治疗前积分]×100%。临床痊愈:证候积分下降百分率≥95%;显效:70%≤证候积分下降百分率<95%;有效:30%≤证候积分下降百分率<70%;无效:证候积分下降百分率<30%。
2.2.3 骨痛程度观察 按照WHO的数字分级量表(numerical rating scale, NRS)评估疼痛程度,0为无痛;1~3为轻度疼痛;4~7为中度疼痛;8~10为重度疼痛。
2.2.4 生活质量改善评价 按Karnofsky评分,参照《体内状况计分标准》[4],凡在治疗后较治疗前增加10分以上者为提高;增加或减少在10分以内者为稳定;减少10分以上者为降低。
2.2.5 调节性T细胞的检测 流式细胞仪(FC-500,贝克曼-库尔特)分别于治疗前、治疗后3个月、治疗后6个月检测外周血CD4+/CD25+、CD4+/CD25high、CD4+/CD25highCD127low调节性T细胞比例。
2.2.6 细胞因子的检测 采用ELISA法分别于治疗前、治疗后3个月、治疗后6个月检测血清白细胞介素-6(interleukin-6, IL-6)、血管内皮生长因子(vascular endothelial growth factor, VEGF)水平。

3 结果
3.1 两组患者近期疗效比较 两组患者近期疗效的分布比较,差异无统计学意义(P>0.05),尚不能认为治疗组近期疗效优于对照组。见表1。

表1 两组患者近期疗效比较
3.2 两组患者治疗前后骨痛评分比较 治疗前两组患者骨痛评分比较,差异无统计学意义(P>0.05);与治疗前比较,两组患者治疗后骨痛评分均明显下降(P<0.05);治疗组患者骨痛评分下降程度明显大于对照组(P<0.05)。见表2。
3.3 两组患者生活质量改善情况比较 两组患者生活质量改善情况比较,差异具有统计学意义(P<0.05),结合平均秩次可以认为治疗组患者生活质量改善效果优于对照组。见表3。
3.4 两组患者中医证候疗效比较 两组患者经化疗后中医证候疗效比较,差异具有统计学意义(P<0.05),结合平均秩可以认为治疗组中医证候疗效优于对照组。见表4。
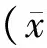
表2 两组患者治疗前后骨痛评分比较±s)
注:与同组治疗前比较,*P<0.05;与对照组比较,#P<0.05。

表3 两组患者生活质量改善情况比较
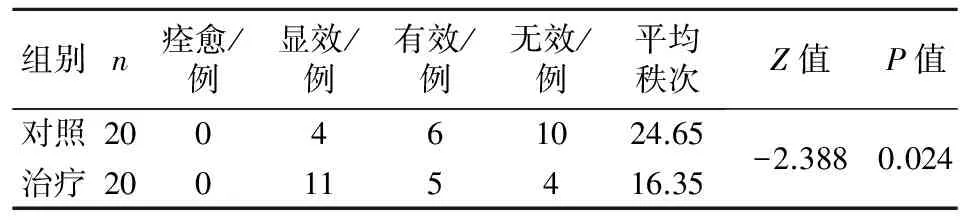
表4 两组患者中医证候疗效比较
3.5 多发性骨髓瘤患者调节性T细胞表达水平的变化及补肾解毒化瘀方联合CPT化疗方案的干预作用 治疗前,与正常对照组相比,多发性骨髓瘤患者CD4+CD25+、CD4+CD25high、CD4+CD25highCD127low细胞比例均升高,差异具有统计学意义(P<0.05),说明多发性骨髓瘤患者体内特征与正常人有显著差异,见表5。但在治疗3个月及6个月后,各组内CD4+CD25+、CD4+CD25high、CD4+CD25highCD127low细胞比例均显著下降(P<0.05),可以认为通过治疗患者病情得到了改善;两组之间比较,治疗3个月后,两组间CD4+CD25+、CD4+CD25high、CD4+CD25highCD127low细胞比例下降程度差异显著(P<0.05),治疗组细胞比例下降更明显,但在治疗6个月后两组间CD4+CD25high及CD4+CD25highCD127low细胞比例下降程度差异不明显(P<0.05),而两组间CD4+CD25+差异显著,见表6。结果提示治疗组治疗效果优于对照组。
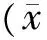
表5 多发性骨髓瘤患者调节性T细胞表达的变化±s)
注:与正常对照组比较,*P<0.05。
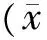
表6 对照组和治疗组多发性骨髓瘤患者治疗前后调节性T细胞表达比较±s)
注:与同组治疗前比较,#P<0.05;与同组治疗3个月后比较,△P<0.05;与同时点对照组比较,*P<0.05。
3.6 多发性骨髓瘤患者细胞因子分泌的变化及补肾解毒化瘀方联合CPT化疗方案的干预作用 治疗前,与正常对照组相比,多发性骨髓瘤患者血清IL-6、VEGF水平均显著升高(P<0.05),说明骨髓瘤使患者体内特征发生显著变化。见表7。但在治疗3个月及6个月后,对照组(西药组)与治疗组(中西医结合组)各组内血清IL-6、VEGF水平均显著下降(P<0.05),说明通过两种方法治疗患者病情都得到改善。两组组间比较,治疗3个月后,两组间多发性骨髓瘤患者血清IL-6、VEGF水平下降程度差异显著(P<0.05),治疗组IL-6、VEGF水平下降更明显;同样,治疗6个月后,两组间血清IL-6、VEGF水平下降程度差异显著(P<0.05),且治疗组下降更明显,见表8。从对细胞因子分泌影响的角度,说明中西药结合组治疗效果优于西药组。

表7 多发性骨髓瘤患者血清IL-6、VEGF的变化
注:与正常对照组比较,*P<0.05。
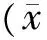
表8 对照组和治疗组多发性骨髓瘤患者治疗前后血清IL-6和VEGF水平比较±s)
注:与同组治疗前比较,#P<0.05;与同组治疗3个月后比较,△P<0.05;与同时点对照组比较,*P<0.05。
4 讨论
多发性骨髓瘤是发生在B细胞分化终末阶段(浆细胞阶段)的肿瘤,一些细胞因子的异常可影响正常B细胞激活、发育和分化,对多发性骨髓瘤的发生、发展均起到关键性作用。IL-6是维持多发性骨髓瘤细胞生长和促进其增殖最为关键的一种细胞因子。IL-6涉及参与多发性骨髓瘤的多条信号通路,其中最为主要的IL-6介导的两条信号通路是JAK/STAT途径、Ras/MAPK途径的级联活化反应。IL-6通过调节Bcl-2表达实现其对骨髓瘤细胞凋亡的抑制作用,促进Bcl-2家族成员Bcl-xL以及Mcl-1等基因的表达,最终IL-6通过这些抗凋亡蛋白的表达介导多发性骨髓瘤细胞的存活与抗凋亡作用[5]。IL-6还激活PI3K/Akt/NF-κB途径,通过Caspase3的上游基因,共同发挥抗凋亡作用[6-7]。
目前多发性骨髓瘤的靶向治疗可通过靶向阻断胞内IL-6信号转导的路径实现,主要是靶向JAK/STAT和靶向丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)的药物开发以及抗RAS疗法等方面。如CYT387使骨髓瘤IL-6信号转导途径的JAK/STAT途径受抑,从而诱导多发性骨髓瘤细胞的凋亡[8]。
VEGF是目前已知最强的内皮细胞选择性促血管生成因子,能促进肿瘤组织血管生成,目前研究显示VEGF在多发性骨髓瘤细胞株及多发性骨髓瘤患者中高表达[9-10]。Valkovic等[11]研究VEGF与骨髓瘤Durie-Salmon分期有关,Durie-Salmon分期越早,则VEGF表达水平越低。李欣等[12]研究显示,多发性骨髓瘤患者血清VEGF水平与疗效、生存期具有相关性,是多发性骨髓瘤危险预后因素。
多发性骨髓瘤是一种免疫细胞缺陷的肿瘤,调节性T细胞的异常在该病的发生及发展中也具有重要作用。CD4+CD25+调节性T细胞是一群具有免疫负调控功能的T细胞亚群,在维持对自身成分免疫耐受的同时,也可能阻止机体对自体同源肿瘤细胞的免疫,导致肿瘤的免疫抑制及免疫逃逸。CD4+CD25+是调节性T细胞中的重要群体,占人类和鼠外周血CD4+T细胞的5%~10%,在人类除表达CD25外,还组成性表达叉头样转录因子3(fork head box protein 3,FOXP3)、细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen 4,CTLA-4),其中FOXP3特定表达在细胞内,是调节性T细胞发育、活化、发挥功能的关键,并且不受活化状态的影响,被公认为是调节性T细胞的特异性标志,但近期研究发现许多活化的、不具有抑制功能的细胞也表达FOXP3,且还不清楚是否所有的表达FOXP3的T细胞都具有抑制功能[13]。随后,研究发现高表达于非调节性T细胞CD127在调节性T细胞低表达。Hartigan-O’ Connor等[14]用CD4、CD25、CD127三色抗体标记发现,人类、鼠及短尾猴外周血存在群体较清晰的CD4+CD25+/highCD127lowT细胞,它们高表达胞内FOXP3和CTLA-4,功能分析发现其具有抑制性、低增殖性和对T细胞受体信号的低反应性。因此,CD4+CD25+/highCD127lowT细胞目前作为调节性T细胞的免疫标记。
研究已证实,多发性骨髓瘤患者外周血调节性T细胞与其发病及预后亦有关,初治的多发性骨髓瘤患者外周血调节性T细胞增多,而在癌前病变阶段及缓解期的患者调节性T细胞正常人相比无显著差异[15]。Beyer 等[16]研究发现,意义未明的单克隆免疫球蛋白血症、多发性骨髓瘤患者外周血及骨髓CD4+CD25high/FOXP3+调节性T细胞均较正常对照者显著增高。韩文敏等[17]通过流式细胞术检测外周血CD4+CD25highCD127low调节性T细胞的结果与Beyer等[16]的结果类似,且Ⅲ期较Ⅰ期、Ⅱ期亦显著升高,目前应用于多发性骨髓瘤治疗的药物(如环磷酰胺、氟达拉滨、雷利度胺)均被证实具有清除多发性骨髓瘤患者调节性T细胞的作用[18-19]。在对硼替佐米治疗移植物抗宿主疾病研究中证实,其可通过抑制核因子κB通路抑制T细胞增殖、活化,对人体外周血调节性T细胞有抑制、清除作用[20]。李滢等[21]研究发现,接受硼替佐米化疗后,多发性骨髓瘤患者的调节性T细胞水平下降更显著,提示硼替佐米对多发性骨髓瘤患者的调节性T细胞具有抑制作用,而对于原发耐药患者外周血调节性T细胞的清除作用较少,化疗效果不佳,提示抑制调节性T细胞的增殖与功能仍是改善治疗的关键因素之一。
本研究进一步证实了多发性骨髓瘤患者VEGF及IL-6水平较正常组升高,治疗后治疗组及对照组指标水平均显著下降,且治疗组较对照组下降更明显,组间差异显著,有统计学意义。骨髓瘤患者治疗前调节性T细胞CD4+CD25+、CD4+CD25high、CD4+CD25highCD127low明显升高,但治疗后两组均显著下降,且治疗后组间CD4+CD25+、CD4+CD25high、CD4+CD25highCD127low差异显著。
多发性骨髓瘤在中医学属“骨痹”“骨蚀”“虚劳”等范畴。本病的发生内因为体质薄弱、劳倦过度、七情所伤,外因为六淫侵犯、饮食失节、接触毒物等。由于内外因相互作用,正气内亏,阴阳气血脏腑功能失调,以致气机阻滞,痰瘀互结,热毒内蕴而成,其中肝脾肾三脏功能失和,瘀毒内伏骨髓尤为重要。周永明[22]认为本病的外在致病因素为“邪毒蕴髓”。尤在泾言:“毒,邪气蕴结不解之谓。”《类证治裁·痹论》认为痹证“久而不愈,必有湿痰败血瘀滞经络”。目前中医药在治疗骨髓瘤方面的临床研究多以补肾活血解毒清热为基本大法,取得较好疗效。本方中补骨脂、菟丝子温补肾阳,山茱萸、女贞子、旱莲草、龟甲滋补肾阴,太子参、黄芪益气,半枝莲、白毛藤、蛇莓清热解毒,三棱、莪术、姜黄、土鳖虫活血祛瘀,苏叶、茯苓化痰利湿。全方共奏补肾活血解毒之功。乔爱国[23]运用益肾活血法组方加用沙利度胺治疗26例多发性骨髓瘤患者,结果CR 4例,PR 14例,未缓解8例,总有效率为69.9%。陈健一等[24]采用扶正解毒活血方,配合亚砷酸注射液治疗30例患者,总有效率为76.67%。陈鹏等[25]在M2方案化疗基础上加用补肾活血的方药取得良好疗效。
本研究结果提示,两组近期临床疗效无显著差异,但治疗组中医证候改善、骨痛缓解程度均明显优于对照组,治疗组VEGF、IL-6水平较对照组明显下降,调节性T细胞水平下降程度显著大于对照组,中药补肾解毒化瘀法结合化疗有明显的免疫调节作用,并可有效改善临床症状,减轻骨痛,改善患者生活质量。
[1]中国医师协会血液科医师分会, 中华医学会血液学分会. 中国多发性骨髓瘤诊治指南(2013年修订)[J].中华内科杂志, 2013,52(9):791-795.
[2]国家中医药管理局.中医病证诊断疗效标准[M].南京:南京大学出版社,1994:7.
[3]郑筱萸.中药新药临床研究指导原则[M].北京:中国医药科技出版社, 2002:383-388.
[4]陈世伦,武永吉.多发性骨髓瘤[M]. 北京:人民卫生出版社, 2004:82.
[5]Zhang YK, Wang H, Ling Y. Over-expression of micro RNA-29b induces apoptosis of multiple myeloma cells through down regulating Mcl-1[J]. Biochemical and Biophysical Research Communications, 2011,414(1):233-239.
[6]Guo YQ, Xu F, Lu T, et al. Interleukin-6 signaling pathway in targeted therapy for cancer[J]. Cancer Treatment Reviews, 2012, 38(7): 904-910.
[7]YOSIFOV DY, REUFSTECK C, KONSTANTINOV SM, et al. Interleukin-6, osteopontin and Raf/MEK/ERK signaling modulate the sensitivity of human myeloma cells to alkylphosphocholines[J]. Leukemia Research, 2012, 36(6): 764-772.
[8]MONAGHAN KA, KHONG T, BURNS CJ, et al. The novel JAK inhibitor CYT387 suppresses multiple signaling pathways, prevents proliferation and induces apoptosis in phenotypically diverse myeloma cells[J]. Leukemia, 2011, 25(12): 1891-1899.
[9]Andersen NF, Vogel U, Klausen TW, et al. Vascular endothelial growth factor (VEGF) gene polymorphisms may influence the efficacy of thalidomide in multiple myeloma[J]. Int J Cancer, 2012,131(5) : E636-342.
[10]Seki R, Yamagishi S, Matsui T, et al. Pigment epithelium-derived factor (PEDF) inhibits survival and proliferation of VEGF-exposed multiple myeloma cells through its anti-oxidative properties[J]. Biochem Biophys Res Commun, 2013,431(4):693-697.
[11]Valkovic T, Babarovic E, Lucin K,et al. Plasma levels of osteopontin and vascular endothelial growth factor in association with clinical features and parameters of tumor burden in patients with multiple myeloma[J]. Biomed Res Int, 2014: 513170.
[12]李欣, 魏秀珍, 刘晋玮, 等. 多发性骨髓瘤患者血清中VEGF水平的临床意义[J]. 中国实验血液学杂志, 2014,22(1):108-111.
[13]Allan SE, Passerini L, Bacchetta R, et al. The role of 2 FOXP3 isoforms in the generation of human CD4+Tregs[J]. J Clin Invest, 2005,115(11): 3276-3284.
[14]Hartigan-O’ Connor DJ, Poon C, Sinclair E, et al. Human CD4+regulatory T cells express lower levels of the IL-7 receptor alpha chain(CD127),allowing consistent identification and sorting of live cells[J]. J Immunol Methods, 2007,319(1/2): 41-52.
[15]Brimnes MK, Vangsted AJ, Knudsen LM, et al. Increased level of both CD4+FOXP3+regulatory T cells and CD14+HLA-DR-/lowmyeloid-derived suppressor cells and decreased level of dendritic cells in patients with multiple myeloma[J]. Scand J Immunol, 2010,72(6):540-547.
[16]Beyer M, Kochanek M, Giese T, et al.Invivoperipheral expansion of naive CD4+CD25highFox P3+regulatory T cells in patients with multiple myeloma[J]. Blood, 2006,107(10):3940-3949.
[17]韩文敏, 邱国强, 周民, 等. CD4+CD25+/highCD127lowTregs及TGF-β在多发性骨髓瘤患者外周血的表达分析[J].细胞与分子免疫学杂志, 2008,24(10):996-998.
[18]Sharabi A, Laronne-Bar-On A, Meshorer A, et al. Chemoimmunotherapy reduces the progression of multiple myeloma in a mouse model[J]. Cancer Prev Res(Phila), 2010,3(10):1265-1276.
[19]Galustian C, Meyer B, Labarthe MC, et al. The anti-cancer agents lenalidomide and pomalidomide inhibit the proliferation and function of T regulatory cells[J]. Cancer Immunol Immunother, 2009,58(7):1033-1045.
[20]Blanco B, Péerez-Simóon JA, Sáanchez-Abarca LI, et al. Treatment with bortezomib of human CD4+T cells preserves natural regulatory T cells and allows the emergence of a distinct suppressor T-cell population[J]. Haematologica, 2009,94(7):975-983.
[21]李滢,李娟,黄蓓晖,等.硼替佐米对多发性骨髓瘤患者Treg细胞的影响及与肿瘤负荷、化疗疗效的关系[J]. 中国病理生理杂志, 2012,28(6):985-990.
[22]任荣政,鞠立霞.周永明治疗多发性骨髓瘤经验[J].中医杂志,2007,48(4):306-308.
[23]乔爱国.益肾活血法配合反应停治疗多发性骨髓瘤的疗效观察[J]. 辽宁中医杂志, 2007,34(4):462-463.
[24]陈健一,李晓惠,孔祥图.扶正解毒活血方合用亚砷酸注射液治疗难治性多发性骨髓瘤30例[J]. 河北中医, 2007,29(11):1009-1010.
[25]陈鹏,丘和明,宋爽,等.补肾活血法辅助化疗治疗多发性骨髓瘤骨病16例疗效观察[J]. 新中医, 2006,38(8):24-25.
Clinical Effect of Kidney-tonifying, Detoxicating, and Stasis-resolving Prescription Combined with CPT Chemotherapy Regimen in Treatment of Elderly Multiple Myeloma
NI Hai-wen, JIANG Peng-jun, KONG Xiang-tu
(Department of Hematology, Jiangsu Hospital of Traditional Chinese Medicine,Jiangsu Nanjing 210029,China)
Objective To investigate the clinical effect of kidney-tonifying, detoxicating, and stasis-resolving prescription combined with CPT chemotherapy regimen in the treatment of elderly multiple myeloma and its influence on immune function. Methods A total of 40 patients with elderly multiple myeloma were randomly divided into treatment group and control group, with 20 patients in each group. The patients in both groups received CPT chemotherapy, with 28 days as one cycle, and the clinical outcome was evaluated after 6 cycles. The patients in the treatment group were given kidney-tonifying, detoxicating, and stasis-resolving prescription in addition. The clinical outcome, change in quality of life, and improvement in TCM clinical symptoms were observed, and the levels of vascular endothelial growth factor (VEGF) and interleukin-6 (IL-6) and the percentage of regulatory T cells were measured before and after treatment. Results There was no significant difference in short-term clinical outcome between the treatment group and the control group (P>0.05). Compared with the control group, the treatment group had significantly better improvements in bone pain, quality of life, and TCM clinical symptoms (P<0.05). There were no significant differences in the levels of VEGF and IL-6 between the two groups before treatment (P>0.05); both groups had significant reductions in the levels of VEGF and IL-6 after 3 and 6 months of treatment (P<0.05), and the treatment group had significantly greater reductions compared with the control group (P<0.05). As for regulatory T cells, both groups had significant increases in the percentages of CD4+CD25+, CD4+CD25high, and CD4+CD25highCD127lowT cells before treatment (P<0.05) and significant reductions in these cells after treatment (P<0.05), and the treatment group had significantly greater reductions compared with the control group (P<0.05). Conclusion In the treatment of elderly multiple myeloma, kidney-tonifying, detoxicating, and stasis-resolving prescription combined with CPT chemotherapy regimen helps to improve patients’ clinical symptoms and increase immune function.
Kidney-tonifying, detoxicating, and stasis-resolving method; CPT chemotherapy regimen; Quality of life; Multiple myeloma
江苏省优秀青年人才专项课题(YX1201)
倪海雯(1971-),女,博士,主任中医师
R733.3
10.3969/j.issn.2095-7246.2016.06.008
2016-10-10;编辑:姚实林)
