抗虫抗除草剂转基因玉米HiII-NGc-1的遗传稳定性分析
2016-12-22刘相国汪洋洲赵方方肖国红冯树丹韩四平尹悦佳
刘 洋, 刘相国, 汪洋洲, 赵方方, 张 艳, 肖国红, 冯树丹, 韩四平*, 尹悦佳*
1.吉林省农业科学院农业生物技术研究所, 吉林省农业生物技术重点实验室, 长春 130033;2.吉林省农业科学院植物保护所, 吉林 公主岭 136100;3.哈尔滨师范大学生命科学与技术学院, 哈尔滨 150025
抗虫抗除草剂转基因玉米HiII-NGc-1的遗传稳定性分析
刘 洋1, 刘相国1, 汪洋洲2, 赵方方3, 张 艳1, 肖国红3, 冯树丹3, 韩四平1*, 尹悦佳1*
1.吉林省农业科学院农业生物技术研究所, 吉林省农业生物技术重点实验室, 长春 130033;2.吉林省农业科学院植物保护所, 吉林 公主岭 136100;3.哈尔滨师范大学生命科学与技术学院, 哈尔滨 150025
目的基因和目标性状遗传稳定性是转基因植物新品种选育和产业化的重要前提。以进入农业部环境释放的抗虫抗除草剂双价转基因玉米HiII-NGc-1为试验材料,采用PCR、RT-PCR和免疫试纸条技术检测转基因玉米连续3代目的基因cryNGc和bar整合及表达的遗传稳定性,采用心叶期除草剂草铵膦抗性鉴定和心叶期/穗期亚洲玉米螟抗性鉴定实验详细分析了目标性状的遗传稳定性。研究结果表明:CryNGc和PAT蛋白在HiII-NGc-1中连续3代遗传稳定,高世代稳定耐受正常5倍大田除草剂草铵膦使用浓度,心叶期和穗期高抗亚洲玉米螟性状稳定,具有潜在的产业化应用价值。转基因玉米HiII-NGc-1目的基因和目标性状遗传稳定性的明确为开展下一步生物安全评价奠定了基础,对复合性状转基因抗虫抗除草剂玉米新品种的选育和产业化具有重要意义。
抗虫;抗除草剂;转基因玉米;遗传稳定性
转基因植物新品种的选育要经过实验研究、中间试验、环境释放和生产性试验、获批安全证书,最终才能进入产业化。遗传稳定性是各阶段选育的前提,对于转基因植物育种的成功与否具有关键作用。遗传稳定性主要考察转基因植物不同世代目的基因整合的稳定性、目的基因表达的稳定性和目标性状表现的稳定性等方面[1]。
目的基因片段大小、转化方法、拷贝数、甲基化、外界环境都能影响基因遗传和表达的稳定性[2~4]。 Srivastava等[5]观察到转基因小麦转化株系2B-2在T1代中能正常表达,在T2代中仅能检测到,在T3中发生了丢失。Reddy等[6]观察到在T2、T3代转基因大豆的GUS表达水平不同,由于转基因甲基化的水平使转基因大豆中15 kDa的玉米蛋白基因的表达也不同。也有许多研究表明目的基因在转基因植物中能稳定遗传并表达,如转基因抗除草剂水稻Bar68-1、转 Btcry1Ah基因抗虫玉米、转cry6Aa2m基因大豆,分别对其进行遗传稳定性分析结果表明转基因材料均可稳定表达[7~9],但上述研究均为转单基因材料遗传稳定性分析。
近年来,转基因技术成为应用发展最为迅速的作物育种技术。复合型转基因玉米被大范围推广,2014年复合性状转基因作物种植面积为5 100万hm2。已商业化的转基因玉米主要是抗虫和耐除草剂品种。但国内尚无转基因玉米进入产业化[10]。具有自主知识产权的、抗亚洲玉米螟抗草铵膦双价转基因玉米的遗传稳定性分析尚未见报道。
本研究以进入农业部环境释放的抗虫抗除草剂转基因玉米HiII-NGc-1为试验材料,开展目的基因cryNGc和bar的整合稳定性、表达稳定性、目标性状表现的稳定性分析评价,为完成农业部环境释放,进一步申请生产性试验奠定了基础,对我国转基因抗虫抗除草剂玉米的安全评价新品种选育及产业化具有重要意义。
1 材料与方法
1.1 试验材料
非转基因玉米(转基因受体材料)为HiII,转基因玉米为转化体HiII-NGc-1,由吉林省农业科学院农业生物技术研究所提供。亚洲玉米螟由北京绽诺思特生物科技有限公司提供。
1.2 不同世代转基因材料的获得
采用农杆菌介导的方法获得转基因玉米HiII-NGc-1。待幼苗长出1~2片新叶后移入大花盆,转移至大型温室,待雄穗散粉后,自交授粉,获得T1代种子。将T1代种子种植到大田,以后按照常规方法进行日常管理和自交授粉,以此类推获得T2、T3、T4代材料。
1.3 连续3代目的基因整合的稳定性
采用PCR技术研究转基因玉米HiII-NGc-1的T2、T3、T4代cryNGc和bar基因整合稳定性。待转基因玉米生长到心叶期时,提取植株叶片基因组DNA,设计引物PCR进行扩增。其中空白对照为水,阴性对照为非转基因玉米HiII,阳性对照为含有目的基因载体的质粒。设计引物序列见表1。扩增条件为:95℃,5 min;95℃ 30 s,58℃ 50 s,72℃ 90 s,30个循环;72℃ 10 min。在1%琼脂糖电泳检测扩增产物条带。
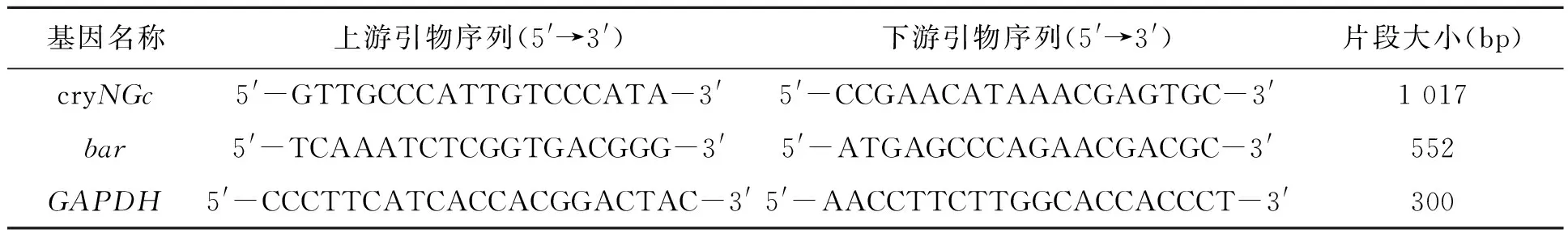
表1 试验所用引物Table 1 Primers used in the study.
1.4 连续3代目的基因表达的稳定性
采用RT-PCR、免疫试纸条检测方法研究转基因玉米HiII-NGc-1的T2、T3、T4代cryNGc和bar基因表达的稳定性。
1.4.1 RT-PCR 待转基因植株生长心叶期时,提取玉米植株叶片总RNA。以RNA为模板合成cDNA,再以cDNA为模板,扩增目的片段。目的基因cryNGc、bar、内参GAPDH引物见表1。
1.4.2 免疫试纸条检测 取约1 cm2左右新鲜幼嫩叶片放在1.5 mL的离心管中,用小型研磨棒将材料研磨成粉,向管中加入500 μL纯净水,放入检测试纸条,1 min后观察质控线和检测线。
1.5 田间除草剂耐性
以玉米转化体HiII-NGc-1的高世代T4代为试验材料,4~6叶期对转基因玉米和非转基因玉米材料喷施除草剂草铵膦,喷施处理分为:不处理、清水喷施、单倍剂量、2倍剂量和5倍剂量。大田除草剂正常使用浓度为0.3 mL/m2(保试达,18%)。本研究最大除草剂浓度大致相当于大田正常使用浓度的5倍,即:1.5 mL/m2。喷洒7 d、28 d后分别观察玉米植株药害情况,药害症状分级参照国家标准GB/T 17980.42执行,级别越低说明抗性越高。1级为玉米生长正常,无任何受害症状;2级:玉米轻微药害,药害少于10%;3级:玉米中等药害,后期能恢复,不影响产量;4级:玉米药害较重,难以恢复,造成减产;5级:玉米药害严重,不能恢复,造成明显减产或绝产。
1.6 田间抗虫性
以玉米转化体HiII-NGc-1的高世代T4代为试验材料代表,心叶期将2个中等大小、即将孵化的玉米螟卵块接于非转基因玉米HiII、转基因玉米HiII-NGc-1心叶中。接虫14 d后,参照国家行业标准(NY/T 1248.5-2006)的分级标准调查食叶级别,评价抗虫级别。
穗期将已经黑头的、即将孵化的玉米螟卵块接于转基因玉米HiII-NGc-1、非转基因玉米HiII的花丝丛中。每株接2~3个中等大小的卵块,接虫14 d后调查雌穗被害程度及植株被害情况。参照国标(农业部953公告-10.1-2007)分级标准,调查玉米蛀孔数量、蛀孔隧道长度以及存活幼虫数量,采用SPSS统计软件进行分析,采用单因素方差分析方法进行差异显著性分析。
2 结果与分析
2.1 连续3代目的基因整合的稳定性
在转基因玉米HiII-NGc-1的T2、T3和T4代材料和非转基因玉米材料HiII的心叶期,用PCR技术分析目的基因遗传稳定性。图1研究结果表明:目的基因cryNGc和bar分别在约1 017 bp、552 bp出现特异性条带,其大小与阳性对照的特异性条带大小一致。阴性对照和空白对照未出现特异性条带。该结果说明外源目的基因cryNGc、bar已整合到玉米基因组中且稳定遗传。

图1 T2~T4代转基因玉米HiII-NGc-1 PCR检测Fig.1 PCR identification of transgenic maize HiII-NGc-1 at T2~T4 generation.A:cryNGc基因;B:bar基因。M:DL 2000 Marker;1:阳性对照;2:空白对照;3:阴性对照;4~6:T2~T4代转基因玉米HiII-NGc-1
2.2 连续3代目的基因表达的稳定性
2.2.1 RT-PCR 为检测转基因玉米目的基因cryNGc、bar在转录水平上是否稳定遗传,提取转基因玉米和非转基因玉米的叶片总RNA。经反转录酶的作用以RNA为模板合成cDNA,再以cDNA为模板,扩增目的片段。图2研究结果表明:内参基因GADPH扩增正确,说明RNA质量完好。阳性质粒和T2~T4代转基因材料扩增出特异性条带,目的基因cryNGc和bar分别呈现约1 017 bp、552 bp大小的检测条带。阴性对照和空白对照均未检测出条带,该结果说明:HiII-NGc-1转化体连续3代均有表达,外源基因cryNGc、bar已在玉米基因组中稳定转录。
2.2.2 免疫检测试纸条检测 选取T2、T3和T4代转基因玉米材料,取幼嫩叶片利用Bt-Cry1Ab/Ac和bar免疫试纸条分别进行测试,分析抗虫基因cryNGc和抗除草剂基因bar表达蛋白的稳定性。图3(彩图见图版一)研究结果表明,非转基因玉米HiII出现质控线,说明免疫试纸条可用于蛋白表达的检测。转基因材料出现质控线和检测线,说明转基因玉米HiII-NGc-1中目的基因cryNGc和bar均有表达。T2、T3和T4代转基因玉米HiII-NGc-1的阳性结果说明转基因玉米HiII-NGc-1连续3代稳定表达。

图2 T2~T4代转基因玉米HiII-NGc-1RT-PCR分析Fig.2 RT-PCR detection of transgenic maize HiII-NGc-1 at T2~T4 generation.M:DL 2 000 Marker;1,6,11:空白对照;2:阴性对照;7,12:阳性对照;3,8,13:T2代转基因材料;4,9,14:T3代转基因材料;5,10,15:T4代转基因材料。

图3 转基因玉米HiII-NGc-1 T2~T4代免疫试纸条检测Fig.3 Strip test of transgenic maize HiII-NGc-1 at T2~T4 generation.A:Bt-Cry1Ab/Ac试纸条;1:非转基因玉米;2:T2代转基因玉米;3:T3代转基因玉米;4:T4代转基因玉米;B: bar试纸条;1:非转基因玉米;2:T2代转基因玉米;3:T3代转基因玉米;4:T4代转基因玉米(彩图见图版一)
2.3 转基因玉米HiII-NGc-1耐除草剂性
在心叶期,对转基因玉米HiII-NGc-1的T4代材料和非转基因玉米HiII进行除草剂草铵膦喷施处理,结果见表2。本试验使用的最高草铵膦剂量大致相当于大田正常使用浓度的5倍,喷洒7 d后调查药害情况发现:转基因玉米和非转基因玉米在不进行任何处理和清水处理均可正常生长,且无明显变化。而在喷施1倍除草剂处理中,非转基因植株出现药害,且受害率100%。转基因玉米HiII-NGc-1在5倍剂量除草剂喷施后,生长正常,无受害情况发生,仍具有较高抗性。
图4(彩图见图版一)研究结果表明:喷施草铵膦7 d后转基因玉米HiII-NGc-1没有观察到明显药害,非转基因材料HiII出现明显药害,叶子枯黄萎蔫。28 d后田间杂草基本被杀灭,非转基因玉米HiII全部萎蔫,甚至死亡。转基因玉米HiII-NGc-1正常生长。继续观察28 d后转基因玉米HiII-NGc-1仍正常生长。说明转基因玉米HiII-NGc-1在高世代T4代仍可遗传抗除草剂特性,与前期T2和T3代抗除草剂性状结果一致(详见环境释放报告),且至少抗5倍大田正常使用浓度的除草剂草铵膦。
2.4 转基因玉米HiII-NGc-1抗虫性
心 叶期将已经黑头的、即将孵化的玉米螟卵块接于非转基因玉米HiII、转基因玉米HiII-NGc-1的T4代心叶中。接虫14 d后调查食叶级别,计算虫害级别,对抗虫性评价结果见表3。
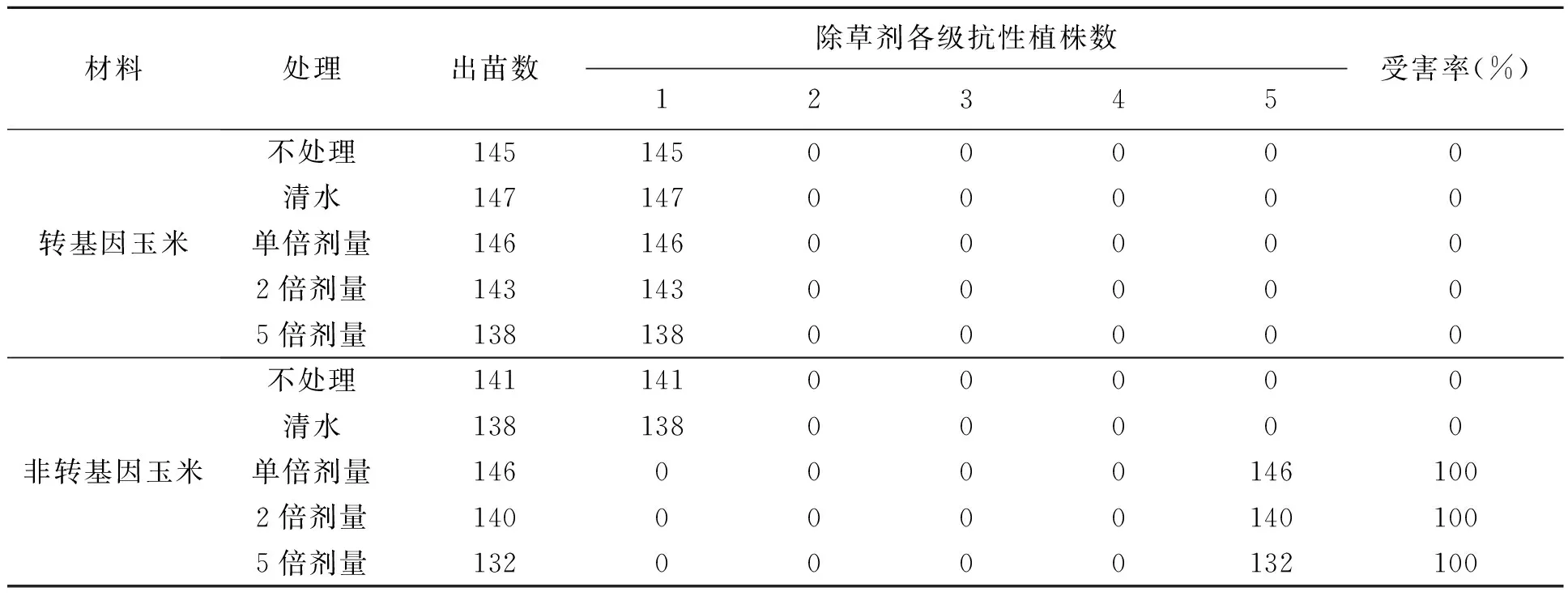
表2 田间转基因玉米T4代对除草剂的抗性Table 2 Herbicide-tolerance of transgenic maize at T4 generation in the field.

图4 喷施5倍除草剂后田间抗除草剂性Fig.4 Herbicide-tolerance of transgenic maize after 5 times glufosinate-ammonium in the field.A、B:喷施7 d后田间生长情况; C、D:喷施28 d后田间生长情况(彩图见图版一)
表3和图5(彩图见图版一)中结果显示,接虫14 d后,转基因玉米HiII-NGc-1没有表现出受害症状,没有存活亚洲玉米螟;非转基因植株表现出明显的受害症状,叶片有排孔,被玉米螟咬食严重,有存活的亚洲玉米螟。参照国家行业标准(NY/T 1248.5-2006)分级标准,通过统计分析得出:非转基因植株抗虫级别为感虫,转基因玉米HiII-NGc-1抗虫级别为高抗。
穗期接虫14 d后调查玉米蛀孔数量、蛀孔隧道长度以及存活幼虫数量,采用SPSS统计软件进行分析,采用单因素方差分析方法进行差异显著性分析。结果(表4)发现转基因玉米HiII-NGc-1和非转基因玉米差异显著。转基因玉米HiII-NGc-1蛀孔数较少,隧道长度<1 cm,几乎无活虫。而非转基因玉米HiII蛀孔数较多,且存在活虫。

表3 T4代转基因玉米心叶期田间抗虫性Table 3 Insect-resistant of transgenic maize at T4generation at whorl stage in the field.
注:同一列数据不同小写字母表示差异显著(P<0.05)。

图5 玉米田间抗虫性Fig.5 Insect resistance performance at whorl stage in the field.A:非转基因玉米HiII; B:T4代转基因玉米HiII-NGc-1(彩图见图版一)
图6(彩图见图版一)研究结果表明:转基因玉米HiII-NGc-1穗和茎秆无虫害,非转基因玉米HiII在茎秆均有虫害和隧道,在玉米穗上出现被咬食痕迹和活虫,玉米螟虫达到两龄。参照国标(农业部953公告-10.1-2007)分级标准,转基因玉米HiII-NGc-1在穗期抗虫性级别为高抗。
综上所述,转基因玉米HiII-NGc-1经过不断自交和培育,在高世代T4代在心叶期和穗期仍表现高抗亚洲玉米螟的性状,且抗虫性与T2和T3代抗虫性表现一致(详见环境释放报告)。研究结果证实转基因玉米HiII-NGc-1目标性状抗虫性稳定遗传,在心叶期和穗期抗虫性级别均达到高抗级别。
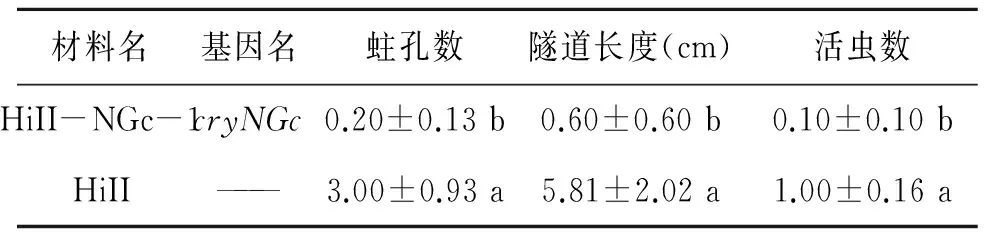
表4 穗期田间抗虫性Table 4 Insect resistance performance at heading stage in the field.
注:同一列数据后不同小写字母表示P<0.05水平上差异显著。
3 讨论
外源基因在无性培养阶段和有性繁殖阶段的遗传稳定性,直接影响着转基因植物的产业化应用价值。评价外源基因在转基因植物中的遗传稳定性对于转基因植物新品种产业化至关重要。外源基因在植物基因组的整合具有一定的随机性,可以插入到一个单一位点,也可以插入到同一染色体或不同染色体的多个位置,且插入拷贝数也是随机的[11]。外源基因在转基因植物中的遗传具有复杂性和多样性的特点,外源基因片段大小、插入位点、拷贝数、受体基因组染色体的结构等都会影响插入基因稳定遗传和表达,甚至同一转化体的不同转基因株系和不同世代间,目的基因的表达也可能具有显著差异[12,13]。Bhomkar等[14]对转glyoxalaseI基因豇豆T1代的遗传稳定性分析结果表明:8个株系中,4个株系glyoxalaseI基因丢失。简玉瑜等[15]对转基因水稻的bar基因和抗菌肽B基因分子检测研究发现,bar能够在T1~T5代保持3∶1的遗传比率,而抗菌肽B基因检测显著低于3∶1比率,存在明显的基因丢失的特点,证实插入基因组的特定位置对基因稳定遗传存在不利影响。
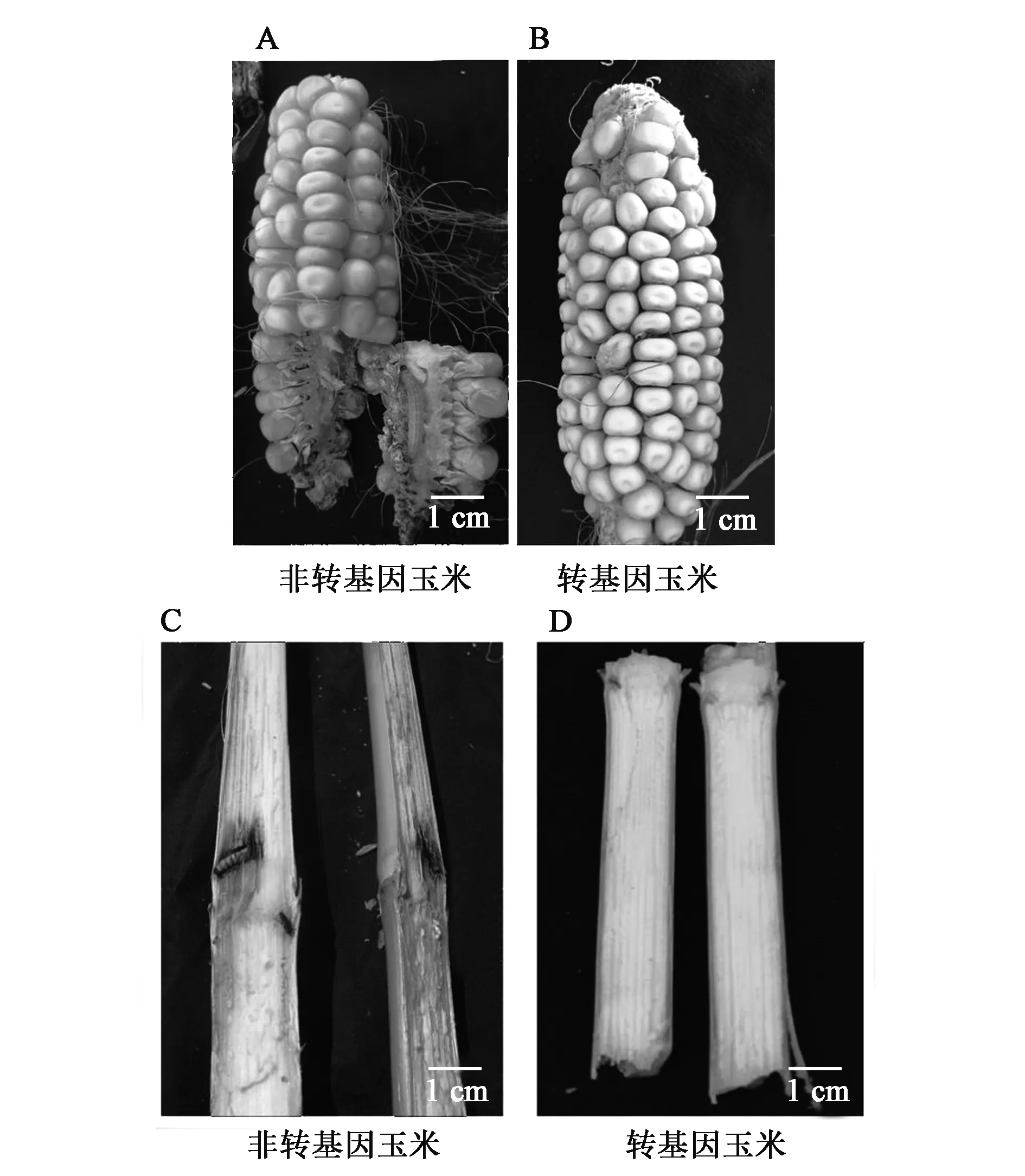
图6 穗期田间玉米抗虫性Fig.6 Insect resistance performance at heading stage in the field.A、B:玉米穗的抗虫性;C、D:玉米茎秆抗虫性(彩图见图版一)
商业化的植物转化体均具有外源基因遗传稳定性好的生物学特征。杜邦、陶氏益农公司研发的已商业化转化体TC1507、孟山都公司研发的商业化转化体Mon89034均可稳定遗传,且表现较高的抗虫性[16];吴刚等[17]对不同世代的转cry1Ab基因克螟稻研究证实目的基因在不同后代中能够稳定遗传,且维持较高的目的蛋白表达量。本研究以进入农业部环境释放阶段的,具有自主知识产权的抗虫抗除草剂转基因玉米HiII-NGc-1为实验材料,开展了目的基因整合和目的基因表达两个方面的基因遗传稳定性评价研究工作。研究结果表明抗虫抗除草剂转基因玉米HiⅡ-NGc-1与成熟的转化体研究结果一致,插入的外源T-DNA均表现为多世代遗传稳定性高的生物学特征,具有潜在的产业化应用价值。
外源基因在受体染色体上的稳定整合和高效表达仅仅是实现基因功能的第一步,转基因植株目标性状是否突出是评价其是否具有应用价值的关键。本研究获得的抗虫抗除草剂转基因玉米材料HiII-NGc-1,其心叶期和穗期抗亚洲玉米螟级别均为高抗,叶片或茎干被咬食较轻,活虫数较少。与戴军等[18]转cry1Ah基因玉米的抗虫性均为高抗水平。本研究结果表明转基因玉米HiII-NGc-1耐5倍正常浓度的草铵膦,较朱常香等[19]研究的耐除草剂草铵膦结果显著提高。
综上,为抗虫抗除草剂双价转基因玉米HiII-NGc-1 连续3代具有目标基因cryNGc和bar均整合稳定,且表达稳定。转基因玉米HiII-NGc-1可耐受5倍除草剂草铵膦大田施用浓度,心叶期和穗期高抗亚洲玉米螟,上述研究结果为培育抗虫抗除草剂转基因玉米新品种的研究及产业化提供了基础实验数据。
[1] 刘培磊, 徐琳杰, 叶纪明, 等. 我国农业转基因生物安全管理现状[J]. 生物安全学报, 2014, 23(4): 297-300.
[2] 王 念, 王军辉, 张建国, 等. 转基因植物发展状况及外源基因在后代中遗传分离研究进展[J]. 生物技术通报, 2004, 1:13-22.
[3] 王海慧, 田 源, 白国辉, 等. 转基因植物遗传稳定性影响因素的研究现状[J]. 贵州农业科学, 2013, 41(9): 5-8
[4] 贺炜华, 曾富华, 陈信波. 转基因植物遗传传递稳定性[J]. 湛江师范学院学报, 2008, 29(6): 57-61.
[5] Srivastava V, Vasil V, Vasil K. Molecular characterization of the fate of transgenes in transformed wheat (TriticumaestivumL.) [J].Theor. Appl. Genet., 1996, 92: 1031-1037.
[6] Reddy M S, Dinkins R D, Collins G B. Gene silencing in transgenic soybean plants transformed via particle bombardment [J]. Plant Cell Rep., 2003, 21(7):676-83.
[7] 蒋显斌, 陈玉冲, 邓力华, 等. 转基因抗除草剂水稻 Bar68-1 的遗传稳定性分析[J]. 西南农业学报, 2015, 28 (3): 925-929.
[8] 岳同卿, 郎志宏, 王延锋, 等. 转Bt cry1Ah基因抗虫玉米的获得及其遗传稳定性分析[J]. 农业生物技术学报, 2010, 18(4): 638-644.
[9] 杨秋姣, 孙晓丽, 孙明哲, 等. 转cry6Aa2m基因大豆遗传稳定性分析及农艺性状调查[J]. 大豆科学, 2014, 33(5): 629-633.
[10] Clive J. 2014年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2015, 35(1): 1-14.
[11] 金万梅, 潘青华, 尹淑萍, 等. 外源基因在转基因植物中的遗传稳定性及其转育研究进展[J]. 分子植物育种, 2005,3(6): 864-868.
[12] 华志华, 黄大年. 转基因植物中外源基因的遗传行为[J]. 植物学报, 1999, 41(1): 1-5.
[13] Meyer P. Understanding and controlling transgene expression[J]. Trends Biotechnol., 1995, 13(9): 332-337
[14] Bhomkar P, Upadhyay C P, Saxena M,etal.. Salt stress alleviation in transgenicVignamungoL. Hepper (blackgram) by overexpression of the glyoxalase I gene using a novel Cestrum yellow leaf curling virus (CmYLCV) promoter[J]. Mol. Breed., 2008, 22(2):169-181.
[15] 简玉瑜, 陈远玲, 李 静, 等. 转基因水稻外源基因的遗传和表达初步研究[J]. 华南农业大学学报, 2001, 22(1):56-59.
[16] Siebert M W, Nolting S P, Hendrix W,etal.. Evaluation of corn hybrids expressing Cry1F, cry1A.105, Cry2Ab2, Cry34Ab1/Cry35Ab1, and Cry3Bb1 against southern United States insect pests[J]. J. Econ. Entomol., 2012, 105(5): 1825-1834.
[17] 吴 刚, 崔海瑞, 舒庆尧, 等. cry1Ab基因在转基因克螟稻后代中的遗传稳定性及表达[J].农业生物技术学报, 2000, 8(3): 253-256.
[18] 戴 军, 李秀影, 朱 莉, 等. 转 Bt cry1Ah基因抗虫玉米的分子检测及农艺性状分析[J]. 生物技术通报, 2014, 5, 62-68.
[19] 朱常香,宋云枝,张杰道, 等. 抗虫、抗除草剂转基因玉米的获得及遗传研究[J]. 山东农业大学学报:自然科学版, 2002, 33 (2): 120-125.
Genetic Stability Analysis of Insect-resistant and Herbicide-tolerance Transgenic Maize HiII-NGc-1
LIU Yang1, LIU Xiang-guo1, WANG Yang-zhou2, ZHAO Fang-fang3, ZHANG Yan1, XIAO Guo-hong3, FENG Shu-dan3, HAN Si-ping1*, YIN Yue-jia1*
1.JilinProvincialKeyLaboratoryofAgriculturalBiotechnology,InstituteofAgriculturalBiotechnology,JilinAcademyofAgriculturalSciences,Changchun130033,China;2.Institute of Plant Protection, Jilin Academy of Agricultural Sciences, Jilin Gongzhuling 130124, China;3.College of Life Science and Technology, Harbin Nomal University, Harbin 150025, China
Thegeneticstabilityoftargetgenesisthepremiseforthebreedingoftransgenicplants.WeanalyzedthegeneticstabilityoftransgenicmaizeHiII-NGc-1,whichapprovedenvironmentalreleaseinJilinprovince,suchasintegrationofthetargetgene,expressionofthetargetgene,stabilityofthetargettraits. cryNGcandbargeneweredemonstratedco-integratedintothemaizegenomeDNAatT2~T4generationbyPCRmethod.RT-PCRandImmunostriptestsdemonstratedthatCryNGcandPATproteinswereexpressedintransgenicmaizeHiII-NGc-1atT2~T4generation.Bioassayforinsectresistanceandherbicide-toleranceanalysisinfieldshowedthattransgenicmaizeHiII-NGc-1had5timesglufosinatetolerance,andhighresistanceagainstOstrinia furnacalisatwhorlstageandheadingstage.GeneticstabilityoftransgenicmaizeHiII-NGc-1isthebasisforfurtherresearchofitsbiologicalsafetyevaluation.Theresultsofthisstudyareimportantforthesafetyevaluationandindustrializationoftransgenicinsectresistantmaize.
insect-resistant;herbicide-tolerance;transgenicmaize;geneticstability
2016-09-26; 接受日期:2016-11-03
吉林省农业科技创新工程(吉财教[2012]1072);吉林省科技发展计划项目(20160520060JH)资助。
刘洋,研究实习员,主要从事作物生物技术研究。E-mail:liuyang_20045894@163.com。*通信作者:韩四平,副研究员,研究方向为作物生物技术。E-mail:hansp@jlu.edu.cn。尹悦佳,助理研究员,研究方向为作物生物技术。E-mail:yyjqishi@163.com
10.3969/j.issn.2095-2341.2016.06.07
