GPC-UPLC-MS/MS法测定食用油中壬基酚和双酚A
2016-12-22钱镭李秀军曲双双肖光辉刘婷
钱镭,李秀军,曲双双,肖光辉,刘婷,*
(1.黑龙江东方学院食品与环境工程学部,黑龙江哈尔滨150086;2.黑龙江飞鹤乳品有限公司,黑龙江齐齐哈尔 162100)
GPC-UPLC-MS/MS法测定食用油中壬基酚和双酚A
钱镭1,李秀军1,曲双双1,肖光辉2,刘婷1,*
(1.黑龙江东方学院食品与环境工程学部,黑龙江哈尔滨150086;2.黑龙江飞鹤乳品有限公司,黑龙江齐齐哈尔 162100)
建立食用油中壬基酚和双酚A的凝胶渗透色谱(GPC)-超高效液相色谱-质谱联用(UPLC-MS/MS)分析检测方法。食用油样品经乙酸乙酯-环己烷溶解,GPC净化后,采用超高效液相色谱-串联质谱法分析测定。仪器使用WATERS ACQUITYUPLCBEHC18色谱柱,以甲醇-0.1%氨水为流动相,梯度洗脱分离后,串联四极杆质谱多反应监测方式检测,采用内标法定量。分析结果表明,目标物检出限为1.0μg/kg,在1.0μg/kg~5.0×102μg/kg的范围内呈良好的线性关系(R2>0.99),试验中平均添加回收率85.1%~112.5%,相对标准偏差2.57%~6.08%。
壬基酚;双酚A;凝胶渗透色谱;超高效液相色谱-质谱联用;食用油
壬基酚(Nonylphenol,NP)和双酚A(bisphenol A,BPA)是具有代表性的环境激素,两者作为内分泌干扰物质,可以通过食物链进入人体,并在人体内富集。NP对人体癌细胞的生长和生殖能力具有严重影响,此前已被欧盟列为优先危害物质[1]。BPA主要是影响哺乳动物的生殖以及后天的发育[2],引起生殖器官异常和雄性雌性化等方面的危害[3]。食用被NP、BPA污染的农作物生产的食用油时会使NP、BPA在人体内积累,同时NP、BPA具有良好的增塑性,一些食品包装企业使用NP、BPA作为包材增塑剂,大量应用于食品包材及容器内部涂层[4]。此外NP和BPA具有较强的脂溶特性,当使用以NP、BPA作为增塑剂的容器盛装食用油时,NP和BPA就会从容器中溶出,长期食用该类食用油将会使NP、BPA在体内大量富集从而影响人体的生殖和内分泌系统,破坏人体健康。截止目前奥斯陆-巴黎公约(OSPAR)已经将NP列入优先控制污染物质名录当中[5]。欧盟2003EC指令也规定商品中NP的含量不得高于0.1%,加拿大卫生部于2008年宣布禁止进口和销售含有BPA的婴儿奶瓶[6]。中国于2011年1月12日将NP、BPA添加至有毒物质限制名单中,禁止NP、BPA化学品的进出口[7]。
凝胶渗透色谱(gel permeation chro-matograph,GPC)又称体积排除法,是使用目标物质的优良溶剂作为流动相,内部分离介质采用多孔交联高分子凝胶的液相色谱法。GPC作为一种样品净化手段,在样品富含脂肪、色素等物质时分离效果较其他方法更加具有优势[8]。
目前NP、BPA的检测主要以生物、环境、玩具等方面为主[9],应用GPC法检测食用油中的NP、BPA几乎未见报道。研究建立GPC-UPLC-MS/MS的检测方法法对食用油中的NP、BPA进行定量分析。该法准确高效,可以为食用油中的环境激素检测分析提供理论参考。
1 材料与方法
1.1 材料与试剂
食用油:市售色拉油;乙酸乙酯(色谱纯):美国SIGMA;环己烷(色谱纯):美国Fisher公司;甲醇(色谱纯):德国默克公司;氨水(优级纯):哈尔滨试剂化工厂;壬基酚和双酚A标准品及同位素内标(纯度> 99%):Dr.EhrenstorferGmbH(上海安谱公司代购);试验用水:Milli-Q净化系统过滤。
1.2 主要仪器与设备
UPLC-TQD超高效液相色谱-质谱联用仪:美国Waters公司;AccuPrepTM自动凝胶色谱系统:GPC,美国J2 Scientific公司,配有内装BIO-Beads S-X3填料的净化柱(400mm×20mm,美国J2公司);SI-0256涡旋振荡器:美国SIVortex-Genie;Milli-Q超纯水器:美国,Millipore公司;N-EVAP112水浴氮吹仪:美国OA公司。
1.3 标准溶液的配制
分别称取壬基酚和双酚A的固体标准品各10mg,用甲醇溶解并定容至100mL,配制成100μg/mL的标准储备液,置于2℃~8℃冰箱冷藏。使用时根据需要,用甲醇稀释成不同浓度的工作液。
分别称取壬基酚和双酚A的固体内标物各20mg,用甲醇溶解并定容至100mL,配制成200μg/mL的内标储备液,置于2℃~8℃冰箱冷藏。
1.4 样品处理
样品提取:准确称取食用油样品0.2 g(精确至0.01 g)于10mL玻璃试管中,加入内标后再加入环己烷-乙酸乙酯(体积比1∶1)溶液溶解定容,涡旋均匀,经0.22μm微孔滤膜过滤后,供GPC上机,同时进行试剂空白试验。样品经GPC净化后,供UPLC-MS/MS检测分析。试验中所用玻璃器具,使用前在400℃马弗炉内灼烧4 h。
1.5 GPC净化条件
凝胶柱300mm×20mm,Bio Beads SX-3作为柱填料;环己烷/乙酸乙酯(体积比为1∶1)作为流动相;流速:5.0mL/min;进样量:5mL;收集时间:6min~16min;检测波长:254 nm。
1.6 超高效液相色谱条件
捕集柱:Waters Isolator Column(P/N186004476),捕集柱位于进样阀之前;色谱柱:ACQUITYUPLCBEH C18柱,1.7μm,2.1mm×50.0mm;柱温:35℃;流速:0.3mL/min;进样量:10μL;流动相:A为0.1%的氨水,B为甲醇;梯度洗脱程序见表1。
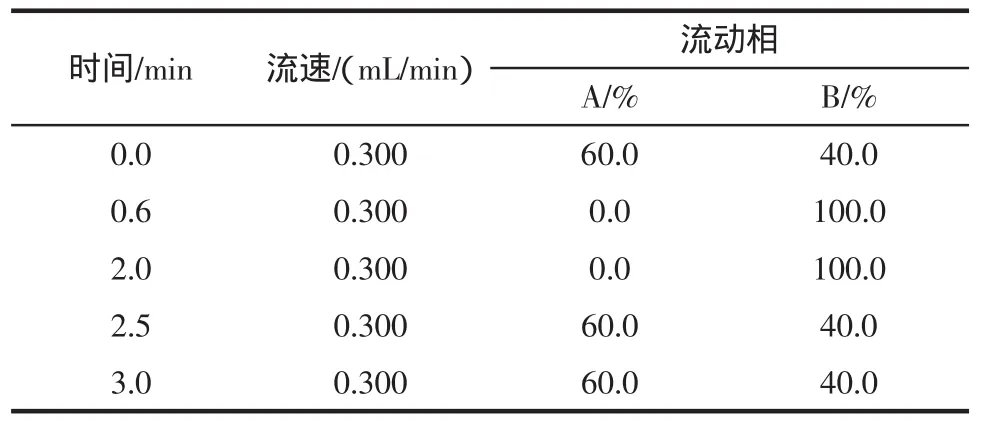
表1 流动相及梯度洗脱条件Table1 M obilephaseand gradientelution conditions
1.7 质谱分析条件
质谱条件:离子源,电喷雾电离ESI(-);离子源温度150℃;脱溶剂温度400℃;脱溶剂气流量800 L/h;锥孔气流量50 L/h;毛细管电压2.8 kV;采用多反应监测模式采集。具体的离子采集参数见表2。
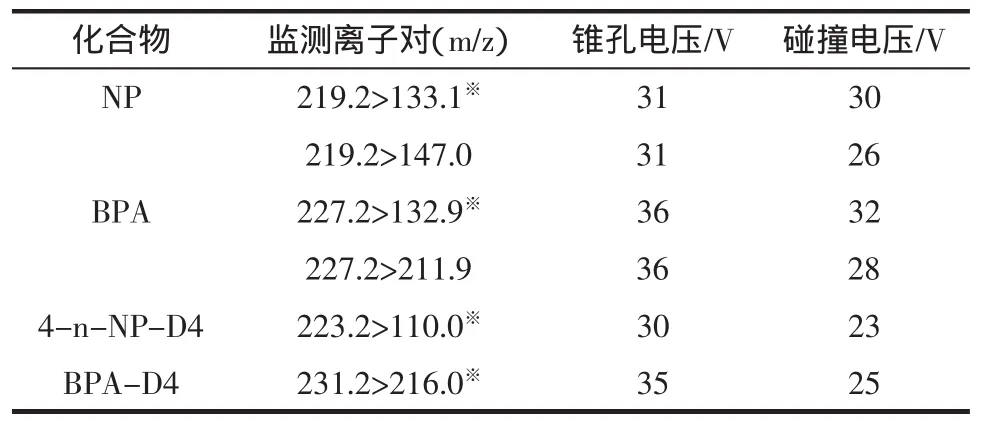
表2 壬基酚和双酚A质谱采集参数Table2 MSparametersof NP and BPA
2 结果与分析
2.1 流出时间的选择
试验选用环己烷-乙酸乙酯作为流动相,选择流速:5.0mL/min;进样量:5mL;检测波长:254 nm,在此条件下对目标样品进行凝胶渗透色谱流出时间测定,得出最佳收集馏分时间,见图1。

图1 NP和BPA混合样品凝胶渗透色谱流出图Fig.1 NP and BPAm ixed samp leGPC outflow Figure
由图1可以确定NP和BPA最佳的收集馏分时间为6min~16min,且两种目标物质的回收率均大于80%。
2.2 净化条件优化
目前国内的样品净化方式多为萃取柱提取,由于食用油中含有大量的脂肪以及色素类物质,对于一般的提取方式而言有很大的干扰,会影响对目标物质的提取效果。这种条件下凝胶渗透色谱可以更加有效的达到预期效果,它具有重现性好、回收率高、适用于多残留分析等特点[10]。综合考虑采用凝胶渗透色谱进行样品的净化以及目标物的提取。
2.3 样品提取剂优化
目前样品提取所使用的试剂多为丙酮、甲醇、正己烷、二氯甲烷以及环己烷-乙酸乙酯等。本次试验针对上述不同试剂对NP、BPA提取效果做出分析,为NP、BPA选择最佳的提取试剂,并计算各试剂提取NP、BPA的回收率。试验结果见图2。
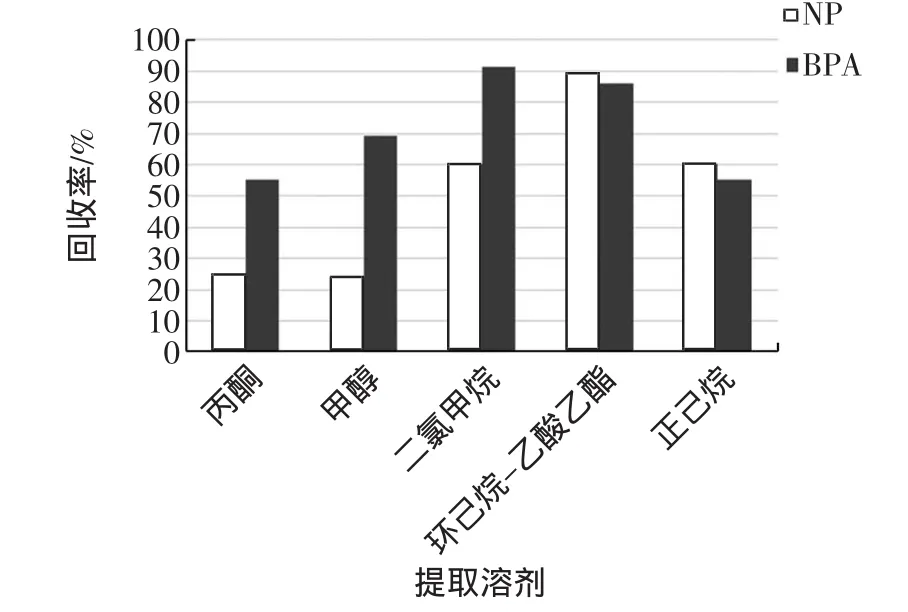
图2 不同提取剂提取双酚A和壬基酚混合样品回收率图Fig.2 Differentextraction agentextraction of BPA and NPm ixed samp le recovery Figure
由图2数据得出:丙酮、甲醇以及正己烷的回收率均达不到理想标准。二氯甲烷在提取BPA时回收率最高,但提取NP的效果相对较低,而环己烷-乙酸乙酯提取NP、BPA时的回收率都较好可以满足试验要求,且回收率大体持平。综合考虑,本试验选用环己烷-乙酸乙酯作为样品的提取溶剂。
2.4 流动相的选择
选择甲醇-水和乙腈-水作为流动相,比较两种流动相发现,乙腈-水保留时间较短,但乙腈-水作为流动相时的响应值明显低于甲醇-水作为流动相时的响应值,故首次试验选择甲醇-水作为流动相。在后续试验中发现,使用甲醇-水时BPA的回收率相对较低,此现象表明流动相存在一定的基质干扰。而弱碱性缓冲液具有增加灵敏度的效果,但考虑碱性太强会使色谱柱寿命缩短[11],所以本方法在流动相中加入0.1%的氨水促进目标化合物的进一步电离同时也避免高浓碱液对色谱柱的损害,从而提高了分离效果,在本试验条件下,两种化合物在3min内完全分离,达到预期效果。
2.5 质谱条件的选择
对NP、BPA进行痕量分析,使用多反应监测模式(MRM)。NP、BPA均含有羟基基团,如要得到理想的分离离子[M-H]-需要在负离子的模式下进行分析[12]。先需要测定待测物的母离子以及子离子(正壬基酚只产生单一的子离子),再对各待测化合物的毛细管电压、脱溶剂温度、锥孔电压等条件进行确定,最佳质谱条件如表2所示。NP、BPA的多反应监测(MRM)色谱图见图3。

图3 双酚A和壬基酚标准品的MRM谱图Fig.3 Chromatogram sof BPA,NP standardsunder MRM mode
2.6 线性方程、相关系数及检出限
在上述UPLC-MS/MS仪器条件下测定2种待测化合物混合标准系列溶液,分别配置浓度1.0μg/kg~5.0×102μg/kg的NP、BPA标准溶液。以定量离子的峰面积Y对相应的浓度X(μg/kg)进行回归分析。NP、BPA的线性范围、线性方程和相关系数以及方法检出限见表3。
由表3可知NP、BPA物质在1.0μg/kg~5.0×102μg/kg范围内具有良好的线性关系。

表3 BPA、NP的线性范围、线性方程、相关系数及检出限Table3 Linear ranges,linear equations,correlation coefficients and LODsof BPA and NP
2.7 回收率与精密度
在样品中添加不同浓度的混合标准溶液,加标水平为1.0、3.0、5.0μg,每个水平设6个平行,按上述试验条件进行处理和测定,得出食用油中NP与BPA的平均加标回收率在85.1%~112.5%之间,其相对标准偏差为2.57%~6.08%,由此可见,该方法精密度良好。具体结果见表4。

表4 食用油中壬基酚和双酚A的加标回收率与相对标准偏差Table4 Recoveriesand RSDs for NP,BPA in edibleoil
2.8 实际样品的测定
应用上述试验方法,随机对市售食用油选取其中六种品牌相同包装的产品进行检测分析,分析结果见表5。

表5 实际样品的测定Table5 Determ ination of realsamples
根据上述试验方法(GPC-UPLC-MS/MS)对实际样品进行分析检测。由表5可以看出市售食用油样品2以及样品5中均未检出NP和BPA。NP在样品1、3、4中检测含量为3.03、2.04、5.56μg/kg,BPA在样品1样品6中检测含量为0.62、2.12μg/kg。表明部分市售食用油当中可以检出少量NP、BPA,该项检测方法使用前景广阔。
3 结论
初步建立了食用油中NP和BPA的GPC-UPLCMS/MS分析检测方法。样品以环己烷-乙酸乙酯(体积比1∶1)溶液溶解,经GPC净化,以UPLC-MS/MS检测,方法所得NP与BPA的平均加标回收率在85.1%~112.5%之间,其相对标准偏差为2.57%~6.08%。该方法准确、操作简单且灵敏度高,能够较好的应用于食用油中NP和BPA的分析检测。
[1] Soell M,Elkaim R,Tenenbaum H,et al.Matrixmetalloproteinases and their tissue inhibitors in gingivalcrevicular fluid from periodontitis-affected patients[J].2002,26(3):174
[2]吴永宁,江桂斌.重要有机污染物痕量与超痕量检测技术[M].北京:化学工业出版社,2007:597
[3]永烈,梁星.种植义齿学第1版[M].北京:北京医科大学中国协和医科大学联合业版社,1999:117-123
[4]马强,白桦.高效液相色谱法对纺织品和食品包装材料中的壬基酚、辛基酚和双酚A的同时测定[J].分析测试学报,2009,38(2): 197-201
[5]KANNAN K,KEITH T L,NAYLOR C G,et al.Nonylphenol and nonylphenolethoxylates in fish,sediment,and water from the Kalamazoo River,Michigan[J].Arch Environ Contam Toxicol,2003,14(4): 77-82
[6]俞雪钧,谷云云,冯睿,等.高效液相色谱串联质谱法同时测定海产品中双酚A及烷基酚残留[J].华中农业大学学报,2014,33(3): 52-59
[7]环境保护部.《中国严格限制进出口的有毒化学品目录》[EB/OL]. 2013年 第 85号公告:http://www.zhb.ggkml/hbb/bgg/201312/ W020131231541093586216.pdf,2014-1-1/2016-2
[8]刘艳琴,王浩,杨红梅,等.凝胶渗透色谱-高效液相色谱法测定植物油中苯并芘[J].食品科技,2013,38(1):327-328
[9]肖全伟,黎源倩,张浩,等.高效液相色谱法测定大鼠血清中4-壬基酚和双酚A[J].四川大学学报(医学版),2004;35(2):271-273
[10]廖雅桦,周冀衡.凝胶渗透色谱-高效液相色谱-串联质谱法测定烟草中50种农药残留量[J].湖南农业大学学报(自然科学版), 2010,36(4):404-409
[11]王天娇,林勤保,安欢,等.超高效液相色谱串联质谱法测定食品包装纸中的酚类物质[J].分析测试学报,2012,12(29):1153-1157
[12]罗纪军.液相色谱串联质谱法测定乳品中双酚A和壬基酚[J].食品科学现代农业科技,2015(1):288-289
Determ ination of NP and BPA in Edible Oil by GPC-UPLC-MS/MS
QIAN Lei1,LIXiu-jun1,QUShuang-shuang1,XIAOGuang-hui2,LIUTing1,*
(1.Instituteof Food Engineering,Heilongjiang EastCollege,Harbin 150086,Heilongjiang,China;2.Heilongjiang Feihe Dairy Co.,Ltd.,Qiqihaer162100,Heilongjiang,China)
Amethod that gel permeation chromatography(GPC)-ultra performance liquid chromatographymassspectrometry(UPLC-MS/MS)used toanalysisand detectnonylphenoland bisphenol A in fatskind foods was established.Samples were dissolved in ethyl acetate-cyclohexane,using ultra performance liquid chromatography-tandem mass spectrometry analysis after GPC purification.The experiment used WATERSACQUITY UPLCBEH C18 column,withmethanol-0.1%aqueousammonia as themobile phase gradientelution rear tandem quadrupole mass spectrometry with multiple reaction monitoring mode detection using internal standardmethod.The analysis showed thatselected objectdetection limitof1.0μg,in the range of1.0μg/kg~5.0×102μg/kg showed a good linear relationship(R2>0.99),the add recovery ratio on average of85.1%-112.5%and the relative standard deviation of2.57%-6.08%.
NP;BPA;GPC;UPLC-MS/MS;edible oil
10.3969/j.issn.1005-6521.2016.24.034
2016-03-17
钱镭(1981—),男(汉),副教授,工学博士,研究方向:乳品工程。
*通信作者
