番石榴叶多酚分离纯化工艺研究
2016-12-22陈智理杨昌鹏赵永锋郭静婕
陈智理,杨昌鹏,*,赵永锋,郭静婕
(1.广西农业职业技术学院,广西南宁530007;2.广西出入境检验检疫局技术中心,广西南宁530021)
番石榴叶多酚分离纯化工艺研究
陈智理1,杨昌鹏1,*,赵永锋2,郭静婕1
(1.广西农业职业技术学院,广西南宁530007;2.广西出入境检验检疫局技术中心,广西南宁530021)
采用AB-8、S-8、D151、X-54种树脂,探讨对番石榴叶中多酚的吸附和解吸条件。结果表明,各种树脂对该多酚的静态吸附效果顺序为S-8>AB-8>X-5>D151,解吸效果为AB-8>X-5>D151>S-8。AB-8树脂是番石榴叶多酚分离纯化的适宜的吸附剂。最佳柱层析条件为上柱液浓度为浓缩2倍原提取液,上柱流速为3BV/h,上柱pH4.5,洗脱剂为80%乙醇,洗脱流速为2BV/h。
番石榴叶;多酚;树脂;分离;纯化
多酚是多羟基酚类化合物的总称,广泛存在于各种植物中。Habrorne发现,番石榴叶子中含有大量的懈皮素、萹蓄苷和番石榴苷,正是这些酚类物质赋予了番石榴叶抗肿瘤、抗氧化、抗动脉硬化等多种功效[1-3]。番石榴在我国广东、广西、福建等地区普遍种植,其叶片中含有大量的多酚物质。在番石榴的栽培管理过程中常进行枝叶修剪,留下大量废弃番石榴叶。如能利用其废弃叶片进行多酚的提取分离,变废为宝,将会推动番石榴深加工产业的发展。
大孔树脂纯化技术是中药制药和食品工业中颇具发展前景的应用新技术之一,具有应用范围广、理化性质稳定、分离性能优良、使用方便,溶剂用量少等优点。目前,大孔树脂在苹果多酚[4]、茶多酚[5]、香蕉多酚[6]、石榴皮多酚[7]的分离研究应用上已有大量的报道,但用树脂法分离纯化番石榴多酚的研究鲜见报道。本论文拟用AB-8、S-8、D151、X-5等大孔吸附树脂对番石榴叶中的多酚进行静态吸附和柱层析工艺研究,探讨最佳的番石榴叶多酚的分离纯化工艺,为番石榴叶中多酚物质资源的开发利用提供理论参考。
1 材料与方法
1.1 材料
番石榴叶采自广西现代农业技术展示中心,洗净、晾干后备用。
1.2 试剂
Folin&CiocaltecusPhenol:美国Sigma公司;AB-8、X-5、S-8、D101等大孔树脂:天津市光复精细化工研究所;焦性没食子酸、无水乙醇、无水碳酸钠等试剂均为国产分析纯。
1.3 仪器
TDL-40B台式离心机:上海安亭科学仪器厂;RE52-86A旋转蒸发器:上海亚荣生化仪器厂;UV755B紫外分光光度计:上海精密科学仪器有限公司;SHZ-82恒温振荡器:国华企业;DHL-ADL电脑恒流泵、DBS-100电脑全自动部分收集器:上海青浦泸西分析仪器厂;1.6 cm×30 cm层析柱:上海锦华层析设备厂。
1.4 方法
1.4.1 番石榴叶多酚的提取
按照陈智理等[8]报道的方法,将番石榴叶清洗、晾干、切碎,与80%乙醇按1∶3(质量比)料液比打浆,在50℃水浴浸提2.5 h,离心过滤、旋转蒸发浓缩后后即得番石榴叶多酚提取液,装瓶置于阴凉处保藏备用。
1.4.2 番石榴叶多酚含量的测定方法
参照Hanmmerschmidt等[9]报道的福林酚改良法进行测定:取样液0.2mL,加入2%NaCO34mL,准确放置2min,再添加稀释成2倍后的福林酚试剂0.2mL,放置30min,在765 nm下测定其吸光度值A765,求得线性回归方程为:
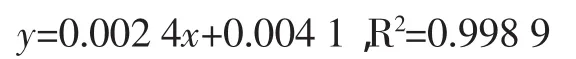
式中:x为焦性没食子酸含量,μg/mL;y为吸光度值(A765)。
1.4.3 番石榴叶中多酚物质的静态吸附
1.4.3.1 各种树脂静态吸附效果的比较
将AB-8、X-5、S-8、D151 4种吸附树脂经处理后,用滤纸吸干表面水分,分别称取20.00 g,装于4个干燥的烧杯中,加入稀释50倍100mL多酚提取液,在室温、120 r/min振荡至吸光度值不在升高达到了吸附平衡,定时吸取上清液,显色后测吸光度,检测溶液中多酚含量的变化,以吸附率比较各种树脂的吸附性能,计算吸附率S公式如下:
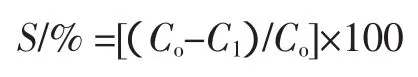
式中:Co为吸附前溶液浓度,mg/mL;C1为吸附后溶液浓度,mg/mL。
1.4.3.2 各种树脂静态解吸效果的比较
准确称取AB-8、X-5、S-8、D151 4种型号树脂5.00 g,分别加入70%的乙醇溶液50 mL,在室温、120 r/min振荡至吸光度值不再升高,定时吸取上清液,显色后测吸光度,检测溶液中多酚含量的变化,以解析率比较各种溶剂的解析效果,计算解析率D公式如下:

式中:Co为吸附前溶液浓度,mg/mL;C1为吸附后溶液浓度,mg/mL;V1为溶液体积,mL;W1为吸附的树脂干重,g;W2为解吸的树脂干重,g;C2为解吸液浓度,%;V2为解吸液体积,mL。
1.4.4 番石榴叶中多酚物质的柱层析分离
1.4.4.1 不同上柱浓度对AB-8动态吸附番石榴叶多酚效果影响
将预处理好的AB-8树脂,装入(1.6 cm×30 cm)玻璃层吸柱中,填充体积为3/5柱床体积(高度约10 cm(15 g),柱床体积约为20 cm3)。再分别用番石榴叶提取液以原液、稀释1倍、稀释2倍、浓缩2倍和浓缩3倍的5种不同浓度,在pH为4.5的条件下,采用2倍柱体积/小时(BV/h)的速度上柱。当流出液中的番石榴叶多酚吸光度达到上柱前番石榴多酚的吸光度1/10时,达到泄露点。停止进样,于765 nm波长下测定其吸光度,计算吸附量并绘制曲线。计算吸附量公式如下:
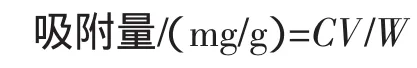
式中:C为进样液浓度,mg/mL;V为进样液体积,mL;W为吸附的树脂干重,g。
1.4.4.2 不同上柱流速对AB-8动态吸附番石榴叶多酚的效果影响
采用番石榴叶原提取液上柱,填充体积为3/5柱床体积、pH为4.5的条件下,选用1、2、3、4 BV/h 4种不同的上柱速度,到达泄露点时停止进样,于765 nm波长下测定其吸光度,计算吸附量并绘制曲线。
1.4.4.3 不同上柱pH对AB-8动态吸附番石榴叶多酚的效果影响
采用番石榴叶原提取液,填充体积为3/5柱床体积、选用2BV/h上柱速度,在pH值为2.5、3.5、4.5、5.5、6.5的条件下上柱,到达泄露点时停止进样,于765 nm波长下测定其吸光度,计算吸附量并绘制曲线。
1.4.4.4 不同浓度乙醇对AB-8动态洗脱番石榴叶多酚的效果
取多酚提取液50mL,在2BV/h的流速下吸附,然后分别用50%、60%、70%、80%、90%的乙醇溶液进行洗脱,收集各部分洗脱液,于765 nm处测定多酚的含量,绘制洗脱曲线,计算回收率公式如下:
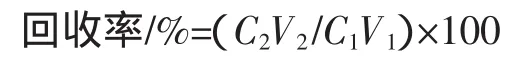
式中:C1为上柱时样液浓度,μg/mL;V1为上柱时样液体积,mL;C2为纯化后收集混合液多酚的浓度,μg/mL;V2为纯化后收集混合液多酚的体积,mL。
1.4.4.5 不同洗脱流速对AB-8动态洗脱番石榴叶多酚的效果影响
取多酚提取液15mL,选用1、2、3、4倍柱体积/小时(BV/h)4种不同的上柱速度,收集各部分洗脱液,于765 nm处测定吸光度,并绘制洗脱曲线,同时计算回收率。
1.4.4.6 多酚纯度计算

式中:C2为纯化后收集混合液多酚的浓度,μg/ mL;V2为纯化后收集混合液多酚的体积,mL;W为多酚物干重,g。
2 结果与分析
2.1 各种树脂静态吸附和解吸效果的比较
4种树脂对番石榴叶多酚的静态饱和吸附与解吸情况见表1。
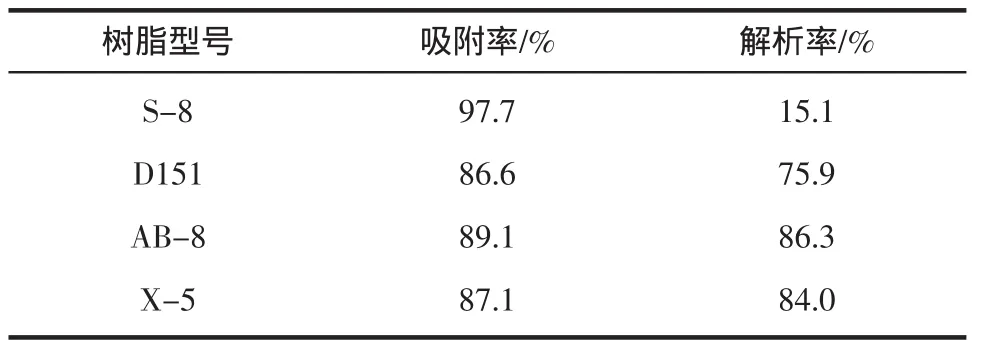
表1 不同大孔吸附树脂对番石榴多酚吸附率与解析率的影响Table1 Effectsof differentofmacroporousadsorption resin on adsorption rateand resolution rateof guava leaf polyphenol
由表1可知4种树脂对番石榴叶多酚的吸附效果大小顺序为S-8>AB-8>X-5>D151,解析效果为AB-8>X-5>D151>S-8,综合考虑以上树脂的吸附能力和解析效果,生产上宜使用AB-8对番石榴多酚进行分离纯化。
2.2 不同上柱浓度对AB-8动态吸附番石榴叶多酚的效果影响
不同上柱浓度对AB-8动态吸附番石榴叶多酚的效果的影响结果如图1所示。
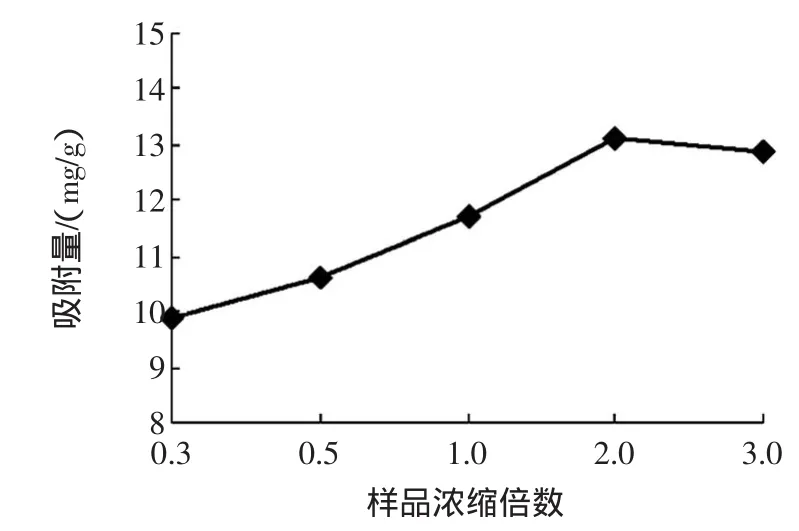
图1 不同上柱浓度对AB-8吸附番石榴叶多酚的效果影响Fig.1 Effectsof different concentrationsof guava leaf polyphenol on adsorption capaclty by AB-8 resin
由图1可知,随着样品上柱浓度的增加,吸附量逐渐增加,但是当多酚的浓度超过浓缩2倍浓度时,吸附量随浓度增加而下降。其原因是样品上柱浓度过高时,在一定流速下,多酚分子和树脂的接触时间变短,造成吸附量的降低。因此在生产上应采用浓缩2倍的样液浓度上柱。这个结果与杨桃多酚[10]以提取液原液直接上柱有所区别。
2.3 不同上柱流速对AB-8动态吸附番石榴叶多酚的效果影响
不同上柱流速对AB-8动态吸附番石榴叶多酚的效果结果如图2所示。
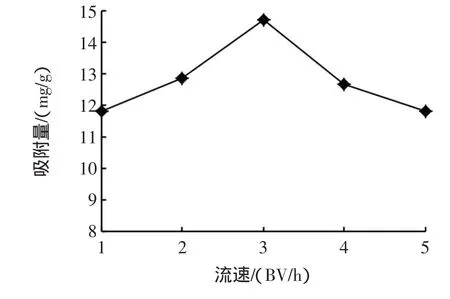
图2 不同上柱流速对AB-8吸附番石榴叶多酚的效果影响Fig.2 Effectsof different flow velocitysof guava leaf polyphenol on adsorp tion capaclty by AB-8 resin
由图2可知,上柱流速为3BV/h时树脂对番石榴叶多酚的吸附量最大,流速过小或过大吸附量都比较低,故生产上宜使用3BV/h的上柱流速。这与玫瑰花多酚分离纯化[11]的上柱流速相同,但与杨桃多酚[10]和红松子种皮中多酚[12]的上柱流速(2BV/h)有所区别。
2.4 不同上柱pH值对AB-8动态吸附番石榴叶多酚的效果影响
不同上柱pH值对AB-8动态吸附番石榴叶多酚的效果结果如图3所示。
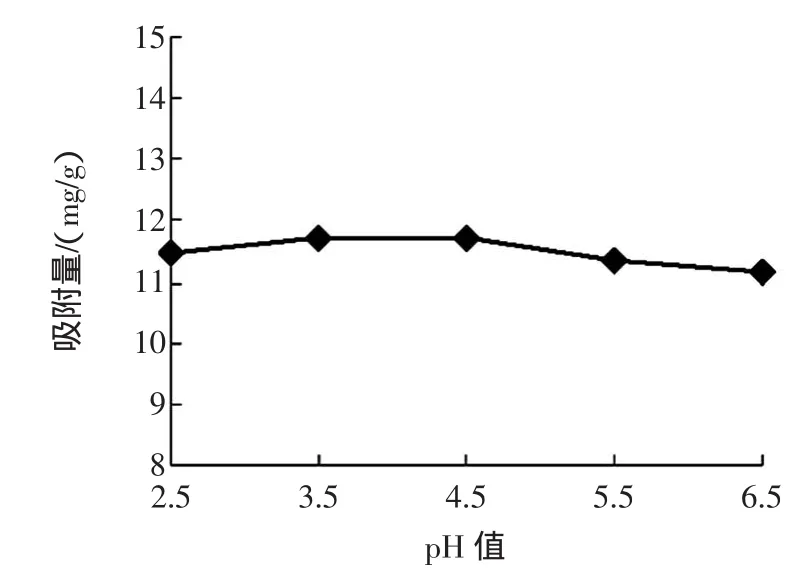
图3 不同上柱pH值对AB-8吸附番石榴叶多酚的效果影响Fig.3 Effectsof different pH of guava leaf polyphenolon adsorption capaclty by AB-8 resin
由图3可知,上柱样液的pH值不同树脂对番石榴叶多酚吸附量区别不大,所以,生产上宜使用pH4.5即番石榴叶多酚的提取原液pH值上柱较为合理,不必再调整上柱样液的pH值。
2.5 不同浓度乙醇对番石榴叶多酚AB-8洗脱效果的影响
不同浓度乙醇对AB-8动态洗脱番石榴叶多酚的结果见图4。
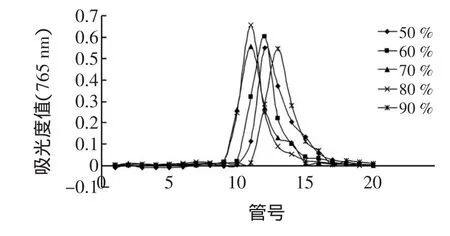
图4 不同浓度乙醇对番石榴叶多酚AB-8洗脱效果的影响Fig.4 Effectsof differentethanolconcentrationson elution capaclty to guava leaf polyphenols in AB-8 resin
由图4可知50%~60%的乙醇洗脱曲线对称性较差,伴随明显的拖尾现象,而且洗脱时间也较长;70%~80%的乙醇洗脱曲线对称性较好,拖尾现象减弱;90%的乙醇洗脱时间也过长。另外,用50%、60%、70%、80%、90%不同浓度的乙醇洗脱番石榴叶多酚的回收率分别是81.4%、81.4%、84.4%、88.4%、83.7%。可见,80%的乙醇洗脱回收率最高,且对称性良好,洗脱时间短且利于富集和纯化,故选择80%的乙醇作为洗脱剂,高于其他多酚物质[7,10-13]的乙醇洗脱浓度。
2.6 不同流速对番石榴叶多酚AB-8洗脱效果的影响
不同流速对番石榴叶多酚AB-8洗脱效果的影响结果见图5。
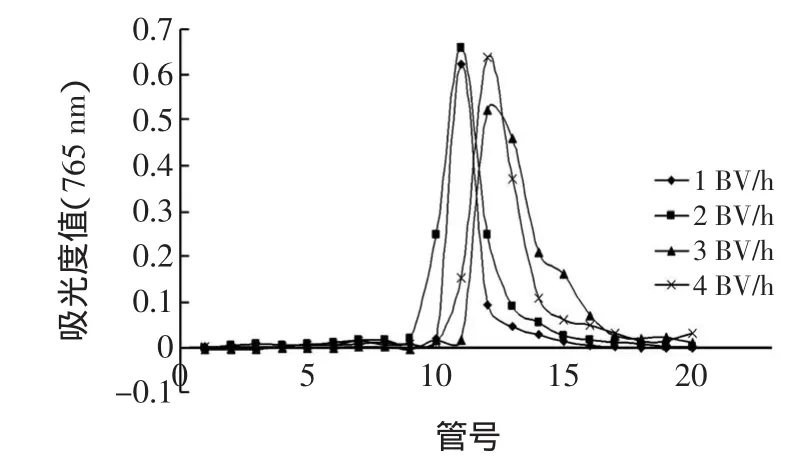
图5 不同流速对番石榴叶多酚AB-8洗脱效果的影响Fig.5 Effectsof different flow velocityson elution capaclty to guava leaf polyphenols in AB-8 resin
由图5可知,流速不同,乙醇对番石榴叶多酚的解吸效果也不同。另外由试验计算得出,洗脱流速为1、2、3、4 BV/h时,分离纯化番石榴叶多酚的回收率分别为83.7%、88.4%、90.7%、76.7%。回收率的大小排序为3BV/h>2BV/h>1BV/h>4BV/h,虽然3BV/h流速洗脱的回收率比2BV/h流速洗脱的回收率大,但是富集和纯化却不如2BV/h,故选择2BV/h流速进行洗脱,这与杨桃多酚[10]的洗脱流速相同。
2.7 最佳层析条件下番石榴叶多酚分离纯化效果
根据试验得到的最佳层析条件,使用大孔树脂AB-8对番石榴叶多酚进行动态吸附与洗脱,即设定上柱液为浓缩2倍浓度的提取原液,上柱流速为3BV/h,上柱pH4.5,洗脱剂为80%乙醇,洗脱流速为2BV/h。
最佳柱层析条件下番石榴叶多酚的动态洗脱曲线见图6。
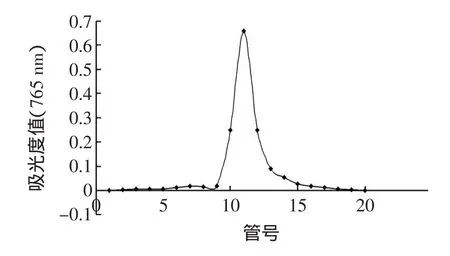
图6 最佳柱层析条件下番石榴叶多酚的动态洗脱曲线Fig.6 Dynam ic elution curveof guava leaf polyphenolsunder the best colum n chromatography conditions
由图6可以看出:通过大孔吸附树脂AB-8吸附后的番石榴叶多酚在解吸时得到了较好的富集与分离效果。经检测,在最佳柱层析条件下分离纯化后的番石榴叶多酚的纯度由原来6.2%提高到70.6%,纯度提高了11倍。
3 结论
1)各种树脂对番石榴叶多酚的静态吸附效果顺序为S-8>AB-8>X-5>D151,解吸效果为AB-8>X-5>D151>S-8。故选择AB-8树脂作为番石榴叶多酚分离纯化的适宜的吸附剂。
2)对番石榴叶中的多酚进行提取与分离纯化工艺研究。结果表明:最佳柱层析条件为上柱液浓度为浓缩2倍原提取液,上柱流速为3 BV/h,上柱pH4.5,洗脱剂为80%乙醇,洗脱流速为2BV/h。
3)在最佳柱层析条件下分离纯化后的番石榴叶多酚的纯度由原来的6.2%提高到70.6%,纯度提高了11倍。
[1]Habrorne,JB Ed.Plant phenolics[M].NewYork:Academic Press, 1989:20-26
[2] Lozoya X,Meckes M,Abou-Zaid M,et al.QuercetinGlycosides in Psidium guajava L.leaves and determination of a spasmolytic principle[J].ArchivesMedicalResearch,1994,25(1):11-5
[3] Begum S,Hassan S I,Siddiqui B S,et al.Triteprenoids from the levaesofPsidium guajava[J].Phytochemistry,2002,61(4):399-403
[4]王振宇,刘春平.大孔树脂AB-8对苹果多酚的分离纯化[J].食品研究与开发2009,30(4):21-24
[5] 吕远平,姚开,何强,等.树脂法纯化茶多酚的研究[J].中国油脂, 2003,28(10):64-66
[6]郭丽萍,卢家炯,韦霁.大孔吸附树脂对香蕉皮多酚吸附特性的初步研究[J].食品与机械,2006,22(2):56-58,112
[7]吴嘉琳.石榴皮多酚的分离纯化及生物活性的研究[D].济南:齐鲁工业大学,2013
[8]陈智理,杨昌鹏,郭静婕,等.番石榴叶多酚提取工艺的优化[J].南方农业学报,2014,45(10):1856-1860
[9] Hanmmerschmidt,Pratt.Phenolic Antioxidants of Dried Soybeans [J].Food Science,1978,43(2):556-559
[10]杨昌鹏,李群梅,郭静婕,等.杨桃多酚分离纯化工艺研究[J].农产品加工(学刊),2014,367(10):31-34
[11]张雪莲.玫瑰花多酚的分离纯化及其功能性饮料研究[D].广州:华南师范大学,2007
[12]苏晓雨,王振宇.红松子种皮中多酚成分的分离纯化研究[J].食品工业,2010,(2):24-26
[13]金莹,孙爱东.大孔树脂纯化苹果多酚的研究[J].食品科学,2007, 28(4):160-163
[9]李群梅.杨桃果实多酚及其抗氧化活性的研究[D].南宁:广西大学,2010
Study on Separation and Purification of Guava Leaf Polyphenol
CHENZhi-li1,YANGChang-peng1,*,ZHAOYong-feng2,GUO Jing-jie1
(1.GuangxiAgriculturalVocationaland TechnicalCollege,Nanning530007,Guangxi,China;2.Technology Center,GuangxiEntry-Exit Inspection and Quarantine Bureau,Nanning530021,Guangxi,China)
Four types of resin(AB-8,S-8,D151,X-5)were used in the adsorption and desorption tests of guava leafpolyphenols.Theorderofdifferent resinsstatic adsorption effectof the polyphenolswas S-8>AB-8> X-5>D151,and the desorption orderwas AB-8>X-5>D151>S-8.The experimental results indicated that AB-8 resin wasa suitable adsorbent forseparation and purification ofguava leafpolyphenols.The amountof the dynamic adsorption to the guava leafpolyphenols on AB-8 colunm was reduced by the decreasion on the sample concentration and the increasion of the flow velocity.Theappropriate flow rate3 BV/h,pH4.5,and theelution peakwas found at80%ethanolby 2BV/h flow rateofelution.
guava leaf;polyphenol;resin;separation;purification
10.3969/j.issn.1005-6521.2016.24.013
2015-11-11
广西教育厅高校科研项目(201106LX794)
陈智理(1979—),女(汉),副教授,硕士,主要从事食品有效成分的检测及分离纯化研究。
*通信作者:杨昌鹏(1964—),教授,博士,主要从事食品分离纯化及果蔬深加工研究工作。
