紫甘蓝食用色素抑制细胞脂质过氧化活性研究
2016-12-22王忠博张志斐姚妍妍李洋
王忠博,张志斐,姚妍妍,李洋
(华北理工大学药学院,河北唐山063000)
紫甘蓝食用色素抑制细胞脂质过氧化活性研究
王忠博,张志斐,姚妍妍,李洋*
(华北理工大学药学院,河北唐山063000)
探讨紫甘蓝食用色素抑制细胞发生脂质过氧化反应的活性。采用H2O2诱导的红细胞溶血、肝匀浆脂质过氧化反应、肝线粒体肿胀实验以及羟基自由基评价紫甘蓝食用色素抑制细胞脂质过氧化损伤的能力。紫甘蓝食用色素能够显著抑制红细胞溶血、降低脂质过氧化反应、减轻线粒体肿胀、清除羟基自由基,均呈一定的量效关系。紫甘蓝食用色素在体外能够抑制细胞脂质过氧化反应,作为天然食用色素开发利用,有广阔前景。
紫甘蓝;天然食用色素;脂质过氧化反应;抗氧化活性
食品中添加的人工合成色素被大量证据证实不仅不能向人体提供营养物质,有些还会危及人类身体健康[1]。随着全球范围内消费者日益关注饮食健康,天然色素的应用成为食品行业色素使用的新趋势。天然色素多来自于动、植物组织以及微生物,不仅对人体无毒害,安全性高,而且部分天然色素具有生理活性,兼有营养保健的作用,如花色苷类色素能够抗衰老、防治心脑血管疾病[2];叶绿素有拮抗诱变及抗癌作用[3];微生物中南极红色素有强抗氧化作用[4]等。因此,天然色素的研发愈加受到重视。
紫甘蓝(Brassicaoleracea L.var.capitata L.f.rubra)为十字花科、芸苔属甘蓝种中的一个变种,富含紫红色色素,颜色鲜艳。紫甘蓝适应能力强,产量高,易贮藏,作为食用蔬菜在我国大面积种植,价格低廉,因而紫甘蓝色素具备开发成天然食用色素的巨大潜力。有研究表明紫甘蓝色素为花色苷类物质[5],揭示了其不仅可作为天然食用色素,更可能具有生理活性。
因此,本文从组织、细胞、细胞器3个方面开展紫甘蓝食用色素防护脂质过氧化损伤实验,以评价其生理活性功能。
1 材料与方法
1.1 材料与试剂
紫甘蓝:购自超市。D101大孔吸附树脂:购自西安蓝晓科技有限公司。芦丁标准品:购自中国药品生物制品检定所。抗坏血酸、无水乙醇、双氧水、十二烷基硫酸钠、三氯乙酸、硫代巴比妥酸、硫酸亚铁、水杨酸均为分析纯。
1.2 主要仪器
RV8旋转蒸发仪:艾卡(广州)仪器设备有限公司;ALPHA 1-2 LD plus冷冻干燥机:德国Christ公司;3K30台式高速冷冻离心机:德国Sigma公司;TU-1810紫外可见分光光度计:北京普析通用仪器有限责任公司;BT 125D分析天平:德国Sartorius公司。
1.3 试验方法
1.3.1 紫甘蓝食用色素的制备
将新鲜、成熟的紫甘蓝剪碎,加入适量含0.1%盐酸的80%乙醇溶液,室温浸提4 h,过滤,置旋转蒸发仪在30℃水浴减压蒸馏,得浓缩液。将浓缩液加入装有D101大孔吸附树脂的色谱柱,吸附饱和后用去离子水洗至洗脱液无色,之后加入含0.1%盐酸的80%乙醇溶液洗脱至无色,收集洗脱液。将洗脱液浓缩除去乙醇,冷冻干燥处理,得紫甘蓝食用色素。
1.3.2 红细胞和肝匀浆的制备
取KM小鼠,18 g~22 g,摘眼球取血,肝素抗凝全血,将小鼠颈椎脱臼处死,快速取肝脏。血液样品用10倍体积的磷酸盐缓冲液(150mmol/LNaCl、8.1mmol/L Na2HPO4、1.9mmol/LNaH2PO4、10mmol/LEDTA,pH 7.4)2 000 r/min、5min离心洗涤3次,去除血浆后得红细胞,4℃保存并在6 h以内使用[6-7]。
肝脏用冰磷酸盐缓冲液清洗,滤纸吸干水分后称重,按1∶9(g/mL)取相应体积的冰磷酸盐缓冲液于冰浴中将肝组织剪碎,玻璃匀浆器中匀浆,得10%(g/mL)肝匀浆,4℃保存。
1.3.3 对红细胞保护作用的测定
取1 mL用磷酸盐缓冲液配制的0.5%(mL/mL)红细胞悬液,加入不同浓度的紫甘蓝食用色素溶液0.1mL(对照组加入0.1mL去离子水)和100mmol/L的H2O2溶液0.1mL,在水浴中37℃恒温加热1 h,之后加入4mL磷酸盐缓冲液并以2 000 r/min离心5min,取上清液在415 nm处测量吸光度,以抗坏血酸作为阳性对照[8]。色素对红细胞溶血的抑制率计算公式如下:

式中:A415(对照)为空白对照组的吸光度;A415(样品)为样品组的吸光度。
按照上述方法,取1mL 0.5%红细胞悬液和0.1mL 0.1mg/mL紫甘蓝食用色素在37℃恒温加热1 h,测量415 nm吸光度以检测色素是否引起红细胞溶血。
1.3.4 肝匀浆脂质过氧化抑制活性的测定
本实验通过测量丙二醛的生成量以检测脂质过氧化程度[9]。取0.2mL 10%肝匀浆和0.1mL不同浓度的紫甘蓝食用色素溶液混匀(对照组取0.1mL去离子水),再加入0.1mL的100mmol/LH2O2溶液,37℃水浴加热1 h,之后加入0.2mL的8.1%十二烷基硫酸钠溶液,1.5mL的15%三氯乙酸溶液和1.5mL的0.8%硫代巴比妥酸溶液,并将此混合液加热至95℃保持1 h。冰浴冷却后3 000 r/min离心10min,取上清液在532 nm处测量吸光度,以芦丁作为阳性对照。色素对脂质过氧化的抑制率计算公式如下:

式中:A532(对照)空白对照组的吸光度;A532(样品)样品组的吸光度。
1.3.5 线粒体肿胀度的测定
将10%肝匀浆在4℃下1 000 r/min离心20min,取上清液在4℃下10 000 r/min离心20min,取沉淀用冰磷酸盐缓冲液在4℃下10 000 r/min离心20min洗涤1次,沉淀即为肝线粒体,再用冰磷酸盐缓冲液将沉淀重悬制成悬液,用考马斯亮蓝法测定该悬液的蛋白质浓度(以牛血清白蛋白为标准),再调整成蛋白质浓度为0.5mg/mL的线粒体悬液,4℃保存备用。
取2mL线粒体悬液、0.2mL不同浓度的紫甘蓝食用色素溶液、0.2mL的0.5mmol/L FeSO4溶液和0.2mL的0.5mmol/L抗坏血酸溶液混匀,37℃水浴孵育,每隔一段时间在520 nm处测量吸光度。对照组用等体积磷酸盐缓冲液代替色素溶液、FeSO4溶液和抗坏血酸溶液,损伤组用等体积磷酸盐缓冲液代替色素溶液,并用芦丁作为阳性对照。吸光度的降低表明线粒体肿胀度增大[10]。
1.3.6 羟基自由基清除能力的测定
通过Fenton反应产生羟基自由基[11]。取不同浓度的紫甘蓝食用色素溶液1mL(对照组加入1mL去离子水),再依次移取1mL 10mmol/LFeSO4溶液、1mL 10mmol/L水杨酸乙醇溶液,之后加1mL 8.8mmol/L H2O2启动反应,37℃反应0.5 h,在510 nm处测量吸光度,以抗坏血酸作为阳性对照。色素对羟基自由基清除率的计算公式如下:

式中:A510(对照)空白对照组的吸光度;A510(样品)样品组的吸光度。
1.3.7 数据分析
用GraphPad Prism 6软件进行单因素方差分析并计算IC50,P<0.05为具有显著性差异。
2 结果与分析
2.1 对红细胞的保护作用
血红蛋白与氧气运送相关,氧化还原反应非常活跃,是活性氧自由基产生的重要来源。由于含有大量的血红蛋白,并且在其细胞膜上还有着高浓度的多不饱和脂肪酸,红细胞被认为是自由基攻击的主要目标[12]。红细胞膜受到氧化损伤后会发生溶血现象,因而红细胞作为一种细胞模型常用于研究生物膜上的氧化损伤。
本试验先验证紫甘蓝食用色素对红细胞的破坏作用。色素作用于红细胞后溶血率为(3.11±0.48)%,这一结果与空白对照组(3.78±0.64)%没有显著性差异(P>0.05),由此可知色素对红细胞无不良影响。
紫甘蓝食用色素对H2O2导致的红细胞溶血的保护作用见图1。
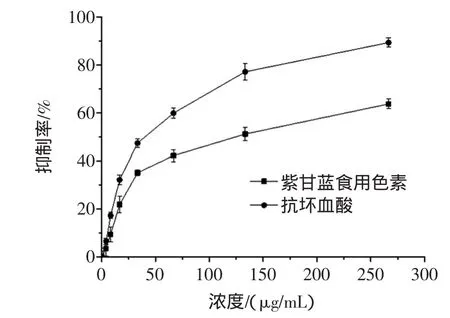
图1 紫甘蓝食用色素对H2O2导致的红细胞溶血的抑制作用Fig.1 Inhibition of pigm ents from red cabbageagainst H2O2induced erythrocytehem olysis
由图1可知,在试验浓度范围内,色素对红细胞溶血的抑制作用随着浓度的增大而增强,能够显著抑制H2O2对红细胞造成的氧化损伤(P<0.05),保护红细胞结构的完整性,其IC50为109.33μg/mL(抗坏血酸IC50为38.23μg/mL)。
2.2 脂质过氧化抑制活性
脂质过氧化是多不饱和脂肪酸的氧化反应,是生物体内常见的氧化进程。其主产物丙二醛,被广泛用于脂质过氧化反应的指示物,也用于指示氧化应激反应的发生[13]。因而测定丙二醛的生成量即可表示脂质过氧化反应的程度。紫甘蓝食用色素对脂质过氧化的抑制活性见图2。
与空白对照组相比,H2O2作用肝匀浆1 h后丙二醛的生成量显著增加(P<0.05),而试验组中丙二醛的生成量显著降低(P<0.05),具有量效关系(见图2),IC50为234.02μg/mL(芦丁组IC50为98.87μg/mL),表明紫甘蓝食用色素对肝匀浆具有显著的抗脂质过氧化活性。此前有研究显示紫甘蓝色素能够抑制亚油酸过氧化作用[14],也证实了紫甘蓝色素的脂质过氧化抑制能力。

图2 紫甘蓝食用色素对脂质过氧化的抑制活性Fig.2 Inhibitory activity of pigm ents from red cabbage to lipid peroxidation
2.3 对线粒体肿胀的抑制作用
在实验中,FeSO4与抗坏血酸反应生成H2O2,导致线粒体膜发生脂质过氧化反应造成其结构损伤,膜通透性改变,从而使线粒体发生肿胀[15]。520 nm处的吸光度降低即代表线粒体发生了肿胀,其结构的完整性遭到了破坏,实验结果如图3所示。

图3 紫甘蓝食用色素对线粒体肿胀的抑制作用Fig.3 Inhibitory effectof pigm ents from red cabbageon m itochondrialswelling
由图3可知,与对照组相比,线粒体模型组的吸光度随着时间推移显著下降,但在含有紫甘蓝食用色素和芦丁的实验组中线粒体肿胀程度明显减弱,表明紫甘蓝食用色素能够抑制氧化损伤造成的线粒体肿胀且抑制能力随着浓度的增大而增强。在200μg/mL相同终浓度下,紫甘蓝食用色素抑制线粒体肿胀的能力要强于芦丁。
2.4 清除羟基自由基能力
羟基自由基是活性最强的自由基,其在生物体内由氧气还原成水的过程中不断产生,是最主要的活性氧自由基,能攻击并破坏几乎所有的生物分子,如DNA、蛋白质、磷脂和糖类[16]。由前述实验结果可知,紫甘蓝食用色素能够抑制H2O2诱导的细胞脂质过氧化反应,因而推测其具有较强清除·OH的能力。结果如图4所示。
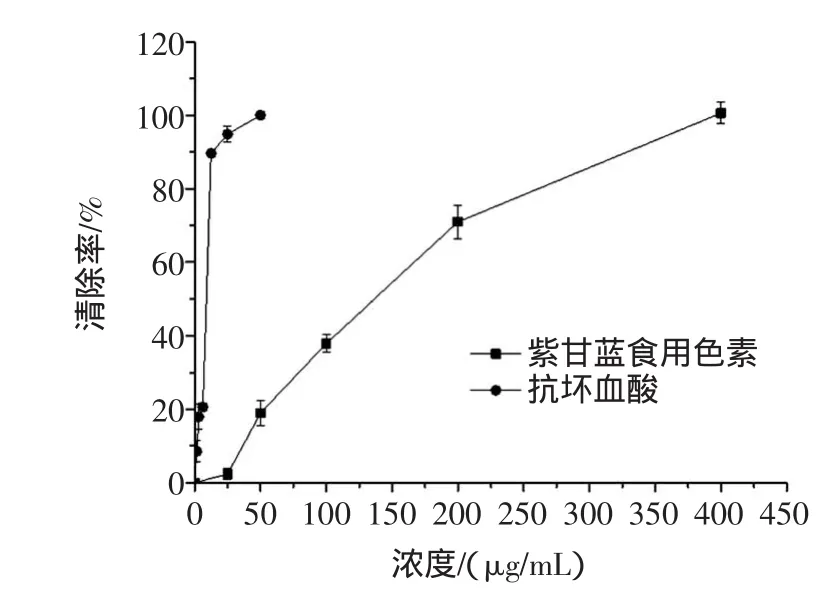
图4 紫甘蓝食用色素对羟基自由基的清除能力Fig.4 Scavenging activity of pigments from red cabbageon hydroxyl radical
由图4可知,色素清除·OH的能力随着浓度的增大而增强,400μg/mL时清除率达到98.6%,IC50为111.06μg/mL,大于阳性对照抗坏血酸(IC50为7.65μg/mL)。
3 结论与讨论
本研究在细胞器-细胞-组织3个层面上评价紫甘蓝食用色素防护细胞脂质过氧化损伤的作用,结果表明紫甘蓝食用色素能够清除·OH,具有显著的体外抗氧化活性,具有一定的量效关系。
花色苷类物质具有多酚羟基结构,而通常认为酚羟基是抗氧化活性的原因所在,如结构中B环上羟基的数量、位置是其清除活性氧自由基能力的决定因素;C环上3-OH能增强清除自由基的能力;B环上3'、4'邻二羟基结构能够极大增强脂质过氧化抑制能力[17]。紫甘蓝食用色素属于矢车菊素花色苷[5],母核结构如图5,其能够有效抑制生物体脂质过氧化反应,可能与其母核结构中B环上存在3'、4'邻二羟基有关,本研究试验结果与理论相符。
天然色素的需求量越来越大,具有功能作用的花色苷类色素尤其受到关注。开发花色苷类色素,不仅要研究体外活性,其在体内的吸收、代谢及功能作用的发挥情况,更是下一步研究的重点。
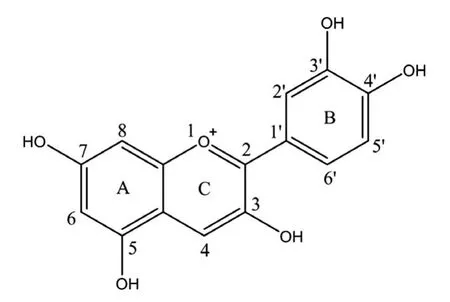
图5 矢车菊素花色苷的基本结构Fig.5 Basic chem icalstructureof cyanidin
[1]海因利希·左林格.色素化学:有机染料和颜料的合成、性能和应用[M].吴祖望,程侣柏,张壮余,译.北京:化学工业出版社, 2005
[2]赵海田,王振宇,路,等.花色苷类物质降血脂机制研究进展[J].东北农业大学学报,2012,43(3):139-144
[3]王静,刘昭明,肖凯军,等.天然食用色素的结构与生理活性分析[J].食品工业科技,2007,28(12):208-212
[4]赵倩,能飞,张梅,等.南极红色素与3种天然色素还原性和抗氧化性对比研究[J].食品研究与开发,2015,36(2):117-120
[5] Mizgier P,Kucharska A Z,Sokół-Łe towska A,et al.Characterization of phenolic compounds and antioxidantand anti-inflammatory properties of red cabbage and purple carrot extracts[J].Journal of Functional Foods,2016,21:133-146
[6]Yuan XP,Wang J,Yao H Y,etal.Free radical-scavenging capacity and inhibitory activity on rat erythrocyte hemolysis of feruloyl oligosaccharides from wheat bran insoluble dietary fiber[J].LWTFood Scienceand Technology,2005,38(8):877-883
[7] Yang H L,Chen SC,Chang NW,et al.Protection from oxidative damage using Bidens pilosa extracts in normal human erythrocytes [J].Food and Chemical Toxicology,2006,44(9):1513-1521
[8] Tedesco I,Russo M,Russo P,et al.Antioxidant effect of red wine polyphenols on red blood cells[J].The Journal of Nutritional Biochemistry,2000,11(2):114-119
[9] Ohkawa H,Ohishi N,Yagi K.Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction[J].Analytical Biochemistry, 1979,95(2):351-358
[10]Song Y N,Hui J,Kou W,et al.Identification of Inonotus obliquus and analysis of antioxidation and antitumor activitiesof polysaccharides[J].CurrentMicrobiology,2008,57(5):454-462
[11]Wang SY,Jiao H J.Scavenging capacity of berry cropson superoxide radicals,hydrogen peroxide,hydroxyl radicals,and singlet oxygen[J].Journal of Agricultural and Food Chemistry,2000,48(11): 5677-5684
[12]LiY,LiH L,Zhang Y,etal.In vitro antioxidantand anticanceractivitiesof the extract from papermulberry(Broussonetia papyrifera L.)fruit[J].Asian JournalofChemistry,2013,25(10):5453-5456
[13]Janero D R.Malondialdehyde and thiobarbituric acid-reactivity as diagnostic indices of lipid peroxidation and peroxidative tissue injury[J].Free RadicalBiology and Medicine,1990,9(6):515-540
[14]徐亚民,赵晓燕,马越,等.紫甘蓝色素抗氧化能力的研究[J].食品研究与开发,2006,27(11):59-62
[15]Chen Z B,Lv JW,Chen FQ,et al.Studies on telluric hyaluronic acid(TeHA):A novel antioxidant[J].Journal of Molecular Catalysis B:Enzymatic,2008,55(3/4):99-103
[16]Lipinski B.Hydroxyl radical and its scavengers in health and disease[J].OxidativeMedicine and Cellular Longevity,2011,2011:1-9
[17]Heim K E,Tagliaferro A R,Bobilya D J.Flavonoid antioxidants: chemistry,metabolism and structure-activity relationships[J].The JournalofNutritional Biochemistry,2002,13(10):572-584
Inhibitory Activity of the Natural Pigm ents from Red Cabbage to Cellular Lipid Peroxidation
WANGZhong-bo,ZHANGZhi-fei,YAOYan-yan,LIYang*
(SchoolofPharmacy,North China University of Scienceand Technology,Tangshan 063000,Hebei,China)
The objective of thiswork was to study the inhibitory activity of the natural pigments from red cabbage to cellular lipid peroxidation.ThemethodsofH2O2-induced erythrocyte hemolysisand lipid peroxidation of liver homogenate,mitochondrial swelling and scavenging hydroxyl radicalwere used to evaluate the inhibitory activity.The results showed that the natural pigments from red cabbage inhibited erythrocyte hemolysis,lipid peroxidation andmitochondrialswelling significantly andwere scavengersofhydroxyl radical.The inhibitory activity showed a dose-dependent increase in the assays.The naturalpigments from red cabbage could inhibit cellular lipid peroxidation andmightbedeveloped asedible pigmentwith broad prospects.
redcabbage;naturalediblepigment;lipidperoxidation;antioxidantactivity
10.3969/j.issn.1005-6521.2016.24.009
2016-04-14
河北省自然科学基金项目(H2016209319);河北省省级大学生创新创业训练计划项目(X2015062)
王忠博(1993—),男(汉),在读本科,主要从事天然产物生物活性研究。
*通信作者:李洋(1983—),男(汉),讲师,博士,主要从事天然产物的化学与生物活性研究。
