HPLC法测定鱼腥草素钠包合物中的药物含量*
2016-12-22宋婉玉黄玉娇李卫红
宋婉玉 黄玉娇 李卫红 李 菲
(泰山医学院药学院,山东 泰安 271016)
HPLC法测定鱼腥草素钠包合物中的药物含量*
宋婉玉 黄玉娇 李卫红 李 菲
(泰山医学院药学院,山东 泰安 271016)
目的 采用高效液相色谱法测定包合物中鱼腥草素钠的含量。方法 色谱柱:大连伊力特C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.01 mol/L四丁基溴化铵-三乙胺(43∶57∶0.3);检测波长:283 nm;流速:1.0 ml/min。结果 鱼腥草素钠在9.6~ 96 mg/L范围内线性关系良好,r=0.9999;平均回收率为97.64%(RSD=1.37%,n=9)。结论 该法检测快速、准确,可用于鱼腥草素钠包合物的含量测定。
鱼腥草素钠;高效液相色谱法;含量测定
鱼腥草别名折耳根,为三白草科植物蕺菜的干燥地上部分,是一味常用中药。中医认为鱼腥草具有清热解毒、消痈排脓、利尿除湿之功效。现代研究发现,鱼腥草的主要有效成分为癸酰乙醛(鱼腥草素),具有抗菌、抗病毒、免疫调节等药理作用[1-2],临床上主要用于治疗支气管肺炎、呼吸道感染、鼻渊等疾病。由于癸酰乙醛游离状态易于聚合失效,所以成品则需制成性质较为稳定的加成物。1971年国内人工合成了癸酰乙醛亚硫酸氢钠,俗称合成鱼腥草素或鱼腥草素钠,具有抗菌、免疫调节等作用[3-4]。鱼腥草素钠在水中微溶,遇水有特殊鱼腥臭,且易于发生水解。将鱼腥草素钠制成β-环糊精包合物可增加其溶解度,掩盖其不良气味,并提高稳定性[5]。本实验建立了HPLC法测定β-环糊精包合物中鱼腥草素钠的含量。
1 仪器与试剂
依利特P230Ⅱ高效液相色谱仪(包括UV230Ⅱ紫外-可见检测器,EC2006色谱数据处理工作站,大连依利特分析仪器有限公司);低速离心机(型号:TDL-40B,上海安亭科学仪器厂);超纯水机(型号:UPT-I-107,成都超纯科技有限公司);医用超声波清洗槽(型号:KQ-500E,昆山市超声仪器有限公司)。
鱼腥草素钠对照品(中国药品生物制品检定所,批号:100247-199601,纯度>98﹪);鱼腥草素钠原料药(西安开来生物工程有限公司,批号:K141203,纯度>98﹪);鱼腥草素钠-β-环糊精包合物(自制);乙腈(中国医药集团上海化学试剂公司,批号:F000128);甲醇(色谱纯,天津市永大化学试剂有限公司);其他试剂均为分析纯。
2 方法与结果
2.1 检测波长的确定
精密称取鱼腥草素钠对照品适量,加乙腈-0.01 mol/L四丁基溴化铵溶液—三乙胺(43∶57∶0.3)溶解并稀释为24 mg/L的溶液。以乙腈-0.01 mol/L四丁基溴化铵溶液—三乙胺(43∶57∶0.3)为空白对照,在UV200~400 nm波长范围内进行扫描,扫描图谱见图1。
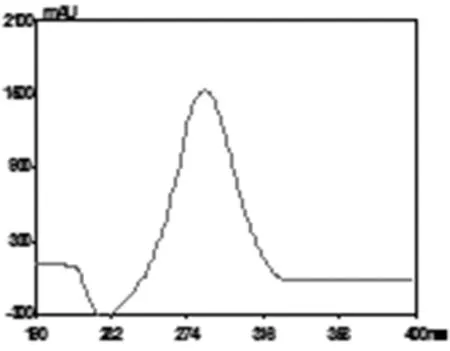
图1 鱼腥草素钠紫外扫描图谱
结果表明,鱼腥草素钠在283 nm有最大吸收峰,故选283 nm作为检测波长。
2.2 色谱条件
色谱柱:大连伊力特C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.01 mol/L四丁基溴化铵—三乙胺(43∶57∶0.3);检测波长:283 nm;流速:1.0 ml/min;柱温:室温;进样量:20 μl。在上述色谱条件下进样,鱼腥草素钠保留时间为6.1 min,色谱峰与相邻物质峰分离度良好,空白溶液、标准品和样品的色谱图见图2。

图2 空白溶液(A)、标准品(B)、样品(C)的高效液相色谱图
2.3 溶液制备
2.3.1 对照品溶液 精密称取鱼腥草素钠对照品适量,加水溶解并稀释,制成质量浓度为240 mg/L的对照品溶液。
2.3.2 供试品溶液 取自制包合物30 mg置于100 ml容量瓶中,加蒸馏水适量,超声5 min,加蒸馏水定容,摇匀,0.22 μm微孔滤膜过滤,续滤液即为供试品溶液。
2.4 标准曲线的绘制
精密称取鱼腥草素钠对照品12.0 mg,加水准确配制浓度为240 mg/L的储备液。精密量取储备液适量至10 ml量瓶中,加水稀释得到系列标准溶液,按照“2.2”项下条件进行HPLC测定。以峰面积(Y)对质量浓度(ρ)进行线性回归,得回归方程Y=80025ρ-20759,r=0.9999,表明鱼腥草素钠在9.6~ 96 mg/L范围内线性关系良好。
2.5 精密度试验
精密称取鱼腥草素钠对照品适量,用水溶解并稀释成低、中、高3个质量浓度为9.6,48,96 mg/L的溶液,于1 d内各连续测定5次,计算日内精密度。结果见表1,RSD<1%,表明精密度良好。

表1 精密度测定结果(n= 5)
2.6 加样回收率实验
精密称取已知含量的鱼腥草素钠包合物30 mg,分别加入对照品溶液10, 20, 30 ml,每个水平3份,共9份。按照“2.3.2”项下方法制备加样回收供试品溶液,按照“2.2”项下条件进行HPLC测定,计算加样回收率,结果见表2。
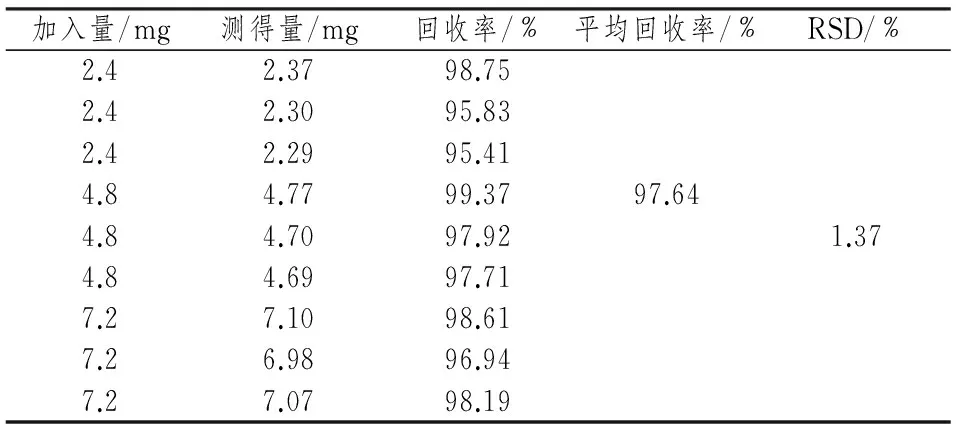
表2 加样回收率测定结果(n= 3)
2.7 稳定性实验
取同一供试品溶液,室温放置0 h、 2 h、 4 h、 8 h进样测定,计算峰面积的RSD为1.89%,表明供试品溶液在室温放置8 h内稳定性良好。
2.8 重复性实验
精密称取包合物样品5份,每份30 mg,按照“2.3.2”项下方法操作制成供试液进样测定,计算峰面积的RSD为1.63%,表明本方法重复性良好。
2.9 样品测定
取3批样品按照“2.3.2”项下方法制备供试品溶液,按照“2.2”项下条件进行HPLC测定,根据标准曲线计算鱼腥草素钠含量为17.32 ± 1.90% (n=3)。
3 讨 论
鱼腥草素钠水溶液不稳定,易于水解为癸酰乙醛和亚硫酸氢钠。将鱼腥草素钠制成包合物可增加其稳定性和溶解度,并掩盖其不良气味。鱼腥草素钠极性较大,流动相中主要以离子形式存在,采用反相色谱保留时间短。流动相中加入离子对试剂四丁基溴化铵,可延长其保留时间[6]。流动相pH对离子对色谱影响较大[7],以乙腈-0.01 mol/L四丁基溴化铵(43∶57)为流动相,出现拖尾峰。加入三乙胺调节水相pH为11可避免拖尾,改善峰形。
[1] 吴卫.鱼腥草的研究进展[J].中草药, 2001, 32(4): 367-370.
[2] 李爽,于庆海,金佩珂.鱼腥草的有效成分、药理作用及临床应用的研究进展[J].沈阳药科大学学报,1997, 14(2):144-147.
[3] 何小燕.鱼腥草素钠类化合物的构效关系研究现状[J].药学进展, 2009,33(4): 163-166.
[4] 王大勇,毕秀丽,周园,等.合成鱼腥草素对巨噬细胞呼吸爆发,细胞内游离钙离子浓度及T细胞分泌白细胞介素-2的影响[J].沈阳药科大学学报,2003, 20(3):210-214.
[5] 夏之宁, 向顺峰, 李珍义, 等.鱼腥草素钠与β-环糊精包络常数的电泳法研究[J].药学学报,2003, 38(1):42-45.
[6] 张志斌,钱卫德,杭亚军, 等.反相离子对色谱法测定鱼腥草素钠的含量[J].中成药,2006, 28(6):895-896.
[7] 马廉举,刘新.反相离子对色谱法测定马尾松松针中莽草酸的含量[J].中药材,2008, 31(1):63-65.
Determination of sodium houttuyfonate in sodium houttuyfonate inclusion complex by HPLC
SONG Wan-yu HANG Yu-jiao LI Wei-hong LI Fei
(Dept.of Pharmacy, Taishan Medical University, Taian 271016, China)
Objective: To establish an HPLC method for the determination of sodium houttuyfonate.Methods: The analysis was performed on a Hypersil ODSC18 column (250 mm×4.6 mm, 5 μm) with acetonitrile -0.01 mol/L tetrabutyl ammonium bromide solution -trithylamine (43∶57∶0.3) as mobile phase at a flow rate of 1.0 ml/min and detection wavelength of 283 nm.Results:The method achieved a good linearity in the range of 9.6~ 96 mg/L for sodium houttuyfonate.The mean recovery of sodium houttuyfonate was 97.64% (RSD = 1.37%,n=9).Conclution: This method is convenient and accurate, it can be used to determine the content of sodium houttuyfonate.
sodium houttuyfonate; HPLC; content determination
国家级大学生创新创业训练计划项目(201510439092)。
宋婉玉,2013级制药工程专业本科生。
李菲,女,讲师,研究方向:中药新剂型和新制剂。
R917
A
1004-7115(2016)10-1102-02
10.3969/j.issn.1004-7115.2016.10.007
2016-07-22)
