珊瑚菜叶绿体基因TrnV-M序列的PCR扩增与分析
2016-12-22慕春歌
慕春歌
(鲁东大学资产处,山东烟台 264025)
珊瑚菜叶绿体基因TrnV-M序列的PCR扩增与分析
慕春歌
(鲁东大学资产处,山东烟台 264025)
[目的]对珊瑚菜TrnV-M基因片段PCR扩增条件进行优化和测序分析,为濒危物种珊瑚菜的种质资源保护和遗传多样性研究提供理论依据。[方法]探索并优化珊瑚菜叶绿体基因片段TrnV-M的PCR扩增条件,并对扩增产物进行测序分析。[结果]珊瑚菜TrnV-M基因片段的PCR最佳反应体系:dNTPs 0.50 μL,Buffer 2.50 μL,TrnM1.25 μL,TrnV1.25 μL,DNA 1.00 μL,rTaqE 0.15 μL,ddH2O 18.35 μL,总体积25.00 μL。最佳扩增程序:94 ℃预变性3.0 min;94 ℃变性50 s,58 ℃退火45 s,72 ℃延伸1 min 25 s,38个循环;72 ℃延伸8 min。[结论]在最优体系下获得了清晰、稳定的目的条带,校正后条带长度约为757 bp,通过 GenBank 的 BLAST 比对,确定为TrnV-M基因片段。
珊瑚菜;TrnV-M;PCR扩增;最佳反应体系
单种属植物珊瑚菜(GlehnialittoralisF.Schmidt ex Miq.)为伞形科(Umbelliferae)珊瑚菜属(Glehnia)多年生草本植物,主要分布在东亚地区的中国、韩国、日本3个国家海岸线区域的沙滩以及北美地区的美国近海沙滩,在我国主要分布在辽宁、山东、江苏、浙江、台湾、福建、广东和海南岛沿海海岸[1]。珊瑚菜耐盐碱,生活环境以海滨沙滩为主,松软的砂质土壤为其膨大的根部发育提供了保证,其根用作镇咳祛痰药,为我国应用广泛的传统中药材[2-5]。另外,珊瑚菜扎入深层土壤的根系对于海岸固沙和盐碱土的改良具有重要意义。近年来,随着海滨开发力度的增加,珊瑚菜原始生态环境遭到严重破坏,野生资源急剧减少,分布面积越来越窄;同时,人为采挖也加大了珊瑚菜野生居群的急剧减少,造成了珊瑚菜很多原产地的消失。目前该物种已被列为国家Ⅱ级重点保护野生植物[6],被称为植物界的“大熊猫”。
植物遗传多样性评估是研究濒危物种保护机制的重要手段。近几年,利用分子手段研究珊瑚菜遗传多样性的报道很多,大多采用等位酶、SRAP、ISSR等分子标记法[7-9],采用叶绿体基因序列进行标记的研究较少。叶绿体基因组DNA由于其属于单系遗传,不受网状进化、杂交等因素的影响,且具有进化速率较快、相对保守等特点,一直作为良好的分子标记被广泛应用于物种进化和遗传多样性的研究[10-11]。叶绿体基因片段TrnV-M作为其中的一员近年来也被用于物种进化的研究,如利用基因片段对肉苁蓉属系统位置的研究[12-13]和高山植物偏花报春居群遗传多样性方面的研究[14-15]。笔者对珊瑚菜TrnV-M基因片段PCR扩增条件进行优化和测序分析,旨在为珊瑚菜物种遗传多样性研究提供理论依据。
1 材料与方法
1.1 材料 试验所用珊瑚菜叶片均为野外采集并用硅胶干燥保存。
1.2 试剂 50 mol/L Tris-HCl(pH 8)、10 mmol/L EDTA(pH 8)、0.7 mol/L NaCl、十六烷基三甲基溴化铵(CTAB)、40 mmol/L β-巯基乙醇、氯仿∶异戊醇(24∶1)、无水乙醇、75%(V/V)乙醇、异丙醇、溴化乙锭(EB)、琼脂糖、0.5×TBE等。TaqDNA聚合酶(TaKaRa 公司)、10×PCR缓冲液、MgCl2、DMSO、dNTP混合物、PCR扩增引物、DL 2000 DNA Marker、Loading buffer、胶回收试剂盒(上海生物工程有限公司),双蒸水。
1.3 器材 恒温水浴锅、PCR扩增仪(BIO-RAD)、电泳仪、电泳槽、电子天平、制冰机、恒温摇床、高压灭菌锅、台式离心机、凝胶成像仪、微量移液器、研钵、解剖刀、一次性手套、0.5、1.5、2.0 mL 离心管、Tip头、PCR小管、电冰箱、吸水纸、微波炉、锥形瓶等。
1.4 方法
1.4.1 总DNA的提取与检测。采用改进的CTAB法[16-17]提取珊瑚菜基因组DNA,用1.0%琼脂糖凝胶进行电泳检测(EB浓度为0.5 mg/mL),用凝胶成像仪进行条带观测,根据条带亮度和有无拖尾情况,粗略估计该样品DNA的质量和浓度。将检测合格的DNA(浓度较大的DNA用超纯水稀释至约20 ng/μL),置于-20 ℃冰箱中备用。
1.4.2TrnV-M基因片段的扩增及检测。以TrnV-M-F(CCTGTAGGYTGNGCNCCYTT)、TrnV-M-R(AAACGATGTGGNAGNAARCA)为引物,在25.00 μL 反应体系中(dNTPs 0.50 μL,Buffer 2.50 μL,TrnM1.25 μL,TrnV1.25 μL,DNA 1.00 μL,rTaqE 0.15 μL,ddH2O 18.35 μL),通过不同退火温度(48、50、52、54、56、58、60 ℃)的扩增程序,确定最适扩增程序。PCR反应结束后,取2 μL PCR产物进行琼脂糖凝胶电泳检测,在全自动数码凝胶成像仪上进行观察并拍照,其余产物置于4 ℃冰箱保存。
1.4.3 PCR扩增产物的纯化与测序。 将成功扩增的条带进行割胶纯化,纯化试剂盒购自上海生物工程有限公司,纯化步骤参考试剂说明书。将 PCR 纯化产物送青岛华大基因公司进行测序,测序结果提交GenBank(GenBank号正在申请中),然后采用 BLAST功能在 GenBank 中进行同源性检测。
2 结果与分析
2.1 DNA提取结果 采用CTAB法提取的基因组DNA纯化后,经1.0%琼脂糖凝胶电泳检测,条带清晰,且纯度较高,可作为PCR反应的模板(图1)。
2.2 PCR扩增结果 PCR产物的琼脂糖凝胶电泳分析结果见图2。由图2可知,58 ℃下可见清晰条带,其他条件不能获得目的基因片段,因此,确定最适扩增程序:94 ℃预变性30 min;94 ℃变性50 s,58 ℃退火45 s,72 ℃延伸1 min 25 s,38次循环;72 ℃延伸8 min。
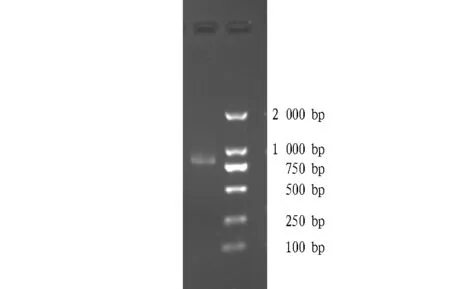
图2 58 ℃退火温度下PCR扩增电泳图谱Fig.2 PCR electrophoretogram under 58 ℃annealing temperature
2.3 PCR产物纯化和测序结果 取纯化后的PCR扩增产物2 μL进行电泳检测,结果见图3。由图3可知,电泳条带清晰,无杂带,纯化效果良好,纯化产物送华大基因公司进行测序,获得基因序列长度校正后约为757 bp,通过 GenBank 的 BLAST 比对,确定为TrnV-M基因片段。

图3 PCR产物纯化电泳图谱Fig.3 Electrophoretogram of PCR purified product
3 讨论
TrnV-M基因片段扩增成功的第一步是高质量基因组DNA的获得,适宜的 PCR 条件也是成功扩增必不可少的。该研究采用改进的 CTAB 法提取珊瑚菜基因组DNA,以TrnV-M-F、TrnV-M-R为引物,利用珊瑚菜基因组 DNA 为模板进行扩增,通过单因素试验研究2对引物的 PCR 扩增条件,并对扩增产物进行纯化,最后送至基因公司测序,通过核酸序列比对确定扩增结果的可靠性。影响 PCR 扩增效果的因素较多,主要有模板 DNA质量、引物的种类与用量、 DNA 聚合酶、 Mg2+、 dNTPs、退火温度等。模板 DNA质量直接影响扩增条带的纯度;引物和DNA 聚合酶浓度影响扩增体系的特异性;Mg2+影响PCR的多个方面,Mg2+浓度过高会引起非特异性扩增,而浓度过低会降低Taq酶活性,使反应产物减少;dNTPs是 PCR 反应的原料,浓度过低会降低PCR产物产量,导致扩增条带模糊不清;浓度过高错配率大大增加,且能与Taq酶竞争Mg2+,使体系中游离的Mg2+浓度降低,进而影响扩增效果;退火温度则是PCR反应体系的最后关口,温度过高使得引物不容易退火,降低PCR产物产量;温度过低会导致错配概率加大。以上各因素并非单独作用而是共同影响PCR体系扩增效果,合理搭配可获得良好扩增效果。
在最优体系的构建过程中,传统上是通过设定单因素试验进行梯度筛选,近年来又发展了正交设计试验和均匀设计试验。由于影响因素很多,逐级筛选需要多次试验才能完成,往往需要大量人力物力。因此,如何尽快地找到最佳扩增条件也是提高试验效率的一个重要步骤。考虑到PCR 扩增体系中各成分的含量允许在一定范围内浮动,且试剂公司提供各试剂适用浓度范围,构建适合于大部分扩增条件的基本体系相对容易,在此基础上,仅需要通过改变退火温度这一个因素进行优化即可得到成功扩增的条件,该研究根据以上优化原则,高效快速地建立了珊瑚菜TrnV-M基因片段的扩增条件。最佳扩增体系:dNTPs 0.50 μL,Buffer 2.50 μL,TrnM1.25 μL,TrnV1.25 μL,DNA 1.00 μL,rTaqE 0.15 μL,ddH2O 18.35 μL,总体积25.00 μL;最适退火温度为58 ℃。
4 结论
该研究通过经验估计和退火温度梯度设计,简便快速地建立了珊瑚菜TrnV-M基因片段的最佳扩增条件,为珊瑚菜的系统进化和遗传多样性研究奠定基础,还可为今后珊瑚菜亲缘物种甚至其他物种该基因的获得提供参考。该方法的优点是高效、简便、快捷,具有较强的实用价值;其缺点是需要丰富的经验来预估相关影响因素的最适浓度,具有一定的主观性和不确定性,在对PCR扩增产物要求较高的研究中,有必要对相关因素进行一定浓度梯度筛选。参考文献
[1] 单人骅,佘孟兰.中国植物志:第55卷第3分册[M].北京:科学出版社,1992:77-79.
[2] 裴鉴,周太炎.中国药用植物志(第八卷)[J].北京:科学出版社,1965.
[3] 中华人民共和国药典委员会,中华人民共和国药典:1990年版(1部)[M].广州:广东科技出版社,1993.
[4] 中国医学科学院药物研究所.中药志(第一卷)[M].北京:人民卫生出版社,1979.
[5] 方新德,孔忠 鸣,应文斌,等.北沙参多糖成分的研究[J].中成药,1987(8):25-27.
[6] 傅立国.中国植物红皮书:稀有濒危植物(一)[M].北京:科学出版社,1991,9.
[7] 王爱兰,王贵琳,李维卫,等.濒危物种珊瑚菜遗传多样性的ISSR分析[J].西北植物学报,2015,35(8):1541-1546.
[8] MAN K H,CHOI J S,HONG W H,et al.Genetic diversity and population structure ofGlehnialittoralis(umbelliferae)in Korea[J].Oriental physiology & pathology,2003,17(6):1519-1523.
[9] 惠红,刘启新,刘梦华.中国沿海中部珊瑚菜居群等位酶变异及其遗传多样性[J].植物资源与环境学报,2001,10(3):1-6.
[10] 黄瑶,李朝銮,马诚,等.叶绿体DNA及其在植物系统学研究中的应用[J].植物学通报,1994,11(2):11-25.
[11] 卢孟柱,谢红丽,张辉,等.利用叶绿体DNA变异研究胡杨系统发育[J].西北植物学报,2000,20(6):1148-1154.
[12] 李汐,祝铭,孙延霞,等.基于叶绿体rps16基因和核基因ITS片段研究肉苁蓉属系统位置[J].植物科学学报,2012,30(5):431-436.
[13] OXELMAN B,LIDÉN M,BERGLUND D.Chloroplast rps-16 intron phylogeny of the tribe sileneae(Caryophyllaceae)[J].Plant systematics and evolution,1997,206(1):393-410.
[14] 王凤英,龚洵,胡启明,等.基于叶绿体DNA变异研究高山植物偏花报春的种内谱系地理结构[J].植物分类学报,2008,46(1):13-22.
[15] 陈仁芳,张泽,唐洲,等.桑属IIS,Trnl-F,rps16序列与进化分析[J].中国农业科学,2011,44(8):1553-1561.
[16] DOYLE J J,DOYLE J L.A rapid DNA isolation procedure for small amounts of fresh leaf tissue[J].Phytochem bull,1987,19(1):11-15.
[17] TABERLET P,GIELLY L,PAUTOU G,et al.Universal primers for amplification of three non-coding regions of chloroplast DNA[J].Plant molecular biology,1991,17:1105-1109.
PCR Amplication and Analysis ofGlehnialittoralisUsingTrnV-MGene Fragments
MU Chun-ge
(Asset Department of Ludong University,Yantai, Shandong 264025)
[Objective] The aim was study PCR amplication and analysis ofGlehnialittoralisusingTrnV-Mgene fragments, to provide a technical basis for germplasm resources protection and genetic diversity study ofGlehnialittoralis. [Methods] The PCR amplification conditions forTrnV-Mgene fragments ofGlehnialittoraliswere explored and optimized, and the PCR products were sequenced. [Result] The optimized PCR system was acquired as follows: dNTPs 0.50 μL, Buffer 2.5 μL,TrnM1.25 μL,TrnV1.25 μL, DNA 1.00 μL, rTaqE 0.15 μL, ddH2O 18.35 μL,the total volume was 25 μL. The optimized thermal cycling profile was as follows: initial template denaturation at 94 ℃ for 3 min, 94 ℃ for 50 s, 58 ℃ for 45 s, and 72 ℃ for 1 min 25 s, followed by 38 cycles, with a final extension of 72 ℃ for 8 min. [Conclusion] The total alignment ofTrnV-Msequences was 757 bp in length after sorting by hand.
Glehnialittoralis;TrnV-Mgene fragments; PCR amplification; Optimized PCR system
山东省自然科学基金面上项目(ZR2010CM056)。
慕春歌(1971- ),男,山东栖霞人,实验师,从事植物学方面的研究。
2016-10-28
S 188+.1;Q 789
A
0517-6611(2016)33-0135-02
