输血相关急性肺损伤对大鼠血浆和肺组织血管生成素-2表达的影响
2016-12-21龚艳杰魏明涂玲刘佳梁颖红张宜花杨璐
龚艳杰 魏明 涂玲 刘佳 梁颖红 张宜花 杨璐
基础研究
输血相关急性肺损伤对大鼠血浆和肺组织血管生成素-2表达的影响
龚艳杰 魏明 涂玲 刘佳 梁颖红 张宜花 杨璐
目的 探讨输血相关急性肺损伤(TRALI)时血浆和肺组织中血管生成素-2(Ang-2)的表达及其意义。方法 选择60只SD大鼠,按随机数字表法分为生理盐水(NS)对照组、脂多糖(LPS)对照组、TRALI模型组、急性肺损伤(ALI)对照组,每组15只。采用“LPS-血浆二次打击”法复制TRALI大鼠模型。NS对照组腹腔注射NS 2 mL,移除大鼠血液1 mL后输注等体积NS。LPS对照组大鼠腹腔注射2 mg/kg LPS(1 min内注完) 1 mL 2 h后静脉输注等体积NS。TRALI模型组腹腔注射2 mg/kg LPS 1 mL,2 h后静脉输注血浆1 mL。ALI对照组静脉输注5 mg/kg LPS 1 mL诱导ALI。制模完成后处死大鼠取肺组织观察病理学改变并进行肺损伤评分;取支气管肺泡灌洗液(BALF)检测细胞总数、中性粒细胞比例(NEUT);用蛋白质免疫印迹试验(Western Bolt)检测血浆中Ang-2蛋白表达;免疫组化法观察肺组织中Ang-2阳性表达;实时荧光定量反转录-聚合酶链反应(RT-PCR)检测大鼠肺组织中Ang-2 mRNA表达水平。结果 光镜下可见,NS对照组大鼠肺组织结构清楚,肺泡壁结构完整,肺泡内未见炎性细胞渗出及肺泡萎陷,肺泡间隔均一无增宽;LPS对照组肺泡间隔轻度增宽、有少量炎性细胞浸润;TRALI模型组肺泡间隔增宽、中等量出血并有较多炎性细胞浸润;ALI对照组肺内大量炎性细胞浸润,间质水肿加重,伴出血、微血栓及灶性肺不张。ALI对照组、TRALI模型组血浆Ang-2蛋白和肺组织Ang-2 mRNA表达均显著高于NS对照组、LPS对照组〔Ang-2蛋白(灰度值):0.58±0.09、0.43±0.07比 0.12±0.03、0.20±0.05,Ang-2 mRNA(2-ΔΔCt):0.39±0.10、0.29±0.09比 0.10±0.05、0.16±0.04,P均< 0.01〕;ALI对照组、TRALI模型组BALF细胞总数(×106/L:361±78、310±76比101±63、165±65)、NEUT(0.396±0.125、0.335±0.115比0.098±0.035、0.114±0.041)均明显高于NS对照组和LPS对照组(P均< 0.05);ALI对照组、TRALI模型组病理学评分、肺湿重/体重比值和动脉血氧分压(PaO2)均显著高于NS对照组和LPS对照组(P均< 0.05)。ALI对照组与TRALI模型组各项指标比较差异无统计学意义(P均> 0.05)。结论 TRALI大鼠肺组织和血浆中Ang-2的表达升高,提示Ang-2可能参与了TRALI病理生理过程。
肺损伤,急性,输血相关;血管生成素-2;脂多糖;血浆
随着血液采集、血制品制备过程中消毒灭菌技术的提高和操作规程的不断完善,多数输血相关并发症已得到了较满意的控制。但免疫相关性输血并发症问题却日益突出[1],输血相关急性肺损伤(TRALI)就是其中之一,TRALI通常发生于输血期间或输血后6 h内,以急性缺氧和非心源性肺水肿为特点,因其病死率高而越来越受到重视[2-3],但TRALI的发病机制目前尚不明确。
血管生成素(Ang)在炎症和血管动态平衡中扮演着重要的角色,被认为可能具有前炎性介质的作用[4],在急性肺损伤(ALI)过程中发挥着重要作用[5-6],但其在TRALI发病中的作用尚不清楚。研究表明,脂多糖(LPS)诱导的小鼠ALI 程度与剂量和时间呈正相关[7]。
本研究通过“LPS-血浆二次打击法”[8]建立TRALI大鼠模型,观察Ang-2在TRALI肺组织中表达水平的变化,探讨Ang-2在介导TRALI大鼠肺损伤中的作用。
1 材料与方法
1.1 实验动物及材料
1.1.1 实验动物 6~7周龄雄性SD大鼠180只,体重(235±25)g,无特定病原体条件下饲养,标准颗粒饲料、饮水、垫料及一切物品均经无菌处理。
1.1.2 主要材料 实时荧光定量反转录-聚合酶链反应(RT-PCR)检测仪、SybrGreen PCR混合液(美国ABI公司);低温高速离心机(美国Beckman公司);-80 ℃冰箱(日本SANYO公司);电热恒温水浴箱(上海净化设备有限公司);LPS(美国Sigma公司);氯胺酮(福建古田药业有限公司);蛋白质免疫印迹试验(Western Bolt)检测试剂(上海生物工程技术服务有限公司);第1链cDNA合成试剂盒、TRIzol试剂、氯仿、异丙醇(美国BBI公司);无水乙醇(上海生物工程技术服务有限公司)。
1.2 动物模型制备及处理 将60只SD大鼠按随机数字表法分为生理盐水(NS)对照组、LPS对照组、TRALI模型组、ALI对照组,每组15只。参照文献[8]方法采用“LPS-血浆二次打击”法复制TRALI模型。① NS对照组经腹腔注射NS 2 mL,并移除大鼠血液1 mL后输注等体积NS。② LPS对照组经大鼠腹腔注射LPS 2 mg/kg(1 min内注完)1 mL 2 h后输注等体积NS。③ TRALI模型组腹腔注射LPS 2 mg/kg(1 min内注完)1 mL,回笼后2 h,腹腔注射氯胺酮80 mg/kg麻醉大鼠分离股血管并插管,内充50%肝素-NS混合液,5~10 min内移除约大鼠10%血容量的血液(1 mL),再输注1 mL血浆,输注速度为≤4 mL/h。④ ALI对照组:移除约为大鼠10%血容量的血液(1 mL)后输注1 mL 5 mg/kg LPS。各组大鼠取血浆-80 ℃冰箱保存备用。
1.3 伦理学 本实验中动物处置方法符合动物伦理学标准。
1.4 观察指标及方法
1.4.1 血浆制备 参照文献[9-10]方法,无菌条件下采集120只SD大鼠全血1.5 U(1 U含全血150 mL及枸橼酸钠、枸橼酸、葡萄糖、腺嘌呤与磷酸二氢钠混合制成的灭菌水溶液45 mL),(4±2)℃储存28 d后,3 000 r/min(离心半径10 cm)分离血浆100 mL,无菌条件下分装100份,每份1 mL,-80 ℃保存备用,输注前将血浆56 ℃水浴30 min。
1.4.2 肺组织相关指标检测及病理学观察 腹腔注射0.35 mg/kg水合氯醛麻醉大鼠后开胸,暴露心肺,右心室采血处死动物,左心室取血,检测动脉血氧分压(PaO2);取左肺称重,计算肺湿重/体重比值;取支气管肺泡灌洗液(BALF),检测细胞总数及中性粒细胞比例(NEUT);取右肺石蜡包埋,苏木素-伊红(HE)染色,光镜下观察肺组织病理损伤程度,并按Mikawa等[11]方法进行肺损伤评分:按肺泡充血、出血、肺泡腔或血管壁中性粒细胞浸润或聚集、肺泡壁增厚和(或)透明膜形成4项指标,分别依病变程度评分:0分为无病变或非常轻微;1分为轻度病变;2分为中度病变; 3分为重度病变;4分为极重度病变。各项评分相加为ALI总评分。
1.4.3 Western Blot检测血浆Ang-2蛋白表达从血浆中提取总蛋白,取50 μg蛋白质行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移到硝酸纤维素膜上。将膜放入含50 g/L脱脂奶粉的磷酸盐吐温缓冲液(PBS-T)中封闭,4 ℃过夜后用PBS-T洗膜3次,每次10 min;然后加入一抗(1∶500 Ang-2)、β-肌动蛋白(β-actin,1∶1 000)37 ℃孵育2 h;除去一抗,用PBS-T洗膜3次,每次10 min;然后加入与一抗相应的二抗(1∶2 000)37 ℃孵育2 h;用PBS-T洗膜3次,每次10 min;最后用电化学发光法(ECL)进行检测,压片、显影、定影,胶片进行图像分析。以目的蛋白与β-actin的灰度值比值作为目的蛋白的表达量。
1.4.4 免疫组化链霉素-亲和素-生物素-过氧化物酶(SABC)法检测肺组织Ang-2阳性表达 浓缩型Ang-2兔抗鼠多克隆抗体、SABC试剂盒及3,3'-二氨基联苯胺(DAB)显色试剂盒均购自中杉金桥生物技术有限公司,操作严格按说明书进行。
1.4.5 实时荧光定量RT-PCR检测肺组织Ang-2 mRNA表达 采用TRIzol方法提取细胞总RNA。cDNA合成RT-PCR前使用DNA Eraser去除基因组DNA,纯化的RNA反转录合成cDNA,反转录体系20 μL。各样品目的基因和管家基因全部进行实时荧光定量PCR,采用SYBRGreen法。引物设计参照 Genebank的基因序列和Primerbank的推荐,Ang-2扩增产物大小236 bp,上游引物:5'-TTCGGA CTCTGTCACAAGCAA-3',下游引物:5'-ACAAGAC GGAACAACGAACTG-3';β-actin扩增产物大小229 bp,上游引物:5'-CGTAAAGACCTCTATGCCAACA-3';下游引物:5'-CGGACTCATCGTACTCCTGCT-3'。引物由上海英骏生物技术有限公司合成。每个样品按相同条件重复3次,与管家基因β-actin均一化以消除误差后取平均值,用2-ΔΔCt法计算基因表达水平。
1.5 统计学方法 采用SPSS 17.0统计软件分析数据,正态分布的计量资料以均数±标准差(±s)表示,多个样本均数采用单因素方差分析(one-way ANOVA),方差齐时采用Bonferroni法进行多重比较,方差不齐时采用Welch分析;P < 0.05为差异有统计学意义。
2 结果
2.1 各组肺组织病理学观察 光镜下可见,NS对照组大鼠肺组织结构清楚,肺泡壁结构完整,肺泡内未见炎性细胞渗出及肺泡萎陷,肺泡间隔均一无增宽;LPS对照组肺泡间隔轻度增宽,有少量炎性细胞浸润;TRALI模型组肺泡间隔增宽、中等量出血并有较多炎性细胞浸润;ALI对照组肺内大量炎性细胞浸润,间质水肿加重,伴出血、微血栓及灶性肺不张。见图1。表1显示,ALI对照组和TRALI模型组肺组织病理学评分明显高于NS对照组及LPS对照组(P均< 0.05);而ALI对照组与TRALI模型组比较差异无统计学意义(P均> 0.05)。

图1 各组肺组织病理学改变(HE染色 中倍放大)
2.2 各组肺湿重/体重比值和PaO2比较 ALI对照组和TRALI模型组大鼠肺湿重/体重比值显著高于NS对照组和LPS对照组(P均< 0.05),同时伴有换气功能的障碍,表现为PaO2降低(P均< 0.05);而ALI对照组与TRALI模型组比较差异无统计学意义(P均> 0.05)。见表1。
表1 各组大鼠肺湿重/体重比值、PaO2及肺组织病理学评分比较(±s)

表1 各组大鼠肺湿重/体重比值、PaO2及肺组织病理学评分比较(±s)
注:与NS对照组比较,aP < 0.01;与LPS对照组比较,bP < 0.05;1 mmHg = 0.133 kPa
病理学评分(分)NS对照组 15 0.10±0.07 96.47±5.64 0.00±0.00 LPS对照组 15 0.13±0.07 75.34±2.78 1.07±0.48 TRALI模型组 15 0.18±0.06ab 60.45±3.68ab 1.98±0.87ab ALI对照组 15 0.20±0.05ab 47.29±4.28ab 2.32±0.70ab组别 动物数(只)肺湿重/体重比值PaO2(mmHg)
2.3 各组BALF细胞总数和NEUT比较 ALI对照组和TRALI模型组BALF细胞总数及NEUT均显著高于NS对照组和LPS对照组(均P < 0.05);而ALI对照组与TRALI模型组比较差异无统计学意义(均P > 0.05)。见表2。
表2 各组大鼠BALF细胞总数和NEUT比较(±s)

表2 各组大鼠BALF细胞总数和NEUT比较(±s)
注:与NS对照组比较,aP < 0.01;与LPS对照组比较,bP < 0.05
组别 动物数(只)细胞总数(×106/L) NEUT NS对照组 15 101±63 0.098±0.035 LPS对照组 15 165±65 0.114±0.041 TRALI模型组 15 310±76ab 0.335±0.115ab ALI对照组 15 361±78ab 0.396±0.125ab F值 13.820 5.410 P值 < 0.001 0.001
2.4 各组血浆Ang-2蛋白表达比较 ALI对照组和TRALI模型组大鼠血浆Ang-2蛋白表达均显著高于NS对照组及LPS对照组(P均< 0.01);而NS对照组与LPS对照组血浆Ang-2蛋白表达比较差异无统计学意义(P > 0.05)。见表3和图2。
表3 各组大鼠血浆Ang-2蛋白和肺组织Ang-2 mRNA表达比较(±s)
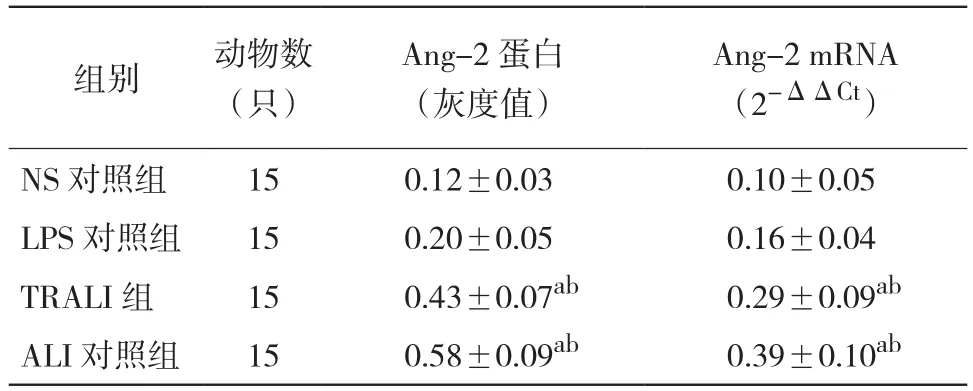
表3 各组大鼠血浆Ang-2蛋白和肺组织Ang-2 mRNA表达比较(±s)
注:与NS对照组比较,aP < 0.01;LPS对照组比较,bP < 0.01
组别 动物数(只)Ang-2蛋白(灰度值)Ang-2 mRNA(2-ΔΔCt)NS对照组 15 0.12±0.03 0.10±0.05 LPS对照组 15 0.20±0.05 0.16±0.04 TRALI组 15 0.43±0.07ab 0.29±0.09ab ALI对照组 15 0.58±0.09ab 0.39±0.10ab
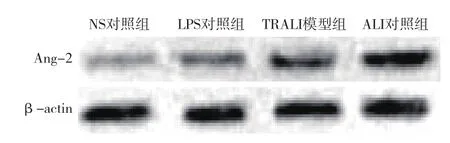
图2 Western Blot检测血浆Ang-2蛋白表达
2.5 各组肺组织Ang-2蛋白表达比较 NS对照组和LPS对照组支气管上皮细胞、内皮细胞、平滑肌细胞均有Ang-2表达,而肺泡腔内无异常表达;TRALI模型组和ALI对照组Ang-2除与NS对照组相同部位的表达之外,TRALI模型组在支气管上皮细胞存在高表达,甚至黏膜下层有表达,肺泡腔内巨噬细胞高表达Ang-2;ALI对照组肺泡腔内巨噬细胞Ang-2表达增高,在血管外膜和浸润巨噬细胞亦存在Ang-2高表达。见图3。
2.6 各组肺组织Ang-2 mRNA表达比较 ALI对照组和TRALI模型组大鼠肺组织Ang-2 mRNA表达均显著高于NS对照组及LPS对照组(P均< 0.01);而NS对照组与LPS对照组比较差异无统计学意义(P > 0.05)。见表3。
3 讨论
关于TRALI的机制有多种学说,“二次打击学说”对TRALI发病机制的解释较为合理:第一次打击是患者输血当时的临床病理状态(如脓毒症、近期外科手术、大量输血),这种状态导致循环中的中性粒细胞(PMN)被激活并隐蔽在肺内[12];呼吸系统细菌感染患者PMN体积参数的变化可为临床诊断呼吸系统疾病起到很好的提示作用[13]。第二次打击是输入含白细胞抗体血液和(或)含生物活性脂质的库存血,与受者白细胞发生反应并激活补体,肺微血管内皮细胞Fcγ受体引起PMN在肺微血管内黏附、聚集和滞留[14-15]。PMN的脱粒产物导致肺微血管内皮损伤和通透性增加,肺微血管渗漏使液体和蛋白质渗入肺泡及间质中,发生渗透性肺水肿,从而影响气体交换,出现低氧血症,引起TRALI的临床表现。有关动物实验也证实TRALI依赖于机体基本情况的严重程度以及所输注的血液制品[16]。危重患者往往有着可能激活PMN的基础条件,“二次打击学说”或许能够解释TRALI在这类人群中的高发病率[17]。

图3 免疫组化法检测肺组织Ang-2阳性表达 NS对照组支气管上皮细胞、内皮细胞可见Ang-2阳性表达(A~B),肺泡腔无Ang-2阳性表达(C);LPS对照组支气管上皮细胞、平滑肌细胞、支气管黏膜下层可见Ang-2蛋白表达(D~E),肺泡腔无Ang-2阳性表达(F);TRALI模型组支气管上皮细胞、肺泡腔、支气管黏膜下层可见Ang-2阳性表达(G~I);ALI对照组支气管上皮细胞、肺泡腔、血管内皮细胞和浸润巨噬细胞均可见Ang-2阳性表达(J~L) 箭头所示为Ang-2蛋白表达(SABC 高倍放大)
PMN于肺内大量积聚可能是导致TRALI的关键,但PMN聚集扣留于肺内的机制尚不清楚[18]。张如愿等[19]对Ang-2在脓毒症和ALI/急性呼吸窘迫综合征(ARDS)中作用的相关研究进行综述,认为Ang-2动态变化的研究将为针对Ang-2进行特异性干预的时机提供基础,此外,由于可溶性Tie-2具有与Ang-1、Ang-2结合的能力,因此需要进一步在临床研究中检测可溶性Tie-2水平,以加深对Ang/Tie-2系统在危重症中作用的理解。钟明媚等[20]采用前瞻性观察性研究方法,通过检测53例ARDS患者血浆Ang-2 浓度,探讨Ang-2在ARDS诊断及预后判断中的意义。结果显示,ARDS 患者血浆Ang-2 水平显著升高,当Ang-2 的最佳临界值为1.79 μg/L时,诊断ARDS的特异度为90.0%,敏感度为92.5%,可以作为肺损伤病情严重程度判断和预后评估的辅助指标。齐志江等[21]前瞻性序贯收集肠道病毒71型(EV71)感染性肺水肿患儿和EV71感染无肺水肿患儿各20例,观察EV71感染患儿肺水肿的临床特点及血清Ang-2的变化,探讨Ang-2与肺水肿发生的关系。结果显示,EV71感染性肺水肿患儿肺水中富含蛋白,且血清及肺水中均高表达Ang-2,Ang-2可能参与肺部血管渗漏、肺水肿的发病过程。还有研究表明,Ang/Tie-2系统在炎症反应、内皮细胞活化及炎性细胞渗出中起重要作用[22]。Fiedler等[23]向小鼠腹腔注入金黄色葡萄球菌,收集腹腔灌洗液显示Ang-2基因缺陷鼠未能有效地招募PMN,炎症反应减轻。Lemieux等[24]发现,Ang-2可诱导人脐静脉内皮细胞P选择素的定位,而Ang-2可以激活PMN的Tie-2,增强其黏附能力,说明Ang-2在介导PMN渗出方面其有重要作用。
本研究肺组织病理学显示,TRALI模型组肺组织中有大量PMN浸润,可见肺泡壁增厚、充血、肺泡萎陷、肺水肿等ALI的病理改变;同时伴有换气功能障碍,表现为氧分压降低;BALF细胞总数和NEUT较NS对照组和LPS对照组增加;免疫组化结果证实,肺泡腔内、支气管黏膜下层及大动脉、静脉外膜存在Ang-2表达的PMN和巨噬细胞,表明Ang-2/Tie-2可能与TRALI发病过程中PMN的浸润和炎症反应有关,由此可以推测,在TRALI病理生理过程中Ang-2可能发挥了一定作用,但其是否参与了TRALI肺毛细血管通透性增加的机制,尚待进一步探讨。
Ang-2能与血管内皮细胞上的Tie-2受体相结合,导致血管失稳、增加血管渗漏、上调内皮对血管内皮生长因子和细胞因子的反应,从而引起肺血管内皮细胞损伤,连续性破坏。本研究Western Blot和RT-PCR结果显示,ALI对照组和TRALI模型组Ang-2表达较NS对照组和LPS对照组明显升高。也有资料显示TRALI模型组大鼠血浆Ang-2表达明显高于正常对照组[25];Gallagher等[26]发现Ang-2是肺损伤时内皮屏障破坏的重要细胞因子,体外应用患者血浆可破坏内皮细胞屏障,且破坏程度与血浆Ang-2水平相关;体外单独应用重组Ang-2也可破坏内皮屏障功能和结构,过度增高的Ang-2水平可增加肺泡通透性。Ang-2基因敲除的大鼠可以避免高氧所致的ALI[6],由此可以推测,肺血管内皮细胞损伤可能参与了TRALI的病理生理过程。
综上所述,通过“LPS-血浆二次打击”的方法建立TRALI模型,大鼠血浆Ang-2蛋白表达和肺组织Ang-2基因表达增高,免疫组化发现肺泡腔和血管及小气道周围炎症区有大量Ang-2在PMN和巨噬细胞表达,同时炎症附着区内皮细胞表达Ang-2增强,说明Ang-2可能参与了TRALI的病理生理过程,但其在TRALI发病过程中的具体作用机制尚有待进一步深入研究。
1 Eder AF, Dy BA, Perez JM, et al. The residual risk of transfusionrelated acute lung injury at the American Red Cross (2008-2011):limitations of a predominantly male-donor plasma mitigation strategy . Transfusion,2013,53:1442-1449.
2 廖刃,刘进.围手术期血液管理:由限制性输血走向个体化输血.中华医学杂志,2014,94:481-482.
3 El Kenz H, Van der Linden P. Transfusion-related acute lung injury. Eur J Anaesthesiol,2014 ,31:345-350.
4 刘明华,田君,陈翔宇,等.多发伤患者早期促血管生成素-2的变化及临床意义.中华创伤杂志,2010,26:328-331.
5 Orfanos SE, Kotanidou A, Glynos C, et al. Angiopoietin-2 is increased in severe sepsis: correlation with inflammatory mediators. Crit Care Med,2007,35:199-206.
6 Bhandari V, Choo-Wing R, Lee CG, et al. Hyperoxia causes angiopoietin 2-mediated acute lung injury and necrotic cell death . Nat Med,2006,12:1286-1293.
7 陶一帆,田方敏,郭向阳,等.不同剂量脂多糖在不同作用时间下诱导小鼠急性肺损伤的效果评价.中国中西医结合急救杂志,2015,22:142-146.
8 李丽玮,花紫菱,张惠箴,等.输血相关急性肺损伤大鼠模型建立及肺组织病理研究.中国输血杂志,2012,25:1121-1124.
9 Kelher MR, Masuno T, Moore EE, et al. Plasma from stored packed red blood cells and MHC class I antibodies causes acute lung injury in a 2-event in vivo rat model. Blood,2009,113:2079-2087.
10 Silliman CC. The two-event model of transfusion-related acute lung injury. Crit Care Med,2006,34:S124-131.
11 Mikawa K, Nishina K, Takao Y, et al. ONO-1714, a nitric oxide synthase inhibitor, attenuates endotoxin-induced acute lung injury in rabbits. Anesth Analg,2003,97:1751-1755.
12 Looney MR, Roubinian N, Gajic O, et al. Prospective study on the clinical course and outcomes in transfusion-related acute lung injury. Crit Care Med,2014,42:1676-1687.
13 俞蕾,翁文浩,施惠兰,等.中性粒细胞VCS参数在呼吸系统细菌感染性疾病中的变化及临床应用.实用检验医师杂志,2012,4:39-42.
14 Takahashi D, Fujihara M, Azuma H, et al. Stimulation of human neutrophils with sera containing HLA Class I alloantibody causes preferential degranulation of azurophilic granules and secretory vesicles. Vox Sang,2010,98:560-566.
15 West FB, Silliman CC. Transfusion-related acute lung injury:advances in understanding the role of proinflammatory mediators in its genesis. Expert Rev Hematol,2013,6:265-276.
16 Sayah DM, Looney MR, Toy P. Transfusion reactions: newer concepts on the pathophysiology, incidence, treatment, and prevention of transfusion-related acute lung injury. Crit Care Clin,2012,28:363-372.
17 Silliman CC, Bercovitz RS, Khan SY, et al. Antibodies to the HLA-A2 antigen prime neutrophils and serve as the second event in an in vitro model of transfusion-related acute lung injury. Vox Sang,2014,107:76-82.
18 李玮,谢如锋,范华骅.中性粒细胞在输血相关的急性肺损伤中的作用.中国输血杂志,2012,25:1335-1338.
19 张如愿,汤耀卿.血管生成素2在脓毒症和急性肺损伤/急性呼吸窘迫综合征中的作用.中华危重病急救医学,2009,21:638-640.
20 钟明媚,张琳,王璠,等.急性呼吸窘迫综合征患者血浆血管生成素2水平及其对预后的诊断价值.中华危重病急救医学,2014,26:804-809.
21 齐志江,李志,郝东,等.血管生成素2在EV71感染性肺水肿中的作用研究.中华危重病急救医学,2014,26:89-93.
22 齐志江,王晓芝,韩兆东,等.大鼠急性肺损伤时Ang-2/Tie-2的表达及意义.中国病理生理杂志,2010,26:314-317.
23 Fiedler U, Reiss Y, Scharpfenecker M, et al. Angiopoietin-2 sensitizes endothelial cells to TNF-alpha and has a crucial role in the induction of inflammation. Nat Med,2006,12:235-239.
24 Lemieux C, Maliba R, Favier J, et al. Angiopoietins can directly activate endothelial cells and neutrophils to promote proinflammatory responses. Blood,2005,105:1523-1530.
25 李丽玮,李志强.输血相关急性肺损伤SD大鼠血管生成素2和白介素10的变化.中国输血杂志,2013,26:439-442.
26 Gallagher DC, Bhatt RS, Parikh SM, et al. Angiopoietin 2 is a potential mediator of high-dose interleukin 2-induced vascular leak. Clin Cancer Res,2007,13:2115-2120.
(本文编辑:邸美仙)
Expression of angiopoietin-2 in plasma and lung tissue of rats with transfusion-related acute lung injury
GONG Yan-jie, WEI Ming, TU Ling, LIU Jia, LIANG Ying-hong, ZHANG Yi-hua, YANG Lu. Department of Transfusion, the Fifth Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
Objective To study the expression of angiopoietin-2 (Ang-2) in plasma and lung tissue of rats with transfusion-related acute lung injury (TRALI) and its significance. Methods Sixty Sprague-Dawley (SD) rats were randomly divided into normal saline (NS) control group, lipopolysaccharide (LPS) control group, TRALI model group, and acute lung injury (ALI) control group, with 15 rats in each group. The rat model of TRALI was reproduced by "LPS-plasma two-hit" method. The rats in NS control group were intraperitoneally injected 2 mL NS, the same volume of NS was intravenously injected after 1 mL blood collection. The rats in LPS control group were intraperitoneally injected 2 mg/kg LPS 1 mL within 1 minute, and the same volume of NS was intravenously injected 2 hours later. The rats in TRALI modelgroup were challenged by intraperitoneal injection of 2 mg/kg LPS 1 mL at 2 hours before the transfusion of 1 mL plasma. The rats in ALI control group were challenged by intraperitoneal injection of LPS 5 mg/kg to reproduce the model of ALI. The lung tissues were harvested to observe the pathological changes, and lung injury score was evaluated. The total cells and neutrophils (NEUT) in bronchoalveolar lavage fluid (BALF) were determined. Western Blot was used to detect Ang-2 protein expression in plasma, and immunohistochemical method was used to detect Ang-2 positive expression in lung tissue. The real-time fluorescent reverse transcription-quantitative polymerase chain (RT-PCR) was used to detect Ang-2 mRNA expression in the lung tissue. Results Under the light microscope, rat lung tissue structure in the NS control group was clear, the alveolar wall was intact, no alveolar exudate, alveolar collapse or inflammatory cells in alveolar septum was found, and alveolar septum did not increase. The alveolar septum was widened slightly in LPS control group, a small amount of inflammatory cell infiltration was found. The alveolar septum, moderate bleeding and more infiltration of inflammatory cells were found in TRALI model group. Lung inflammatory infiltration, interstitial edema, hemorrhage, micro-thrombosis and focal atelectasis were found in the ALI control group. Compared with NS control group and LPS control group, Ang-2 protein expression in plasma and Ang-2 mRNA expression in the lung tissue were significantly increased in ALI control group and TRALI model group [Ang-2 protein (gray ralue): 0.58±0.09, 0.43±0.07 vs. 0.12±0.03, 0.20±0.05, Ang-2 mRNA (2-ΔΔCt): 0.39±0.10, 0.29±0.09 vs. 0.10±0.05, 0.16±0.04, P all < 0.01]. The total cells [total cells (×106/L: 361±78, 310±76 vs. 101±63, 165±65) and NEUT (0.396±0.125, 0.335±0.115 vs. 0.098±0.035, 0.114±0.041)] in BALF of ALI control group and TRALI model group were significantly higher than those of NS control group and LPS control group (P all < 0.05). The pathological score, wet lung weight/body weight ratio and arterial partial pressure of oxygen (PaO2) in ALI control group and TRALI model group were significantly higher than those of NS control group and LPS control group (P all < 0.05). There were no significant differences in above parameters between ALI control group and TRALI model group (P all > 0.05). Conclusions Expression of Ang-2 in the lung tissue and plasma were increased in rats with TRALI. Ang-2 may be involved in the TRALI pathophysiological process.
Transfusion-related acute lung injury; Angiopoietin-2; Lipopolysaccharide; Plasma
450052 郑州市,郑州大学第五附属医院输血科
魏明,Email:gushiweiming@126.com
10.3969/j.issn.1674-7151.2016.03.015
2016-04-20)
