CD4+/CD8+比值在乳腺癌新辅助化疗前后变化的临床意义
2016-12-21易春生
易春生
临床研究
CD4+/CD8+比值在乳腺癌新辅助化疗前后变化的临床意义
易春生
目的 观察乳腺癌患者新辅助化疗(NAC)前后CD4+/CD8+比值的变化,探讨其对NAC临床疗效的评估价值。方法 选择湖南省怀化市第二人民医院2014年1月至2016年8月需进行NAC的乳腺癌患者210例作为研究对象,采用流式细胞仪检测NAC前后静脉血CD4+/CD8+比值的变化,以评价其临床疗效,将病理学检查的评价方法作为“金标准”,与临床检查、乳腺钼靶、乳腺超声评价标准进行比较。结果 临床评估提示,研究组210例患者中有168例NAC有效(完全缓解35例,部分缓解133例),化疗后CD3+、CD4+均较化疗前均显著升高(CD3+:0.69±0.06比0.64±0.06,CD4+:0.35±0.06比0.30±0.04),CD8+较化疗前显著降低(0.27±0.04比0.34±0.05),CD4+/CD8+比值亦显著升高(1.91±0.87比1.02±0.26),差异有统计学意义(P均< 0.01),且均恢复至健康对照组水平;42例临床显示化疗无效患者(肿瘤稳定33例,肿瘤进展9例)化疗后CD3+、CD4+及CD4+/CD8+比值均较化疗前进一步下降(CD3+:0.61±0.07比0.64±0.06,CD4+:0.25±0.05比0.29±0.04,CD4+/CD8+:0.64±0.35比0.97±0.71),CD8+较化疗前进一步升高(0.37±0.04比0.33±0.05),差异有统计学意义(P均< 0.05)。CD4+/CD8+比值评估NAC疗效的准确率、敏感度、特异度与假阳性率分别为81.0%、86.3%、59.5%和19.0%,与乳腺超声法接近(80.5%、85.7%、59.5%、19.5%),但高于临床检查(60.5%、67.3%、33.3%、39.5%)与乳腺钼靶法(73.8%、81.5%、42.9%、26.2%)。结论 乳腺癌患者NAC后CD4+/CD8+比值明显升高,可作为评估乳腺癌患者NAC临床疗效的一种有效方法。
CD4+/CD8+比值;乳腺癌;新辅助化疗
近年来,乳腺癌发病率可达女性恶性肿瘤发病率的30%,且呈逐年上升的趋势,致死率高达恶性肿瘤总致死率的15%,对女性身心健康造成了严重威胁[1]。随着乳腺癌研究的深入,越来越多的预后标志物被人们发现,部分已经应用于临床作为乳腺癌分子分型的依据,但尚处于初步阶段,需要大量临床研究证实[2]。研究表明,远处转移是晚期乳腺癌致死的主要原因[3]。因此,控制远处转移是延长乳腺癌患者远期生存极为重要的手段。
传统采用环磷酰胺(CTX)、阿霉素(ADM)、5-氟脲嘧啶(5-FU)和顺铂(PDD)联合(CAF-P方案)治疗乳腺癌效果不佳[4];而新辅助化疗(NAC)具有降低局部晚期乳腺癌(LABC)肿瘤分期、改善手术预后、降低细胞耐药性的作用,可消除全身微转移灶、缩小肿瘤、提高保乳率,且可以提高经化疗获得病理性完全缓解患者的存活率,目前已广泛应用于临床[5]。本研究采用流式细胞仪检测LABC患者NAC前后外周血CD4+/CD8+比值的变化,旨在探讨CD4+/CD8+比值评价NAC临床疗效的意义,报告如下。
1 资料与方法
1.1 一般资料 随机选取本院2014年1月至2016年8月需进行NAC的210例乳腺癌患者,按美国癌症联合会(AJCC)的肿瘤分期标准确诊为Ⅱb期(仅为T3N0M0)和Ⅲ期(不包含N3);年龄39~68岁,平均(50.24±5.33)岁。患者入院前均未采用免疫抑制剂进行治疗、无病毒性疾病;入院后进行常规生化检查、其他辅助检查,均无化疗禁忌证。
NAC采用标准含蒽环类方案(CEF):第1天静脉注射表阿霉素(EPI)80 mg/m2,静脉滴注(静滴)CTX 500 mg/m2和5-FU 500 mg/m2,第8天则仅给予5-FU 500 mg/m2静滴;以3周作为1个疗程,共3个疗程。
随机选取60例门诊体检的健康女性志愿者为健康对照组,年龄39~68岁,平均(49.82±4.93)岁。
研究组在NAC前3 d和NAC疗程结束后通过查体触诊、乳腺钼靶及乳腺超声等方法检测肿瘤最大径与最大垂直径。每个疗程开始前行血常规、心电图及肝肾功能检查,化疗后每周行血常规检查,并评价患者的全身情况。
1.2 检测指标及方法 两组均于07:00至08:00采集2 mL空腹血,用流式细胞仪检测T淋巴细胞亚群CD3+、CD4+、CD8+以及CD4+/CD8+比值。
1.3 主要试剂与仪器 异硫氰酸荧光素(FITC)标记的抗CD3及藻红蛋白(PE)标记的CD4和CD8单克隆抗体、红细胞裂解液、流式细胞仪均为美国Becton Dickinson公司产品,数字乳腺钼靶机(美国罗爱德公司),高频超声诊断仪(美国GE730)。
1.4 评价标准
1.4.1 临床评估 参照世界卫生组织(WHO)标准[6]进行评估,分为完全缓解(CR)、部分缓解(PR)、肿瘤稳定(SD)和肿瘤进展(PD)。CR为肿瘤全部消失;PR为肿瘤最大径和最大垂直径的乘积减少幅度> 50%;SD为肿瘤最大径和最大垂直径的乘积减少幅度< 50%或增加幅度< 25%;PD为肿瘤最大径和最大垂直径的乘积增加幅度> 25%以及其他转移征象出现。CR和PR表明治疗有效,而SD和PD则表明治疗无效。
1.4.2 病理学评估 通过Miller与Payne分级[7]进行病理学评估,分为Ⅰ~Ⅴ 5级。Ⅰ级为癌细胞数量不变;Ⅱ级为癌细胞数量减少幅度≤30%;Ⅲ级为癌细胞数量减少幅度30%~90%;Ⅳ级为癌细胞的数量减少幅度≥90%,仅存少数残余的癌细胞散在分布;Ⅴ级为无浸润性癌残存,可有导管内癌成分残存。Ⅰ级、Ⅱ级表明治疗无效,Ⅲ~Ⅴ级表明治疗有效。
1.4.3 免疫功能评估 采用流式细胞法计数,NAC后CD4+/CD8+比值升高表明治疗有效,比值不变或者下降则表明无效。
1.5 统计学处理 采用SPSS 21.0软件对数据进行统计学分析,正态分布的计量资料以均数±标准差(±s)表示;两组间计量资料比较采用t检验,多组间计量资料比较采用方差分析,计数资料采用χ2检验;P < 0.05为差异有统计学意义。
2 结果
2.1 两组治疗前T淋巴细胞亚群及CD4+/CD8+比值比较 NAC前研究组CD4+与CD4+/CD8+比值均较健康对照组显著降低,CD8+较健康对照组显著升高,差异有统计学意义(P均< 0.01);两组CD3+比较差异无统计学意义(P > 0.05)。见表1。
表1 NAC前两组患者T淋巴细胞亚群及CD4+/CD8+比值比较(±s)
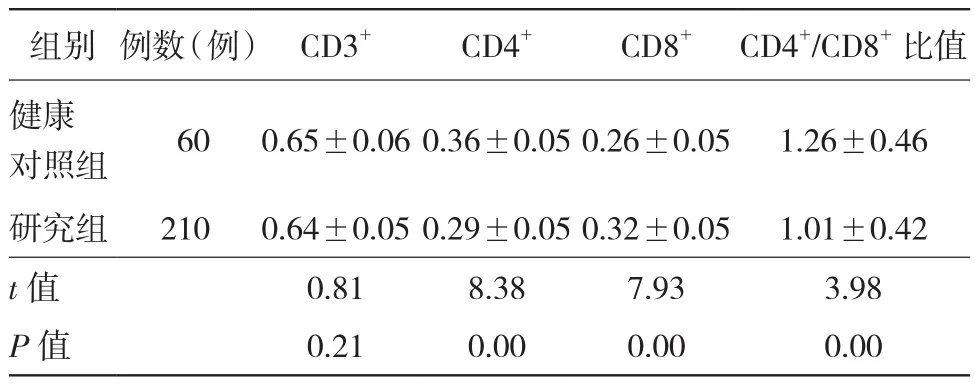
表1 NAC前两组患者T淋巴细胞亚群及CD4+/CD8+比值比较(±s)
组别 例数(例) CD3+ CD4+ CD8+ CD4+/CD8+比值健康对照组 60 0.65±0.06 0.36±0.05 0.26±0.05 1.26±0.46研究组 210 0.64±0.05 0.29±0.05 0.32±0.05 1.01±0.42 t值 0.81 8.38 7.93 3.98 P值 0.21 0.00 0.00 0.00
2.2 NAC疗效评价结果比较 由表2可以看出,以病理学评估为“金标准”,通过评估NAC对LABC疗效的准确率、敏感度、特异度以及假阳性率发现,临床检查<乳腺钼靶<免疫功能<乳腺超声。可见,免疫功能法评估疗效的准确率、敏感度及特异度均较高,而假阳性率则较低,其总体效果要优于临床检查和乳腺钼靶法。此外, 11例病理提示为CR的患者通过乳腺超声和乳腺钼靶均显示SD,然而免疫功能法显示化疗有效,更进一步明确了该方法在评估NAC疗效中的地位。

表2 NAC疗效评价结果比较
2.3 研究组NAC有无疗效两组NAC前后T淋巴细胞亚群变化比较 临床评估提示,研究组210例患者中有168例化疗后有效(CR 35例,PR 133例),其化疗后CD3+、CD4+均较化疗前显著升高,CD8+较NAC前显著降低,CD4+/CD8+比值亦显著升高(P均< 0.05),且均恢复至健康对照组水平;42例临床显示化疗无效患者(SD 33例,PD 9例)化疗后的CD3+、CD4+及CD4+/CD8+比值均较化疗前进一步下降,CD8+较化疗前进一步升高(P均< 0.05)。见表3。
表3 NAC有无疗效两组NAC前后T淋巴细胞亚群及CD4+/CD8+比值比较(±s)

表3 NAC有无疗效两组NAC前后T淋巴细胞亚群及CD4+/CD8+比值比较(±s)
注:与本组化疗前比较,aP < 0.05;与健康对照组比较,bP < 0.05,cP < 0.01
(例) CD3+ CD4+ CD8+ CD4+/CD8+比值健康对照组 60 0.65±0.06 0.36±0.05 0.26±0.05 1.26±0.46 NAC有效组化疗前 168 0.64±0.06 0.30±0.04c0.34±0.05c1.02±0.26b化疗后 168 0.69±0.06a 0.35±0.06a0.27±0.04a1.91±0.87a NAC无效组化疗前 42 0.64±0.06 0.29±0.04c0.33±0.05c0.97±0.71b化疗后 42 0.61±0.07ab0.25±0.05ac0.37±0.04ac0.64±0.35a F 值 106.27 230.67 300.30 12.20 P值 0.00 0.00 0.00 0.00组别 例数
3 讨论
肿瘤患者的免疫功能和肿瘤的发生发展联系密切,而T淋巴细胞的作用尤为重要[7]。血液中的T淋巴细胞在免疫调节中发挥重要作用,最主要的是T淋巴细胞中的CD4+辅助性T细胞和CD8+细胞毒性T细胞。CD4+T细胞有免疫记忆、直接杀死肿瘤细胞的功能[8],而CD8+为抑制性T细胞,具有抑制体液、细胞免疫功能的作用。临床研究表明,CD4+/CD8+比值降低或倒置提示机体细胞免疫功能紊乱,因此,用CD4+/CD8+比值可以评价机体的细胞免疫功能[9]。CD4+/CD8+比值在正常人体内处在动态平衡,约在1.5~2.0之间,抗肿瘤作用得以正常发挥[10];而在患有恶性肿瘤的人群往往失调,且T淋巴细胞的数量和功能均显示出不同程度的异常,进而影响细胞的免疫功能,导致免疫功能低下,促进了肿瘤的发生发展[11]。本研究通过比较研究组210例LABC患者与健康对照组60例健康女性T淋巴细胞亚群的比例发现,研究组CD3+与CD4+T细胞数量均显著低于健康对照组,而CD8+细胞却升高,提示乳腺癌患者的细胞免疫功能已经发生紊乱,其机制可能与细胞因子的异常分泌有关。
近年来,针对乳腺癌的治疗取得了很大的进展,中西医结合优势互补,提高了乳腺癌诊治的准确性和针对性,临床研究证实,西医手术、化疗,结合中医以顾护脾胃为先,疏肝解郁,调理冲任,同时重视饮食和心理的调护,取得了明显的疗效[12],但相关机制尚未明确。展富琴等[13]研究显示,对肿瘤患者进行有效的治疗可使其免疫功能获得不同程度恢复,可能是患者病情改善的机制之一。
本研究的210例LABC患者化疗前CD4+T细胞数量低于健康对照组,即细胞的免疫功能低于健康对照组。经过3个疗程的化疗后,其中168例化疗有效,42例无效,与国内的报道基本一致[14]。化疗有效患者化疗后CD3+、CD4+T细胞数量均明显高于化疗前,而CD8+细胞数量低于化疗前,且CD4+/CD8+比值高于化疗前,提示化疗有效患者免疫功能较化疗前有所提高,其机制可能为肿瘤细胞所释放免疫抑制因子减少,说明有效化疗可使肿瘤的负荷减少。相反,化疗后无效患者CD3+、CD4+T细胞数量较化疗前显著下降,CD8+细胞数量高于化疗前。表明乳腺癌患者的免疫功能下降,可能是对NAC药物具有耐药性或有较高的恶性程度,伴随肿瘤细胞数目的增加从而产生了大量的免疫抑制性因子,导致CD4+T细胞数量降低,最终造成患者细胞免疫功能大幅下降。
目前,临床上应用于评估NAC疗效的主要有临床检查、病理学检测和影像学检测[15]。临床检查根据医生个人的临床经验对治疗前后的肿块进行综合评价,易出现人为主观臆断的情况,导致误诊。乳腺钼靶是临床上最常用的乳腺检查方式,通过对肿块周围的清晰度、肿块影大小、微钙化灶及肿块边缘毛刺等影像学变化的观察来评价化疗的疗效。有研究显示:数字乳腺对NAC疗效评价有一定临床价值,其评价的客观性优于临床检查。但乳腺钼靶对腺体丰富且致密的乳腺的评价效果欠佳[16]。
乳腺超声是通过观察化疗前后肿块的体积变化以及肿瘤的大小、形态、浸润状况、回声特征以及钙化灶评估NAC疗效,有文献表明其效果明显优于临床检查,可反复使用,但有对乳腺癌病灶测量结果不准确、检测肿瘤细胞残留等局限性[17-18]。随着NAC方法的不断发展,临床上需要一种更简便、准确、及时的疗效评估方法。
本研究显示,通过流式细胞仪监测乳腺癌患者NAC前后外周血T细胞亚群数量及CD4+/CD8+比值变化,不但可以了解乳腺癌患者免疫功能情况,而且能够弥补人为因素对评估NAC疗效的影响等不足,值得临床推广。
1 宋云骏,姜林鹤,刘运江,等. CD133在乳腺癌新辅助化疗后的表达及其临床意义.临床和实验医学杂志,2014,13:297-300.
2 张磊超,王雪梅,王丽萍.乳腺癌预后分子生物学标志物的研究进展.实用检验医师杂志,2013,5:248-249,225.
3 陈伟财,何劲松,王敏,等.老年乳腺癌患者新辅助内分泌治疗的临床应用.中国癌症杂志,2011,21:359-362.
4 金利民,刘文明. CAF-P方案治疗常规方案失败的晚期乳腺癌.中国中西医结合急救杂志,2002,9:152-152.
5 Matsubara N, Mukai H, Fujii S, et al. Different prognostic significance of Ki-67 change between pre- and post-neoadjuvant chemotherapy in various subtypes of breast cancer. Breast Cancer Res Treat, 2013,137:203-212.
6 王红梅,魏尚典,陈新文. Ki-67在乳腺癌中的表达及临床意义.中国普通外科杂志,2012,21:616-618.
7 张同先,王亚红,张巍,等. Ki67作为ER+和(或)PR+乳腺癌进一步分型指标的研究.实用医学杂志,2013,29:374-377.
8 刘现栋,蒋宏传.乳腺癌分子分型的临床病理表现.医学综述,2014,20:2631-2633.
9 陈世德,李超乾,秦雪,等.多器官功能障碍综合征患者外周血CD3+、CD4+、CD8+T淋巴细胞的变化.中华危重病急救医学,2009,21:183-184.
10 倪韵碧,曾婉珊,谢文杰.乳腺癌分子分型的研究进展.中华病理学杂志,2014,43:433-436.
11 白海亚,马秀芬.新辅助化疗对局部进展期乳腺癌患者T淋巴细胞亚群及NK细胞免疫功能的影响.中国免疫学杂志,2012,28:843-845.
12 马金丽,吴涛,陆明.陆明教授治疗乳腺癌经验总结.中国中西医结合急救杂志,2015,22:537-538.
13 展富琴,冯萍.恶性肿瘤患者化疗前后免疫功能的变化.中国血液流变学杂志,2007,17:137-138.
14 杨欢,陈晓耕,陈新,等.乳腺浸润性导管癌组织Ki-67表达及其分子分型的意义.中华肿瘤防治杂志,2012,19:212-216.
15 曹林林,刘颖男,郑德明,等.乳腺癌患者手术前后T淋巴细胞亚群变化的实验研究.中国实验诊断学,2013,17:113-114.
16 胡聂,梁庆模.乳腺癌新辅助化疗疗效评价方法研究进展.中国医药导报,2010,7:7-9.
17 白海亚,龚晓军,刘慧民,等. CD4+/CD8+在评价局部进展期乳腺癌新辅助化疗疗效中的应用价值.中国优生优育,2014,20:129-132.
18 任林广,徐广伟,齐红,等.乳腺癌患者外周血T细胞亚群与NK、NKT细胞检测的临床意义.中国妇幼保健,2012,27:4614-4616.
(本文编辑:邸美仙)
Clinical research on the alteration of CD4+/CD8+before and after neoadjuvant chemotherapy in breast cancer
YI Chun-sheng. Department of Clinical Laboratory, Huaihua Second People's Hospital, Huaihua 418000, China
Objective To observe of the changes in CD4+/CD8+before and after neoadjuvant chemotherapy (NAC) in patients with breast cancer, and to explore the evaluative value of clinical effect. Methods 210 patients with breast cancer who need NAC from January 2014 to August 2016 in Huaihua Second People's Hospital in Hunan Province were enrolled as research subject. The alteration of CD4+/CD8+before and after NAC was determined by flow cytometry (FCM) in order to evaluate the clinical effect of NAC. The evaluation methodology of the pathological examination was regarded as the "golden standard", and the evaluative value of the alteration of CD4+/CD8+was compared with evaluation standard of clinical examination, breast molybdenum target as well as the breast sonography. Results Clinical evaluation revealed that there were 168 patients with effective NAC (35 patients with complete remission, 133 patients with partial remission in) in 210 patients in the study group, and CD3+and CD4+were significantly higher than those before chemotherapy (CD3+: 0.69±0.06 vs. 0.64±0.06, CD4+: 0.35±0.06 vs. 0.30±0.04), CD8+was significantly lower than that before chemotherapy (0.27±0.04 vs. 0.34±0.05), and the ratio of CD4+/CD8+increased significantly (1.91±0.87 vs. 1.02±0.26, P all < 0.01), and they recovered to the levels in healthy control group; CD3+, CD4+and CD4+/CD8+after chemotherapy in 42 chemotherapy invalid patients (33 patients with stable tumor and 9 patients with tumor progression) were further decreased as compared with those beforechemotherapy (CD3+: 0.61±0.07 vs. 0.64±0.06, CD4+: 0.25±0.05 vs. 0.29±0.04, CD4+/CD8+: 0.64±0.35 vs. 0.97±0.71), and CD8+was further increased (0.37±0.05 vs. 0.33±0.05, P all < 0.01). The accuracy, sensitivity, specificity, and false positive rate of CD4+/CD8+ratio method for evaluation of NAC effect were 81.0%, 86.3%, 59.5%, and 19.0% respectively, which were close to the ultrasound method (80.5%, 85.7%, 59.5%, 19.5%), but they were higher than the clinical examination (60.5%, 67.3%, 33.3%, 39.5%) and the breast molybdenum target method (73.8%, 81.5%, 42.9%, 26.2%). Conclusion CD4+/CD8+ratio after NAC was significantly increased in patients with breast cancer, which can be regarded as the a kind of effective may to evaluate the clinical effect of NAC.
CD4+/CD8+ratio; Breast cancer; Neoadjuvant chemotherapy
418000 怀化市,湖南省怀化市第二人民医院检验科
易春生,Email:1182013305@qq.com
10.3969/j.issn.1674-7151.2016.03.009
2016-08-27)
