参芪抑瘤方药物血清对胃癌MKN-45细胞周期阻滞及抗侵袭转移的影响
2016-12-21马春林吴红彦李海龙陈杰张宣
马春林,吴红彦,2,3,李海龙,2,陈杰,张宣
1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省中医方药挖掘和创新转化重点实验室,甘肃 兰州 730000;3.甘肃省中药新产品创制工程实验室,甘肃 兰州 730000
参芪抑瘤方药物血清对胃癌MKN-45细胞周期阻滞及抗侵袭转移的影响
马春林1,吴红彦1,2,3,李海龙1,2,陈杰1,张宣1
1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省中医方药挖掘和创新转化重点实验室,甘肃 兰州 730000;3.甘肃省中药新产品创制工程实验室,甘肃 兰州 730000
目的 探讨不同浓度参芪抑瘤方药物血清对胃癌MKN-45细胞周期阻滞及抗侵袭转移作用的相关机制。方法 60只SPF级Wistar大鼠,随机分为对照组和参芪抑瘤方低、中、高剂量组,每组15只。参芪抑瘤方低、中、高剂量组分别给予0.25、0.50、1.00 g原药材/mL药液灌胃,空白组给予等量饮用水灌胃,每日2次,连续7 d,末次灌胃2 h后取血,分离血清。MKN-45细胞经不同浓度药物血清处理后,流式细胞术检测细胞周期,免疫组化检测COX-2、PTEN蛋白表达。结果 药物血清干预后细胞G0~G1期比例增加,S期比例减少;药物血清可降低MKN-45细胞COX-2蛋白阳性表达率,升高PTEN蛋白阳性表达率(P<0.05)。结论 参芪抑瘤方药物血清阻滞细胞周期及抗侵袭转移作用可能与影响COX-2、PTEN蛋白表达有关。
参芪抑瘤方;胃癌;MKN-45细胞;细胞周期;COX-2蛋白;PTEN蛋白;大鼠
中医药防治恶性肿瘤方面,近年来显示出了一定优势,并越来越受到关注。当归贝母苦参丸出自《金匮要略》,原用于治疗妊娠小便困难。现代研究显示,其对肝癌、胃癌细胞等有明显的抑制作用[1-3]。参芪抑瘤方为临床经验方,用于多种肿瘤疾病的治疗,由当归贝母苦参丸加黄芪、全蝎、山慈菇等组成,契合了肿瘤正气不足,痰(湿)浊、癌毒、瘀血内阻的发病机制[4]。方中药材所含有效成分黄芪多糖、当归多糖、贝母碱、苦参碱等对多种癌细胞有明显的抑制作用[5-8]。本实验在前期研究基础上,进一步探索其抗肿瘤的相关作用机制,为抗肿瘤中药研发提供一定的实验依据。
1 实验材料
1.1 动物
60只SPF级Wistar大鼠,雌雄各半,6~8周龄,体质量(200±20)g,甘肃中医药大学科研中心动物实验室,合格证号SYXK(甘)2001-0001。室温20~25 ℃、湿度45%~55%分笼饲养,喂标准饲料(甘肃中医药大学科研中心动物实验室提供),自由饮水。
1.2 药物和细胞
参芪抑瘤方由苦参、黄芪、山慈菇、全蝎、当归、浙贝母等组成,所有饮片购自甘肃中医药大学附属医院中药房,经甘肃中医药大学中药鉴定教研室杨扶德教授鉴定符合《中华人民共和国药典》规定。胃癌MKN-45细胞,中国医学科学院肿瘤医院肿瘤研究所提供。
1.3 主要试剂与仪器
DMEM高糖培养基(Gibco公司),四季青胎牛血清(杭州四季青公司),胰蛋白酶(Gibco公司),二抗(中杉金桥生物技术有限公司),RNAisoTMPlus(D9810A),the PrimeScript RT reagent、kit(DRRO37A),SYBR Premix Ex TaqTM(DRR081A,TakarBio),国产分析纯试剂(北京化学试剂公司)。细胞培养箱(上海申力,HF212),高速冷冻离心机(德国Eppendorf公司,5804R),倒置显微镜(日本OLYMPUS公司,CKX41+DP21),流式细胞仪(美国COULTER EPICS XL)。
2 实验方法
2.1 分组、给药及药物血清制备
将60只SPF级Wistar大鼠随机分为对照组和参芪抑瘤方低、中、高剂量组,每组15只。参芪抑瘤方低、中、高剂量组予0.25、0.50、1.00 g原药材/mL药液灌胃,对照组予等量饮用水灌胃。给药体积均为1.5 mL/100 g,每日2次,连续7 d。末次灌胃2 h后取血,3000 r/min低温离心15 min,分离血清,0.22 μm微孔滤膜过滤,56 ℃、30 min灭活,-80 ℃保存。
2.2 细胞培养
MKN-45细胞经常规传代培养,采用含10%灭火胎牛血清及青链霉素(100 U/mL)的DMEM培养基,于37 ℃、5%CO2饱和湿度恒温培养箱中贴壁生长,每2~3 d换液1次。倒置显微镜下观察细胞情况,当生长状态良好且铺满瓶底时,采用25%胰酶消化、传代,并取处于对数生长期细胞进行实验。
2.3 流式细胞术检测MKN-45细胞周期
取对数生长期的MKN-45细胞接种于6孔板中,增殖为80%时,加入20%药物血清处理48 h,检测前用胰酶消化,1500 r/min离心5 min,弃上清液,PBS洗2次,70%乙醇固定,4 ℃固定过夜。用PBS配制成单细胞悬液,50 μg/mL碘化丙啶染色液室温染色30 min后,流式细胞仪分析细胞周期。
2.4 免疫组化检测MKN-45细胞COX-2、PTEN蛋白表达
将无菌10 mm×10 mm的24片盖玻片置入24孔培养板中,取对数生长期的MKN-45细胞消化后,制成单细胞悬液,以500 μL/孔接种于24孔培养板中。待细胞贴壁后,对照组加50 μL完全培养基,余孔依次加空白血清和高、中、低剂量药物血清各50 μL,每组设3个复孔。细胞爬满盖玻片后,取爬片浸入4%多聚甲醛中过夜。用PBS洗3次,5 min/次,加50 μL 0.1%Triton X-100室温下孵育15 min后,再用PBS洗5 min×3次,加3%H2O2室温下孵育30 min,继续用PBS洗5 min×3次,滴加50 μL 5%BSA封闭液。室温封闭20 min后,甩去多余液体,滴加50 μL稀释过的Rabbit Anti-collagen TypeⅡ(1∶100),置湿盒中4 ℃孵育过夜。并以PBS代替一抗,作为阴性对照,PBS洗3次,2 min/次,加生物素化山羊抗兔IgG,37 ℃孵育20 min,再用PBS洗2 min×3次。然后加SABC,37 ℃继续孵育20 min,PBS洗5 min×4次。DAB显色,自来水冲洗1 min。苏木素复染5 min,0.5%盐酸乙醇分化10 s,氨水返蓝10 s。梯度乙醇脱水干燥,每一梯度5 min,二甲苯透明10 s,甘油封片。倒置相差显微镜观察爬片,每组选6张爬片,每张爬片选择3个高倍视野照相,用Leica Qwin病理图像分析系统对所拍照片进行分析,测定相对灰度值。
3 统计学方法
4 结果
4.1 参芪抑瘤方药物血清对MKN-45细胞周期的影响
10%浓度药物血清处理后MKN-45细胞较对照组细胞G0/G1期比例升高,S期低于对照组,见表1、图1。表明药物血清可有效抑制细胞进入增殖周期,降低细胞S期,阻滞细胞于G0~G1期。
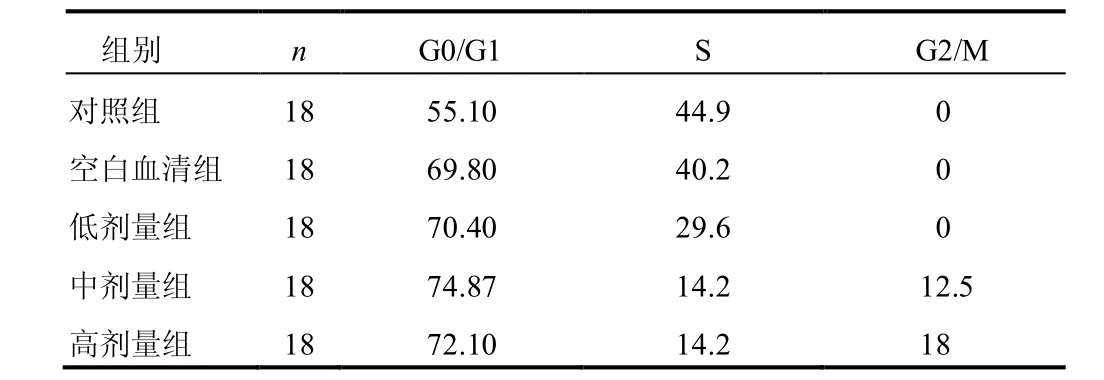
表1 各组MKN-45细胞细胞周期分布比较(%)
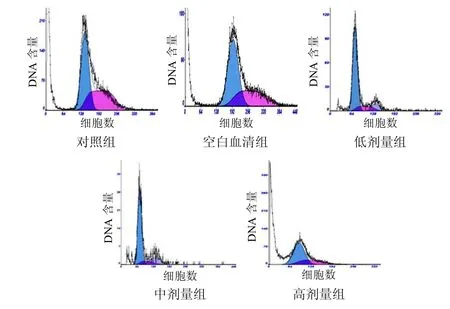
图1 各组MKN-45细胞流式细胞图
4.2 参芪抑瘤方药物血清对MKN-545细胞COX-2、PTEN蛋白表达的影响
对照组细胞COX-2以强阳性和阳性表达为主,而药物血清干预组细胞着色逐渐变浅,COX-2呈弱阳性或阴性表达;对照组细胞着色较浅,PTEN呈弱阳性或阴性表达,药物血清干预组细胞着色逐渐变深,PTEN表达逐渐增强,呈强阳性或阳性表达,差异有统计学意义(P<0.05)。结果见表2、图2和图3。
表2 各组MKN-45细胞COX-2、PTEN蛋白表达比较(±s,%)

表2 各组MKN-45细胞COX-2、PTEN蛋白表达比较(±s,%)
注:与对照组比较,▲P<0.05
组别 n COX-2 PTEN对照组 18 0.22±0.12 1.02±0.01空白血清组 18 0.20±0.01 0.99±0.02低剂量组 18 0.45±0.02▲0.78±0.03▲中剂量组 18 0.69±0.04▲0.57±0.01▲高剂量组 18 0.89±0.03▲0.23±0.01▲

图2 各组MKN-45细胞COX-2蛋白表达(免疫组化染色,×400)

图3 各组MKN-45细胞PTEN蛋白表达(免疫组化染色,×400)
5 讨论
胃癌的发生、发展是一个多因素、多步骤、多基因参与的复杂病理过程。正常情况下,胃黏膜上皮细胞的增殖和凋亡之间保持动态平衡。这种平衡的维持有赖于癌基因、抑癌基因及一些细胞因子等共同调控。多种因素会影响上述调控体系,共同参与胃癌的发生。
中医认为,胃癌是牵涉整体的全身性疾病的局部表现,多由先天禀赋不足、邪毒侵袭、痰凝血瘀等因素,引起机体阴阳失衡,脏腑经络功能失调,进而导致局部癌变。其主要病机为本虚标实,本虚为素体虚弱或先天禀赋因素,标实不外乎气滞、血瘀、痰凝、毒聚。中医药治疗在个体化、多层次、多靶点控制肿瘤生长、抗转移、减少复发等方面具有独到的优势,是胃癌的重要辅助治疗方法。胃癌早期采用中西医结合治疗,可有效逆转病情的恶化。利用中医药的整体调节作用,胃癌术后放化疗过程中,使患者对放化疗药物的耐受性增强,免疫功能得到提高,抑瘤效果得以强化,痛苦明显缓解,生存期延长,生活质量提高。
COX-2是前列腺素合成关键限速酶环氧合酶的一种亚型,近年来研究发现,COX-2高表达与肿瘤发生发展密切相关,在肿瘤细胞增殖、凋亡过程中起重要作用,其表达可延长癌细胞的生存期,促进肿瘤细胞侵袭转移。在正常胃黏膜COX-2几乎不表达,而在胃癌变时则过表达,对胃癌细胞的异常增殖、细胞凋亡、抑制血管形成及转移复发有重要生物学作用。COX-2过表达可上调黏附因子、基质金属蛋白酶等促进肿瘤细胞发生浸润与转移;上调肿瘤细胞周围血管生成因子,促进肿瘤血管生成。研究表明,其在正常胃黏膜、浅表性胃炎、萎缩性胃炎伴肠化、不典型增生及胃癌组织中的表达呈逐渐递增趋势[9]。
作为抑癌基因的PTEN低表达会激活PPI3K-Ark信号通路,从而缩短细胞的分裂周期,促进细胞增殖,与肿瘤细胞浸润、转移密切相关[10]。PTEN的表达过低、受到抑制或缺失都会诱导肿瘤细胞的无限增殖,从而促进肿瘤的发生[11-13]。PTEN蛋白的表达与淋巴结转移、侵袭程度密切相关。胃癌组织中PTEN蛋白的检测可了解与判断肿瘤增生、侵袭及转移的能力和程度。
综上,参芪抑瘤方药物血清能明显阻滞胃癌细胞于G0/G1期,减少S期细胞数量,有效抑制细胞进入增殖周期,诱导胃癌细胞周期阻滞。参芪抑瘤方药物血清可能通过抑制COX-2的表达从而抑制血管内皮生长因子的活性,降低细胞间E-钙黏蛋白活性,减弱肿瘤细胞的侵袭能力,也可能通过升高PTEN的表达量,使其去磷酸化作用增强,进而抑制细胞周期,诱导细胞凋亡和分化,抑制肿瘤细胞转移等,从而发挥抗胃癌细胞侵袭转移的作用。
[1] 舍雅莉,闫德祺,刘永琦,等.当归贝母苦参丸对顺铂化疗H22荷瘤小鼠肿瘤及肝脏、肾脏和胸腺组织病理形态的影响[J].中国中医药信息杂志,2014,21(5):56-60.
[2] 闫德祺,刘永琦,李应东,等.当归贝母苦参丸对顺铂化疗H22荷瘤小鼠的抑瘤作用及对血清HIF-1α和LDH的影响[J].中成药,2014,36(7):1351-1355.
[3] 石金凤,李海龙,吴红彦,等.当归贝母苦参丸含药血清对胃癌细胞SGC-7901和侵袭转移能力和周期的影响[J].辽宁中医药大学学报, 2014,16(10):30-33.
[4] 梁云麒,沈克平,胡兵.中医胃癌病机与治法研究[J].中华中医药学刊, 2014,32(3):513-515.
[5] GUO L, BAI S P, ZHAO L, et al. Astragalus polysaccharide injection integrated with vinorelbine and cisplatin for patients with advanced non-small cell lung cancer:effects on quality of life and survival[J]. Med Oncol,2012,29(3):1656.
[6] 吴素珍,李加林,陈水亲,等.硫酸酯化当归多糖抗肿瘤实验研究[J].时珍国医国药,2012,23(2):319-320.
[7] 刘琦,程旭锋,张新峰,等.山慈菇-蜂房药对抑制人乳腺癌MDA-MB-231细胞体外侵袭转移的机理研究[J].中药新药与临床药理,2014,25(4):389-392.
[8] 王晶娟,张贵君,吴明侠,等.全蝎蛋白药效组分对HepG2细胞的体外抑制作用[J].药物分析杂志,2011,31(1):71-74.
[9] TATSUGUCHI A, MATSUI K, SHINJI Y, et al. Cyclooxygenase-2 expression correlates with angiogenesis and apoptosis in gastric cancer tissue[J]. Hum Pathol,2004,35:488.
[10] WANG S I, PARSONS R, ITTMANN M, et al. Homozygous deletion of PTEN tumor suppressor gene in a subset of prostate adenocarcinoma[J]. Clin Cancer Res,1998,4(6):811-815.
[11] TIBAREWAL P, ZILIDIS G, SPINELLI L, et al. PTEN protein phosphatase activity correlates with control of gene expression and invasion, a tumor-suppressing phenotype, but not with AKT activity[J]. Sci Signal,2012,213:18.
[12] ZHENG H, TAKAHASHI H, MURAI Y, et al. Low expression of FHIT and PTEN correlates with malignancy of gastric carcinomas:tissue-array findings[J]. Appl Immunohistochem Mol Morphol,2007, 15(4):432-440.
[13] ZHANG B G, LI J F, YU B Q, et al. MicroRNA-21 promotes tumor proliferation and invasion in gastric cancer by targeting PTEN[J]. Oncol Rep,2012,27(4):1019-1026.
Effects of Shenqi Yiliu Decoction Medicated Serum on Blocking Cell Cycle and Inhibiting
Invasion and Metastasis of Gastric Cancer Cell Lines MKN-45
MA Chun-lin1, WU Hong-yan1,2,3,
LI Hai-long1,2, CHEN Jie1, ZHANG Xuan1(1. Gansu University of Traditional Chinese Medicine, Lanzhou 730000, China; 2. Key Laboratory of Traditional Chinese Medicine Excavation Innovation and Transformation of Gansu Province, Lanzhou 730000, China; 3. Laboratory for TCM New Products Development Engineering of Gansu Province, Lanzhou 730000, China)
Objective To investigate the relevant mechanism of different concentrations of Shenqi Yiliu Decoction medicated serum on blocking cell cycle and inhibiting invasion and metastasis of gastric cancer cell lines MKN-45. Methods Sixty SPF Wistar rats were randomized into Shenqi Yiliu Decoction low-, medium-, and high-dose groups and control group, with 15 rats in each group. Low-, medium- and high-dose groups were fed with different concentrations of TCM liquid from which containing crude medicine (0.25, 0.50, 1.00 g/mL) separately for gavage. Rats in the blank group were given the same amount of drinking water for gavage, twice a day, for 7 days. 2 h after the last gavage, rat blood was taken and serum was separated. After MKN-45 cells were dealt with different concentrations of medicinal serum, FCM was used to detect cell cycle and immunohistochemistry technology was used to detect the expressions of COX-2 and PTEM proteins. Results FCM analysis showed that medicated serum could increase G0-G1 phase and shorten S phase of cells; medicated serum could reduce the positive expression rate of COX-2 of the MKN-45 cells and increase positive expression rate of PTEN proteins (P<0.05). Conclusion Shenqi Yiliu Decoction medicated serum can block the cell cycle and inhibit invasion and metastasis of MKN-45 cell lines, which may be related to the intervention in the expression levels of COX-2 and PTEN proteins.
Shenqi Yiliu Decoction; gastric cancer; MKN-45 cell; cell cycle; COX-2; PTEN; rats
10.3969/j.issn.1005-5304.2016.04.017
R285.5
A
1005-5304(2016)04-0064-04
2015-06-24)
(
2015-07-03;编辑:华强)
甘肃省高等学校科研项目(2013A-088)
吴红彦,E-mail:wuhy@163.com
