鹿角灵芝免疫调节蛋白基因的克隆及生物信息学分析
2016-12-21姜芳燕尹乐乐王辉芳
姜芳燕,李 花,尹乐乐,马 军,王辉芳
(1海南热带海洋学院 热带生物与农学院,海南 三亚 572022;2长沙市公安局刑侦支队,湖南 长沙 410004)
鹿角灵芝免疫调节蛋白基因的克隆及生物信息学分析
姜芳燕1,李 花2,尹乐乐1,马 军1,王辉芳1
(1海南热带海洋学院 热带生物与农学院,海南 三亚 572022;2长沙市公安局刑侦支队,湖南 长沙 410004)
采用同源克隆法,从Ganodermaamboinense07基因组中成功PCR扩增到编码FIP-gam的全长基因,并进行测序.通过生物信息学分析,可知FIP-gam基因全长333 bp,编码107个氨基酸,理论分子量为12.0 kDa,等电点为4.4 8.进化树及序列分析结果显示,FIP-gam与灵芝组FIPs同源性较高,而与金针菇、草菇和血红丛赤壳的FIPs同源性较低.采用SWISS-MODEL进行同源建模,结果表明FIP-gam为α-螺旋和β-折叠形成哑铃形的二聚体蛋白.本研究为进一步高效表达FIP-gam及其结构功能关系的研究奠定基础.
Ganodermaamboinense;免疫调节蛋白;基因克隆;生物信息学
0 引言
灵芝(Ganodermasp.)是我国传统药用真菌,含有多糖、三萜类、蛋白类、甾醇、脂肪酸、微量元素等多种营养和药用成分,它们在抗肿瘤、免疫调节、心血管病以及抗菌中发挥着不同的作用[1].近年来,随着生物技术在药物研究和开发中的应用,特别是对中草药中基因、蛋白和药理作用之间关系的逐渐探索,灵芝蛋白质的研究逐渐得到重视[2].真菌免疫调节蛋白(Fungal Immunomodulatory Protein,FIP)是从某些药(食)用真菌中提取的具有与真菌凝集素和免疫球蛋白相类似的结构和免疫调节功能的一类小分子蛋白质[3]. 1989年,Kino等首次从赤芝(G.lucidum)子实体中分离获得FIP,并命名为Ling Zhi-8(LZ-8或FIP-glu)[4].到目前为止,已分别从赤灵芝(G.lucidum)、松杉灵芝(G.tsugae)、紫芝(G.japoncium)、小孢灵芝(G.microsporum)、紫芝(G.sinensis)、金针菇(Flammulinavelutipes)及草菇(Volvariellavolvacea)中得到了7种FIPs,分别为LZ-8(FIP-glu)、FIP-gts、FIP-gja、FIP-gmi、FIP-gsi、FIP-fve和FIP-vvo,形成了一个新的蛋白质家族——FIPs[5-7].已分离出的天然FIPs的基本特征为分子量约12~13 kDa,110~114个氨基酸残基.林忠等[8]和Lin等[9]研究报道,FIPs在免疫调节和抗肿瘤病等方面具显著效果.
鹿角灵芝(G.amboinense)因其形状似鹿角而得名,主要产于我国海南和云南等地区[10].目前对鹿角灵芝的研究主要集中于多糖和三萜类化合物的提取、分离和生理活性的研究[11],而有关其蛋白质研究报道较少.因此,笔者开展了鹿角灵芝免疫调节蛋白(FIP-gam)基因克隆的研究,并应用生物信息学的方法对其编码的蛋白进行一系列的分析,以期为FIP-gam的后续高效表达打下基础,同时也为其在开发FIPs相关保健产品、功能性食品以及免疫治疗药物等方面提供理论参考和依据.
1 材料与方法
1.1 菌株与试剂
G.amboinense07购于江苏新沂市康原食用菌研究所.PCR相关试剂如r-TaqDNA聚合酶、DNA Marker、dNTPs等购自北京三博远志有限公司;PCR产物胶回收试剂盒购自北京百泰克生物技术有限公司.CTAB、乙醇和异戊醇等常规试剂购自海口天地生物技术有限公司.
1.2 培养基
液体培养基(g/L):马铃薯333g,葡萄糖20g,磷酸氢二钾3g,硫酸镁1.5 6g.
固体培养基(g/L):马铃薯330g,葡萄糖19.8g,磷酸氢二钾2.97g,硫酸镁1.5 4g,琼脂17.82g.
1.3 主要分子操作
灵芝总DNA提取和PCR产物回收等分子操作参照文献[12]进行.通过GenBank查询比对,克隆FIP-gam基因保守区所用简并引物为GA-F(HHGTCCGACACTGCCTTGATCTTCAGG)和GA-R(CTAGTTCCACTGG GCGATGATGAAGTC).以G.amboinense07基因组为模板,以GA-F和GA-R为引物进行PCR扩增,将扩增获得约300 bp的DNA保守片段,送往深圳华大基因有限公司测序.
1.4 系统发育分析
将FIP-gam氨基酸序列提交NCBI数据库,进行BLASTP比对,搜索同源蛋白序列,以确定FIP-gam的归属.系统发育树构建参照文献[13].
1.5 FIP-gam序列分析
FIP-gam基因编码蛋白的理化性质采用ProtParam预测;信号肽使用SignalP 4.1 Server进行分析;亚细胞定位采用CELLO v.2.5 预测; 二级结构采用SOPMA进行分析,并应用SWISS-MODEL通过同源建模的方法,预测FIP-gam的三级结构.
2 结果与讨论
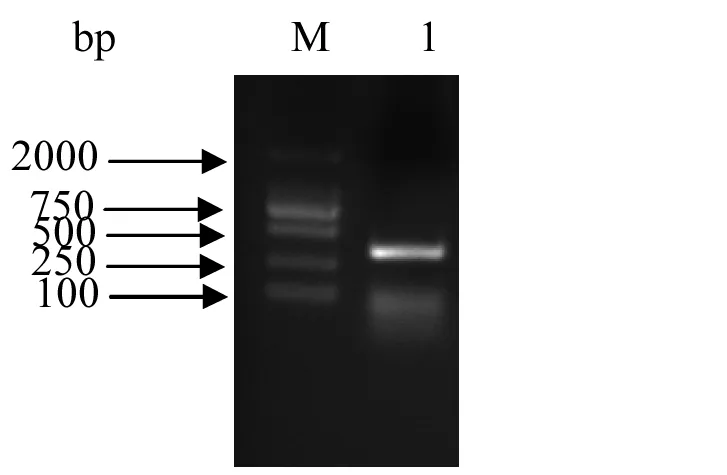
图1 FIP-gam基因保守片段PCR电泳图(泳道M:分子量DL2000,泳道1:FIP-gam)
2.1 FIP-gam基因保守片段的克隆
以鹿角灵芝(G.amboinense07)的基因组为模板,以GA-F和GA-R为引物,进行基因保守PCR扩增,目的片段大小为300 bp左右的条带,结果如图1所示.回收目的片段送往深圳华大基因有限公司测序,FIP-gam基因保守片段的测序结果显示,该片段长为333 bp,条带与目的片段大小相符合.
2.2 FIP-gam理化性质分析
采用ProtParam对FIP-gam氨基酸序列的理化性质进行分析.结果表明,FIP-gam分子式为C542H813N139O167S,分子量为11980.3 ,等电点为4.4 8.其氨基酸数目为107,其中负电荷残基总数(Asp+Glu)为12;正电荷残基总数(Arg+Lys)为8.FIP-gam的不稳定系数为3.01,该蛋白分类为稳定蛋白.A280 nm摩尔消光系数:19940;A280nm消光系数:1.6 44 mg/mL;脂溶系数:80.09;总平均亲水性值(Grand average of hydropathicity,GRAVY)为-0.2 44,说明FIP-gam为亲水蛋白.
2.3 FIP-gam蛋白结构与功能的预测和分析
2.3.1 信号肽分析
采用SingalP 4.1 对FIP-gam进行信号肽分析.结果表明,基于神经网络(neural networks,NN),其预测值为Smean score;基于隐马尔可夫模型(hidden Markov models,HMM),其预测值为Sprob.将SignalP 4.1 预测所得Smeanscore=0.2 40和HMM Cmaxscore=0.3 99等数值带入公式L=-918.2 35-123.4 55×Smeanscore+1983.4 4×HMM Cmaxscore,对L值进行计算,L>0的蛋白为具信号肽的分泌蛋白.FIP-gam的L值=-386.4 85<0,说明FIP-gam不具有信号肽.
2.3.2 亚细胞定位预测
采用CELLO v.2.5 对FIP-gam进行亚细胞定位检测,结果则显示其预测FIP-gam在细胞(2.1 22)和周质空间(0.826)均有分布,其中细胞外分布较多.在真核细胞中,大多数蛋白都是通过内质网-高尔基体蛋白分泌途径分泌到细胞外,这个过程被称为经典分泌途径[14].根据信号肽预测可知,FIP-gam不具有信号肽,不能通过经典分泌途径分泌到细胞外.在真核细胞中,有少数蛋白质的分泌并不依赖于内质网-高尔基体途径,而是通过其他途径进行分泌,这些在细胞外有明确功能的蛋白质并不含有信号肽,这类分泌途径被称为非经典分泌途径[14].真核细胞蛋白非经典分泌与细胞增殖、免疫反应、肿瘤形成、传染病病理学等密切相关[14],而目前研究证明FIPs在促进淋巴细胞的增殖、抗过敏、抗肿瘤和诱导细胞分泌细胞因子等方面均有重要作用[8, 9].因此,推测FIP-gam的分泌方式应属于真核细胞非经典蛋白分泌途径.但由于真核细胞非经典分泌途径较多,所以目前仍不清楚FIP-gam属于何种方式.
2.4 FIP-gam氨基酸序列同源性分析
将FIP-gam氨基酸序列提交NCBI,采用BLASTP搜索蛋白库,查找相同或相似的氨基酸序列,应用DNAMAN 6.0进行单序列比对及同源性分析,结果如图2所示.由图可知,FIP-gam具有FIPs家族标志性氨基酸残基“-FDY-P”、“-KAY-YRV”、“-GYG-”和“-IADT-TI”等保守序列[8].不同FIPs的氨基酸序列具有一定的同源性,其中FIP-gam与黄灵芝(G.multiplicatum)FIP-gmu、泰山灵芝(G.taishanense)FIP-gta、赤芝(G.lucidum)FIP-glu、紫芝(G.japoncium)FIP-gja、川芝(G.sichuanense)FIP-gsi、松杉灵芝(G.tsugae)FIP-gts[15]和LZ-8等FIPs的同源性较高(大于86%),分别为86.5 5%、86.4 4%、87.2 9%、89.5 7%、87.2 9%、93.6 9%和93.6 9%.与黑芝(G.atrum)FIP-gat、黑灵芝(G.astum)FIP-gas[16]、树舌灵芝(G.applanatum)FIP-gap以及小孢灵芝(G.microsporum)FIP-gmi的同源性略低,分别为79.2 8%、79.2 8%、73.4 5%和79.2 8%.而FIP-gam与非灵芝属的FIPs之间同源性较低,如金针菇(F.velutipes)FIP-fve(58.77%)、草菇(Volvariellavolvacea)FIP-vvo[6](53.98%)和血红丛赤壳(Nectriahaematococca)FIP-nha(60.5 3%).

图2 不同FIPs氨基酸序列比对
(LZ-8(GenBank:AAA33350.1 )、金针菇(F.velutipes)FIP-fve(GenBank:GU388420.1 )、树舌灵芝(G.applanatum)FIP-gap(GenBank:JN167598.1 )、黑芝(G.atrum)FIP-gat(GenBank:AJD79556.1 )、小孢灵芝(G.microsporum)FIP-gmi(PDB:3KCW_A)、血红丛赤壳(Nectriahaematococca)FIP-nha(GenBank:EEU37941.1 );松杉灵芝(G.tsugae)FIP-gts[15]、黑灵芝(G.astum)FIP-gas[16]、草菇(Volvariellavolvacea)FIP-vvo[6]等分别来自文献;鹿角灵芝(G.amboinense)FIP-gam、黄灵芝(G.multiplicatum)FIP-gmu、泰山灵芝(G.taishanense)FIP-gta、赤芝(G.lucidum)FIP-glu、川芝(G.sichuanense)FIP-gsi、紫芝(G.japoncium)FIP-gja等6种FIPs为本课题组克隆.下图同)

图3 FIP-gam的系统进化树
上述15种FIPs氨基酸序列通过MEGA 4.0中的邻接算法(neighbor-Joining algorithm)构建系统进化树,可靠性分析采用Bootstrap检验(重复1000次).由图3可知,15个FIPs分布于4个聚类组,其中树舌灵芝(FIP-gap)和金针菇(FIP-fve)各自聚成一个聚类组,草菇(FIP-vvo)和血红丛赤壳(FIP-nha)聚成一个聚类组,其余10个灵芝FIPs聚成一个聚类组(同源性达87.4 7%).在灵芝聚类组中,黑芝(FIP-gat)和黑灵芝(FIP-gas)[16]聚成一个分支,同源性高达100%;小孢灵芝(FIP-gmi)单独聚成一个分支,与两种黑芝FIPs的同源性达93.99%;鹿角灵芝(FIP-gam)、黄灵芝(FIP-gmu)、泰山灵芝(FIP-gta)、赤芝(FIP-glu)、紫芝(FIP-gja)、川芝(FIP-gsi)、松杉灵芝(FIP-gts)和LZ-8,同源性达90.6 3%,其中FIP-gam单独成了一个末支,但是它与该分支内其他FIPs的差异并不是很大.说明10个灵芝FIPs聚类组内虽然存在着一定的遗传差异,但总体上亲缘关系比较近,遗传多样性并不丰富.苏春丽等[17]用β-微管蛋白基因部分序列对38个灵芝属菌株的亲缘关系进行探讨,结果表明这些灵芝菌株分布于6个聚类组,其中树舌亚属、紫芝组的菌株各自聚成一组,其中黑灵芝归于紫芝组.灵芝组的菌株分成四组,但大部分灵芝组菌株均聚于同一组,这表明树舌亚属、紫芝组和灵芝组间的遗传差异较大.苏恺琪等[16]根据灵芝FIPs氨基酸序列分析,采用NJ方法进行分子系统进化分析,认为黑灵芝的FIP-gas与紫芝的FIP-gsi和紫灵芝的FIP-gja为同一个分支.赵明文等[18]利用RAPD技术对生产中常用的灵芝属 8个菌株的亲缘关系进行分析,结果表明根据UPGMA构建的树状图表明:8个菌株在较低的相似水平上可以分成 3个明显不同的组:第 1组包括灵芝 0770(G.lucidum0770 )、黑芝(G.atrum)、松杉灵芝(G.tsugae)、韩国灵芝 (G.lucidumHG)和圆芝(G.rotundatum);第2组包括紫灵芝(G.sinense)和密纹灵芝(G.crebrostriatum);第 3组为树舌灵芝(G.applanatum).而在本研究中,紫芝(FIP-gja)与其他灵芝FIPs归为一个分支,且两种黑芝FIPs与FIP-gja遗传差异较大,并未归为一个分支.总体来说,树舌亚属FIP和灵芝组间的FIPs遗传差异较大.这些结果说明以FIPs作为灵芝的分类依据具有一定的可行性,但仍有一定的局限性,可结合其他分子分类标记,如RAPD技术、ITS序列,或者其他一些编码参与新陈代谢和结构性蛋白的基因等,对灵芝进行更加准确的分类.

图4 FIP-gam的SWISS-MODEL模拟
采用SOMPA预测FIP-gam的二级结构.分析结果表明,其蛋白质二级结构中,无规则卷曲占42.06%,β-折叠占34.5 8%,β-转角占12.1 5%,α-螺旋占11.2 1%,这一比例说明FIP-gam为四种蛋白质二级结构混合型蛋白,其中无规则卷曲占了较高的比例.将FIP-gam蛋白序列提交PDB数据库,寻找与其同源的蛋白质晶体结构.结果显示FIP-gam与已报道的G.lucidumLZ-8(PDB登录号:3f3h)的同源性(93.6 9%)最高.进一步通过DNAMAN 6.0比对两个蛋白的同源性,结果显示除个别氨基酸外,两者氨基酸序列几乎完全相同.以G.lucidiumLZ-8为模板,采用SWISS-MODEL对FIP-gam氨基酸序列进行蛋白质三级结构同源建模,结果如图4所示.FIP-gam三级结构具有以下几个结构特点:①其三级结构为由α-螺旋和β-折叠形成哑铃形的二聚体,其中哑铃的两端由7个反向平行β-折叠组成球形,中间由2个α-螺旋和1个β-折叠组成哑铃的柄;②N-末端结构域是由一个α-螺旋和β-折叠是通过结构域交换维持的二聚化,其中α-螺旋由约12个氨基酸形成,推测该结构对二聚体的形成以及FIP-gam识别靶细胞表面受体并行使生物学活性至关重要.Lin等[15]通过松杉灵芝(G.tsugae)FIP-gts突变缺失实验证明,N 端α-螺旋中的有2个氨基酸(△ L5/ △L7)对于保持活性至关重要, 如果移去△ 5-△7 这三个氨基酸,α-螺旋的两亲性特征将被打乱,从而失去活性.③C-端结构域属于免疫球蛋白样β-三明治折叠,其三明治结构包括两个β-片层(I和II)的,分别由β-链(ABE)和β-链(GFCD)形成,两个β-片层之间通过无规则卷曲相连接.结构分析表明,FIP-gam通过三维结构域的N-末端螺旋的交换实现二聚化,并主要由疏水作用稳定,因此二聚化对FIP-gam活性极其重要.有研究报道,FIPs具有抗肿瘤、免疫调节和抗氧化等生物功能,但是FIP-gam是否具有这些功能,如何起作用,以及其结构和功能之间关系,还有待进一步的研究.
3 结 论
本研究运用基因工程技术,成功获得G.amboinense07免疫调节蛋白的全长基因.运用生物信息学方法对FIP-gam的氨基酸序列进行分析.结果表明,FIP-gam的氨基酸数目为107,分子量为12.0 kDa,等电点为4.4 8.FIP-gam不具有信号肽,亚细胞定位预测表明,FIP-gam在细胞外分布较多,推测其通过非经典分泌途径分泌到细胞外.氨基酸序列和进化树分析,FIP-gam与灵芝组FIPs同源性较高,而与非灵芝属的FIP-fve、FIP-vvo和FIP-nha同源性较低,FIP-gam与 FIP-gat、FIP-gas、FIP-gap和FIP-gmi的同源性则介于两组之间.蛋白结构模拟表明,FIP-gam三级结构由α-螺旋和β-折叠形成哑铃形的二聚体.本研究获得FIP-gam基因序列及生物信息学分析结果,为进一步重组表达FIP-gam及研究其结构与功能的关系奠定良好基础,也为灵芝FIPs在开发保健产品、功能性食品以及免疫治疗药物等提供理论依据.
[1]Zhou X. W., Lin J.,Yin Y. Z., et al. Ganodermataceae: natural products and their related pharmacological functions [J].American Journal of Chinese Medicine, 2007,35(4):559-574.
[2]李奇璋.真菌免疫调节蛋白基因的克隆、优化、功能及多克隆抗体制备[D].上海交通大学,2009.
[3]林景卫,孙非,张韧,等.真菌免疫调节蛋白的研究进展[J].中国免疫学杂志, 2005(6):477-450.
[4]Kino K., Yamashita A., Yamaoka K., et al. Isolated and characterization of a new immunomodulatory protein Ling Zhi-8 (LZ-8) from Ganoderma lucidum [J].Journal of Biological Chemistry, 1989,264(1):472-478.
[5]Wu M. Y., Hsu M. F., Huang C. S., et al. A 2.0 Å structure of GMI, a member of the fungal immunomodulatory protein family from Ganoderma microsporum [J].Protein Crystallography, 2007,II-132.
[6]Zhou X. W., Xie M. Q., Hong F., et al. Genomic cloning and characterization of a FIP-gsi gene encoding a fungal immunomodulatory protein from Ganoderma sinensis (Aphyllophoromycetideae)[J].International Journal of Medicinal Mushroom, 2009,11(1):77-86.
[7]Hsu H. C., Hsu C.I., Lin R. H., et al. Fip-vvo, a new fungal immunomodulatory protein isolated from Volvariella volvacea [J].Journal of Biological Chemistry, 1997,323(2):557-565.
[8]林忠,白杰英,李彦舫.真菌免疫调节蛋白(FIP)结构与功能研究[J].辽宁师范大学学报, 2006,29(1):84-87.
[9]Lin J. W., Hao L. X., Xu G. X., et al. Molecular cloning and recombinant expression of a gene encoding a fungal immunomodulatory protein fromGanodermaluciduminPichiapastoris[J].World Journal of Microbiology and Biotechnology, 2008,25(3):383-390.
[10]李静,邓毛程,王瑶,等.鹿角灵芝提取三萜酸的研究[J].四川理工学院学报(自然科学版), 2014,27(6):9-12.
[11]刘研新,余彦,王蓓.鹿角灵芝胶囊的抗肿瘤活性及对顺铂所致肾损伤的保护作用[J].华西药学杂志, 2008,23(5):564-566.
[12]Zhou X. W., Li Q. Z., Zhao J. Y., et al. Comparison of rapid DNA extraction methods applied to PCR identification of medicinal mulshroomGanodermaspp. [J].Preparative Biochemistry and Biotechnology, 2007,37(4):369-380.
[13]姜芳燕,黄申,李春.荧光假单胞菌BIT-18磷脂酶B基因的克隆及生物信息学分析[J].琼州学院学报, 2013,20(5):56-63.
[14]张楠楠,刘欣,李庆伟,等.真核细胞非经典蛋白分泌途径[J].遗传, 2009,31(1):29-35.
[15]Lin W. H., Hung C. H., Hsu C. I., et al. Dimerization of the N-terminal amphipathic α-Helix domain of the fugal immunomodulatory protein fromGanodermatsugae(FIP-gts) defined by a yeast two-hybridsystem and site-directed mutagenesis [J].Journal of Biological Chemistry, 1997,272(32):20044-20048.
[16]苏恺琪,王雪飞,周选围.黑灵芝免疫调节蛋白基因的克隆和生物信息学分析[J].上海交通大学学报(农业科学版), 2012,30(1):65-71.
[17]苏春丽,唐传红,张劲松,等.基于β-微管蛋白基因部分序列探讨灵芝属菌株的亲缘关系[J].菌物学报, 2006,25(3):439-445.
[18]赵明文,陈明杰,王南,等.灵芝生产用种的亲缘关系研究[J].南京农业大学学报, 2003,26(3):60-63.
(编校:曾福庚)
Cloning and Bioinformatics of Fungal Immunomodulatory Protein Gene fromGanodermaamboinense
JIANG Fang-yan1, LI Hua2, YIN Le-le1, MA Jun1, WANG Hui-fang1
(1 School of Tropical Biology and Agronomy, Hainan Tropical Ocean University, Sanya Hainan, 572022, China;2 Criminal Investigation Division, Changsha Public Security Bureau, Changsha, 410004, China)
By applying homology cloning method, a gene fromGanodermaamboinense07 encoding a fungal immunomodulatory protein (FIP-gam) was cloned and sequenced. The results of bioinformatics analysis revealed that FIP-gam contains an open reading frame 333 bp in length. The cloned gene was predicted to encode a protein of 107 amino acid residues with a theoretical molecular mass of 12.0 kDa and a deduced pI of 4.4 8. Phylogenetic and sequence analysis suggested that FIP-gam shares relatively high homology with the FIPs fromGanodermasp., but shares relatively low homology with FIP-fve (F. velutipes), FIP-vvo (Volvariella volvacea), and FIP-nha (Nectriahaematococca). The homology modeling by SWISS-MODEL exhibited that FIP-gam, composed of α-helixes and β-strands that sustain the dimerization via domain swapping, forms a dumb-bell-shaped dimmer. This study provides the foundations for the further research on the expression of FIP-gam and the relationship between its structure and functions.
Ganodermaamboinense; fungal immunomodulatory protein; gene cloning; bioinformatics
2016-02-28
海南省自然基金(313049,20153141);国家(省)重点科技项目三亚市配套资金(2014PT13);海南省大学生创新训练项目(20130127)
姜芳燕(1984-),女,浙江衢州人,海南热带海洋学院热带生物与农学院副教授,博士,研究方向为微生物的资源及其催化与转化.
Q75
A
1008-6722(2016) 02-0054-06
10.1 3307/j.issn.1 008-6722.2 016.1 2.
