气相色谱-质谱法同时测定饲料中6种雌激素类药物
2016-12-20林小莉董艳峰
林小莉,李 宁,霍 峰,董艳峰,彭 玮
(哈尔滨市兽药饲料监察所,黑龙江 哈尔滨 150010)
气相色谱-质谱法同时测定饲料中6种雌激素类药物
林小莉*,李 宁,霍 峰,董艳峰,彭 玮
(哈尔滨市兽药饲料监察所,黑龙江 哈尔滨 150010)
建立了固相萃取/气相色谱-质谱法(GC-MS)同时测定饲料中己烷雌酚、己烯雌酚、双烯雌酚、雌酮、17β-雌二醇、雌三醇的检测方法。饲料样品经乙醚提取后,HLB固相萃取柱净化、衍生化后用气相色谱-质谱仪进行检测,外标法定量。结果表明,己烷雌酚在2.5~250 ng/mL,其它5种雌激素类药物在5~500 ng/mL范围内具有良好的线性关系,相关系数不小于0.99,检出限为3~8 μg/kg,样品的平均加标回收率为75.9%~96.3%。该方法检出限低,能够准确进行定性和定量测定,可同时测定饲料中的6种雌激素类药物。
气相色谱-质谱;己烷雌酚;己烯雌酚;双烯雌酚;雌酮;雌二醇;雌三醇;饲料
近年来,我国食品安全问题日益突出,而动物源性食品的激素类药物残留问题已成为目前国内外食品安全的一个热点问题。饲料是各种畜禽动物摄入外源性激素的主要途径,这些激素类药物不仅会引起动物自身生理特征的变化,而且在动物生长发育的过程中会残留于动物体内,通过食物链进入人体,人类长时间食用这些食品,会产生如性早熟、第二特征异常、各种癌症和肿瘤等疾病,最终影响人体健康[1-5]。因此,饲料的质量安全是保障人类食品安全的重要基础。农业部陆续发布了如235号公告《动物性食品中兽药最高残留限量》和176号公告《禁止在饲料和动物饮用水中使用的药物品种目录》等政府文件,明确规定禁止在食用动物饲养及饮用水中使用如己烷雌酚、己烯雌酚等激素类药物促进动物快速生长发育或其它相关用途[6-7]。当前文献报道的激素残留检测主要针对动物源食品[8-12],关于饲料方面的报道较少[13-14]。本文建立了气相色谱-质谱联用法同时测定饲料中6种雌激素的方法,具有检出限低、准确度高、可同时测定多种雌激素类药物等特点,适用于饲料中雌激素类药物的检测。
1 实验部分
1.1 实验试剂
己烷雌酚、乙烯雌酚品、双烯雌酚、17β-雌二醇、雌三醇、雌酮标准品(Dr.Ehrenstorfer GmbH);N,O-双(三甲基硅基)三氟乙酰胺+三甲基氯硅烷(99+1)衍生剂;甲醇、乙腈、丙酮(色谱纯,Fisher 公司);氨水、乙酸铵、盐酸、乙酸乙酯、正己烷、乙醚、三氯甲烷、氢氧化钠(分析纯,科密欧试剂公司)。
1.2 仪器与设备
7890A/5975A气相色谱-质谱联用仪(美国 Agilent 公司):单四极杆,配分流/不分流毛细管柱进样器、GC-MS化学工作站和 EI 电离源;HP-5 MS石英毛细管柱,固定相(5%苯基)-甲基聚硅氧烷,25 mm×0.32 mm×0.52 μm,购自美国 Agilent 公司;12通道半自动固相萃取装置(美国Gilson公司);AB204-N型电子分析天平(精度 0.000 1 g)、AB265-S型电子分析天平(精度 0.000 01 g)和DELTA320精密 pH 计(德国梅特勒-托利多仪器有限公司);HLB固相萃取柱(500 mg/3 mL,美国Waters公司);VELOCITY 18R高速冷冻离心机(澳大利亚Jouan 公司);N-EVAP-24氮吹浓缩装置(美国Organomation公司)。
1.3 样品测定
1.3.1 样品前处理及测定 准确称取5 g动物饲料于50 mL离心管中,加入10 mL 0.2 mol/L的乙酸铵缓冲溶液,匀质1 min,加入10 mL乙醚,旋涡振荡提取3 min,10 000 r/min离心5 min,吸取乙醚层于另一试管中,用乙醚重复提取1次,合并乙醚相用旋转蒸发仪蒸干,加入5 mL三氯甲烷溶解残余物,旋涡振荡1 min,加入5 mL的1 mol/L氢氧化钠溶液,旋涡振荡1 min,于10 000 r/min离心5 min,上层水相移入另一试管中,用氢氧化钠溶液重复提取1次,合并氢氧化钠溶液提取液。加入1 mL甲醇,用HCl调pH值为6.0~6.5。
依次用5 mL乙酸乙酯、5 mL甲醇和5 mL盐酸溶液(pH 3.0)活化HLB固相萃取柱,取全部备用液过柱,控制流速不超过2 mL/min,再依次用5 mL水-甲醇(体积比为9∶1)和5 mL正己烷淋洗小柱,将固相萃取柱抽干,最后用5 mL甲醇洗脱,50 ℃氮气吹干。
于试管中加入100 μL N,O-双(三甲基硅烷基)三氟乙酰胺+三甲基氯硅烷(99+1)衍生化试剂,于振荡器上混匀,在70 ℃烘箱中加热1 h,放置冷却后用氮气吹干,加入200 μL异辛烷溶解,上机测定。
1.3.2 标准溶液配制 准确量取25 mg标准品,用甲醇溶解,定容于25 mL容量瓶中,配成浓度为1 mg/mL的标准储备溶液,吸取各标准储备溶液,装入50 mL棕色容量瓶中,以甲醇定容,所得每种标准溶液中含己烷雌酚为5 μg/mL,其它雌激素为10 μg/mL,将混合标准溶液逐级稀释成己烷雌酚浓度分别为2.5,5.0,12.5,25,50,250 ng/mL,其它雌激素浓度为5.0,10,25,50,100,500 ng/mL的标准溶液。
1.3.3 标准溶液的衍生化 吸取100 μL混合标准溶液,在40 ℃下用氮气吹干,与上述样品衍生化同样处理,上机测定。
1.4 仪器条件
1.4.1 色谱条件 升温程序:初始柱温 150 ℃,保持 0 min,以10 ℃/min升至180 ℃(保持10 min),以5 ℃/min升至250 ℃,保持2 min,再以30 ℃/min升至300 ℃(保持1 min)。载气:高纯氦气,纯度≥99.999%,流速1.0 mL/min;进样口温度:250 ℃;接口温度:280 ℃。进样方式及进样量:不分流进样,1 μL。
1.4.2 质谱条件 离子源:EI 源,离子源温度:250 ℃;四极杆温度:100 ℃;溶剂延迟:22 min;选择离子监测(m/z):己烷雌酚(179,207,208,399)、己烯雌酚(383,397,412,413)、双烯雌酚(381,395,410,411)、雌酮(218,257,342,343)、17β-雌二醇(232,285,416,417)、雌三醇(311,345,386,504)。
2 结果与讨论
2.1 样品前处理试剂的选择
文中6种雌激素在弱极性或中等极性的有机溶剂中有较高的溶解性,因此分别用乙醚、乙酸乙酯、乙腈进行提取。结果显示,以上述3种溶剂作为提取剂时,样品的回收率分别为85%~95%,51%~75%和52%~65%。其中,使用乙醚作为提取剂的回收率最高,且提取完全、除脂效果好。由于饲料中的蛋白质含量高,所以溶液蒸干后需去除蛋白质。分别考察了三氯甲烷、四氯化碳、正己烷、二氯甲烷4种有机溶剂对蛋白质的去除效果,结果表明,三氯甲烷的除蛋白效果优于其他有机溶剂。本实验采用乙醚作为样品提取溶剂,并用三氯甲烷去除饲料中的蛋白。
2.2 固相萃取柱的选择
饲料样品基质复杂,含有大量的色素、有机酸等,不仅会干扰目标物的分析,而且对色谱柱和质谱会造成影响[14]。本实验对HLB柱、PEP柱、Max柱和PAX柱4种固相萃取柱的净化效果进行比较,结果表明,使用HLB柱时6种雌激素类药物的回收率最高,为89%~102%,使用其他固相萃取柱获得的回收率均偏低。HLB柱不仅能同时除去饲料中的色素及有机酸等基质,而且能够获得较高的回收率。因此采用HLB柱对饲料样品进行净化处理。
2.3 衍生化试剂的选择
常用的衍生化方法有硅烷化、酰化、烷基化和肟化。实验选用七氟丁酸酐(HFBA)、BSTFA(99+1)和三甲基苯胺(TMAH) 3种衍生化试剂进行比较。由于BSTFA(99+1)是将硅烷基引入到分子中,一般取代活性氢,进而使得含活性氢反应位点数目减少,化合物的稳定性得以加强。另一方面,由于生成的硅烷化衍生物的极性减弱,导致其被测能力增强,热稳定性提高[15]。本实验的结果表明,HFBA不稳定,易变色失效;使用BSTFA(99+1)作为衍生化试剂时样品的回收率为86%~98%,而使用TMAH时的回收率为73%~89%,表明TMAH的衍生效果不如BSTFA(99+1)好。因此,实验使用BSTFA(99+1)作为衍生化试剂。
2.4 衍生化反应温度及时间的选择
衍生化反应需在一定的温度条件下进行,否则重复性差。实验分别在60,70,80 ℃进行衍生化,结果表明,样品在70 ℃下衍生效果最好,回收率可达82%~96%,而在60 ℃和80 ℃时雌酮和雌三醇的回收率均低于60%。实验最终确定衍生化温度为70 ℃。采用60 min的反应时间时,衍生反应比较完全。若衍生时间过短,反应不完全,而时间过长,则反应副产物增加,回收率降低。因此本实验采用60 min作为最佳反应时间。
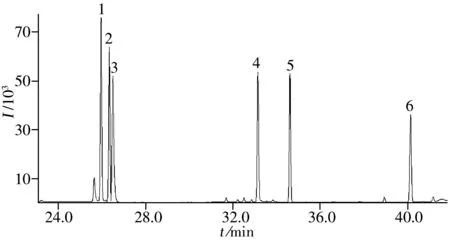
图1 采用HP-5 MS色谱柱时6种雌激素类药物的色谱图Fig.1 Chromatogram of six extrogenous hormones on a HP-5 MS column peak No.(1-6) was the same as those in Table 1
2.5 色谱-质谱实验条件的确定
2.5.1 色谱系统适应性实验 雌激素类药物衍生物的极性低,相对分子质量大,实验采用固定相为5%苯基-甲基聚硅氧烷的HP-5 MS石英毛细管柱进行分离,为使目标峰与衍生副产物峰及其它干扰峰分开,采用程序升温进行GC分离。在上述色谱条件下,向空白饲料样品中添加100 ng/mL的标准混合溶液,得到的色谱图如图1所示。由图可以看出各待测物的分离良好,峰形尖锐且对称。
2.5.2 质谱条件的优化 在全扫描模式下,分别获得雌激素类药物标准溶液(10 μg/mL)衍生物的总离子流色谱图,确定被测物的保留时间。同时,扣除本底后,根据对全扫描平均质谱图的分析,确定被测物的特征离子及离子间的相对强度。本实验选择4个特征离子进行定性。如表1所示,采用GC-MS的全扫描方式,对目标物的定性离子扫描,从而提高了灵敏度,改善了峰形和精确度,完全能满足痕量分析的要求。
表1 6种雌激素类药物的保留时间、特征离子与相对丰度
Table 1 Retention times,characteristic ions and relative abundances of six extrogenous hormones
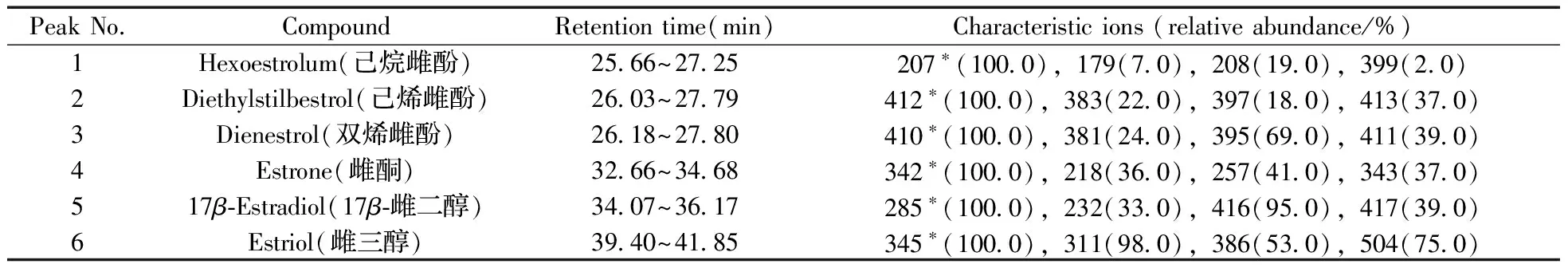
PeakNo.CompoundRetentiontime(min)Characteristicions(relativeabundance/%)1Hexoestrolum(己烷雌酚)2566~2725207∗(1000),179(70),208(190),399(20)2Diethylstilbestrol(己烯雌酚)2603~2779412∗(1000),383(220),397(180),413(370)3Dienestrol(双烯雌酚)2618~2780410∗(1000),381(240),395(690),411(390)4Estrone(雌酮)3266~3468342∗(1000),218(360),257(410),343(370)517β⁃Estradiol(17β⁃雌二醇)3407~3617285∗(1000),232(330),416(950),417(390)6Estriol(雌三醇)3940~4185345∗(1000),311(980),386(530),504(750)
*quantitative ion
2.6 回收率与精密度
采集浓缩饲料、配合饲料和预混合饲料空白样品各5份,经粉碎处理后,在样品中按高、中、低3个浓度水平添加混合标准溶液进行回收实验及精密度实验。按照“1.3”进行样品处理,采用GC-MS测定,回收率结果见表2。结果显示:浓缩饲料、配合饲料和预混合饲料的平均回收率分别为76.3%~96.3%,77.4%~90.1%和75.9%~87.4%。6种雌激素类药物的批内相对标准偏差(RSD) 为5.1%~16.9%,批间RSD为6.7%~22.7%,表明本方法具有良好的精密度。
表2 饲料中雌激素类药物的回收率及相对标准偏差
Table 2 Recoveries and relative standard deviations(RSD) of six estrogens spiked in feed samples
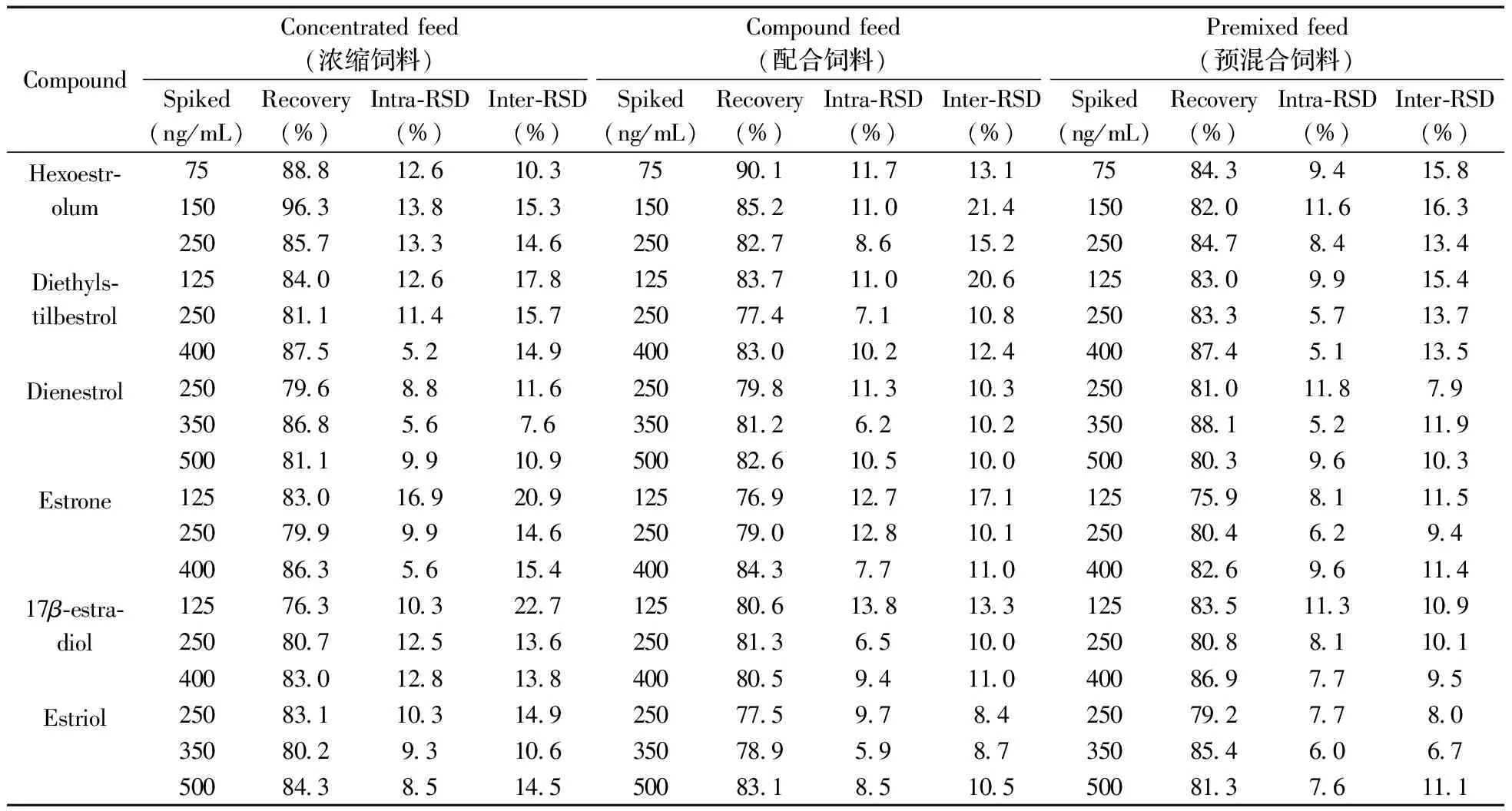
CompoundConcentratedfeed(浓缩饲料)Compoundfeed(配合饲料)Premixedfeed(预混合饲料)Spiked(ng/mL)Recovery(%)Intra⁃RSD(%)Inter⁃RSD(%)Spiked(ng/mL)Recovery(%)Intra⁃RSD(%)Inter⁃RSD(%)Spiked(ng/mL)Recovery(%)Intra⁃RSD(%)Inter⁃RSD(%)Hexoestr⁃olum751502508889638571261381331031531467515025090185282711711086131214152751502508438208479411684158163134Diethyls⁃tilbestrol1252504008408118751261145217815714912525040083777483011071102206108124125250400830833874995751154137135Dienestrol2503505007968688118856991167610925035050079881282611362105103102100250350500810881803118529679119103Estrone1252504008307998631699956209146154125250400769790843127128771711011101252504007598048268162961159411417β⁃estra⁃diol1252504007638078301031251282271361381252504008068138051386594133100110125250400835808869113817710910195Estriol250350500831802843103938514910614525035050077578983197598584871052503505007928548137760768067111
2.7 标准工作曲线与检出限
按“1.3.2”方法将混合标准液逐级稀释,配成系列混合标准工作液,按照本方法依次进行测定,以得到的峰面积(y)为纵坐标,对应的溶液浓度(x,ng/mL)为横坐标,绘制工作曲线(结果见表3)。
表3 6种雌激素的线性方程、线性范围、相关系数及检出限
Table 3 Regression equations,linear ranges,correlation coefficients(r2) and limits of detection of six estrogens
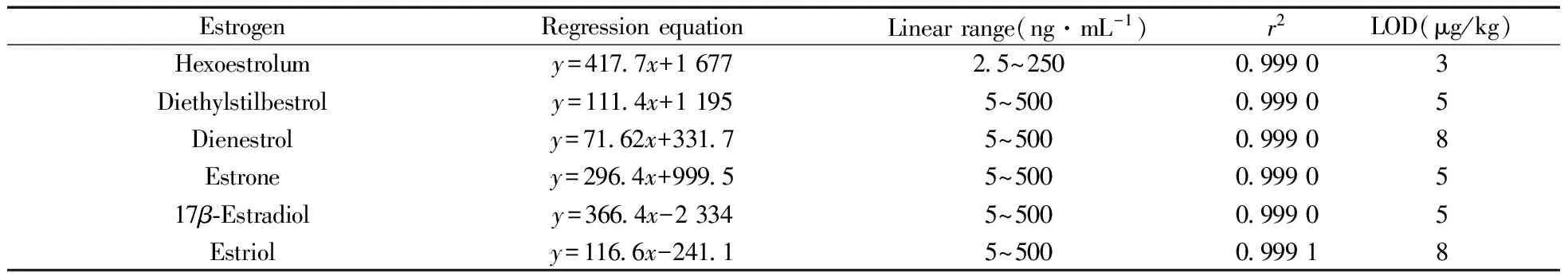
EstrogenRegressionequationLinearrange(ng·mL-1)r2LOD(μg/kg)Hexoestrolumy=4177x+167725~250099903Diethylstilbestroly=1114x+11955~500099905Dienestroly=7162x+33175~500099908Estroney=2964x+99955~50009990517β⁃Estradioly=3664x-23345~500099905Estrioly=1166x-24115~500099918
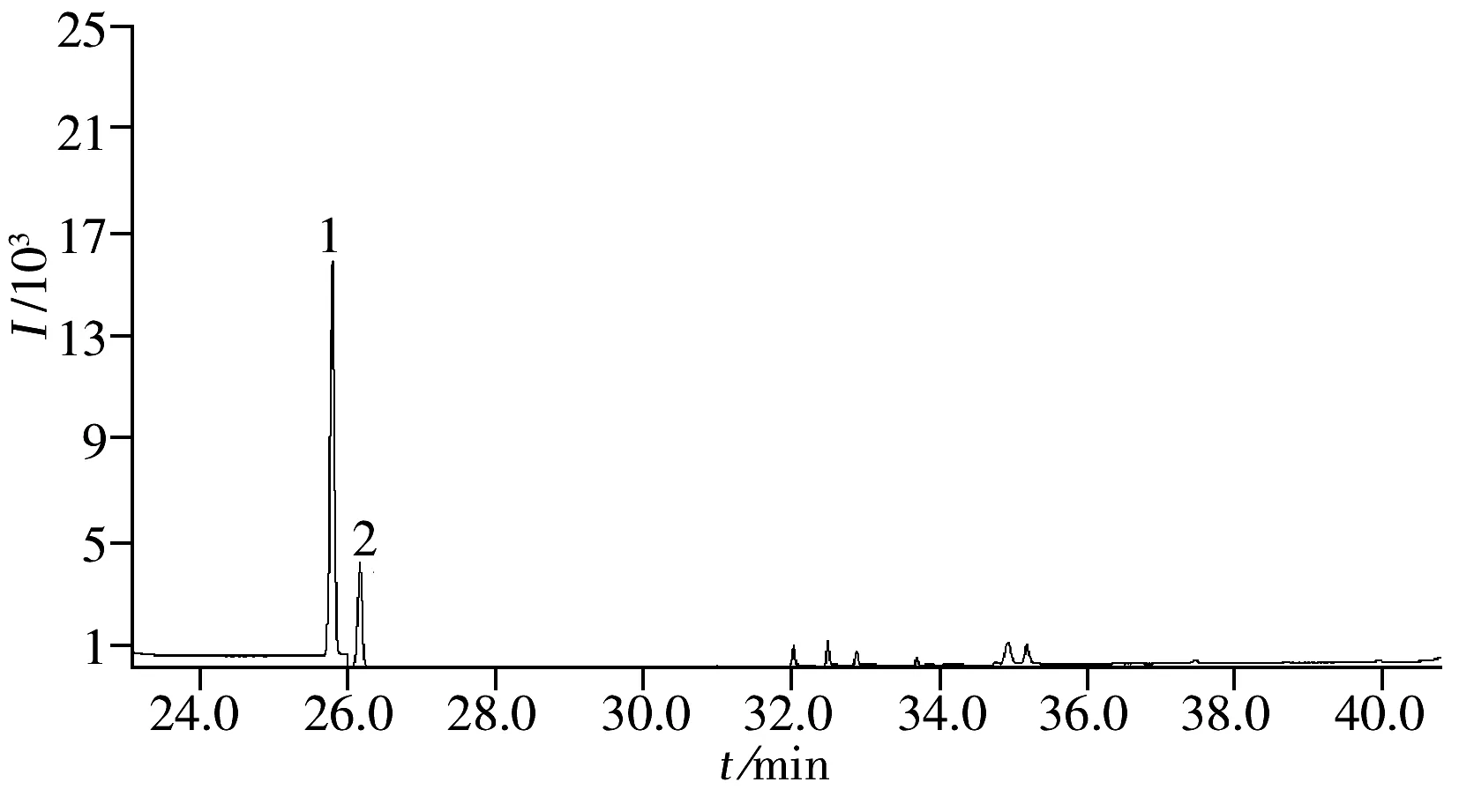
图2 实际样品的色谱图Fig.2 Chromatogram of a real sample1.hexoestrolum,2.diethylstilbestrol
由表3可知:该方法的线性范围宽,相关系数均在 0.99以上。在空白样品中添加混合标准液,以信噪比S/N≥3时空白样品中的添加浓度确定分析物的检出限(LOD)[15]。每次平行操作7次,记录对应的待测物浓度,求出平均浓度。结果表明,本方法的检出限为3~8 μg/kg,适用于饲料中6种雌激素类药物的测定。
2.8 样品的测定
依据本文建立的测定方法,对监督检测、企业委托的100份饲料进行了测定,其中1份饲料样品中检出己烷雌酚和己烯雌酚,其检出含量分别为0.37%和0.21%。其它化合物则均未检出,检出样品的图谱见图2。
3 结 论
本文建立了气相色谱-质谱同时测定饲料中6种雌激素类药物的分析方法。样品用乙醚提取后用三氯甲烷去除蛋白质,使用HLB固相萃取柱净化后进行衍生化,上机进行定量和定性分析。该方法的线性范围宽,检出限低,能够满足饲料中雌激素类药物的检测要求,可实现多种雌激素的同时测定,从而为提高检测效率、维护饲料安全、防止非法添加、确保食品安全提供了理论依据。
[1] Li X,Mu G Q,Chen L J,Jiang T M.Chin.J.Chromatogr.(李雪,牟光庆,陈历俊,姜铁民.色谱),2013,31(9):908-913.
[2] Liu H J,Yan C,Liu H G.ChinaFeed(刘红菊,闫冲,刘宏果.中国饲料),2010,5(18):34-36.
[3] Li L,Suo D C,Du H G.TheQualityandSafetyofAgriculturalProducts(李兰,索德成,杜洪鸽.农产品质量与安全),2010,2(45):35-37.
[4] Zhao C J,Gao W H.FeedRev.(赵春娟,高文惠.饲料博览),2015,32(1):37-38.
[5] Xiao Q W,Wu W L,Yang W L,Liang R,Li S B,Liu L L.Chin.J.Chromatogr.(肖全伟,吴文林,杨万林,梁润,李绍波,刘玲利.色谱),2014,32(11):1209-1213.
[6] Ministry of Agriculture of the People’s Republic of China.Announcement No.235(中华人民共和国农业部.公告第235号),http://www.moa.gov.cn/zwllm/tzgg/gg/201101/t20110113_1807253.htm.
[7] Ministry of Agriculture of the People’s Republic of China.Announcement No.176 (中华人民共和国农业部.公告第176号),http://www.moa.gov.cn/zwllm/tzgg/gg/201101/t20110113_1806.088.htm.
[8] Luo H T,Huang X L,Wu H Q,Zhu Z X,Huang F,Lin X S.J.Instrum.Anal.(罗辉泰,黄晓兰,吴惠勤,朱志鑫,黄芳,林晓珊.分析测试学报),2011,30(12):1329-1337.
[9] Xu Y J,Tian X H,Zhang X Z,Gong X H,Zhang S J,Liu H H.J.Instrum.Anal.(徐英江,田秀慧,张秀珍,宫向红,张世娟,刘慧慧.分析测试学报),2010,29(2):63-68.
[10] Kang H N,Ouyang S,Lin L,Yue Z F,Shen J C.ChinJ.Chromatogr.(康海宁,欧阳姗,林黎,岳振峰,沈金灿.色谱),2012,30(10):58-62.
[11] Zhang G S,Dong X Z,Li C,Wang A F.Chin.FoodSci.(张国胜,董学芝,李畅,王爱芳.食品科学),2008,29(2):484-485.
[12] Zhang L,Zhang L,Zhu Y L,Wang S H,Wang X.Chin.J.Chromatogr.(孙雷,张骊,朱永林,王树槐,汪霞.色谱),2008,26(6):709-713.
[13] Zhu X M,Liang B,Tang Y,Zhang J,Nan Y Q,Xu N N,Wu Z Q,Wang D L.AnimalHusbandryandFeedScience(祝秀梅,梁斌,唐煜,张憬,南玉琴,许妮妮,吴志奇,王登临.畜牧与饲料科学),2015,16(3):35-37.
[14] Wu H Q,Huang F,Lin X S,Deng X,Ma Y F,Huang X L.J.Instrum.Anal.(吴惠勤,黄芳,林晓珊,邓欣,马叶芬,黄晓兰.分析测试学报),2008,27(10):32-35.
[15] Zhao J Z.Int.J.Lab.(赵建忠.国际检验医学杂志),2011,(10):64-68.
Simultaneous Determination of Six Estrogens in Feed by Gas Chromatography-Mass Spectrometry
LIN Xiao-li*,LI Ning,HUO Feng,DONG Yan-feng,PENG Wei
(Institute of Veterinary Drug and Food Control in Harbin,Harbin 150010,China)
A method was developed for the simultaneous determination of hexoestrolum,diethylstilbestrol,dienestrol,estrone,17β-estradiol and estriol in feed by solid phase extraction and gas chromatography-mass spectrometry(GC-MS).After extracted with ethyl ether and cleaned-up on an HLB phase extraction column,six kinds of estrogens were derived and quantified by GC-MS.The external standard calibration curves were used for the quantification.The results showed that the high linear ranges from 2.5 ng/mL to 250 ng/mL for hexoestrolum and from 5 ng/mL to 500 ng/mL for five other estrogens were obtained with correlation coefficients (r2) not less than 0.99.The limits of detection were in the range of 3-8 μg/kg and the average recoveries were 75.9%-96.3%.The results demonstrated that the developed method could be applied in the qualitative and quantitative determination of six kinds of estrogens in feed with low limit of detection and high accuracy.
gas chromatography-mass spectrometry(GC-MS);hexoestrolum;diethylstilbestrol;dienestrol;estrone;17β-estradiol;estriol;feed
2015-06-17;
2015-09-21
哈尔滨市科技攻关计划(2014AB3BN041)
10.3969/j.issn.1004-4957.2016.03.011
O657.63;O629.8
A
1004-4957(2016)03-0322-05
*通讯作者:林小莉,高级工程师,研究方向:兽药及兽药残留检测管理,Tel:0451-84300879,E-mail:y84300879@126.com
