海捕野生大黄鱼选育子代生长性能及现实遗传力分析
2016-12-20黄伟卿韩坤煌陈仕玺周绍峰周瑞发
黄伟卿,韩坤煌,陈仕玺,张 艺,周绍峰,周瑞发,罗 芬
( 1.大黄鱼育种国家重点实验室,福建 宁德 352103; 2.宁德市鼎诚水产有限公司,福建 宁德 352100;3.厦门大学 海洋与地球学院, 福建 厦门 361102; 4.宁德市水产技术推广站,福建 宁德 352100; 5.宁德市南海水产科技有限公司,福建 宁德 352102; 6.宁德师范学院 生物系,福建 宁德 352100 )
海捕野生大黄鱼选育子代生长性能及现实遗传力分析
黄伟卿1,2,韩坤煌1,陈仕玺3,张 艺4,周绍峰5,周瑞发5,罗 芬6
( 1.大黄鱼育种国家重点实验室,福建 宁德 352103; 2.宁德市鼎诚水产有限公司,福建 宁德 352100;3.厦门大学 海洋与地球学院, 福建 厦门 361102; 4.宁德市水产技术推广站,福建 宁德 352100; 5.宁德市南海水产科技有限公司,福建 宁德 352102; 6.宁德师范学院 生物系,福建 宁德 352100 )
以海捕野生大黄鱼为基础群体进行选择育种,其子代与网箱养殖选育群体子代进行比较分析。研究结果显示,野生群体的受精率虽小于对照群体,但孵化率却显著高于对照群体(P<0.05);野生群体的质量绝对增加率[(0.02±0.004) g/d~(0.26±0.081) g/d]、绝对增长率[(0.02±0.008) cm/d~(0.11±0.009) cm/d]、增积量(0.007±0.005~0.153±0.015)和肥满度(1.66±0.18~1.97±0.29)等生长性能均优于对照群体。野生群体的生长性状一开始就显现出现实遗传力,体长和体质量的现实遗传力分别为0.027~0.185和0.001~0.040。对野生群体进行良种群体选育时可以提早根据体长和体质量进行苗种选择淘汰,将节省大量的选育时间和避免后期操作的不便,但野生群体现实遗传力较低,选育应该结合家系选择和家系内选择进行。
野生;大黄鱼;生长性能;现实遗传力
大黄鱼(Pseudosciaenacrocea)俗称黄花鱼,属于鲈形目、石首鱼科、黄鱼属,为我国特有的中下层暖温性近海集群洄游鱼类,主要分布于南海、东海和黄海南部,原居我国海洋四大主捕对象之首[1-2]。因其口唇朱红、体色金黄而象征吉祥富贵,倍受国民青睐,是人类较为理想的动物性蛋白源[3]。以往对大黄鱼种质资源保护不够重视,人为的酷渔滥捕致使其资源枯竭[4]。为此,福建省有关部门立项“大黄鱼人工繁殖及育苗技术研究”并于“六五”期间首获成功。经过30多年养殖的发展,至2014年,我国已实现年产大黄鱼1.27917×105t,大黄鱼已成为我国最大规模的海水网箱养殖鱼类和八大优势出口养殖水产品之一。但在大黄鱼养殖业快速发展的同时,出现了累代近亲繁殖导致其生长性能、形态特征、抗逆性能降低等现象[5-9]。而海捕野生大黄鱼群体在遗传特性、营养结构、形态特征、抗逆性能等方面均优于养殖大黄鱼群体[10-13],因而以海捕野生大黄鱼为基础资源,对整个大黄鱼群体进行遗传性状改良和良种选育具有现实意义。
鱼类的生长过程、方式和特点,是遗传型所决定的生长潜力的结果,而遗传力可作为揭示和研究数量性状的遗传规律,对制定和优化育种方案、正确评定育种值、探讨选育效果具有重要指导意义。本研究采用海捕野生大黄鱼为选育对象并以养殖群体选育子代作为对照,通过对不同生长时期体长和体质量的生长性能进行对比分析,以期为大黄鱼选择育种提供必要的基础依据和技术参数。
1 材料与方法
1.1 试验用鱼
2009年从福建宁德市三都湾东冲口自然海域捕捞平均体长(16.47±1.81) cm、平均体质量(81.97±27.40) g的海捕野生大黄鱼作为野生基础群体,在海水网箱经中间培育。至2014年2月,从该野生基础群体中随机取100尾进行生物学测定,群体体长26.3~38.5 cm,平均体长(34.39±3.53) cm,体质量458~1270 g,平均体质量(802.83±168.79) g。同年3月,从上述基础群体中挑选优质成熟亲鱼(选择标准为个体大、体色金黄、活力强)700尾进行人工繁育,随机抽取50尾亲鱼进行生物学测定,体长33.8~50.6 cm,平均体长(38.11±3.10) cm。体质量520~1350 g,平均体质量(928.13±231.75) g。
同期从海水网箱中随机挑选经2代人工选育的大黄鱼亲鱼700尾,作为养殖基础群体进行人工繁育,随机抽取50尾亲鱼进行生物学测定,体长32.0~39.5 cm,平均体长(35.92±1.58) cm。体质量624.5~1058.5 g,平均体质量(788.43±100.49) g。
1.2 饲养管理与跟踪
经过2个月的育苗池培育,大黄鱼幼鱼平均体长达(2.1±0.03) cm,体质量(0.05±0.003) g,将野生和对照组放置于水质条件符合NY 5052-2001《无公害食品海水养殖用水水质标准》要求的同一海域的海上网箱养殖,不同群体隔离放养,每个群体设3个重复组,每组5万尾。饲料均采用上海“农好”牌膨化颗粒饲料(粗蛋白质≥49.0%,粗灰分≤17.0%,粗纤维≤2.0%,钙≤5.0%,总磷≥1.2%,氯化钠≤4.0%,粗脂肪≥5.0%,赖氨酸≥2.2%,水分≤11.0%)。每日8:00和16:00各投喂一次,按鱼体质量的2%~5%投喂,并视摄食情况酌情调整,同时对其体长和体质量生长性状进行跟踪和比较分析。
1.3 生物学测量
1.3.1 受精卵直径和油球直径
用经台微尺校对后的OLYMPUS CX31显微镜随机测定各群体100个清晰可见的受精卵直径和油球直径。
1.3.2 体长和体质量测量
参照刘贤德等[14]的方法,每月7日,在海上网箱养殖基地,定点、定时对野生及对照组进行取样。每个群体设置3个重复组,每个重复组随机取34尾样品,并用量鱼板(精度0.1 cm)和电子天平(精度0.1 g)分别测定体长和体质量。
1.4 生物学统计
1.4.1 受精率与孵化率
受精率/%=(N1/N2)×100%
孵化率/%= (n1/n2)×100%
式中,N1为鱼体所产受精卵的总数量,N2为鱼体所产卵的总数量;n1为实际孵出鱼苗的数量,n2为所用受精卵应孵出鱼苗的数量。
1.4.2 部分生长性能统计公式[15]
质量绝对增加率/g·d-1=(m2-m1)/(t2-t1)
绝对增长率/cm·d-1=(L2-L1)/(t2-t1)
增积量= (m2-m1)(L2-L1)/(t2-t1)2
肥满度=m/L3×100
式中,m为体质量(g),L为体长(cm),m1、m2和L1、L2分别为时间t1、t2时的体质量(g)和体长(cm)。
1.4.3 现实遗传力[16]
现实遗传力=(选择群体平均值-对照群体平均值)/(选择强度×对照群体标准差)
1.5 数据分析
数据统计分析采用SPSS 17.0处理软件处理。用独立样本T检验对不同样本间的卵径、油球径、受精率、孵化率、体长和体质量进行显著性差异检验,用单因素方差分析对同一群体体长、体质量进行显著性差异检验。
2 结 果
2.1 卵子直径、受精率、孵化率和油球直径比较分析
测量结果表明,野生群体的卵子直径略大于对照群体,但两者之间差异不显著(P>0.05);而野生群体的油球直径显著小于对照群体(P<0.05);相比之下,虽然野生群体的受精率小于对照群体,但孵化率却显著高于对照群体(P<0.05)(表1)。
2.2 不同群体间相关生长性能比较分析
野生群体质量绝对增加率为(0.02±0.004) g/d ~(0.26±0.081) g/d, 270日龄达到最大,除150日龄和210日龄外,野生群体体质量增长速度均大于对照群体; 180日龄时,极显著大于对照群体(P<0.01),在240日龄和279日龄时,显著大于对照群体(P<0.05)(图1a)。
野生与对照群体的绝对增长率均在270日龄达到最大值,分别为(0.11±0.009) cm/d和(0.08±0.007) cm/d,在300日龄为最小值,分别为(0.02±0.008) cm/d和(0.01±0.008) cm/d。除120日龄和240日龄外,野生群体的体长增长速度均快于对照群体;在180日龄时,野生群体体长增长速度极显著快于对照群体(P<0.01),在270日龄,体长生长速度显著快于对照群体(P<0.05)(图1b)。
野生群体的增积量为0.007±0.005~0.153±0.015,对照群体维持在0.003±0.001~0.104±0.015。 2个群体的增积量均在270日龄达到最大,且在270日龄之前保持比较小的增积量;野生群体在150日龄和180日龄,体长和体质量的生长速度极显著大于对照群体(P<0.01)(图1c)。
野生群体的肥满度保持在1.66±0.18~1.97±0.29,均比对照群体低,在150日龄和300日龄,肥满度极显著低于对照群体(P<0.01),在120日龄和210日龄,肥满度显著低于对照群体(P<0.05)(图1d)。
2.3 海捕野生大黄鱼群体遗传力分析
经统计,野生群体与对照群体在270日龄之前,体长生长呈现显著差异(P<0.05),300日龄,体长差异不显著(P>0.05);野生群体在150日龄,体长极显著大于对照群体(P<0.01),在180日龄,体长显著大于对照群体(P<0.05);野生群体的体长现实遗传力为0.027~0.185,270日龄达到最大(表2)。
野生群体与对照群体在240日龄之后体质量生长呈现显著性差异(P<0.05);野生群体在150日龄和180日龄,体质量的生长速度极显著大于对照群体(P<0.01);野生群体体质量的现实遗传力均较低,但是从一开始就显现出来,为0.001~0.040,270日龄达到最大(表3)。

表1 2个不同大黄鱼群体的卵子直径、油球直径以及受精率孵化率
注:*表示不同群体差异显著(P<0.05).




表2 海捕野生大黄鱼选育群体体长遗传力统计情况
注:不同的字母表示同一群体差异显著(P<0.05);*表示不同群体差异显著(P<0.05),**表示不同群体差异极显著(P<0.01).下同.
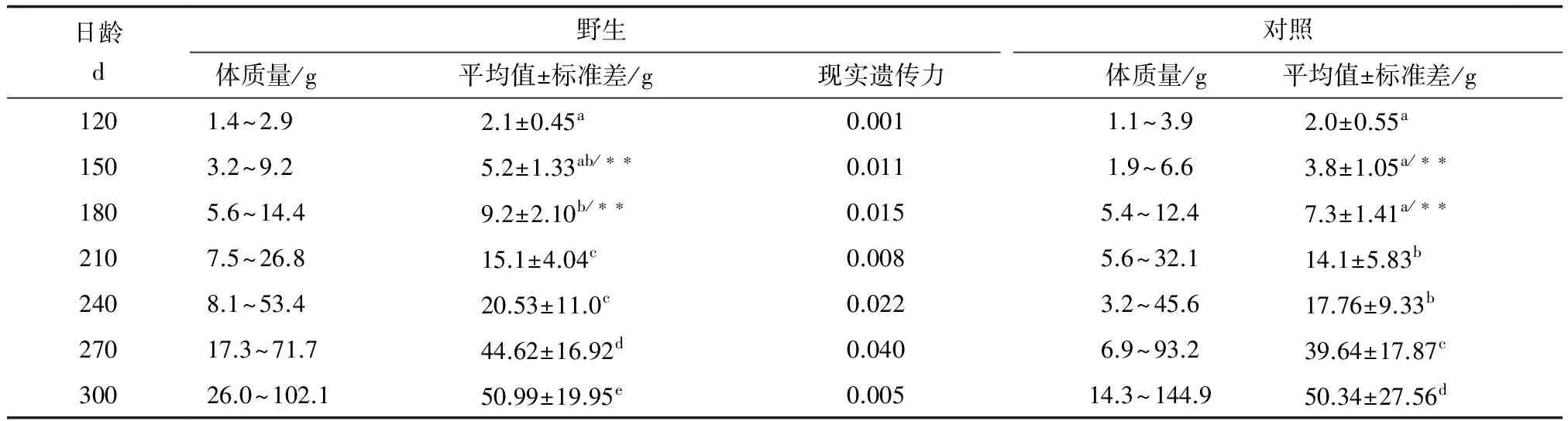
表3 海捕野生大黄鱼选育群体体质量遗传力统计情况
3 讨 论
3.1 大黄鱼体长和体质量的遗传力
遗传力反映的是亲本性状遗传给子代的能力,遗传力高的性状,子代可继承的性状可能性就高,选择效果就越明显,反之则较难。王晓清等[17]通过大黄鱼15 个半同胞家系鱼苗对低盐、低溶氧和低pH 值水体的抗性试验,采用半同胞组内相关法,对大黄鱼耐各环境因子遗传力进行了估计。结果表明,大黄鱼对耐低溶氧、低盐和低pH 值的遗传力估计值分别为0.23、0.10 和0.23。王晓清等[18]构建了5个半同胞家系和15个全同胞家系,应用全同胞组内相关法估计40日龄大黄鱼的体长和体质量的遗传力,结果表明,大黄鱼鱼种阶段体质量和体长遗传力分别为0.29和0.31。黄伟卿等[19]对2个养殖大黄鱼选育群体的子二代生长性状进行分析,结果表明,10~13月龄XY2012-JC-F2体长现实遗传力为0.228~0.364、体质量的现实遗传力为0.131~0.243,XY2012-XP-F2体长现实遗传力为0.193~0.265、体质量的现实遗传力为0.126~0.134。本次通过以海捕野生大黄鱼为选育基础群体为研究对象,统计了0~300日龄各个阶段的现实遗传力,结果体长现实遗传力为0.027~0.185,体质量为0.001~0.040,相较已有的研究结果,两个生长性状的现实遗传力均明显偏小,但与已报道的虹鳟(Oncorhynchusmykiss)[20-24]体长遗传力(0.16~0.37)和体质量遗传力(0.06~0.29)、大西洋鲑(Salmosalar)[25-26]的体长遗传力(0.12~0.28)和体质量遗传力(0.08~0.37)等鱼类相当。笔者认为这主要与其生长阶段、环境差异、样品来源及取样条件等有关。
3.2 大黄鱼生长性能分析
本研究对比了0~300日龄的野生与对照群体体长与体质量的生长速度,结果表明,虽然野生群体质量绝对增加率在150日龄和210日龄、绝对增长率在120日龄和240日龄及增积量在210日龄均低于对照群体,但其他阶段的体长与体质量生长速度均较快,说明野生群体具有较大的经济养殖和优良品种选育的潜力。李明云等[15]采用官井洋与岱衢洋网箱养殖的大黄鱼,通过自交以及正反向杂交子代0~526 日龄进行生长特性观察,大黄鱼质量绝对增加率随着养殖时间增加而增大,此次观察结果并未出现如此规律效果,但其发现,大黄鱼绝对增长率在270日龄呈最高水平,各子代绝对增长率呈波动趋势一致,笔者认为造成这一现象的主要原因与所选群体及养殖环境有着密切的关系。
肥满度常用作衡量鱼体肥满程度、营养状况和环境条件的指标[27],肥满度越高,体型越肥胖。养殖大黄鱼普遍肥胖,脂肪含量高[28],不受消费者青睐,使售价远远低于野生大黄鱼,所以解决养殖大黄鱼肥胖问题很早就引起了人们的关注。本次使用海捕野生大黄鱼群体进行选育子代生长的跟踪研究发现,野生群体肥满度均比对照群体小,说明野生群体遗传了亲本体型修长等良好品质,采用海捕野生鱼作为选育对象,其子代效果更佳。
3.3 对大黄鱼遗传育种的指导意义
通过对野生群体统计结果显示,质量绝对增加率、绝对增长率、增积量和肥满度生长特性均优于对照群体,表明用海捕野生群体作为基础群体进行选择育种更有利于优良品性及生长性能的改良。
刘贤德等[14]研究了大黄鱼各形态性状对体质量的影响,测定了272尾7月龄闽—粤东族大黄鱼的全长、体长、头长、眼后头长、躯干长、体高、尾柄长、尾柄高和体质量,计算相关系数,采用通径分析方法计算了以体质量为依变量、其他性状为自变量的通径系数和决定系数。结果表明,头长对体质量的直接影响最大(0.429),其次分别为体长(0.242)、躯干长(0.136)、体高(0.113)和尾柄高(0.079)。在全长、体长、头长等8个性状中,以头长、体长对体质量的直接作用较大,显著高于其他几个性状对体质量的直接作用,说明体长和头长是影响幼鱼体质量的最重要的早期性状,体长和头长的共同决定系数最大。体质量的变异系数在所有的9个性状中最大,而全长、体长和头长的变异系数较小。据此,他们认为在选择育种的时候,可根据体长性状进行选种,从而对体质量进行间接选择。这样可以最大程度地减少环境的影响,保证选择的有效性与稳定性。黄伟卿等[19]统计2个网箱养殖选育群体F2体质量与体长遗传力,得出体长和体质量性状选择时应放在稍后一些的时期进行,两者往往在生长后期[体长(16.59±2.06) cm,体质量(56.06±25.22) g]才开始显现。而本次研究统计了野生群体体长与体质量的现实遗传力,发现该群体选育子代一开始就显现出现实遗传力,故以海捕野生大黄鱼为选育对象进行良种选育时,可以提早根据体长和体质量的生长性能进行苗种选择淘汰,节省选育时间。考虑到野生群体现实遗传力较低,建议选育应该结合家系选择和家系内选择进行。
[1] 黄伟卿,张艺,柯巧珍,等.大黄鱼选育子二代生长性状研究[J].南方水产科学, 2013,9(3):14-19.
[2] 黄伟卿.淡水养殖大黄鱼技术初探[J].水产科学,2015,34(5):327-330.
[3] 黄勤,陈曦,杨金先,等.福建养殖大黄鱼(Pseudosciaenacrocea)RAPD标记及多态性调查[J].福建农业学报,2007,22(2):130-135.
[4] 丁诗华,黄丽英,张海琪,等.大黄鱼(Pseudosciaenacrocea)岱衢洋选育群体和官井洋养殖群体的遗传差异分析[J].海洋与湖沼,2006,37(1):41-46.
[5] 王军,全成干,苏永全,等.官井洋大黄鱼遗传多样性的RAPD分析[J].海洋学报,2001,23(3):87-91.
[6] 王娟,封永辉,蔡立胜,等.来自大黄鱼(Pseudosciaenacrocea)肠道的弧菌拮抗菌的筛选与鉴定[J].海洋与湖沼,2010,41(5):707-713.
[7] 黄振远,苏永全,张建设,等.闽粤群和岱衢群养殖大黄鱼(Pseudosciaenacrocea)及其杂交子代遗传差异的SSR分析[J].海洋与湖沼,2011,42(4):592-596.
[8] 郑炜强,黄伟卿,韩坤煌,等. 大黄鱼选育群体与野生群体杂交F1生长性状研究[J].水产科学, 2014,33(11):667-673.
[9] 刘招坤. 大黄鱼群体选育世代F1和F2生长比较分析[J]. 水产科学,2015,34(1):38-42.
[10] 刘必谦,董文琦,王亚军,等.岱衢族大黄鱼种质的AFLP分析[J].水生生物学报,2005,29(4):413-416.
[11] 徐继林,严小军,罗瑜萍,等.岱衢族野生大黄鱼与养殖大黄鱼肌肉脂类和脂肪酸组成的比较研究[J].中国食品学报,2008,8(1):108-114.
[12] 陈慧,陈武,林国文,等.官井洋种群网箱养殖大黄鱼的形态特征与生长式型[J].海洋渔业,2007,29(4): 331-336.
[13] 苗亮,李明云,陈炯,等. 快长、耐低温大黄鱼新品种东海1号的选育[J].农业生物技术学报,2014,10(4): 1314-1320.
[14] 刘贤德,蔡明夷,王志勇,等.闽—粤东族大黄鱼生长性状与通径分析[J].中国海洋大学学报:自然科学版, 2008,38(6):916-920.
[15] 李明云,胡玉珍,苗亮,等.岱衢洋和官井洋大黄鱼自交与杂交子代生长性能及杂交优势分析[J].水产学报,2010,34(6):859-864.
[16] 吴仲庆.水生生物遗传育种学[M].厦门:厦门大学出版社,2000:138-140.
[17] 王晓清,王志勇,何湘蓉.大黄鱼(Larimichthcrocea)耐环境因子试验及其遗传力的估计[J].海洋与湖沼,2009,40(6):781-785.
[18] 王晓清,王志勇,何湘蓉.大黄鱼40日龄体长和体重遗传力估计[J].集美大学学报:自然科学版,2010,15(1):8-13.
[19] 黄伟卿,刘招坤,郑昇阳,等.2个大黄鱼群体选育世代F2生长性状研究[J].水生态学杂志,2014,35(2):80-84.
[20] Aulstad D, Gjedrem T, Skjervold H. Genetic and environmental sources of variation in length and weight of rainbow trout (Salmogairdneri) [J]. Fish Res Board Can, 1972, 29(3):237-341.
[21] Refstie T. Genetic and environmental sources of variation in body weight and length of rainbow trout fingerlings [J]. Aquaculture, 1980, 19(4):351-357.
[22] Gunnes K, Edrem T. A genetic analysis of body weight and length in rainbow trout reared in seawater for 18 months [J]. Aquaculture, 1981, 24(1/2):161-174.
[23] Mckay L R, Ihssen P E, Friars G W. Genetic parameters of growth in rainbow trout,Salmogairdneri, as a function of age and maturity[J]. Aquaculture, 1986, 58(3/4):241-254.
[24] Hyums K, Nobuyuki I, Akihiro K. Estimation of heritability for growth by factorial mating stem in rainbow trout (Oncorhynchusmykiss) [J]. Suisanzoshoku, 2001, 49(2):243-251.
[25] Gunnes K, Edrem T. Selection experiments with salmon Ⅳ: growth of Atlantic salmon during two years in the sea [J]. Aquaculture, 1978, 15(1):19-33.
[26] Refstie T, Steine T A. Selection experiments with salmonⅢ: genetic and environmental sources of variation in length and weight of Atlantic salmon in the freshwater phase [J]. Aquaculture, 1978,14(3):221-234.
[27] 陈琳,张达云,郑凯宏,等.岱衢族和闽-粤东族大黄鱼生长对比试验[J].科学养鱼,2007(8):25-26.
[28] 徐镇,江锦坡.不同品系大黄鱼致死低温的研究[J].宁波大学学报,2006,19(4):462-464.
RealizedHeritabilityandGrowthofOffspringsofWildLargeYellowCroakerPseudosciaenacrocea
HUANG Weiqing1,2, HAN Kunhuang1, CHEN Shixi3, ZHANG Yi4, ZHOU Shaofeng5, ZHOU Ruifa5, LUO Fen6
( 1. State Key Laboratory of Large Yellow Croaker Breeding,Ningde 352103, China; 2.Ningde Dingcheng Fishery Company Limited, Ningde 352100, China; 3. College of Ocean and Earth Sciences, Xiamen University, Xiamen 361102, China; 4. Fishery Technology Promotion Station, Fishery Department of Ningde, Ningde 352100, China; 5. Ningde Nanhai Aquatic Products Technology Company Limited , Ningde 352102, China;6. Department of Bioengineering, Ningde Normal University, Ningde 352100, China )
The growth performance and realized heritability were compared in offsprings of wild and sea cage-reared large yellow croakerPseudosciaenacrocea. The results showed that the wild large yellow croaker had lower fertilization rates than the sea cage-reared did, but significant higher hatching rates than the sea cage-reared did (P<0.05). There were higher absolute growth rates in body weight [(0.02±0.004) g/d — (0.26±0.081) g/d], absolute growth rate in body length [(0.02±0.008) cm/d — (0.11±0.009) cm/d, daily length and weight increment (0.007±0.005 — 0.153 ± 0.015), and condition factor(1.66±0.18 — 1.97±0.29) in the wild large yellow croaker than those in the sea cage-reared. The realized heritability was 0.027 — 0.185 in body weight and 0.001—0.040 in body length. The findings indicate that selective breeding program for wild population is very promising, but family selection and within-family selection should be combined due to the relatively low realized heritability.
wild;Pseudosciaenacrocea; growth trait; realized heritability
10.16378/j.cnki.1003-1111.2016.03.002
S917
A
1003-1111(2016)03-0204-06
2015-06-30;
2015-10-23.
福建省自然科学基金资助项目(2015J06019);福建省科技平台建设项目(2015N2002);福建省海洋生物资源开发利用协同创新中心产学研基金资助项目(FJMBIO1502);宁德师范学院创新团队项目(2015T10).
黄伟卿(1988-),男,助理工程师;研究方向:鱼类遗传育种及增养殖.E-mail:07huangweiqing@163.com.通讯作者:韩坤煌(1984-),男,博士研究生;研究方向:鱼类遗传育种及增养殖.E-mail: hankunhuang@foxmail.com.
