局部中晚期鼻咽癌四程诱导化疗后肿瘤靶区勾画的研究
2016-12-20王蕾吴峥程皖琴周树钟睿曾睿芳苏勇
王蕾吴峥程皖琴周树钟睿曾睿芳苏勇
·临床研究与应用·
局部中晚期鼻咽癌四程诱导化疗后肿瘤靶区勾画的研究
王蕾①吴峥②程皖琴③周树①钟睿①曾睿芳④苏勇①
目的:探讨根据诱导化疗后肿瘤变化勾画靶区的方式及其临床疗效。方法:回顾性分析2009年8月至2013年8月中山大学肿瘤防治中心57例局部中鼻咽癌患者,行诱导化疗联合同期放化疗。诱导化疗前后鼻咽原发肿瘤范围(gross tumor volume,GTV)(包括咽后淋巴结)分别为GTVnx-pre和GTVnx-post。临床靶区(clinical tumor volume,CTV)CTVnx1为GTVnx-post外扩10 mm范围,并包括GTVnx-pre的区域。颈部淋巴结的靶区勾画与上述方法相似,分别命名为GTVnd-pre、GTVnd-post和CTVnd1。CTV2为CTVnx1及CTVnd1外扩5 mm~10 mm范围及淋巴引流选择性预防照射范围。观察全组患者不良反应、近期及远期疗效。结果:GTVnx-pre和GTVnx-post平均体积分别为63.7 cm3和21.8 cm3(P<0.01);GTVnd-pre和GTVnd-post平均体积分别为21.7 cm3和7.5 cm3(P<0.01)。中位随访时间60.0个月,全组患者5年总生存率(overall survival,OS)为86.0%(49/57),无远处转移生存率(distant metastasis free survival rate,DMFS)为91.2%(52/57),无局部复发生存率(local recurrence survival rate,LRFS)为93.0%(53/57),无进展生存率(progression free survival,PFS)为93.0%(53/57),复发患者均为GTVnx-post或GTVnd-post内复发。结论:鼻咽癌4个疗程诱导化疗后肿瘤体积明显缩小,按化疗后肿瘤勾画靶区疗效较好,值得进一步验证。
鼻咽癌 诱导化疗 调强放射治疗 靶区勾画 临床疗效
鼻咽癌高发于中国华南地区和东南亚地区[1],大部分为非角化性鳞状细胞癌及未分化癌[2],对放疗及化疗较敏感,放射治疗为其首选治疗方法。随着放疗技术的发展,适型调强放射治疗(intensity modulat⁃ed radiation therapy,IMRT)已成为鼻咽癌的主要放疗方法[3-4],局部区域中晚期鼻咽癌的局控率已得到显著提高,但远处转移率仍高达15%~19%[1]。对鼻咽癌综合治疗的Meta分析认为[5-6],化疗对鼻咽癌的治疗优势主要体现在同期化疗中。因此,以铂类为主的同期放化疗已成为局部中晚期鼻咽癌的首选治疗方案[5-7],但其5年无远处转移生存率(distant metasta⁃ses-free rate,DMFS)仅为65%~75%[8-9]。为进一步提高鼻咽癌的疗效,关于鼻咽癌诱导化疗的研究越来越受到关注。目前,鼻咽癌一般采用PF或TPF方案进行2~3个疗程诱导化疗,患者生存获益尚存争议[10-13]。本研究对初诊局部区域中晚期鼻咽癌患者开展4个疗程诱导化疗的前瞻性临床研究。在研究中,诱导化疗后肿瘤不同程度退缩,肿瘤体积、位置发生变化,正常组织也有不同程度修复,这为放疗靶区设计带来挑战。《放射肿瘤学的原理与实践》第4版、第5版认为应按诱导化疗前的肿瘤范围勾画,Salama等[14]提出相似观点,并提出即使肿瘤诱导化疗后达到完全缓解(complete remission,CR),也不降低照射剂量。然而,肿瘤负荷与所需根治剂量密切相关[15],随着诱导化疗后肿瘤缩小,原肿瘤外围区域肿瘤细胞密度已明显下降减少,肿瘤负荷相应降低,杀灭肿瘤所需的根治剂量也应可相应减少。如仍然按上述观点勾画诱导化疗后肿瘤靶区显然存在不合理之处。为此,本研究自2006年进行相关的预试验研究[16],并自2009年以来开展鼻咽癌4个疗程诱导化疗后IMRT靶区勾画的研究。
1 材料与方法
1.1病例资料
回顾性分析2009年8月至2013年8月中山大学肿瘤防治中心57例局部中晚期鼻咽癌患者,行诱导化疗联合同期放化疗,其中男性47例、女性10例。中位年龄为44(26~65)岁。入组标准:经病理确诊为WHOⅡ~Ⅲ型的鼻咽癌的18~65岁初治患者;临床分期为Ⅲ~Ⅳ期(AJCC第6版分期);KPS评分≥80分;白细胞≥4.0×109/L,中性粒细胞≥2.0×109/L,血红蛋白≥90 g/L,血小板≥100×109/L;肝功能各项指标均在正常值上限的2倍范围内,肾肌酐清除率≥60 mL/min;影像学检查证实无远处转移。排除标准:妊娠期、哺乳期妇女;曾经接受过放疗或化疗;严重精神疾患,认为无法完全或充分理解本研究可能存在的并发症。本研究经过被研究对象或其家属知情同意并得到医院伦理委员会批准。
1.2方法
1.2.1诱导化疗及同期化疗诱导化疗方案:PF顺铂(DDP)剂量80 mg/m2,化疗第1天静脉滴入;氟尿嘧啶(5-FU)剂量750 mg/(m2·d),第1~5天,持续120 h静脉灌注;每3周1个疗程,共行4个疗程。同期化疗方案:DDP单药剂量30 mg/m2,化疗第1天静脉滴入,每周1个疗程,共行6个疗程。本组患者均行2个疗程诱导化疗后结合影像学及电子鼻咽镜检查结果观察患者肿瘤变化情况,若诱导化疗后肿瘤变化不明显则终止诱导化疗,行同期放化疗,否则继续行诱导化疗,4个疗程诱导化疗结束3周后行同期放化疗。
1.2.2放射治疗全部患者接受根治性外照射。患者在诱导化疗后1~2周行面颈肩热塑面罩固定,CT模拟定位扫描[17],MRI及电子鼻咽镜等检查。CT扫描图像传输至IMRT工作站的逆向治疗计划系统(Monaco 3.0)后,根据患者诱导化疗前后临床检查、影像学检查及电子鼻咽镜检查对比结果进行靶区勾画。由Eclipse 10.0或Monaco 3.0逆向计划系统进行计算优化,计划主要评价指标参照RTOG 0225、RTOG 0615及本院计划评定标准[18],口腔及涎腺的评价指标参照本组研究标准[19]。其中靶体积主要评价指标为:PTVnx-post及PTVnd-post:V100>95%或至少V95>95%,且V110<10%。治疗计划最终由临床医师与物理师共同讨论通过。计划经质量控制和质量保证的验证后,通过直线加速器实施。
1.2.3靶区勾画和剂量GTVnx-pre和GTVnd-pre、GTVnx-post和GTVnd-post分别为诱导化疗前后临床和影像学检查可见的GTV(包括咽后淋巴结)和颈部转移淋巴结。CTVnx1为GTVnx-post加外扩10 mm范围,并包括GTVnx-pre的区域;CTVnd1为GTVndpost加外扩5~10 mm范围,并包括诱导化疗前颈部转移淋巴结侵犯区域。CTV2为CTVnx1和CTVnd1加外扩5 mm范围,并包括所需预防照射的淋巴引流区(图1)。PTV由系统按不确定性因素自动生成[20-21]。采用同期加速推量放疗(simultaneous modulated ac⁃celerated radiation therapy boost,SMART Boost)方法予靶区处方剂量,PTVnx-post为68 Gy;PTVnd-post为63~66 Gy;PTVnx1为60 Gy;PTVnd1为60 Gy;PTV2为50 Gy;分30次照射,1次/d,5 d/周。
1.2.4观察指标远期疗效指标采用OS、DMFS、无局部复发生存率(local recurrence survival rate,LRFS)及复发患者肿瘤复发情况评价。每程诱导化疗结束后10~14 d行临床检查、电子鼻咽镜检查,2个疗程及4个疗程化疗后行鼻咽和颈部MRI检查,评估诱导化疗的疗效。全程治疗结束及治疗后第1年每3个月,第2年每3~6个月,第3年及以后每6个月进行临床、鼻咽及颈部MRI检查以评价肿瘤疗效。治疗期间定期复查血常规、肝、肾功能及行电子鼻咽镜检查记录肿瘤变化。
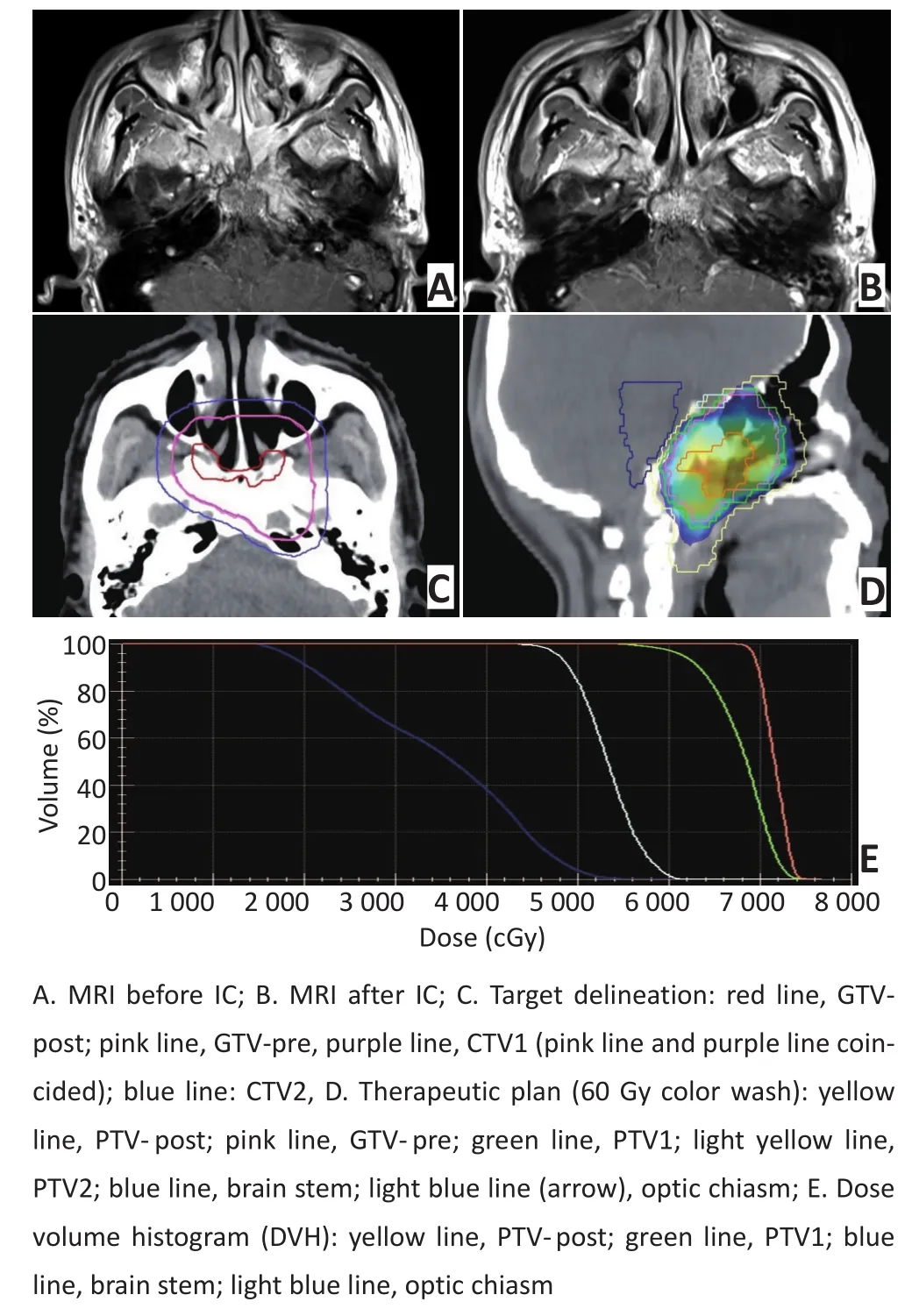
图1 靶区勾画示意图Figure 1Example of target delineation
1.3统计学分析
采用SPSS 20.0软件进行统计学分析,连续型变量采用t检验,生存分析应用Kaplan-Meier法。双侧检验,检验标准α=0.05。
2 结果
2.1诱导化疗及同期化疗完成情况
57例患者临床资料见表1。其中24例完成4程PF诱导化疗;1、4、29例患者分别完成2、3、4程TPF诱导化疗。同期放化疗期间,7例、24例、14例患者分别完成3、4、6程DDP单药化疗;各4例患者分别完成3、4、6程奈达铂单药化疗。诱导化疗TPF方案:多烯紫杉醇剂量为50 mg/m2(化疗d1静脉滴入);DDP剂量为60 mg/m2(化疗d1静脉滴入);5-FU剂量为500 mg/m2(化疗d1~5持续120 h静脉灌注);每3周1个疗程,共行4个疗程。同期化疗奈达铂方案,单药剂量为40 mg/m2(化疗d1静脉滴入),每周1个疗程,共行6个疗程。
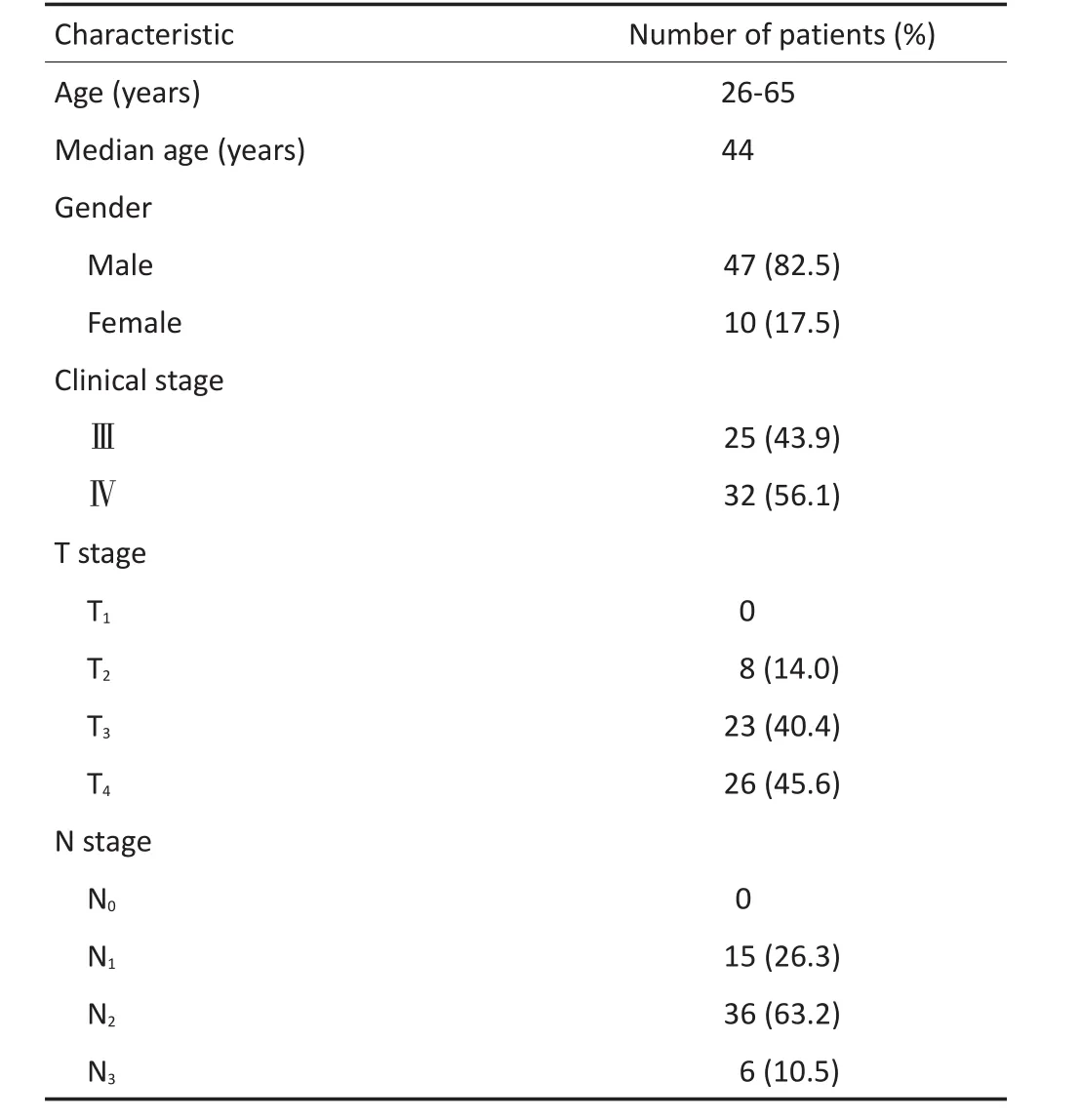
表157 例鼻咽癌患者临床资料Table 1Characteristics of the 57 NPC patients
2.2治疗期间不良反应
诱导化疗前后肿瘤体积变化情况见表2。诱导化疗期间,7.0%(4/57)出现Ⅲ度白细胞下降,1.8%(1/ 57)出现Ⅲ度血小板下降,其余均为Ⅰ~Ⅱ度白细胞、血小板下降。57例患者诱导化疗期间体质量增加(1.97±2.81)kg。同期放化疗期间,21.1%(12/57)出现Ⅲ度白细胞下降,3.5%(2/57)、1.8%(1/57)分别出现Ⅲ、Ⅳ度血小板下降,其余均为Ⅰ~Ⅱ度骨髓抑制及皮肤黏膜反应。15.8%(9/57)患者分别于放射治疗结束后4、6、7、9、10、11个月出现四肢肢端麻木感,肌力体检及自主运动无明显异常。
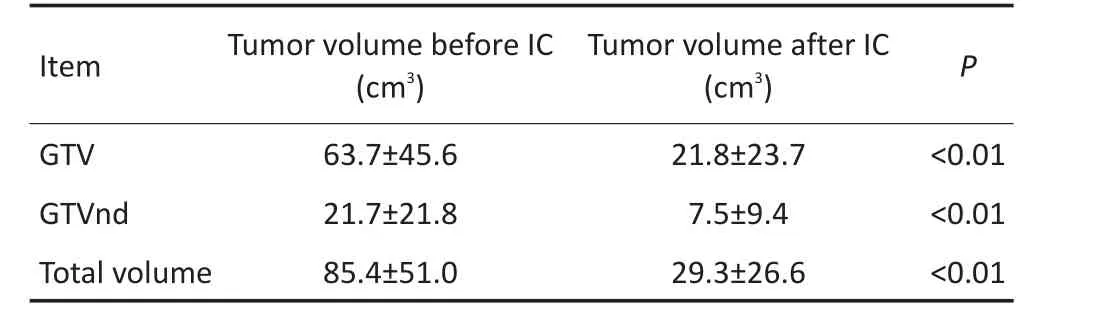
表257 例患者多疗程诱导化疗前后肿瘤体积变化情况Table 2Tumor volume before and after IC
2.3远期疗效
全组病例中位随访时间60(14~84)个月,共8例死亡,1例治疗结束后15个月左侧颈部淋巴结复发,随访期间死亡,死亡时间不明,以治疗结束后15个月死于肿瘤复发纳入统计。1例治疗结束50个月发现胰腺癌,57个月死亡,未见鼻咽部及颈部局部区域复发征象,以死于胰腺癌纳入统计。因此,8例患者死亡,其中1例胰腺癌、3例远处转移、4例局部区域复发。全组患者5年OS为86.0%(49/57),DMFS为91.2%(52/57),LRFS为93.0%(53/57),无进展生存率(progression free survival,PFS)为93.0%(53/57)(图2)。4例患者出现局部区域复发,复发情况及复发部位剂量见表3,图3。
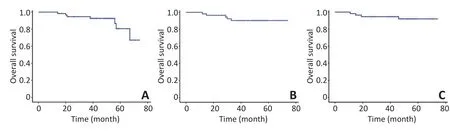
▶A.OS;B.LRFS;C.DMFS图257例患者Kaplan-Meier生存曲线Figure 2Kaplan-Meier curves for OS,LRFS,and DMFS
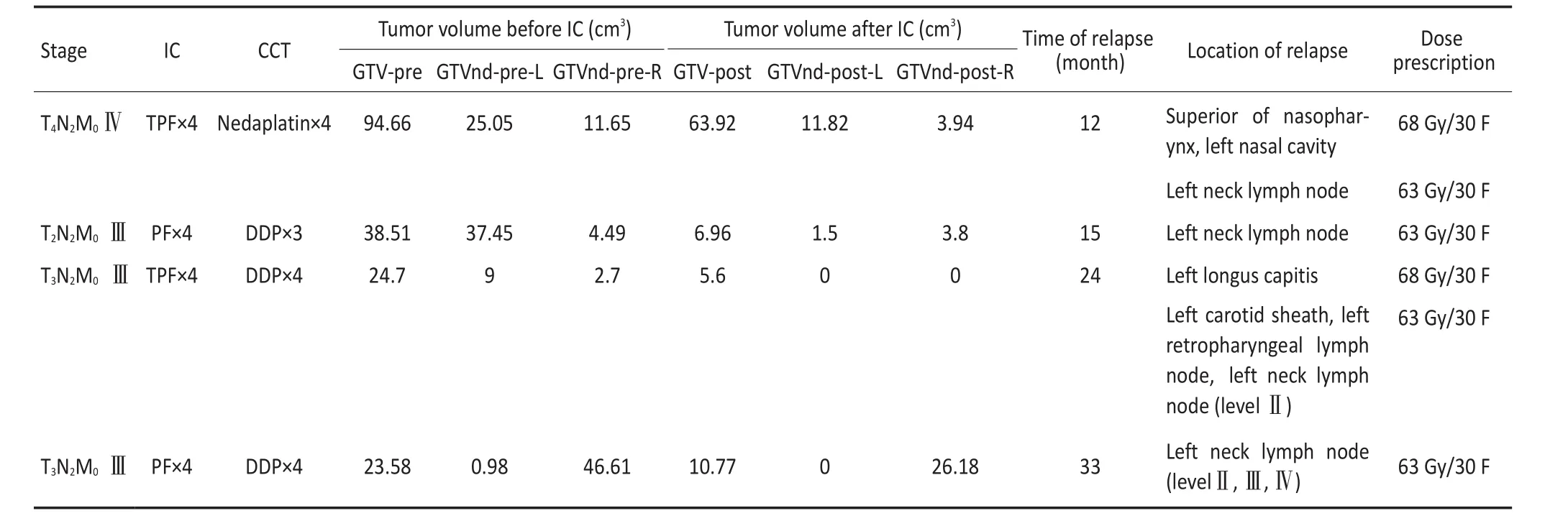
表3 局部区域复发情况Table 3Patterns of locoregional failure
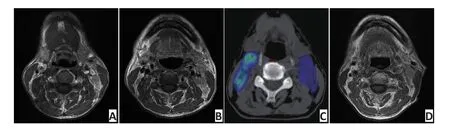
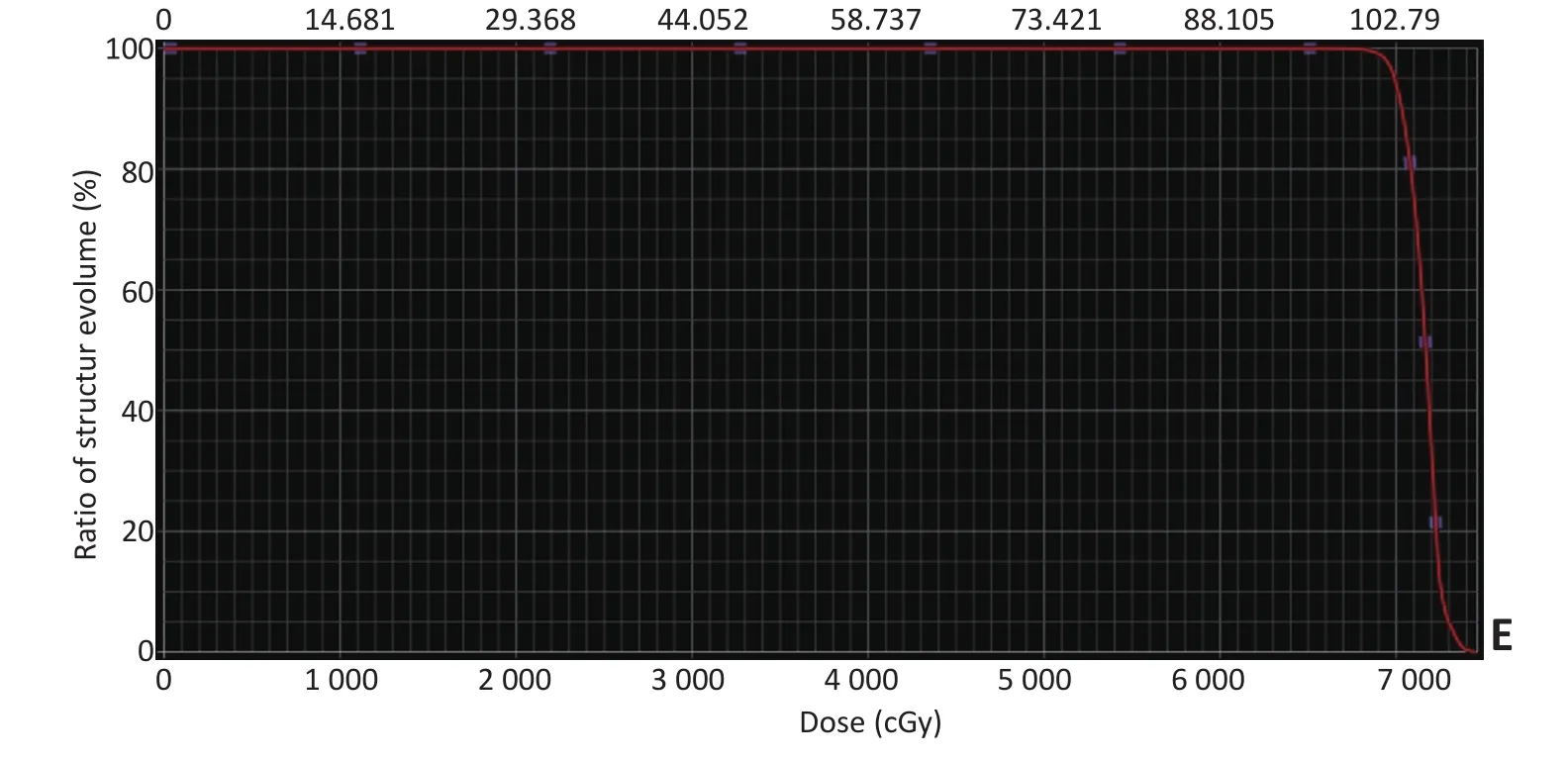
▶A.MRI before IC;B.MRI after IC;C. Therapeutic plan:60 Gy color wash; D.MRI of recurrence;E.Dose volume histogram(DVH)red line:PTVnd-L图3局部区域复发患者复发部位剂量图Figure 3Example of locoregional failure
3 讨论
准确地勾画靶区及给予适当的剂量是IMRT计划设计和执行的前提和关键。ICRU 50号及62号文件指出,GTV为临床可检出肿瘤体积范围;GTV周围可能存在未能检出的亚临床病灶CTV,这些亚临床病灶随着与GTV距离的增加,细胞密度逐渐下降;文件认为在紧邻GTV周围10 mm范围内亚临床病灶的存在风险及细胞密度较高。因此,目前鼻咽癌的靶区勾画大多将GTV外10 mm范围勾画为CTV1,CTV1外5 mm~10 mm及选择性预防照射淋巴结引流范围勾画为CTV2。根据Fletcher[22]研究结果,50 Gy的放射剂量可控制肿瘤90%以上亚临床病灶,60 Gy可控制1×106/cm3或1 cm3大小的肿瘤细胞集合。因此,大量鼻咽癌临床研究[18,23-24]对高风险CTV1及较低风险CTV2分别给予60 Gy及50 Gy的较低剂量照射,并取得较好疗效。
研究报道鼻咽癌诱导化疗后肿瘤部分缓解率(partial response,PR)可达80%[11-13],但关于鼻咽癌诱导化疗后IMRT靶区如何勾画,特别是肿瘤退缩区剂量可否降低,还存在较大争议。Niu等[25]在治疗颅内侵犯的晚期鼻咽癌患者时,诱导化疗后主要按诱导化疗前肿瘤范围勾画GTV及CTV1,在邻近脑干、颞叶、视路等重要危及部位区域适当缩小GTV及CTV1以保护正常器官。该研究2年PFS为77.7%,LPFS为88.2%,区域无进展生存率(regional progression free survival,RPFS)为100.0%,DMFS为89.6%,OS为100.0%。有研究认为[15],影像上不可见肿瘤一般密度<1×109/cm3,6.5~7.0 Gy的照射剂量能使头颈部鳞状细胞癌肿瘤密度降低1个10进制数量级。据此,余湛等[26]对局部中晚期鼻咽癌行3个疗程TPF诱导化疗后,按诱导化疗后肿瘤范围勾画GTV,诱导化疗后肿瘤退缩范围勾画为GTV pre-post-IC-NP、GTV post-IC-LN,在诱导化疗前原发肿瘤大体区域外扩8~10 mm和诱导化疗后颈部可见阳性淋巴结外扩5 mm作为CTV1。GTV处方剂量为68 Gy/30次,GTV pre-post-IC-NP、GTV post-IC-LN为63~64 Gy/30次,CTV1为60 Gy/30次,CTV2为54 Gy/30次,该研究中位随访时间9个月,全组患者局部区域控制率100%,仅1例患者在治疗后15个月出现肺、骨多处远处转移。这两项研究提示,鼻咽癌诱导化疗后原肿瘤退缩,肿瘤消退区域放射根治所需照射剂量可有所下降。类似的研究报道在其他肿瘤,如非霍奇金淋巴瘤[27]及非小细胞肺癌(non-small cell lung cancer,NSCLC)[28]的临床治疗中也已得到验证。
根据文献及前期研究结果提示[16],本研究诱导化疗后靶区勾画缩小GTV的范围,原肿瘤消退区域勾画为CTV1给予60 Gy处方剂量,5年OS为86.0%(49/57),DMFS为91.2%(52/57),LRFS为93.0%(53/ 57),PFS为82.5%(47/57),与同期文献报道疗效相似[9,29]。全组患者复发均在靶区GTV-post/GTVndpost内,无GTVnx-post/GTVnd-post边缘复发或CTV1内复发,与Kong等[30]关于鼻咽癌局部区域复发模式的研究结果相比,无射野边缘及野外复发,提示本研究靶区勾画方法并无增加肿瘤复发风险,临床合理性和可行性较好,值得进一步临床研究验证。本研究中,GTVnd-post复发部位受照剂量63 Gy,GTVnxpost复发部位受照剂量68 Gy,是否与诱导化疗后残存肿瘤的放射敏感性相关,尚待进一步研究考证。
本研究过程中,诱导化疗方案有所调整。有研究显示[31],TPF与PF诱导化疗方案对局部中晚期鼻咽癌远期生存率及局部控制率并无较大差异,自2010年12月始将诱导化疗方案由PF改为TPF。研究期间少数患者出现周围神经症状,考虑可能与诱导并同期化疗后DDP累积剂量较高有关,故自2012年11月始将同期化疗方案由DDP改为奈达铂。从不良反应分析,全组患者诱导化疗期间体质量增加,主要出现Ⅰ~Ⅱ度骨髓抑制,辅以对症治疗后可较快恢复,同期放化疗期间不良反应加重,加强对症及营养支持治疗,均能如期完成治疗。
本研究病例均为门诊治疗,大部分属于经济较为困难的患者,诱导化疗前未另行CT模拟定位扫描,GTVnx-pre/GTVnd-pre仅根据诱导化疗前影像学及电子鼻咽镜检查勾画,存在一定偏倚,且本研究病例数较少,有待进一步临床扩展验证。
[1]Razak AR,Siu LL,Liu FF,et al.Nasopharyngeal carcinoma:the next challenges[J].Eur J Cancer,2010,46(11):1967-1978.
[2]Nicholls J.Nasopharyngeal carcinoma:classification and histological appearances[J].Adv Anat Path,1997,4(2):13.
[3]Zhang B,Mo Z,Du W,et al.Intensity-modulated radiation therapy versus 2D-RT or 3D-CRT for the treatment of nasopharyngeal carcinoma:A systematic review and meta-analysis[J].Oral Oncol,2015, 51(11):1041-1046.
[4]Lee AW,Ng WT,Chan LL,et al.Evolution of treatment for nasopharyngeal cancer--success and setback in the intensity-modulated radiotherapy era[J].Radiother Oncol,2014,110(3):377-384.
[5]Baujat B,Audry H,Bourhis J,et al.Chemotherapy in locally advanced nasopharyngeal carcinoma:an individual patient data meta-analysis of eight randomized trials and 1753 patients[J].Int J Radiat Oncol Biol Phys,2006,64(1):47-56.
[6]Blanchard P,Lee A,Marguet S,et al.Chemotherapy and radiotherapy in nasopharyngeal carcinoma:an update of the MAC-NPC metaanalysis[J].Lancet Oncol,2015,16(6):645-655.
[7]Chan AT,Leung SF,Ngan RK,et al.Overall survival after concurrent cisplatin-radiotherapy compared with radiotherapy alone in locore-gionally advanced nasopharyngeal carcinoma[J].J Natl Cancer Inst, 2005,97(7):536-539.
[8]Cao CN,Luo JW,Gao L,et al.Concurrent chemotherapy for T4 classification nasopharyngeal carcinoma in the era of intensity-modulated radiotherapy[J].PLoS One,2015,10(3):e0119101.
[9]Setton J,Han J,Kannarunimit D,et al.Long-term patterns of relapse and survival following definitive intensity-modulated radiotherapy for non-endemic nasopharyngeal carcinoma[J].Oral Oncol,2016,53(4):67-73.
[10]Lee AW,Lau KY,Hung WM,et al.Potential improvement of tumor control probability by induction chemotherapy for advanced nasopharyngeal carcinoma[J].Radiother Oncol,2008,87(2):204-210.
[11]Hui EP,Ma BB,Leung SF,et al.Randomized phaseⅡtrial of concurrent Cisplatin-Radiotherapy with or without neoadjuvant docetaxel and cisplatin in advanced nasopharyngeal carcinoma[J].J Clin Oncol,2009,27(2):242-249.
[12]Fountzilas G,Ciuleanu E,Bobos M,et al.Induction chemotherapy followed by concomitant radiotherapy and weekly cisplatin versus the same concomitant chemoradiotherapy in patients with nasopharyngeal carcinoma:a randomized phaseⅡstudy conducted by the Hellenic Cooperative Oncology Group(HeC[J].Ann Oncol, 2012,23(2):427-429.
[13]Bae WK,Hwang JE,Shim HJ,et al.PhaseⅡstudy of docetaxel,cisplatin,and 5-FU induction chemotherapy followed by chemoradiotherapy in locoregionally advanced nasopharyngeal cancer[J].Cancer Chemother Pharmacol,2010,65(3):589-595.
[14]Salama JK,Haddad RI,Kies MS,et al.Clinical practice guidance for radiotherapy planning after induction chemotherapy in locoregionally advanced head-and-neck cancer[J].Int J Radiat Oncol Biol Phys,2009,75(3):725-733.
[15]Mcbride WH.Biologic basis of radiation oncology[M].Perez and brady principles and practice of rdiation oncology.Sixth edition. Philadelphia:Lippincott Williams&Wilkins,2013:203-268.
[16]Long JH,Dong S,Jin F,et al.Study on delineation of tumor volume of primary locally advanced nasopharyngeal carcinoma after induction chemotherapy[J].Chin J Radiat Oncol,2012,21(5):417-420.[龙金华,董事,金风,等.局部晚期鼻咽癌诱导化疗后靶区勾画探讨[J].中华放射肿瘤学杂志,2012,21(5):417-420.]
[17]Zhao C,Han F,Lu LX,et al.Intensity modulated radiotherapy for local-regional advanced nasopharyngeal carcinoma[J].Cancer,2004, 23(11):1532-1537.[赵充,韩非,卢丽霞,等.调强适形放射治疗对局部晚期鼻咽癌的临床疗效[J].癌症,2004(1):1532-1537.]
[18]Sun X,Su S,Chen C,et al.Long-term outcomes of intensity-modulated radiotherapy for 868 patients with nasopharyngeal carcinoma:an analysis of survival and treatment toxicities[J].Radiother Oncol,2014,110(3):398-403.
[19]Cheng WQ,Zheng SM,Su Y.et al.Protective effect od intensitymodulated radiation therapy on salivary gland function in nasopharyngeal carcinoma patients[J].Chin J Clin Oncol,2014,41(21):1389-1393.[程皖琴,郑斯明,苏勇,等.鼻咽癌适形调强放疗中涎腺功能的全面保护[J].中国肿瘤临床,2014,41(21):1389-1393.]
[20]Grégoire V,Levendag P,Ang KK,et al.CT-based delineation of lymph node levels and related CTVs in the node-negative neck:dahanca,eortc,gortec,ncic,rtog consensus guidelines[J].Radiother Oncol,2003,69(3):227-236.
[21]Chi F,He ZY,Lin CG,et al.Analysis of intrafractional setup errors in intensitymodulated radiation therapy for nasopharyngeal carcinoma besed on cone-beam computed tomograph[J].Chin J Cancer Prev Treat,2013,20(18):1422-1424.[迟锋,何振宇,林承光,等.鼻咽癌基于锥形束CT调强放疗的摆位误差分析[J].中华肿瘤防治杂志,2013,20(18):1422-1424.]
[22]Fletcher GH.Clinical dose-response curves of human malignant epithelial tumours[J].Br J Radiol,1973,46(541):1-12.
[23]Zhao C,LU LX,Han F,et al.Prospective trial of volume delineation for radiotherapy in nasopharyngeal carcinoma[J].J Oncol,2006,12 (4):263-266.[赵充,卢丽霞,韩非,等.鼻咽癌靶体积划分的前瞻性临床验证[J].肿瘤学杂志,2006,12(4):263-266.]
[24]Zhao C,Lu TX,Han F,et al.Clinical study of 139 nasopharyngeal carcinoma patients for intensity modulated radiation therapy[J].Chin J Radiat Oncol,2006,15(1):1-6.[赵充,卢泰祥,韩非,等.139例鼻咽癌调强放疗的临床研究[J].中华放射肿瘤学杂志,2006,15(1):1-6.]
[25]Niu X,Chang X,Gao Y,et al.Using neoadjuvant chemotherapy and replanning intensity-modulated radiotherapy for nasopharyngeal carcinoma with intracranial invasion to protect critical normal tissue[J].Radi Oncol,2013,8(3):226.
[26]Yu Z,Luo W,Zhou QC,et al.Impact of changing gross tumor volume delineation of intensity-modulated radiotherapy on the dose distribution and clinical treatment outcome after induction chemotherapy for the primary locoregionally advanced nasopharyngeal carcinoma[J].Cancer,2009,28(11):1132-1137.[余湛,罗伟,周琦超,等.诱导化疗后局部晚期鼻咽癌调强放疗肿瘤靶区勾画方式改变对剂量分布和临床疗效的影响[J].癌症,2009,28(11):1132-1137.]
[27]Ghielmini M,Vitolo U,Kimby E,et al.ESMO Guidelines consensus conference on malignant lymphoma 2011 part 1:diffuse large B-cell lymphoma(DLBCL),follicular lymphoma(FL)and chronic lymphocytic leukemia(CLL)[J].Ann Oncol,2013,24(3):561-576.
[28]De Ruysscher D,Faivre-Finn C,Nestle U,et al.European organisation for research and treatment of cancer recommendations for planning and delivery of high-dose,high-precision radiotherapy for lung cancer[J].J Clin Oncol,2010,28(36):5301-5310.
[29]Lan XW,Zou XB,Xiao Y,et al.Retrospective analysis of the survival benefit of induction chemotherapy in stageⅣa-b nasopharyngeal carcinoma[J].PLoS One,2016,11(8):e0160758.
[30]Kong F,Ying H,Du C,et al.Patterns of local-regional failure after primary intensity modulated radiotherapy for nasopharyngeal carcinoma[J].Radi Oncol,2014,9(1):1-7.
[31]Casanova M,Özyar E,Patte C,et al.International randomized phase 2 study on the addition of docetaxel to the combination of cisplatin and 5-fluorouracil in the induction treatment for nasopharyngeal carcinoma in children and adolescents[J].Cancer Chemother Pharmacol,2016,77(2):289-298.
(2016-06-12收稿)
(2016-09-27修回)
Target volume delineation in locoregionally advanced nasopharyngeal carcinoma after four circles of induction chemotherapy
Lei WANG1,Zheng WU2,Wanqin CHENG3,Shu ZHOU1,Rui ZHONG1,Ruifang ZENG4,Yong SU1Correspondence to:Yong SU;E-mail:suyong@sysucc.org.cn
1Department of Radiotherapy,Cancer Center,Sun Yat-sen University,State Key Laboratory of Oncology in South China,Guangzhou 510060,China;2Department of Radiation Oncology,Tumor Hospital of Hunan Province,Changsha 410000,China;3Department of Oncology,the First People's Hospital of Shunde,Foshan 528000,China;4Department of Radiotherapy,TCM-Integrated Cancer Center of Southern Medical University,Guangzhou 510000,China
Objective:To investigate target volume delineation after four cycles of induction chemotherapy in locoregionally advanced nasopharyngeal cancer(NPC).Methods:From August 2009 to August 2013,57 patients with stageⅢ-ⅣNPC were treated with induction-concurrent chemotherapy and intensity-modulated radiotherapy.The primary gross tumor volume(GTV),including retropharyngeal lymph node metastasis before and after induction chemotherapy,was defined as GTVnx-pre and GTVnx-post,respectively,and the clinical target volume(CTV)was divided into two parts:CTV1 and CTV2.The CTVnx1 was defined as the GTVnx-post plus a 10-mm margin,covering the region of GTVnx-pre.The contouring of neck lymph nodes was similar to the primary gross tumor,with the neck lymph nodes GTV and CTV defined as GTVnd-pre,GTVnd-post,and CTVnd1,respectively.CTV2 was defined as CTVnx1 and CTVnd1 plus a 5-mm margin together with the bilateral cervical selective lymph drainage respectively areas.Treatment outcome and toxicity were determined in all patients.Results:The GTVnx-post was significantly smaller than the GTVnx-pre(21.8 cm3vs.63.7 cm3,P<0.01), whereas the GTVnd-post was significantly smaller than the GTVnd-pre(21.7 cm3vs.7.5 cm3,P<0.01).With a median follow-up of 60.0 months,the 5-year overall survival(OS),locoregional relapse-free survival(LRFS),distant metastasis-free survival(DMFS),and progression-free survival(PFS)rates were 49/57(86.0%),53/57(93.0%),52/57(91.2%),and 53/57(93.0%)respectively.All locoregional failures occurred in the GTVnx-post or GTVnd-post field with no relapses in the CTVnx1 or CTVnd1.Conclusion:Four cycles of IC can significantly reduce tumor volume.The target volume delineation according to the tumor volume after IC has encouraging long-term treatment outcome.
nasopharyngeal carcinoma,induction chemotherapy,intensity-modulated radiation therapy,target volume delineation, clinical therapeutic effect

10.3969/j.issn.1000-8179.2016.22.696
①中山大学肿瘤防治中心放疗科,华南肿瘤学国家重点实验室(广州市510060);②湖南省肿瘤医院放疗科;③南方医科大学附属医院,
顺德第一人民医院肿瘤科;④南方医科大学中西医结合肿瘤中心放疗科
苏勇suyong@sysucc.org.cn
王蕾专业方向为肿瘤放射治疗学。
E-mail:wanglei@sysucc.org.cn
