如何做好猪繁殖与呼吸综合征免疫前的评估
2016-12-19赵福相农华杰马荣超刘亚斌王科文陈阳
赵福相,农华杰,马荣超,刘亚斌,王科文,陈阳
[1.硕腾(上海)企业管理有限公司,上海长宁200050;2.四川正大养猪事业部技术中心,四川成都611130]
猪病防制与保健
如何做好猪繁殖与呼吸综合征免疫前的评估
赵福相1,农华杰1,马荣超1,刘亚斌1,王科文1,陈阳2
[1.硕腾(上海)企业管理有限公司,上海长宁200050;2.四川正大养猪事业部技术中心,四川成都611130]
猪繁殖与呼吸综合征(PRRS)的大流行导致全球养猪业蒙受巨大损失,使用PRRS弱毒活疫苗免疫是控制PRRS流行的最重要手段之一,但在PRRS的免疫问题上国内外研究报道传递着不尽相同的声音,这源自于不同的猪场免疫PRRS表现出的并不一致的保护结果,而对于PRRS的免疫人们常常陷于两难的境地,没有进行免疫的猪场难以承担PRRS可能暴发的损失,但免疫也有可能会带来一定的风险性。那么猪群PRRS的免疫是否会真的有保护作用?又是哪些因素会导致PRRS免疫保护的缺失呢?这些有必要通过免疫评估来回答。
1 PRRS免疫评估的重要性
一方面,经大量的研究已经证明了接种PRRS疫苗能够产生保护性免疫反应、减轻临床症状和减少病毒排毒量(Cano等,2007ab;Gorcyca等,1995;Hesse等,1996;Mengeling,1996;PlanaDuran等,1995)。
另一方面,也有PRRSV病原遗传的多变异性与异源毒株免疫交叉保护不确定特性;PRRSV弱毒疫苗存在散毒、重组、返强及抗体依赖增强效应(ADE)特性,免疫后有效细胞免疫和体液免疫反应滞后等诸多因素使得PRRS的免疫保护充满不确定性,如果在免疫前没有进行科学系统的免疫评估,可能会导致不能取得预期的免疫效果,而且还有可能使免疫猪群发生意外,甚至发生较大的生产损失。在准确的免疫评估基础上进行免疫,可最大限度确保PRRS的免疫保护,从而在一定范围内控制PRRS的流行。
2 PRRS免疫前评估在实际生产中的指导意义
如何才能做到既能取得良好的免疫效果,又能有效规避因免疫PRRS疫苗带来的风险?兽医在做这个决策时得权衡许多,何种状态的猪群是必须免疫的?该选择何种疫苗免疫?该执行何种免疫方案?免疫时应有那些补充措施?决策依据又都是什么?这些就要依赖于PRRS免疫程序的制定前有科学、系统、准确的免疫评估。
PRRS疫苗免疫前系统严谨的免疫评估有助于了解猪群PRRS免疫前的具体情况,为正确制定免疫程序提供有效依据,可以有效规避免疫时出现的如免疫抑制、免疫保护欠佳及ADE现象等负面问题,增强免疫效果,有助我们规避风险增加免疫成功几率,从而起到控制PRRS在猪群中流行的作用。
3 当前PRRS免疫前评估研究进展
PRRS的免疫前评估,是指在免疫PRRS前针对待免猪群的健康状况、PRRSV感染状态、PRRS血清型等方面系统性了解分析,为正确免疫PRRS提供依据,从而做到合理规避风险,增加PRRS免疫保护效果。PRRS的免疫评估一般都是由专业兽医进行,可分为4个部分进行评估:猪群PRRS感染状态的评估、猪群非PRRS因素健康状态的评估、猪舍环境及生物安全的评估、疫苗有效性与安全性的评估等几个方面。
其中,最主要是猪群PRRS感染状态的评估,重点是确定病毒活跃的时间段,难点是母猪群稳定状况。种猪是否稳定?稳定程度如何?是否排毒?是否影响仔猪?
感染状态评估:根据猪群持续生产数据、猪群临床及剖检病变、猪群血清抗体及病原检测结果等进行评估,可以将猪场PRRSV感染状态大致分为:1)阴性猪场;2)基础母猪群稳定/生长猪病毒不活动场;3)基础母猪群稳定/病毒在生长猪阶段活动场;4)不稳定猪场等4种类型。并根据不同感染状态的评估相应地提出了防治建议:阴性猪场,且生物安全良好的,不免疫;基础母猪群稳定/生长猪病毒不活动场,生物安全也良好的,也可以不免疫;基础母猪群稳定/病毒在生长猪阶段活动场,提倡个性化免疫;不稳定猪场,首先要加强基础母猪群的免疫,稳定基础母猪群(Zimmerman等,1998)。
4 如何做好PRRS的免疫前评估
根据免疫PRRS前需要的了解信息,可将PRRS系统的免疫评估分为4个步骤进行。
4.1 第一步,评估猪群大致感染状态,决定是否需要免疫
4.1.1 PRRS阴性猪场评估生产成绩评估:猪群3月内没有出现与PRRS相关繁殖及生产成绩下降或繁殖成绩不稳定的特征。
临床及剖检评估:猪群现场巡查也没有发现与PRRS相关的临床症状或病理剖检变化。
血清及病料检测评估:血清抗体及抗原检测诊断都是阴性,可以暂认定为PRRS阴性场。目前PRRS阴性场已非常少见,这类场多数都能取得理想的生产成绩(图1),如生物安全措施也做得非常严谨,一般可以不进行PRRS免疫,但有很高的风险性,针对PRRS感染状态持续定期的血清抗体监测是必不可少的。

图1 重庆嫦娥猪业科技新丹系种猪场阴性场
4.1.2 稳定/非活动场评估一般指的是阳性而猪群稳定场,“稳定”是指种猪群和生长猪群蓝耳病抗体呈阳性或阶段性阴性,但生产稳定没有波动,“非活动”是指种猪群和生长猪群都没有野毒循环。
生产成绩评估:这类猪场虽然为蓝耳病阳性,但蓝耳病病毒并未在繁殖群内循环,生产中母猪的繁殖成绩一般良好而稳定,产房、保育成绩也都恢复到感染前的水平。
临床及剖检评估:临床和剖检也没有发现与PRRS相关的临床症状及病理变化。
血清及病料检测评估:血清学检测抗体阳性率的趋势、S/P均值趋势、离散度趋势分析没有PRRS在猪群循环的表现,可以暂定为:稳定/非活动的猪场。此类猪场可以通过良好的免疫管理等做到,可能来源于感染后稳定场,也可能来源于非免疫猪场。这类猪场一般也可以不免疫PRRS疫苗,但要随时观察猪群健康状态和定期对猪群PRRS血清趋势检测,应注意评估猪群是否存在发生PRRS的个体及走势。
4.1.3 稳定/活动猪场评估生产成绩评估:生产中母猪的繁殖成绩较好或者中等,产房往往也可能会有好的成绩,但一些猪群产房弱仔率会有所增加,断奶后的保育期或者肥育前期往往出现不稳定现象,表现为保育猪群非常难养等,断奶后到出栏会增加5%~10%的死淘率等。
临床及剖检评估:母猪繁殖生产大体正常,有时也可能会有个别母猪流产及个别窝产房弱仔率增加,保育期或生长肥育前期猪群有PRRS相关临床症状,如厌食、精神沉郁、皮肤充血、呼吸加快或呼吸困难、被毛粗乱、大小不均(Moore,1990;White,1992b)和地方性多发及继发感染加重的现象,死亡率有时高达12%~20%(Blaha,1992;Keffaber等,1992;Loula,1991;Moore,1990;Stevenson等1993;White,1992a);或剖检发现间质性肺炎、淋巴结肿大2~10倍(Dea等,1992c;Halbur等,1995b;Rossow等,1994ab)等PRRS病理变化,但在临床解剖时观察到比较多的病变是PRRS继发感染引起的心包炎、胸膜炎、腹膜炎、多发性关节炎等(图2)。

图2 PRRS稳定/活性猪场保育期发病仔猪及腹膜炎
血清及病料检测评估:检测多数猪场保育期或肥育前期猪的血清抗体发现,蓝耳病抗体的阳性率、S/P均值、离散度的变化趋势与临床发病出现的时间相一致,病毒往往在该阶段处于比较活跃状态,可以暂定为:稳定/活动猪场。
该类猪场一般出现在流行蓝耳病之后,种猪群因感染产生抗体而稳定,应进一步分析受PRRS感染后生长猪群生产成绩下降多少,包括保育期成活率、保育期发生关节炎的比例;与健康同期相比下降多少?有的猪群感染PRRS后日增重降低50%~75%,死亡率增加10%~25%;药物疗效降低,是否持续?预判以后趋势,根据猪场可接受程度决定是否需要进行PRRS免疫。生产中该类猪场是非常普遍的,为PRRS重点免疫类型猪场,这样的猪场科学地免疫PRRS往往会有非常良好的防治效果。
4.1.4 不稳定猪场的评估该类猪场一般是最近暴发了严重的PRRS或处于种猪群PRRS持续感染状态的猪场。
生产成绩评估:猪场有1%~3%或更高比例的母猪发生流产(图3),不规则发情或不孕母猪明显增多(Hopper等,1992;Keffber,1989;Loula,1991;White,1992a);有学者指出如母猪2周内突然出现以下指标中的两个就可判断为PRRS感染的不稳定场:1)母猪流产或早产超过8%;2)死产占产仔数的20%;3)仔猪出生后1周内死亡率超过25%。

图3 不稳定场母猪流产
临床及剖检病变评估:猪场所有阶段猪群都可能会出现PRRS的临床症状及死亡个体,如哺乳期仔猪出现如消瘦、饥饿、呼吸急促、呼吸困难和球结膜水肿、震颤或外翻腿等PRRS的临床症状(Keffaber,1989;Loula,1991),一般认为是妊娠期就已感染蓝耳病病毒(图4)。

图4 不稳定场哺乳仔猪发病
血清及病料检测评估:PRRSV的血清学检测有PRRS阳性率突然增加及S/P均值突然升高并有抗体离散度缩小的趋势;且该期病猪组织样品往往也分离到PRRSV,可暂定为不稳定猪场。该类型猪群应进行PRRS疫苗紧急免疫。
通过以上对猪群PRRS大致感染状态的评估,如猪群处于稳定/活动猪场或不稳定猪场,应更进一步评估了解感染PRRSV血清型及PRRS感染规律,有助于准确的制定免疫方案。对于各类感染状态下的血清学评估,可以分为两种情况的评估,一种是未免疫猪群血清学评估,如表1所示。

表1 未免疫猪群血清学评估(Roongroje,2010)
另一种是已免疫PRRS弱毒活疫苗猪场的评估:对于已免疫猪群血清学评估是评估中的难点和重点,应注意血清抗体野毒感染与疫苗免疫抗体之间的区别。
4.2 第2步,评估猪群感染规律,制定免疫程序
评估猪群感染规律之前,首先要评估猪群感染PRRSV的血清型:可以通过感染PRRS病猪的病料做抗原测序分析检测PRRSV基因片段,根据检出的NSP2片段区分是中等毒力的经典亚型,还是强毒高致病性变异的亚型,是单一血清型毒株感染还是多血清型毒株感染;如是多血清型毒株,还要进一步评估优势毒株,根据蓝耳病病原亚型鉴定结果,选择同一亚型PRRS疫苗免疫。选定血清型后,还得对该型PRRS疫苗安全性进行评估,对于危害严重的高致病性PRRSV弱毒活疫苗的评估如表2所示。
猪群PRRS感染规律评估:对于稳定/活动猪场还要评估其感染规律,主要根据临床症状出现的时间及血清抗体变化规律而确定,但要注意区分免疫及野毒感染产生的抗体。

表2 评估选择疫苗的安全性及有效性
临床及剖检评估感染规律:商品猪群应按周龄、批次分析发病率、死亡率,标出发病高峰及死亡高峰的周龄及剖检记录发生继发感染高峰段的周龄。
血清及病料检测评估感染规律:猪群各阶段分周龄检测血清,分析PRRS抗体阳性率、S/P均值、S/P离散度等3个血清相走势,结合PRRS临床症状出现的时间,推断大致出现感染时间、感染时长等,以此推荐大致免疫时间。
一般猪群野毒感染后可以检测到抗体的快速升高,整齐度好,疫苗刺激机体的反应相对弱,整齐度也较差。
稳定/活动猪场血清学评估是免疫评估的难点和重点,这种感染状态一般在猪群PRRS暴发或流行结束以后,在猪群呈地方性流行,根据猪群临床症状出现时间、血清相变化规律评估PRRS大致感染时间。如图5—图7所示,PRRS抗体阳性率、S/P均值、S/P离散度3个血清相走势推断,多数猪群会在6~10周龄出现发病,这可能是母猪群的不稳定引起;如在保育后期及肥育前期的12~18周龄发病一般来自于大龄猪群的感染;一般即使种猪群基本稳定场也会零星发生流产等现象。
评估PRRS抗体维持时间,母猪群稳定场多数断奶仔猪获得母源抗体维持时间为3~7周龄(图5—图7),免疫抗体因不同疫苗类型、不同生产厂家而有所不同。
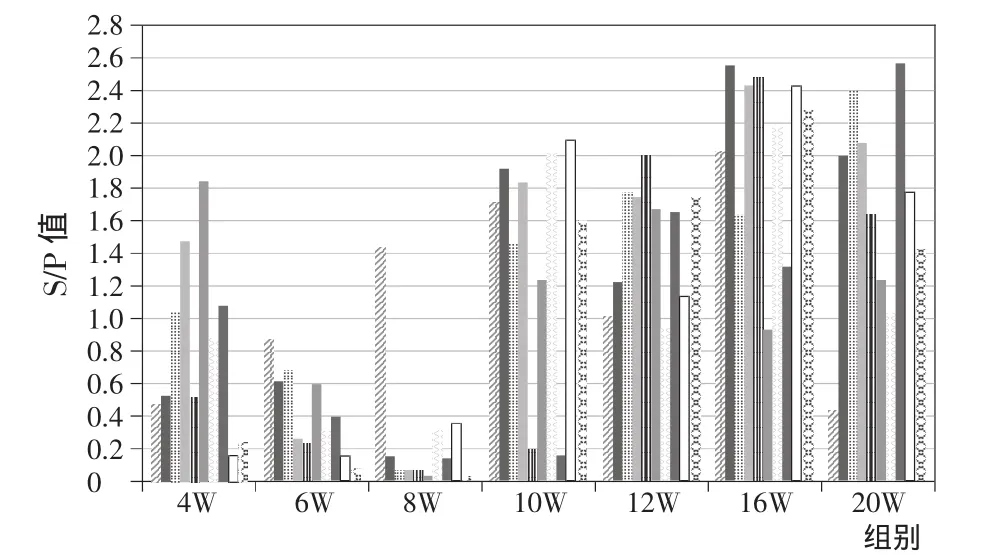
图5 猪繁殖与呼吸综合征病毒抗体S/P值

图6 猪繁殖与呼吸综合征病毒抗体阳性率

图7 猪繁殖与呼吸综合征病毒抗体S/P平均值及离散度
稳定/活动场生产成绩评估:猪群种猪繁殖成绩大体正常或略低,包括配种分娩率、产房乳猪成活率、保育及肥育猪一段时期内一定幅度下降或不稳定性;还要统计各阶段发病率、死亡率、增重、病变等多方面。
稳定/活动场临床及剖检评估:母猪个别出现体温升高、流产、早产、死胎、弱仔、母猪返情等繁殖障碍问题,仔猪及生长猪高比例发病及剖检呈间质性肺炎或继发感染的心包炎、胸膜炎、腹膜炎等。
稳定/活动场血清及病料检测评估:病猪肺脏、淋巴结、扁桃体检测出存在PRRS病原,要进一步病原检测区分经典毒株或HP-PRRSV高致病性毒株。
根据以上评估结果,结合发病率、死亡率、淘汰率、病程、发病持续时间、导致损失的程度、免疫风险等综合判断是否需要紧急免疫。
4.3 第3步,评估非蓝耳病因素对免疫效果可能带来的影响,决定是否保健
4.3.1 猪群健康状态评估其它病原感染状态评估:评估猪群圆环病毒2型(PCV2)、伪狂犬病病毒、猪瘟病毒、猪肺炎支原体、传染性胃肠炎病毒、流行性腹泻病毒及其它细菌病原(如猪丹毒,图8)的感染率及严重性。笔者在2011—2014年田间发现,PCV2严重的猪场,可能会严重降低免疫PRRS的临床效果,在免疫PRRS时如猪群发生腹泻(图9),也可能会降低PRRS的免疫效果,其免疫PRRS产生的抗体高度及持续时间都会降低。评估细菌性疾病感染的病原及压力,如猪场副猪嗜血杆菌、链球菌感染严重的猪场,猪群临床表现会趋于更严重、死亡率会更高;猪群非感染性疾病评估:营养水平、膘情、有无霉菌毒素污染及程度等。

图8 免疫后感染猪丹毒

图9 哺乳仔猪腹泻
生物安全评估:免疫猪群200天内是否新引进种猪或使用场外精液而引入新毒株,周边猪群数量、密度、规模,本场规模、饲养密度、饲养工艺流程、猪舍设施等。
4.3.2 评估影响PRRS免疫效果的其它因素
(1)影响PRRS免疫后免疫保护的因素评估。
①对待免种猪群的评估:母猪整体健康状态、膘情、营养状况、霉菌毒素的控制;环境温度、湿度、通风、光照是否合适,极端天气时的猪舍状况等是否适宜免疫猪群;最近是否外引种猪及使用场外精液等,已发病猪群有无封群及封群时间。
②对待免仔猪群的评估:待免疫仔猪免疫前后是否出现腹泻、仔猪哺乳是否充足、母猪PRRS的母源抗体高低及维持时间和仔猪发病时间等。临床上能否发现霉菌毒素危害的表现?断奶时间、免疫间隔;应激因素:是否长途运输、是否多次转栏、是否多次混群。
(2)其他协同感染病原的防治情况。相关研究报道,与PRRS有协同感染的病毒性病原有:猪圆环病毒2型、猪呼吸道冠状病毒(PRCV)、猪流感病毒(SIV)、猪伪狂犬病病毒(PRV);与PRRS有协同感染的细菌性病原有:猪肺炎支原体(MHP)、副猪嗜血杆菌(HPS)、胸膜肺炎放线杆菌(APP)、巴氏杆菌(PM)、猪沙门氏菌、猪链球菌(SS)(Shibata等,2003;Thacker等,1999;vanReeth等,1996,2001)。如果这些病原没有得到很好的控制,会间接影响PRRS的免疫效果。
(3)降低猪群PRRS免疫效果的因素:协同感染病原MHP、HPS、PCV2、SIV等的严重感染;猪群本身不健康:母猪体质差、营养缺乏、体况瘦弱、母猪群严重便秘、霉菌毒素超标、多次混群;猪舍条件不适:温度、湿度不适,高浓度的氨气、粉尘,卫生差,密度大(图10);生物安全:一条龙饲养、多次引种、多地引种、使用场外精液等;猪群存在PRRS多毒株感染。

图10 密度大,卫生差
(4)促进PRRS免疫成功的因素:多点饲养、猪舍温度、湿度、通风适宜;良好平衡的营养、猪群膘情良好、饲喂颗粒饲料、霉菌毒素得到良好的控制;种猪群来源单一、使用本场精液、隔离良好;其他疾病得到良好防治;猪群PRRS感染毒株单一。
4.3.3 根据评估情况决定应对措施对环境条件差、细菌性疾病污染严重场、以前没有免疫PRRS疫苗的猪群。母猪免疫前后7天:每吨饲料添加雅定兴1~2千克+黄芪多糖300克+种猪多维200克。体况瘦的种猪群如图11,免疫前10天加大喂料量,待膘情恢复再进行免疫。有霉菌毒素污染场:免疫前3~4周更换优质霉菌毒素达标饲料并添加优质霉菌毒素吸附剂如欧泰霉克0.5~1千克/吨饲粮;种猪群普遍便秘的要检查原因,是营养或饮水原因,还是疾病原因?调整恢复正常后再免疫;正在发生其它疾病或采食、精神不正常的猪群要避免或延后免疫;正在腹泻的仔猪要待其恢复后再免疫。

图11 体况过瘦的母猪加料后再免疫
4.4 第4步,评估以往免疫效果,选择PRRS疫苗并制定过渡方案
猪群接种PRRS后可能会出现不同的保护效果,免疫的结果不同,反应了地区流行变异株的差异或疫苗株与临床流行株之间交叉保护方面的关系,也可能来自于不同生产厂家之间的差异,猪群在选择免疫PRRS疫苗毒株时应对以前免疫PRRS做安全性及保护效果评估。
4.4.1 以往PRRS疫苗免疫保护效果的评估分为安全性评估、有效性评估。有效性又可分为:完全保护、不完全保护及没有保护3个层面(本篇文章不做具体分析),以血清相评估、生产成绩及临床表现评估为主,针对不同的免疫保护应采取的不同策略。
弱毒疫苗对同源毒株的攻击保护总体上是有效的,但对于异源毒株保护效率很低甚至没有;对异源毒株的保护力很大程度取决于疫苗毒株和野毒株之间的抗原和基因的同源性(Key等,2001);单纯基因同源百分率不能准确评估交叉保护(Monte McCaw,2006);单个疫苗毒株不能完全保护异源病毒的感染(Kimman等,2009;Labarque等,2004)。
坚持选用完全保护的PRRS疫苗及其免疫方案,对于部分保护或完全没有保护的猪群,应分析评估免疫保护失败或不足的原因,是PRRS疫苗本身原因,还是猪群原因或其它因素引起,应做相应的调整。如涉及到PRRS疫苗原因应具体分析,评估影响HP-PRRSV苗效果的因素:疫苗毒株因素?该区域流行的优势毒株及本场流行毒株?流行时间?免疫背景?分析可能是血清型原因、毒株原因、疫苗生产质量原因或疫苗保存原因,对于确认是疫苗原因应建议更换基因亚型同源性更近的PRRS疫苗。
应对先前免疫疫苗的类型、血清型、毒株、质量、免疫程序(时间、剂量、频率),决定如何过渡。免疫程序:免疫时间是否确定准确,确保免疫后在猪群高发病时段前免疫猪群的抗体水平已达最高值,以减少在PRRS最易发病期临床症状的出现。
4.4.2 更换疫苗时的注意事项确认要更换疫苗时,注意减少更换疫苗带来的不稳定性。以硕腾瑞兰安为例说明:如以前是使用PRRS经典毒株疫苗的猪群,种猪群更换疫苗时应注意离上次免疫经典株疫苗后至少1个月后再进行瑞兰安的免疫;如以前是免疫JXA1-R、HuN4-F112等高致病毒株疫苗的猪群,种猪群应在上次免疫JXA1-R等其它高致病毒株至少2个月后再进行瑞兰安的免疫;以前免疫TJ-92株,可根据硕腾推荐的免疫程序直接转换为瑞兰安免疫;仔猪的免疫:如种猪群使用非同源毒株疫苗,则仔猪免疫瑞兰安时最好避开母猪妊娠后期使用非同源毒株疫苗免疫,即在母猪免疫瑞兰安后所产仔猪再顺延更换瑞兰安进行免疫,而以前使用其他毒株疫苗免疫所产仔猪按以前母猪使用疫苗毒株免疫;如以前母猪群就是使用TJ-92株则仔猪可以直接使用瑞兰安免疫。
总之,对于PRSS的理想防治目前依然是一个非常有难度的课题,对以往的免疫效果评估有助于本次正确制定免疫方案、减少免疫不当产生的副作用、增加免疫保护效果、提高免疫成功率。
(编辑:柳青)
S858.285.3
A
1002-1957(2016)01-0089-05
2016-01-08
赵福相(1969-),男,重庆人,执业兽医师,研究方向为规模化猪场现代繁殖技术、猪繁殖障碍性疾病的防控等. E-mail:1178191942@163.com
