鹅去氧胆酸诱导HCT-116细胞凋亡及其作用机制研究*
2016-12-19高艳平赵亚影周恩旭高慧茹任元静赵安芳
郭 帅,高艳平,赵亚影,周恩旭,付 丽,高慧茹,任元静,赵安芳△
(1.河南省平顶山市第二人民医院普外科 467000;2.河南省驻马店市环境监测站 463000;3.河南城建学院生命科学与工程学院,河南平顶山 467036)
·论 著·
鹅去氧胆酸诱导HCT-116细胞凋亡及其作用机制研究*
郭 帅1,高艳平2,赵亚影3,周恩旭3,付 丽3,高慧茹3,任元静3,赵安芳3△
(1.河南省平顶山市第二人民医院普外科 467000;2.河南省驻马店市环境监测站 463000;3.河南城建学院生命科学与工程学院,河南平顶山 467036)
目的 研究鹅去氧胆酸(CDCA)对结肠癌细胞HCT-116的影响,并探讨其作用机制。方法 采用体外细胞培养、四甲基偶氮唑蓝(MTT法)、苏木素-伊红染色(HE染色)、吉姆萨染色(Giemsa染色)、吖啶橙/溴化乙锭染色(AO/EB染色)和流式细胞术检测经CDCA诱导处理对结肠癌HCT-116细胞的存活率、形态学变化、细胞周期、线粒体膜电位和细胞凋亡率的影响。结果 试验结果表明,CDCA作用于结肠癌细胞HCT-116细胞株48 h的半抑制浓度为0.304 mmol/L。0.800 mmol/L CDCA处理48 h后细胞抑制率达88.4%,且表现出细胞体积缩小、细胞核固缩和染色质凝聚等凋亡特征性的形态学改变。流式细胞仪检测结果显示,经CDCA诱导处理后,细胞株细胞周期被阻滞于G2/M期,线粒体膜电位降低,0.400 mmol/L CDCA处理48 h后HCT-116细胞凋亡率达54.5%。结论 CDCA对人结肠癌HCT116细胞株的抑制作用与其剂量有依赖性,并可能通过线粒体途径诱导人结肠癌细胞HCT-116细胞株凋亡。
鹅脱氧胆酸;结肠肿瘤;细胞凋亡;细胞
结直肠癌(colorectal cancer,CRC)是人类高发消化道恶性肿瘤,近些年在我国部分地区发病率呈明显上升趋势,部分城市低龄化明显,但其发病机制仍不明[1]。因此,寻找有效治疗CRC的靶向药物和方法成为了全球抗肿瘤研究的一个重要课题。鹅去氧胆酸(chenodeoxycholic acid,CDCA)别名为3α′7α-二羟基-5-β-胆烷酸,为无色针状结晶,无臭,味苦,是目前世界上用量最大的治疗胆结石药物之一,又是合成熊去氧胆酸和其他甾体化合物的原料,由胆汁提取而来[2-3]。CDCA具有降低胆汁内胆固醇饱和度,抗菌消炎和止咳平喘等多种药理学作用[4]。近年来国外合成了CDCA衍生物用于胆结石的治疗,细胞凋亡的诱导和抗肿瘤等方面的研究,但对于CDCA的作用机制尤其是抗肿瘤作用的机制尚未阐明[5]。因此,本研究对CDCA诱导处理结肠癌细胞HCT-116细胞凋亡及其作用机制进行研究,旨在为CDCA的抗肿瘤研究提供更加科学、客观的依据和方法,并为相关疾病的治疗提供一定的理论依据。
1 材料与方法
1.1 材料 人结肠癌细胞株HCT-116细胞,购自中科院上海细胞库。四甲基偶氮唑蓝(MTT)、碘化丙啶(PI)购自美国Sigma公司;青霉素-链霉素双抗,苏木素、伊红染液购自江苏碧云天公司;DMEM培养基购自Gibco公司;胎牛血清(FBS)购自浙江天杭生物科技有限公司;其他试剂均购自洛阳市化学试剂厂(国产AR级)。CO2细胞培养箱(型号3111)购自美国赛默飞世尔科技公司;流式细胞仪(Guava easyCyte 6-2L)和超纯水仪(Milli-Q Reference)购自美国Millipore公司;荧光显微镜(ZYF-600)购自上海兆仪有限公司;酶联免疫反应检测仪(EnSpire)购自美国Perkin Elmer仪器有限公司。
1.2 方法
1.2.1 细胞培养和诱导处理 HCT-116细胞培养于DMEM培养液中(内含12%热灭活胎牛血清和1%青霉素-链霉素双抗,pH7.2),于37 ℃,5% CO2的培养箱培养。处理组细胞为HCT-116细胞培养24 h后进行CDCA诱导处理,对照组细胞则不加药物处理。
1.2.2 MTT法 检测细胞毒性并筛选药物合适浓度 MTT试验方法同文献[6]。CDCA的浓度设计为0.1、0.2、0.3、0.4、0.5、0.6、0.7和0.8 mmol/L。经SPSS13.0软件处理计算CDCA对HCT-116细胞的半抑制浓度(或称半抑制率),即IC50值。
1.2.3 苏木素-伊红染色(HE染色) 对照组和处理组细胞( 0.3 mmol/L CDCA)培养48 h后,取出长有细胞的盖玻片用磷酸盐缓冲液(PBS)漂洗3次,每次洗1 min。95%乙醇固定20 min,温PBS漂洗3次,每次1 min。苏木素染色10 min,自来水洗3 min。在1%的氨水中碱化5 min,自来水洗2次,每次2 min。超纯水洗2次,每次1 min。1%的伊红中染色5 min,95%乙醇中洗5 min,无水乙醇中浸泡10 min,在等量乙醇和二甲苯中置3 min。转移至二甲苯中透明2次,每次5 min。中性树脂封片,光学显微镜下观察拍照。
1.2.4 吉姆萨染色(Giemsa染色) 对照组和处理组细胞(0.3 mmol/L CDCA)培养48 h后,取出长有细胞的盖玻片,用PBS漂洗3次,每次1 min。95%乙醇固定20 min,温PBS漂洗3次,每次1 min。Giemsa染液染色10~30 min,超纯水洗,摇床脱色1~10 min(视情况而定)。90%甘油封片,光学显微镜下观察拍照。
1.2.5 吖啶橙/溴化乙锭双荧光染色(AO/EB染色) 对照组和处理组细胞(0.3 mmol/L CDCA)培养48 h后,取出长有细胞的盖玻片,PBS漂洗3次,每次1 min。加1~2滴AO/EB工作液,滴加时避光,荧光显微镜下观察拍照。
1.2.6 流式细胞仪的相关检测
1.2.6.1 PI单染法测细胞周期 流式细胞仪测细胞周期试验方法参考文献[6]。CDCA处理浓度为0、0.2和0.4 mmol/L。
1.2.6.2 线粒体膜电位的检测 应用流式细胞仪检测脱氧胆酸对HCT-116细胞线粒体膜电位的影响,Rhodamine123荧光强度值反映的是线粒体膜电位的高低。试验方法参考文献[7],诱导处理组细胞为0.2、0.3和0.4 mmol/L CDCA,流式细胞仪检测。
1.2.6.3 AnnexinV-FITC/PI双染法检测细胞凋亡率 收集对照组和不同浓度(0.1、0.2、0.3、0.4 mmol/L)CDCA处理48 h的HCT-116细胞,加入195 μL AnnexinV-FITC结合液重悬细胞,再加入5 μL AnnexinV-FITC,室温避光孵育10 min。离心后加入190 μL AnnexinV-FITC结合液重悬细胞,再加入10 μL PI染色液,过200目滤网后进行流式细胞仪(guava easyCyteTM4200-0140)检测。其中,AnnexinV-FITC为绿色荧光,PI为红色荧光。

2 结 果
2.1CDCA显著抑制HCT116细胞的生长和增殖MTT法检测结果显示,CDCA对人CRCHCT-116细胞的生长有明显的抑制作用,并呈剂量依赖性(P<0.05),见图1。经CDCA处理48h后,HCT-116细胞抑制率由15.3%上升到88.4%。对试验数据进行处理,可得到CDCA处理48h的IC50为0.304mmol/L。
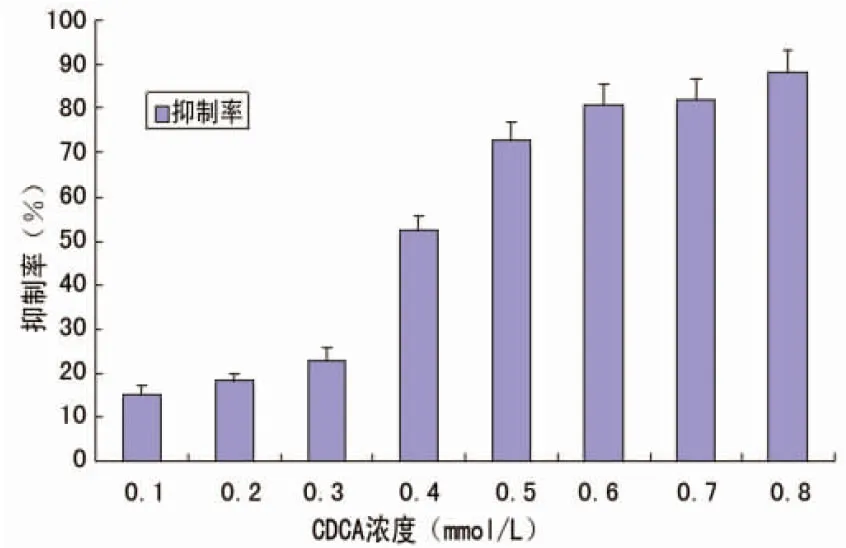
图1 CDCA对HCT-116细胞的抑制作用
2.2CDCA处理后HCT-116细胞的形态学变化HE和Giemsa染色结果显示,经0.3mmol/LCDCA处理48h后,HCT-116细胞表现出典型的凋亡形态:细胞数量明显减少,细胞体积变小,细胞核固缩和染色质凝聚(图2B、D)。AO/EB染色结果显示,细胞核着绿色呈固缩状或圆珠状的为早期凋亡细胞,核染色质为橘红色并呈固缩状或圆珠状为晚期凋亡细胞。结果表明,CDCA处理后HCT-116细胞表现出典型的凋亡形态特征(图2F)。
2.3CDCA对HCT-116细胞周期的影响CRCHCT-116细胞经0.2、0.4mmol/L的CDCA作用48h后,HCT-116细胞在各时相的分布发生了显著的变化,见表1。其中,G2/M期细胞比例增加(P<0.05),S期细胞比例明显减少(P<0.05),见图3。
2.4CDCA对HCT-116细胞线粒体膜电位的影响 检测结果显示,随着CDCA浓度的增加,绿色荧光强度降低;随着CDCA处理浓度的增加,细胞的荧光峰逐渐向左移动,线粒体吸附Rhodamine123的能力下降,荧光强度逐渐减弱,细胞线粒体膜电位出现降低和崩塌,见图4。
2.5CDCA对HCT-116细胞凋亡的影响 应用流式细胞仪检测脱氧胆酸对BGC-823细胞凋亡率的影响发现,在一定浓度范围内,随着浓度的升高,细胞凋亡率逐渐升高,其中在0.4mmol/L的CDCA作用下细胞凋亡率达到54.50%,早期凋亡率达到27.52%(P<0.05),见表2、图5。

图4 流式细胞术检测线粒体膜电位
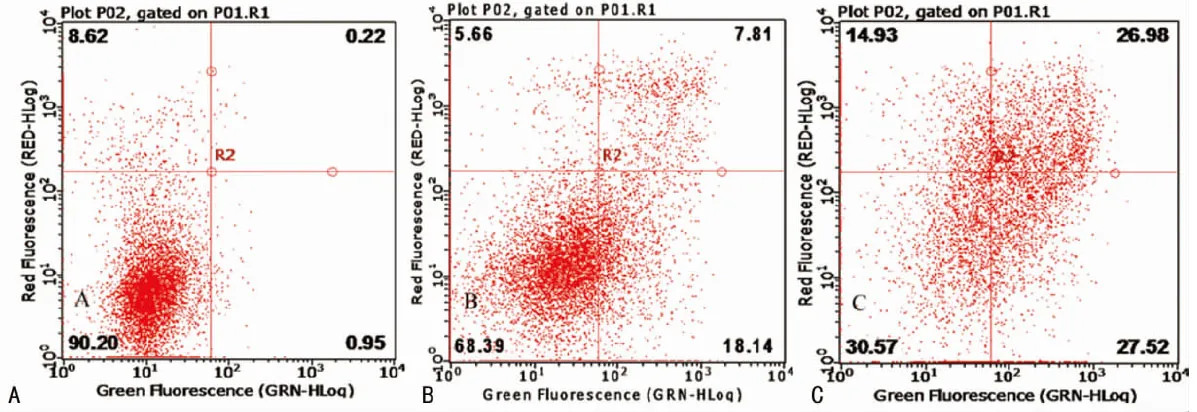
图5 流式细胞术检测细胞凋亡情况
3 讨 论
细胞凋亡在肿瘤发生、发展和治疗中具有重要作用,目前诱导肿瘤细胞的凋亡成为肿瘤治疗研究中的一个主要目标与常用手段[8]。本试验选用结肠癌HCT-116细胞为试验材料,研究了CDCA对HCT-116细胞的增殖抑制作用及诱导其凋亡的作用。本研究证实了CDCA能够有效地抑制结肠癌HCT-116细胞的增殖,并且呈现剂量依赖性。这也同前人用其他药物作用于结肠癌细胞的结果一致[9-11]。同时,形态学检测也表明CDCA可诱导HCT-116细胞产生明显的凋亡现象。
凋亡的早期表现是线粒体膜电位的降低。经CDCA诱导处理后的HCT-116细胞线粒体膜电位降低,且随着药物浓度的升高,低荧光强度细胞所占比例越来越多。提示CDCA可能具有通过线粒体途径诱导HCT-116细胞凋亡的生物学效应。此外,流式细胞术检测细胞凋亡率的结果表明CDCA诱导HCT-116细胞凋亡具有浓度依赖性。
细胞周期的调控是抑制肿瘤细胞生长的一个有效的方法,许多抗癌药物将细胞周期阻滞在G2/M期[12-13]。本研究发现,CDCA能够有效地把HCT-116细胞阻滞在G2/M期,并可能通过线粒体途径诱导HCT-116细胞凋亡,说明CDCA可通过抑制HCT-116细胞的周期进程从而抑制肿瘤细胞的生长增殖,而对于具体凋亡机制的确定还需要更进一步的研究和探讨。因此,深入探索脱氧胆酸诱导人结肠癌HCT-116 细胞凋亡的机制,对于进一步研究人结肠癌细胞凋亡发生的机制及抗肿瘤的研究具有非常重要的指导意义和实际应用意义。
[1]吕强,邢沈阳,赵志辉,等.结肠癌的研究现状及展望[J].中国实验诊断学,2009,13(8):1134-1137.
[2]LiJ,WuWJ,YangJB,etal.Effectofchenodeoxycholicacid(CDCA)additiveonphenothiazinedyessensitizedphotovoltaicperformance[J].SciChinaChem,2011,54(4):699-706.
[3]张飞,赵静国,赵蒙浩.鹅去氧胆酸与熊去氧胆酸的合成工艺研究[J].化学与生物工程,2014,31(1):47-50.
[4]肖冰,青青,智发朝.胆石症的药物治疗[J].现代消化及介入诊疗,2010,15(6):358-362.
[5]KeeneCD,RodriguesCM,EichT,etal.Abileacidprotectsagainstmotorandcognitivedeficitsandreducesstriataldegenerationinthe3-nitropropionicacidmodelofHuntington′sdisease[J].ExpNeurol,2001,171(2):351-360.
[6]SongW,YangHB,WangSM.ApoptosisofhumangastriccarcinomaSGC-7901inducedbydeoxycholicacidviatheMitochondrial-Dependentpathway[J].ApplBiochemBiotechnol,2013,28(10):2273-2289.
[7]YangHB,SongW,ChengMD,etal.DeoxycholicacidinhibitsthegrowthofBGC-823gastriccarcinomacellsviaap53-mediatedpathway[J].MolMedRep,2015,11(4):2749-2754.
[8]deSouzaPM,LindsayMA.Apoptosisasatherapeutictargetforthetreatmentoflungdisease[J].CurrOpinPharmacol,2005,5(3):232-237.
[9]郭立达,焦振霞,宋瑛,等.姜黄素诱导结肠癌LoVo细胞凋亡的作用及机制研究[J].中国中药杂志,2013,38(13):2191-2196.
[10]沈岚,谭洁.熊果酸诱导结肠癌HT-29细胞凋亡与凋亡相关基因的关系[J].实用诊断与治疗杂志,2006,20(11):784-786,860.
[11]彭军,林久茂.魏丽慧半枝莲提取物诱导结肠癌HT-29细胞凋亡的机制研究[J].福建中医药大学学报,2010,20(6):35-38.
[12]李士怡,周一荻.莪术三棱白花蛇舌草对肿瘤细胞抑制作用的研究[J].实用中医内科杂志,2006,20(3):246-247.
[13]张丽.苦豆碱抑制结肠癌细胞HT29增殖诱导细胞周期阻滞的作用及机制研究[D].广州:南方医科大学,2014.
The effect and mechanism of apoptosis induced by chenodeoxycholic acid in human colon cancer HCT-116 cells*
GuoShuai1,GaoYanping2,ZhaoYaying3,ZhouEnxu3,FuLi3,GaoHuiru3,RenYuanjing3,ZhaoAnfang3△
(1.DepartmentofGeneral,theSecondPeople′sHospitalofPingdingshanCity,Pingdingshan,Henan467000,China;2.ZhumadianEnvironmentalMonitoringStation,Zhumadian,Henan463000,China;3.SchoolofLifeSciencesandEngineering,HenanUniversityofUrbanConstruction,Pingdingshan,Henan467036,China)
Objective To evaluate the effects of chenodeoxycholic acid (CDCA) on human colon cancer cell line and to explore its mechanisms.Methods We used cell culture,MTT assay,HE staining,Giemsa staining,AO/EB staining and flow cytometry to detect cell survival rate,morphological changes,cell cycle,mitochondrial membrane potential and cell apoptosis rate of HCT116 cells after CDCA treated.Results HCT-116 cells were treated with CDCA for 48 h and itsIC50was 0.304 mmol/L;the inhibition rate of 88.4% was achieved when the concentration was 0.800 mmol/L,showing nuclear chromatin concentration and fragmentation as well as cell shrinkage and other morphological changes characteristic of apoptosis;CDCA arrested cell cycle at G2/M phase and induced mitochondrial membrane potential low.After treated with CDCA(0.400 mmol/L) for 48 h,cell apoptosis rate was 54.5%.Conclusion CDCA significantly inhibits the growth of HCT-116 cells in a dose-dependent manner and arrested cell cycle at G2/M phase,which indicates apoptosis of HCT-116 cells could be induced by CDCA via the mitochondrial-dependent pathway.
chenodeoxycholic acid;colonic neoplasms;apoptosis;cells
国家自然科学基金项目(81402309);河南省科技攻关项目(132102310118,142102310120);河南省教育厅科学技术研究重点项目(13A180044)。 作者简介:郭帅(1978-),主治医师,本科,主要从事普外科方面研究。△
10.3969/j.issn.1671-8348.2016.23.001
R36;Q291
A
1671-8348(2016)23-3169-04
2016-04-08
2016-06-21)
