RP-HPLC法同时测定石榴皮和石榴汁中鞣花酸的含量
2016-12-19范高福付恩桃刘修树
范高福,付恩桃,汤 洁,刘修树,王 玮
(1.合肥职业技术学院 生物应用技术系,安徽 合肥 238000;2.合肥市食品药品监督检验所,安徽 合肥 238000)
RP-HPLC法同时测定石榴皮和石榴汁中鞣花酸的含量
范高福1,付恩桃1,汤 洁1,刘修树1,王 玮2
(1.合肥职业技术学院 生物应用技术系,安徽 合肥 238000;2.合肥市食品药品监督检验所,安徽 合肥 238000)
目的:建立同时检测石榴皮、汁中鞣花酸的含量测定方法。方法:采用反相高效液相色谱法,Hypersil C18 (250 mm×4.6 mm,5μm)色谱柱,以乙腈-0.3% TFA(20 ∶80)为流动相,梯度洗脱,流速1.0 mL/min,柱温30 ℃,检测波长254 nm。结果:鞣花酸0.1048~20.96 μg/mL之间线性关系良好(r=0.9999),平均加样回收率为99.55%(RSD=1.44%,n=9)。结论:此方法灵敏快速、准确易行,可用于石榴皮、汁中鞣花酸含量的同时检测。
鞣花酸;石榴皮;石榴汁;反相高效液相色谱法;含量测定
石榴(PunicagranatumL.),别名安石榴,为石榴科石榴属落叶灌木或小乔木,具有药食同源价值,可以离体种植培养[1],主要分布于安徽怀远、山东枣庄、陕西临潼、四川会理、云南蒙自、新疆叶城等地区。石榴皮和石榴汁分别为石榴的干燥果皮和新鲜果汁,均含有丰富的多酚类、类黄酮、花色素等生物活性物质[2],其中多酚类鞣花酸(ellagic acid, EA)成分研究较多,呈多酚二内酯结构特征,是没食子酸的二聚衍生物,具有抗氧化、抗肿瘤、抗炎及抗菌等多种药理作用[3]。据文献报道以石榴皮提取物测定鞣花酸含量方法较多,而以石榴汁为原料测定少见,未见对安徽地区石榴皮、汁中鞣花酸含量同时测定方法具体报道,本实验采用反相高效液相色谱法(RP-HPLC),建立石榴皮、汁提取物中鞣花酸含量同时测定方法,为安徽本地石榴提取物的深加工研究与开发提供参考。
1 材料与方法
1.1 材料与试剂
石榴:安徽怀远(购自蚌埠市石榴水果批发市场,经安徽中医药大学药学院彭华胜教授鉴定为石榴科石榴属石榴);甲醇、乙腈为色谱纯;鞣花酸对照品:纯度≥95%(美国Sigma,批号:2075083);Milli-Q超纯水,其他试剂均为分析纯;石榴汁、皮提取物,本实验室自制。
1.2 仪器与设备
Thermo-U3000 UHPLC系统:配有TCC-3000RS紫外检测器及DAD-3000二极管阵列检测器,美国赛默飞公司;Milli-Q Biocel超纯水系统;KQ-2200E型超声波清洗器(昆山舒美超声仪器有限公司);RE-52AA型旋转蒸发仪(上海楚柏实验室设备有限公司);FA1004型电子天平(天津天马),HWS24型电热恒温水浴锅(上海一恒科技有限公司),SHB-III型循环水式多用真空泵(郑州长城科教仪器有限公司)。
1.3 方法
1.3.1 色谱条件 色谱柱:Hypersil C18(250 mm×4.6 mm,5 μm) ;流动相:乙腈:0.3%三氟乙酸(Trifluoroacetic acid ,TFA)(20 ∶80);柱温30 ℃;流速1.0 mL/min;进样量10 μL;检测波长254 nm。在此色谱条件下,鞣花酸特征峰峰型良好,其色谱图如图1所示。
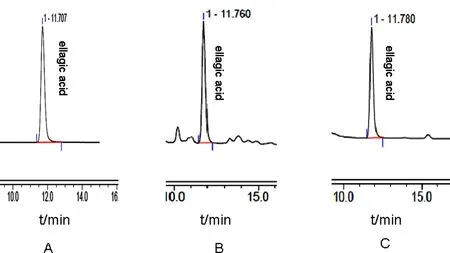
图1 HPLC色谱图
1.3.2 对照品溶液的制备 精密称定鞣花酸对照品10.48 mg,置于100 mL容量瓶中,用甲醇溶解并定容至刻度,制成浓度为0.1048 mg/mL的对照品储备液[4]。
1.3.3 供试品石榴汁溶液的制备[5]称取新鲜石榴,剥皮去籽榨汁,4000 r/min离心除去悬浮物,用旋转蒸发仪浓缩体积约至原来1/10,取10 g浓缩物,再用酸化甲醇(含盐酸1.2 mol/L和0.2 g维生素C)50 mL超声1 h,溶解后10000 r/min离心5 min后再取上清液,备用。酸化甲醇加入量=W/2*10(W为浓缩物质量)。
1.3.4 供试品石榴皮溶液的制备 将石榴皮在30 ℃晾干,用粉碎机打成粉末,精密称取1.005 g,加80%(φ)丙酮100 mL浸渍约6 h,超声(功率500 W,频率40kHz)处理1 h,滤过,残渣用80%(φ)丙酮30 mL洗脱,合并滤液和洗涤液,用旋转蒸发仪浓缩至干燥物,加50%酸化甲醇溶液100 mL(含1. 2 mol /L的盐酸和0. 2 g维生素C),90 ℃回流,再用旋转蒸发仪浓缩至干燥物,用甲醇溶解,定容100 mL 容量瓶中[6-7]。精密吸取10 mL于50 mL容量瓶中,用甲醇定容,0.45 μm的微孔滤膜滤过,滤液作为供试品溶液。
1.3.5 检测波长的选择 对照品溶液采用二极管阵列检测器进行扫描,吸收图谱见图2。结果表明在254 nm处鞣花酸有最大吸收,无干扰峰出现,且分离度较好。最终确定254 nm作为检测波长[8-9]。
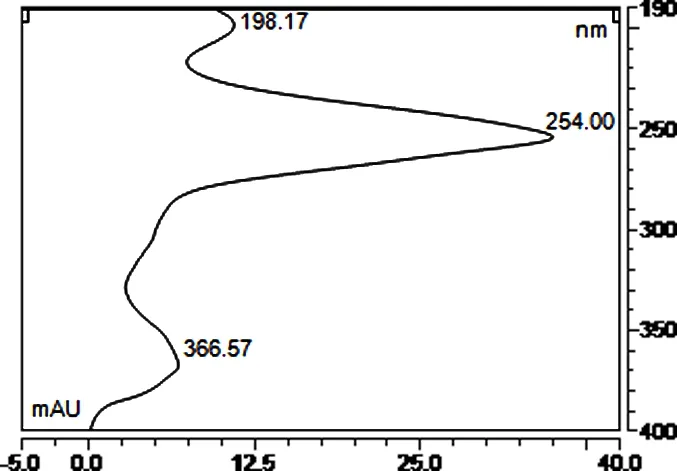
图2 鞣花酸对照品溶液二极管阵列扫描图
2 结果与分析
2.1 线性关系考察
精密吸取鞣花酸对照品溶液适量,稀释后得浓度为0.1048、0.524、1.048、2.096、5.240、10.48、20.96 μg/mL的系列标准溶液,照“1.3.1”项下色谱条件注入高效液相色谱仪,记录色谱图,以峰面积为横坐标(X),系列标准溶液浓度为纵坐标(Y),绘制鞣花酸的标准曲线,鞣花酸的回归方程为:Y=0.6285X+0.0468,r=0.9999(n=7),线性范围为0.1048~20.96 μg/mL。
2.2 精密度试验
取浓度为1.048 μg/mL的对照品溶液,连续进样6次,每次进样量为10 μL,得鞣花酸的峰面积的RSD 0.28%,说明仪器精密度良好。
2.3 稳定性试验
取石榴汁样品溶液按上述色谱条件分别在0、1、2、4、6、8、12、24 h进样,进样量为10 μL,计算得鞣花酸的峰面积的RSD 0.41%,说明样品在24 h内稳定。
2.4 重复性试验
取石榴汁样品平行制取供试品溶液6份并分别进样,进样量为10 μL,鞣花酸峰面积的RSD 1.02%,重复性良好。
2.5 加样回收率试验
取已知质量浓度(1.048 μg/mL)的石榴汁10 mL,共9份,按照低、中、高三个浓度分别加入适量鞣花酸对照品溶液,按1.3.3项下方法制备。并进样分析,计算鞣花酸的平均回收率为99.55%(见表1),RSD 1.44%。
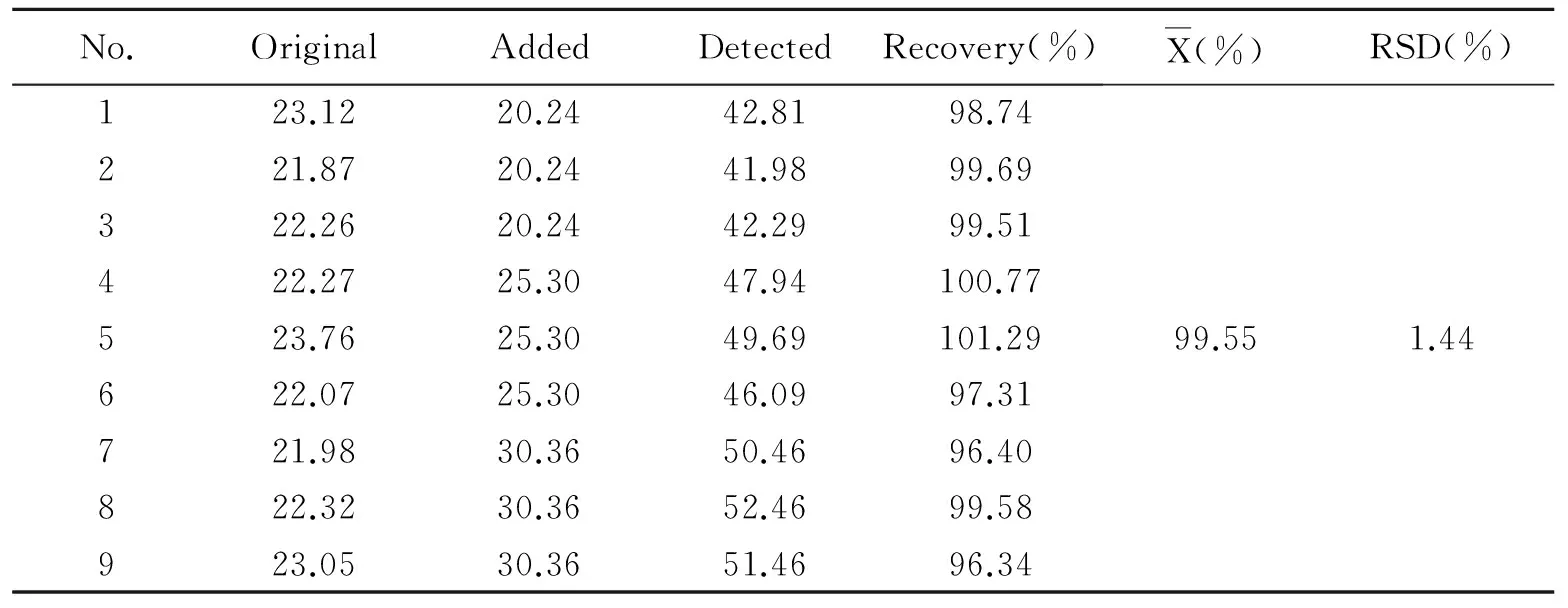
表1 鞣花酸加样回收率(n=9)
2.6 样品含量测定
取安徽怀远产地石榴2种,分别为白石榴(A品种)和红石榴(B品种),按照“1.3.3和1.3.4”项下制备供试品石榴汁、皮溶液,按外标法测定鞣花酸的含量,结果见表2。
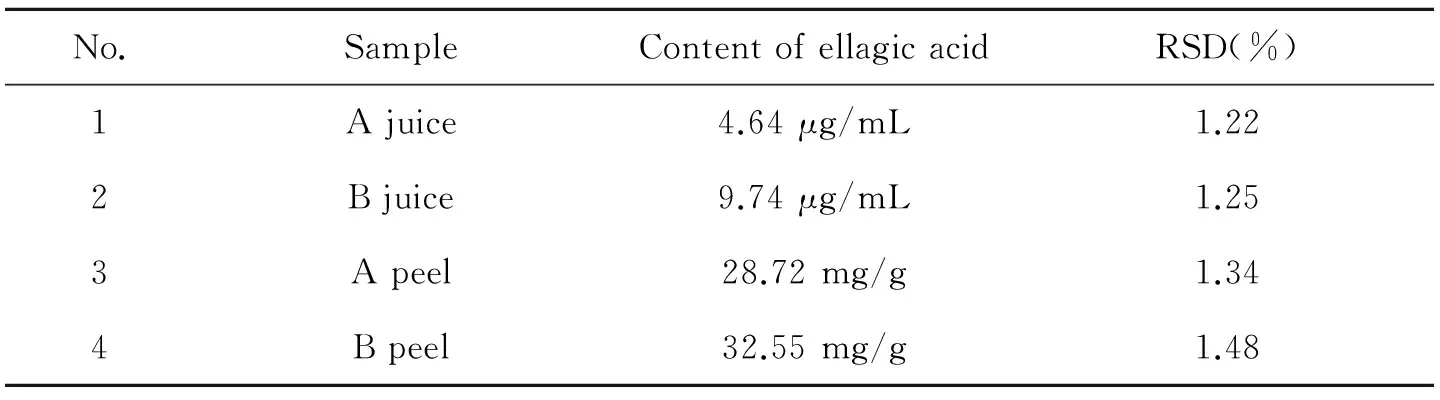
表2 石榴汁、皮中鞣花酸的含量(n=3)
3 结论与讨论
采用RP-HPLC法同时测定安徽石榴皮、汁中鞣花酸含量时,考察了样品提取过程及样品不同部位对提取物含量的影响。通过酸化提取液可加速提取物石榴鞣花酸的浸出,因提取物石榴鞣花酸具有多酚结构,易氧化,加入维生素C可阻碍提取过程中石榴鞣花酸的氧化变质。通过对石榴汁、皮的相同处理方法,结果表明石榴皮部位鞣花酸含量是石榴汁部位约3.5~6倍,白石榴品种鞣花酸含量是红石榴品种约1倍。另外,在乙醇、丙酮、甲醇不同溶剂对石榴皮、汁中石榴鞣花酸提取物溶解度对比,结果发现甲醇中的溶解度较好,且干扰峰较少,可以满足样品制备的需要,因此选择甲醇作为样品制备的溶剂。
预实验结果表明该样品以乙腈-0.2%TFA作为流动相有可能实现预期的色谱峰分离,并在此流动相系统基础上进一步进行比例筛选,最终确定以乙腈-0.3%TFA(20 ∶80)为流动相体系时,样品峰和杂质峰能够实现较好的分离,且分离度大于1.5。此外,考察了流动相的不同pH对峰形的影响,分别选择加入0.1%、0.2%、0.3%及0.4%的TFA的出峰情况,结合峰的分离和峰形,最终选择加入0.3%的TFA作为流动相。
本实验建立了同时测定石榴皮、汁中鞣花酸含量的反相高效液相色谱(RP-HPLC)方法,经方法学考察,该方法符合《中国药典(2015年版)》中有关质量标准建立的要求[10],具有灵敏快速、准确易行、重现性好等优点,可用于准确测定石榴皮、汁中鞣花酸的含量。
本课题组收集了安徽地区主产地怀远的石榴样品,并对其石榴皮、汁中鞣花酸含量进行了测定,结果表明石榴皮所含鞣花酸含量较石榴汁中明显高,白石榴品种所含鞣花酸含量较红石榴品种高,提示以石榴皮为药材有一定的合理性,并可作为石榴中鞣花酸质量控制提供参考。此外,目前石榴主要作为水果食用,加工主要是取石榴瓤榨汁为主,其石榴皮多作为废物处理,为石榴皮变废为宝,回收再利用提供依据。
[1]彭丽萍,郜海莲.防止软籽石榴外植体褐变的研究[J].安徽科技学院学报,2011,25(2):28-31.
[2]李海霞,王钊,刘延泽.石榴科植物化学成分及药理活性研究进展[J].中草药,2002,33(8):765-766.
[3]冯立娟,陶吉寒,尹燕雷,等.石榴功能物质鞣花酸研究进展[J].食品科学,2014,35(23):325-330.[4]唐婧,郑胜彪,张雪梅,等.超声提取-高效液相色谱测定滁菊中的木犀草素[J].安徽科技学院学报,2010,24(6):48-51.
[5]彭海燕,陈祥贵,刘振平,等.RP-HPLC法测定石榴汁中鞣花酸的含量[J].食品科技,2012,37(4):283-285.
[6]丁楠,高晓黎.HPLC法测定石榴皮提取物中鞣花酸的含量[J].新疆医科大学学报,2012,35(6):770-772.
[7]周本宏,吴振华,刘春,等.高效液相色谱法测定石榴皮中鞣花酸的含量[J].广东药学院学报,2005,21(6):693-694.
[8]刘振平,陈祥贵,彭海燕,等.RP-HPLC法同时测定石榴皮中4种多酚类成分的含量[J].中国药房,2013,24(3):238-240.
[9]陈孝娟,顾政一,徐芳,等.不同产地的石榴皮总多酚的含量测定[J].时珍国医国药,2011,22(3):541-543.
[10]国家药典委员会编.中华人民共和国药典(四部)[S].2015年版,北京:中国医药科技出版社,2015:59-61.
Content Simultaneous Determination of Ellagic Acid in Pomegranate Peel and Juice by RP-HPLC
FAN Gao-fu1, FU En-tao1, TANG Jie1, LIU Xiu-shu1,WANG Wei2
(1.Department of Biotechnology Applications, Hefei Vocational and Technical College, Hefei 238000, China;2. Hefei Institute for Food and Drug Control, Hefei 238000, China)
Objective: To estabish a method for the content determination of ellagic acid in pomegranate peel and juice. Methods: RP-HPLC method was used. The determination was carried out on Hypersil C18(250 mm×4.6 mm, 5 μm)with mobile phase consisted of acetonitrile-0.3%TFA(20 ∶80)with gradient elution at a flow rate of 1.0 mL/min. The column temperature was 30 ℃. The detection wave length of ellagic acid was at 254 nm. Results: The line range was 0.1048~20.96 μg/mL for ellagic acid(r=0.9999). The average recoveries were 99.55%(RSD=1.44%, n=9). Conclusion: The method is sensitive and rapid, accurate and feasible for the content determination of ellagic acid in pomegranate peel and juice.
Ellagic acid;Pomegranate peel; Pomegranate juice; RP-HPLC; Content determination

(责任编辑:马世堂)
2016-02-20
安徽省高校自然基金研究重点项目(KJ2015A440, KJ2016A616); 安徽省教育厅重点质量工程项目(2014sxzx047)。
范高福(1982-), 男, 安徽省全椒县人,硕士, 讲师, 主要从事药物制剂研究。
S132
A
1673-8772(2016)05-0067-04
