利奈唑胺治疗感染性心内膜炎临床分析
2016-12-19卢芬何朝生胡湘明张莉滟李晓明廖火生林蔡弟
卢芬,何朝生,胡湘明,张莉滟,李晓明,廖火生,林蔡弟
· 论著 ·
利奈唑胺治疗感染性心内膜炎临床分析
卢芬1,何朝生1,胡湘明1,张莉滟1,李晓明1,廖火生1,林蔡弟1
目的 探讨利奈唑胺治疗感染性心内膜炎(IE)的疗效及安全性。方法 纳入2009年1月~2015年3月间于广东省人民医院平洲分院收治的诊断为感染性心内膜炎并使用利奈唑胺抗感染治疗的住院患者11例,分析其临床特点及使用利奈唑胺治疗IE的临床疗效及不良反应。结果 入选患者男性6例,女性5例,平均年龄(47.0±19.4)岁;既往心脏病史:二尖瓣脱垂3例,风湿性心脏病瓣膜置换术后3例(其中1例安装起搏器),既往感染性心内膜炎病史2例,先天性心脏病史1例,无心脏病史2例;心脏瓣膜损害情况:左心自体瓣膜4例,右心自体瓣膜1例,左右心自体瓣膜1例,人工瓣膜5例;病原菌:粪肠球菌3例,丙酸丙酸杆菌1例,路邓葡萄球菌1例,金黄色葡萄球菌2例,表皮葡萄球菌1例,血链球菌1例,血培养阴性2例;血培养阳性细菌对糖肽类及噁唑酮类抗菌药物均敏感;心脏超声情况:单纯瓣膜赘生物形成5例,赘生物并穿孔3例,赘生物并瓣周脓肿1例,单纯瓣膜脓肿2例;治疗情况:急诊手术1例,择期手术4例,保守治疗6例,治愈10例,治愈率达90.90%;使用利奈唑胺时间5~56 d,平均(23.6±16.2)d;随访时间最短6个月,最长4年无复发;主要不良反应为血小板减少,总共有6例,占54.55%,患者停药和输注血小板或予重组人血小板生成素治疗后均恢复正常。结论 利奈唑胺治疗IE临床疗效好,主要不良反应为血小板减少,是一种可逆性不良反应。
利奈唑胺;感染性心内膜炎;临床疗效;血小板减少
利奈唑胺是目前唯一获准应用于临床的噁唑酮类抗菌药物,于2000年4月获得美国FDA批准上市,其抗菌作用机制新颖,与其他药物无交叉耐药,对革兰氏阳性球菌具有广谱强效的抗菌活性,口服生物利用度高,组织穿透性强,在全身多种组织中分布浓度高,其良好的临床疗效和安全性已经在大量的临床研究与实践中得到证实[1]。但利奈唑胺治疗革兰阳性球菌引起的感染性心内膜炎的大规模临床研究报导在国内外尚少见。本文回顾性分析广东省人民医院平洲分院于2009年1月~2015年3月期间应用利奈唑胺治疗感染性心内膜炎(IE)患者11例,总结这11例患者的临床特点,并探讨利奈唑胺在IE患者中的疗效及安全性。
1 资料与方法
1.1 研究对象 通过电子病历系统搜索广东省人民医院平洲分院2009年1月~2016年1月诊断IE的住院患者共734例,其中11例患者在住院过程中使用利奈唑胺(斯沃,美国辉瑞公司,用法:静脉滴注600 mg,1/12 h) 抗感染治疗,部分患者病情稳定出院后予以序贯治疗(斯沃,美国辉瑞公司,用法:口服600 mg,1/12 h)抗感染治疗;11例患者均符合改良的Duke诊断标准[2]。
1.2 收集临床资料 查阅住院病历,收集入选患者的性别、年龄、病史、实验室及超声心动图检查、诊治过程等临床资料,并在门诊随访和电话随访患者及家属询问患者目前状况。
1.3 评价指标
1.3.1 血培养药敏结果分析 7例血培养阳性细菌(3例粪肠球菌及4例葡萄球菌)由法国生物梅里埃VITEK-2 Compact细菌鉴定仪进行鉴定与药敏试验,所用试剂为其配套试剂。参照美国临床和实验室标准协会(CLSI)推荐的MIC法测定肠球菌菌种常用抗菌药物的最小抑菌浓度;另外有1例血链球菌及1例丙酸杆菌采用K-B纸片扩散法,操作和结果判读按美国临床实验室标准化委员会(NCCLS)制定的新规定及标准进行。
1.3.2 利奈唑胺不良反应 收集患者用药前后全血细胞计数和肝肾功能的动态变化数据。全血细胞计数中记录白细胞、中性粒细胞、血红蛋白和血小板计数;肝功能中记录丙氨酸氨基转移酶和总胆红素;肾功能采用肌酐值,采用改良的肾病膳食改良试验公式估算肾小球滤过率[3],以估算的肾小球滤过率<60 ml/min定义为肾功能不全[4]。
1.3.3 治疗转归 主要分为治愈,复发,未愈,死亡。治愈:应用抗生素4~6周后体温和血沉恢复正常,自觉症状改善和消失,脾脏缩小,红细胞和血红蛋白上升,尿常规转阴,且在停用抗生素后第1、2、6周作血培养均为阴性,可认为IE已治愈[4]。治愈率为治愈患者总数占治疗总人数的百分比。复发:如在治疗结束,症状改善,血培养转阴后又出现感染征象,且菌种和早期培养相同,称之为复发[4]。未愈:应用抗生素治疗过程中临床症状未改善或恶化甚至死亡,炎症指标无好转,持续血培养阳性,赘生物无机化或缩小。死亡:IE已治愈,由于其他原因导致死亡。
1.4 数据处理及统计学分析 应用SPSS 13.0分析数据,采用均数±标准差(±s)的形式表示计量数据,计数资料以百分数表示。
2 结果
2.1 入组患者的临床情况描述 共入选11例患者,男性6例,女性5例,男女比例约1:1,年龄25~79岁,平均(47.0±19.4)岁。合并其他疾病情况:1例有2型糖尿病合并慢性支气管炎史;1例有静脉药瘾史合并丙型肝炎史;1例有糖尿病史;1例有重度营养不良合并急性肾病综合征;1例有甲状腺功能亢进合并高血压,均对症治疗中。基础心脏病史:二尖瓣脱垂3例,风湿性心脏病瓣膜置换术后3例(其中1例安装起搏器),既往感染性心内膜炎病史2例,先天性心脏病史1例,无心脏病史2例;心脏瓣膜损害情况:左心自体瓣膜4例,右心自体瓣膜1例,左右心自体混合瓣膜1例,人工瓣膜5例。血培养结果:粪肠球菌3例,丙酸丙酸杆菌1例,路邓葡萄球菌1例,金黄色葡萄球菌2例(1例为耐甲氧西林金黄色葡萄球菌),表皮葡萄球菌1例,血链球菌1例,血培养阴性2例。超声提示瓣膜病变特点:单纯瓣膜赘生物形成5例,赘生物并穿孔3例,赘生物并瓣周脓肿1例,单纯瓣膜脓肿2例(表1)。
2.2 血培养药敏结果 3例粪肠球菌对青霉素类、喹诺酮类、糖肽类及噁唑酮类抗菌药物均敏感;4例葡萄球菌中有3例对青霉素耐药,有1例金黄色葡萄球菌对苯唑西林耐药,4例对糖肽类及噁唑酮类抗菌药物均敏感(表2)。另有1例血链球菌及1例丙酸丙酸杆菌均对青霉素类、头孢类、喹诺酮类、糖肽类及噁唑酮类抗菌药物均敏感。
2.3 利柰唑胺治疗IE临床疗效及不良反应分析 11例患者使用利奈唑胺治疗时间为5~56 d,平均(23.6±16.2)d。使用利奈唑胺治疗过程中患者临床症状均明显改善,复查炎症指标好转,血培养转阴性,心脏超声提示好转;主要不良反应为血小板降低,总共有6例,占54.55%,其中1例合并贫血(表3)。
2.4 转归及随访情况 急诊手术1例,择期手术4例,保守治疗6例,治愈10例,治愈率达90.90%(10/11);随访时间最短6个月,最长4年无复发。随访内容主要包括治疗疗程结束后分别于第1、2、6个月复查患者临床症状、体温、血沉、血常规、尿常规、血培养、心脏超声等,治愈患者中随访期间有2例出现死亡(1例患者于1年10个月后因小脑出血死亡,另1例患者于9个月后死亡,死因不明)。1例患者于3年后出现人工生物瓣重度瓣内返流并中度梗阻。未治愈者1例,为主动脉瓣人工生物瓣膜置换术后,患者拒绝手术,于6个月后因反复菌血症及顽固性心衰死亡(表3)。
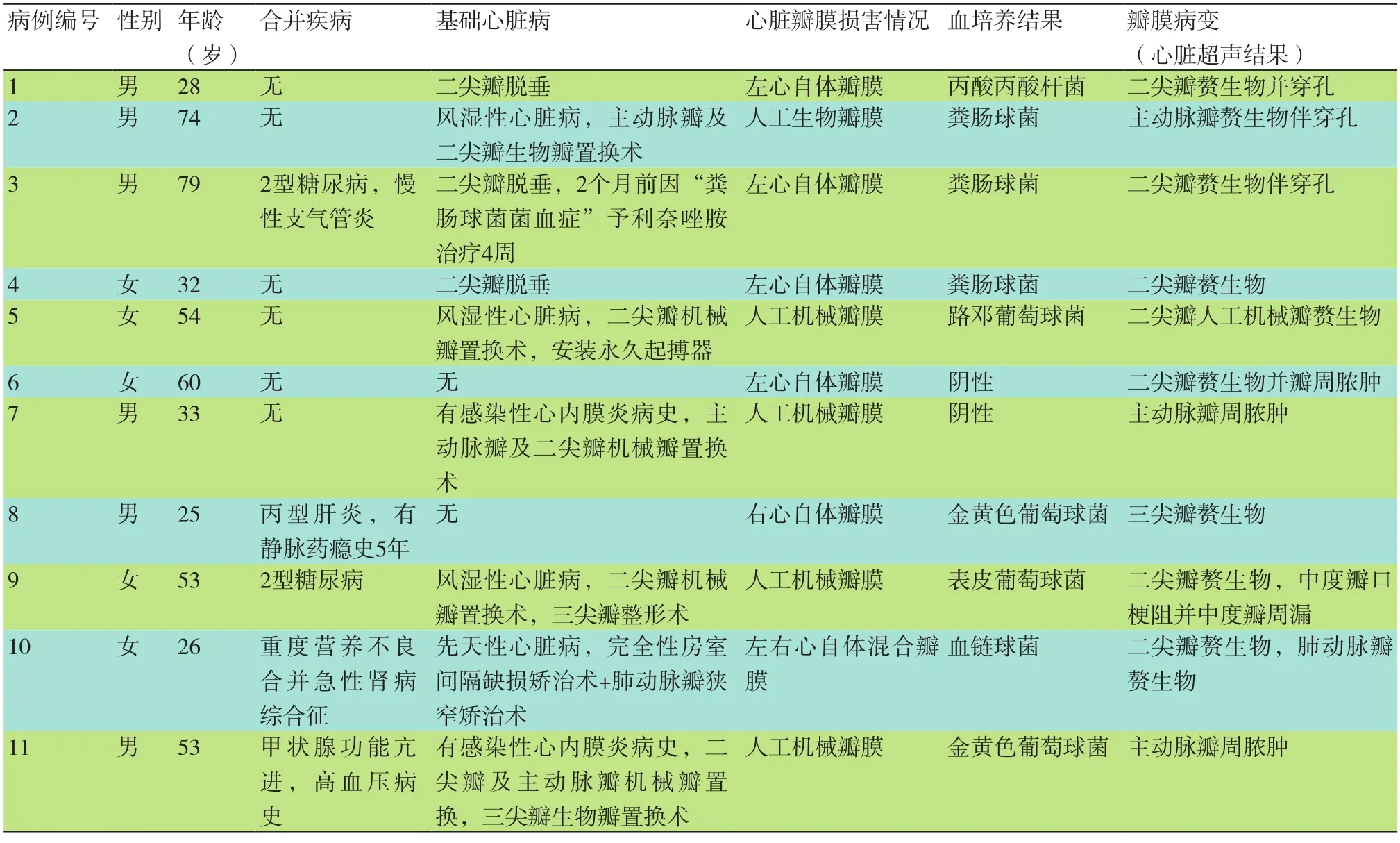
表1 11例感染性心内膜炎患者的临床情况
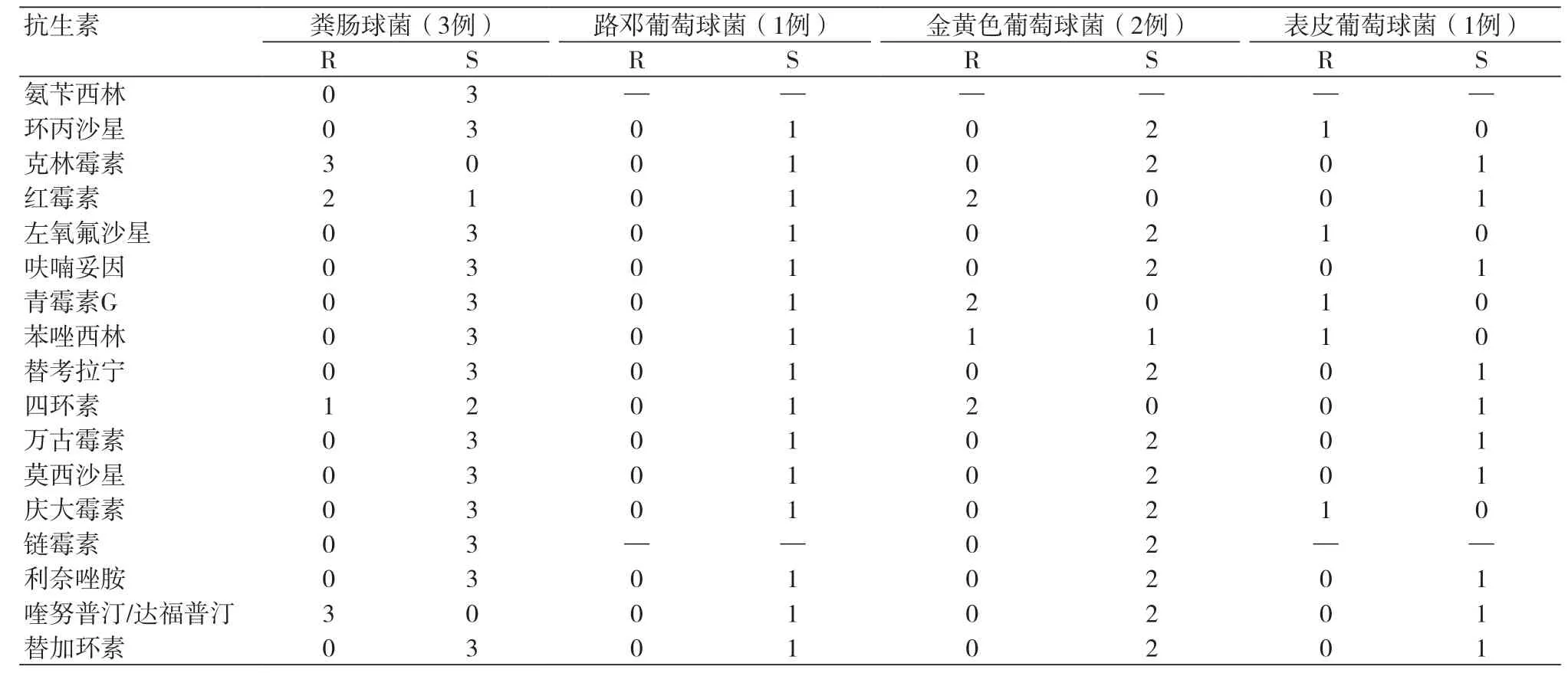
表2 7例血培养阳性细菌对各种抗菌素的药敏结果(MIC法)
3 讨论
目前,利奈唑胺已在临床使用10余年,现有资料证明利奈唑胺几乎在所有器官组织(血液,皮肤软组织,脂肪,肌肉,骨关节,肺部,泌尿道,中枢神经系统,腹腔等)细胞内渗透达到有效的抑菌浓度,可用于各种敏感菌所致的感染[5]。有学者认为,利奈唑胺与盐酸万古霉素注射液相比在治疗重症革兰阳性菌感染的患者中有更好的临床效果[6]。但是,由于其只具抑菌活性及长疗程使用导致毒副反应的不确定性,所以目前仍未被指南认定为治疗感染性心内膜炎的规范化抗感染药物[7]。最近,美国心脏学会委员会成员建议,对于不能耐受万古霉素或用其它抗生素治疗失败的多重耐药革兰阳性细菌性IE,利奈唑胺是可供选择的替代药物[8]。Falagas等[9,10]于2006年统计,英文文献已报道利奈唑胺治疗IE 33例,其中大多为多重耐药革兰阳性菌感染。2007年Munoz等[11]补充报道了经利奈唑胺治疗的IE9例,并对上述42例的临床特点与治疗效果进行了分析,结果为利奈唑胺治愈率达79%。

表3 利奈唑胺使用情况及不良反应和治疗转归
本文回顾分析我科室近6年使用利奈唑胺治疗IE11例,治愈10例(其中包括急诊手术1例,择期手术4例,保守治疗5例),治愈率达90.90%,临床疗效好,并且该药口服生物利用度高,可方便患者出院后口服序贯治疗。其中一例病例失败者考虑原因为患者拒绝手术,感染灶未去除有关,应重视手术治疗在感染性心内膜炎的重要性;病原菌为粪肠球菌3例,丙酸丙酸杆菌1例,路邓葡萄球菌1例,金黄色葡萄球菌2例(其中1例为MRSA),表皮葡萄球菌1例,血链球菌1例;所有细菌均对利奈唑胺敏感。
国外研究报道,1046例临床试验患者中,利奈唑胺较常见的不良反应包括腹泻、头痛、恶心、呕吐、失眠、便秘、皮疹和头晕等;实验室检查有肝功能异常、尿素氮升高和血小板减少症等[12],偶见可逆性的骨髓抑制[13]。本文回顾性分析利奈唑胺治疗感染性心内膜炎11例,其中使用利奈唑胺治疗时间最短5 d,最长为56 d,主要不良反应为血小板降低,总共有6例,占54.55%,使用利奈唑胺治疗后血小板降低时间分别为5 d,14 d,28 d,35 d,14 d,24 d,其中2例无需停药,有4例需停药(其中2例需输注血小板及重组人血小板生成素治疗),多数患者停药后3~10 d血小板恢复正常,其中2例换用氨基糖肽类抗生素治疗,血小板无继续下降。利奈唑胺相关性血小板减少症的发生机制尚不完全明确,国外报道其发生率从2.4%~64.7%各异[14-17],血小板减少一般认为是骨髓抑制,但也有人认为与免疫介导有关,而非骨髓抑制[18]。本文有两例血小板减少时行骨髓穿刺涂片及活检结果均未提示骨髓抑制。其中有一例出现贫血,考虑可能为利奈唑胺的不良反应,但具体原因未明;血小板的生长周期为7~14 d,本文6例患者停药后3~10 d血小板恢复正常,说明这是一种可逆不良反应。临床使用利奈唑胺时应密切监测血象尤其是血小板变化。
本研究样本量较小,且为回顾性研究,IE患者在使用利奈唑胺治疗过程中和或联合使用多种抗生素治疗,可能对骨髓抑制或血小板减少等不良反应存在多重影响;临床上对于长疗程使用利奈唑胺的疗效评价及不良反应总结尚欠缺,尚需在大样本量、前瞻性研究中进一步证实。
[1] 陈佰义. 利奈唑胺在特殊人群中应用的临床疗效与安全性[J]. 中华内科杂志,2013,52(3):248-50.
[2] Li JS,Sexton DJ,Mick N,et al. Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis[J]. Clin Infect Dis,2000,30(4):633-8.
[3] 古丽拜尔·卡哈尔,侍效春,刘晓清. 利奈唑胺临床治疗安全性分析[J]. 中国全科医学,2013,16(7A):2296-8.
[4] 王吉耀,廖二元,黄从新,等. 内科学2版[M]. 北京:北京人民卫生出版社,2012.
[5] 王国建,陈建. 临床治疗中利奈唑胺的药效学和药动学研究进展[J]. 中国抗生素杂志,2013,38(10):730-5.
[6] 张旭东,崔琳,刘柳. 利奈唑胺和万古霉素治疗重症感染的疗效观察[J]. 中国现代医生,2013,51(35):42-4.
[7] Munoz.P, Rodriguez-Creixems M, Moreno M, et al. Linezolid therapy for infective endocarditis[J]. Clin Microbiol Infect,2007,13(2):211-5.
[8] 苗丽,邓万俊. 利奈唑胺治疗多重耐药革兰阳性细菌性心内膜炎的研究进展[J]. 国外医药:抗生素分册,2007,28(6):272-6.
[9] Hill EE,Herijgers P,Herregods MC,et al. Infective endocarditis treated with linezolid: case report and literature review[J]. Eur J Clin Microbiol Infect Dis,2006,25(3):202-4.
[10] Falagas ME,Manta KG,Ntziora F,et al. Linezolid for the treatment of patients with endocarditis: a systematic review of the published evidence[J]. J Antimicrob Chemother,2006,58(2):273-80.
[11] Munoz P,Rodriguez-Creixems M,Moreno M,et al. Linezolid therapy for infective endocarditis[J]. Clin Microbiol Infect,2007,13(2):211-5.
[12] American Thoracic Society. Infectious Diseases Society of America Guidelines for the management of adults with hospitalacquired,ventilator-associated,and healthcare-associated pneumonia[J]. Am J Respir Crit Care Med,2005,171(4):388-416.
[13] Stevens DL,Bisno AL,Chambers HF,et al. Practice guidelines for the diagnosis and management of skin and soft-tissue infections[J]. Clin Infect Dis,2005,41(10):1373-406.
[14] Gerson SL,Kaplan SL,Bruss JB,et al. Hematologic effects of linezolid: summary of clinical experience[J]. Antimicrob Agents Chemother, 2002,46(8):2723-6.
[15] French G. Safety and tolerability of linezolid[J]. J Antimicrob Chemother,2003,51(suppl 2): ii45-53.
[16] Bishop E,Melvani S,Howden BP,et al. Good clinical outcomes but high rates of adverse reactions during linezolid therapy for serious infections: a proposed protocol for monitoring therapy in complex patients[J]. Antimicrob Agents Chemother,2006,50(4):1599-602.
[17] Rao N,Hamilton CW. Efficacy and safety of linezolid for grampositive orthopedic infections: a prospective case series[J]. Diagn Microbiol Infect Dis,2007,59(2):173-9.
[18] Vardakas KZ,Kioumis I,Falagas ME. Association of pharmacokinetic and pharmacodynamic aspects of linezolid with infection outcome[J]. Curr Drug Metab,2009,10(1):2-12.
本文编辑:阮燕萍
Clinical analysis of infective endocarditis treated with linezolid
LU Fen*, HE Chao-sheng, HU Xiang-ming, ZHANG Li-yan, LI Xiao-ming, LIAO Huo-sheng, LIN Cai-di.*Department of General Medicine, Pingzhou Branch of Guangdong Provincial People's Hospital
(Guangdong Provincial Academy of Medical Sciences), 528251 Foshan, China.
Objective To investigate the curative effect and safety of linezolid in treatment of infective endocarditis (IE). Methods The patients (n=11) diagnose with IE and treated with linezolid in the Pingzhou Branch of Guangdong Provincial People’s Hospital were chosen from Jan. 2009 to Mar. 2015. The clinical characteristics of the patients, and curative effect and adverse reactions of linezolid were analyzed. Results There were 6 male patients and 5 female ones among all patients, and the average age (47.0±19.4). Among all patients, there were 3 with mitral valve prolapsed, 3 with valve replacement after rheumatic heart disease (one of them implanted pacemaker), 2 with history of IE, 1 with history of congenital heart disease, and 2 without history of heart disease. There were 4 cases with left autologous valve IE, 1 with right autologous valve IE, 1 with left-right autologous valve IE, and 5 with artificial valve IE. There were 3 cases with infection of enterococcus faecalis, 1 with propionibacterium, 1 with staphylococcus lugdunensis, 2 with staphylococcus aureus, 1 with staphylococcus epidermidis, 1 with streptococcus sanguis, and 2 with negative blood culture results. Blood culture positive bacteria were sensitive to glycopeptides antibiotics and oxazolidinone antibiotics. There were 5 cases with simple valvular vegetation, 3 with vegetation and perforation, 1 with vegetation and paravalvular abscess, and 2 with simple valvular abscess. There was 1 case with emergency surgery, and there were 4 with selective surgery and 6 with conservative treatment. There were 10 cases cured and the cure rate was 90.90%. The duration of taking linezolid was from 5 d to 56 d and average day=(23.6±16.2). The shortest follow-up time was 6 m and the longest time of no recurrence was 4 y. The major adverse reaction was thrombocytopenia. There were totally 6 cases (54.55%) with thrombocytopenia, and they recovered after stopping medication, transfusing platelet or giving recombinant human thrombopoietin (rhTPO). Conclusion Linezolid is effective to IE in clinic. The major adverse reaction was thrombocytopenia, which is a reversible adverse reaction.
Linezolid; Infective endocarditis; Clinical efficacy; Thrombocytopenia
R542.4
A
1674-4055(2016)11-1333-04
广东省科技计划(2014A020290010);广东省医学科学技术研究基金项目(A2016386)
1528251 佛山,广东省人民医院 广东省医学科学院平洲分院综合内科
何朝生,E-mail:13711629988@139.com
10.3969/j.issn.1674-4055.2016.11.14
