氟化物对家蚕血液和中肠酪氨酸酶活性的影响
2016-12-17米智,曾彪,徐水,朱勇*
米 智, 曾 彪, 徐 水, 朱 勇*
(1.西南大学生物技术学院,重庆 400716;2.山西大同大学生命科学学院,山西 大同 037009)
氟化物对家蚕血液和中肠酪氨酸酶活性的影响
米 智1,2, 曾 彪1, 徐 水1, 朱 勇1*
(1.西南大学生物技术学院,重庆 400716;2.山西大同大学生命科学学院,山西 大同 037009)
为了探讨氟化物对家蚕代谢机制的影响,以家蚕耐氟品种T6和氟化物敏感品种734为研究材料,从5龄起蚕开始分别添食经50、100、200、400 mg/kg NaF溶液浸泡后的新鲜桑叶,检测家蚕血液和中肠中酪氨酸酶活性的变化。结果表明,在血液中,734添氟组酪氨酸酶活性是对照组的0.79~1.71倍,T6约是对照组的0.59~0.96倍。734对照组和2个低浓度添氟组(50、100 mg/kg NaF处理组)之间差异极显著(P<0.01),2个高浓度添氟组之间差异显著(P<0.05);T6对照组和最高浓度添氟组之间的差异极显著。在中肠中,734添氟组酪氨酸酶活性是对照组的0.60~1.16倍,T6约是对照组的1.23~1.62倍。734、T6对照组和最高浓度添氟组之间差异显著(P<0.05)。敏感家蚕酪氨酸酶活性因添食NaF浓度的高低表现出不同的活性,NaF对耐氟家蚕血液酪氨酸酶活性起抑制作用,而对中肠酪氨酸酶活性起促进作用。本试验表明,家蚕酪氨酸酶活性与蚕体的耐氟性能有一定的相关性。
家蚕;氟化物;血液;中肠;酪氨酸酶
近年来随着工农业的发展,陶瓷、砖瓦、磷肥、炼铝、水泥、玻璃、火力发电等部门排放的废气中含有大量氟化物,给蚕桑生产带来较大的危害。氟化物是一类原生质毒剂,研究表明,氟化物随桑叶进入蚕体累积于消化液、肠壁和体壁等处,通过消化管进入血液,在血液和组织中与蛋白质结合,抑制生长发育,出现氟中毒症状[1]。氟中毒能损害中枢神经系统,内分泌系统及心、肝、肾等,并引起生物酶学改变和免疫功能改变[2]。
酪氨酸酶(EC.1.14.18.1)是一种含铜的氧化还原酶,广泛存在于生物体中[3]。在植物中,酪氨酸酶一般称为多酚氧化酶;在昆虫中,则称为酚氧化酶;在微生物和人体中,称为酪氨酸酶。根据分解底物的不同,通常将昆虫酚氧化酶分为酪氨酸酶类型酚氧化酶(tyrosinase-type phenoloxidase,简称酪氨酸酶tyrosinase)和漆酶类型酚氧化酶(laccase-type phenoloxidase,简称漆酶laccase)。这2种类型酚氧化酶都是含多个铜离子的金属蛋白酶,结构和性质非常相似[4]。酪氨酸酶具有双重催化功能,既可以催化单酚类物质(如酪氨酸)的羟化,又可以催化多酚类物质的氧化,这种双重反应功能,对生物体黑色素的形成和外来物侵入时获得性免疫反应的产生至关重要[5-6];漆酶不能氧化酪氨酸等单酚类物质,只能催化多酚类物质进行氧化,尤其对间位酚和对位酚类似物表现出较强的催化能力,不被一氧化碳所抑制[7]。昆虫酪氨酸酶原经体内蛋白酶水解激活成酪氨酸酶,在表皮损伤部位催化黑化反应合成黑色素,在凝集外源侵染物过程中发挥重要作用[8-9]。目前酪氨酸酶是已知生物体中参与黑色素合成的关键酶[10-12],不仅决定黑色素合成的速率,还是黑色素细胞分化成熟的特征性标志[13-14]。
本试验通过研究家蚕添食NaF后中肠和血液中酪氨酸酶活性变化,为从生理生化水平上阐明家蚕对氟化物的代谢机制提供参考。
1 材料与方法
1.1 试验材料
家蚕耐氟品种T6、敏感品种734,由中国农业科学院蚕业研究所提供,西南大学生物技术学院家蚕遗传育种室保存。按照常规方法饲养到5龄起蚕时,对照组喂食清水浸泡11 min后自然晾干的新鲜桑叶,试验组分别用50、100、200、400 mg/kg NaF溶液浸泡11 min后自然晾干的桑叶饲养[15],每隔8 h添食1次,每天添食3次。试验采用平行设计,每组设3个重复。从5龄起蚕第1~7天每天分别取各组幼虫的组织样品。
1.2 组织样品制备
1.2.1 血淋巴的提取[16-17]将蚕体表用蒸馏水擦洗处理后,并用吸水纸擦干,使蚕体弯曲,用无菌剪刀剪其腹足让血液滴入放有少许苯基硫脲的预冷离心管中,在0~4 ℃下5000 r/min离心15 min,取上清液作为酶液,-70 ℃冰箱保存备用。
1.2.2 中肠组织的分离[16-17]在冰浴中,用消毒解剖刀将幼虫从腹部到头部剖开,取出整个肠道,去除肠道内由围食膜包裹的食物,将中肠部分放到预冷的生理盐水中漂洗干净桑叶残渣,将中肠于滤纸上迅速吸干,每5头蚕的中肠收集于1个离心管中。加预冷的0.1 mol/L pH 6.2磷酸缓冲液进行匀浆,之后10 000 r/min离心10 min,取上清液作为酶粗提液,放于-70 ℃冰箱保存备用。
1.3 测定方法
1.3.1 蛋白质含量的测定 蛋白质含量的测定参照Bradford[18]考马斯亮蓝G-250染色法进行测定。以牛血清白蛋白的含量为横坐标,以OD595为纵坐标绘制标准曲线。所得方程为:y=0.0068x+ 0.0172,R2=0.998。
1.3.2 酪氨酸酶活性测定 参照刘吉平[19-20]的方法,并略有改动。取0.01 mol/L邻苯二酚1.5 mL,0.1 mol/L pH 6.2磷酸缓冲液1.4 mL于试管内混匀后,作为酶液的底物反应体系,放在30 ℃水浴中10 min,以2.9 mL的底物反应体系做空白对照调零后,加入0.1 mL经磷酸缓冲液稀释后的酶粗提液;混匀后立即在紫外分光光度计420 nm处测定吸光值在90s内的变化,记录每30 s测定的OD420值的大小。每个样品均重复3次测定,取平均值,以每分钟每毫克蛋白的吸光度改变0.001为所需的酶量,计算酶比活力,计算公式如下。
U=ΔOD/[(0.001×蛋白量(mg)×测定时间(min)]
其中,U为酶的比活力值(U/mg)。ΔOD为测定起始时间与终止时间的吸光度差值。
1.4 数据统计
试验数据使用Excel软件对酪氨酸酶活性做柱状图分析;运用SPSS17.0软件对酶活性采用Duncan方法进行多重比较。
2 结果与分析
2.1 氟化物对家蚕血液酪氨酸酶活性的影响
从图1~2可以看出,氟化物敏感品种734对照组血液酪氨酸酶活性前3 d呈上升趋势,且在第3天达到最大值,后4 d呈下降趋势,但变化趋势很缓,近乎一条直线;50 mg/kg NaF处理组的酶活性前2 d上升,之后下降,但在第6天的酶活性突然升高达12.41U,第7天的酶活性降低整个试验期最低;100 mg/kg NaF处理组在前4 d呈先升后降的趋势,且在第2天达最大值,最后3 d的酶活性呈下降趋势,但后3 d的酶活性远大于前4 d的;200 mg/kg NaF处理组的酶活性前2 d呈上升,之后骤降至约3.22 U,后4 d呈波折型上升趋势,第6~7天变化幅度很大;400 mg/kg NaF处理组前4 d酶活力变化很平缓,略小于4 U,之后的2 d酶活力上升。耐氟品种T6对照组血液酪氨酸酶活性在1~3 d呈下降趋势,且酶活性大于添氟处理组,4~6 d的酪氨酸酶活性约在6~7 U之间,最后1 d稍下降;50 mg/kg NaF处理组的活性在整个试验期呈现先升后降再升的变化趋势,第7天的活性最大,且远大于其他各处理组;100 mg/kg NaF处理组整体上呈现“M”的变化趋势,第1天的酶活性最低,且低于其它各处理组,在第2和6天出现2个极大值;200 mg/kg NaF处理组酶活性变化规律基本同100 mg/kg NaF处理组,但是幅度大于100 mg/kg NaF处理组。400 mg/kg NaF处理组变化趋势较缓和,前4 d呈下降趋势,后3 d的酶活性相似。
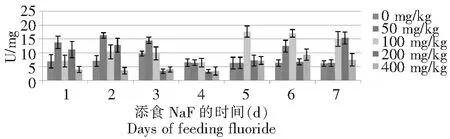
图1 734的5龄幼虫添食NaF后血液酪氨酸酶活性的变化Fig.1 Variations of tyrosinase activity of hemolymph in 5th instar larvae of Bombyx mori 734 after treatment with NaF
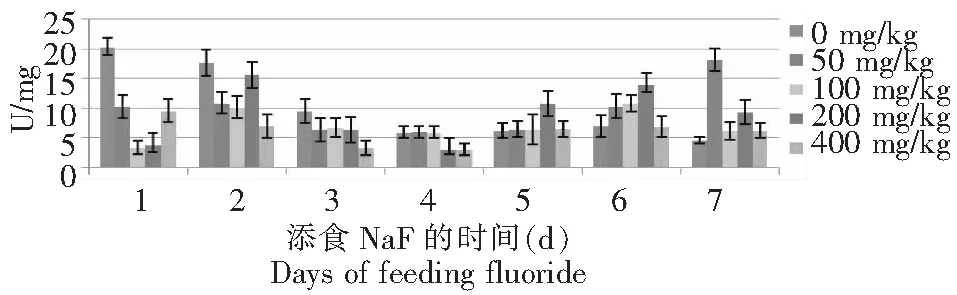
图2 T6 的5龄幼虫添食NaF后血液酪氨酸酶活性的变化Fig.2 Variations of tyrosinase activity of hemolymph in 5th instar larvae of Bombyx mori T6 after treatment with NaF
2.2 氟化物对家蚕中肠酪氨酸酶活性的影响
从图3~4可见,氟化物敏感品种734对照组中肠酪氨酸酶活性在整个试验期呈上下波动趋势变化,第2和4 天均是极大值;50 mg/kg NaF处理组的酶活性前2 d下降,在3~4 d上升,且达到最大值,之后又呈波动型变化;100 mg/kg NaF处理组前4 d呈上升趋势,最后3 d呈波动型变化,200 mg/kg NaF处理组前4 d和后3 d均呈现上升的趋势,只是第5天的酶活性最低;400 mg/kg NaF处理组的酶活性变化较缓和,前3 d的酶活性略大于3 U,中间2 d的酶活性略小于7 U,最后2 d约11U,从整个实验数据来看,最后4 d的酶活性大于前3 d的,而且变化幅度较大;耐氟品种T6对照组中肠酪氨酸酶活性在1~3 d相似,第4天是试验期的最大值,最后3 d呈上升的变化趋势;500 mg/kg NaF处理组前4 d呈直线上升,之后波折型变化;100 mg/kg NaF处理组前2 d酶活性相当,之后呈波折型变化,在第3和6天出现极大值;200 mg/kg NaF处理组前4 d和后3 d均呈上升趋势,但第4 天的酶活性最大;400 mg/kg NaF处理组前4 d呈上升趋势,后3 d波折型变化。
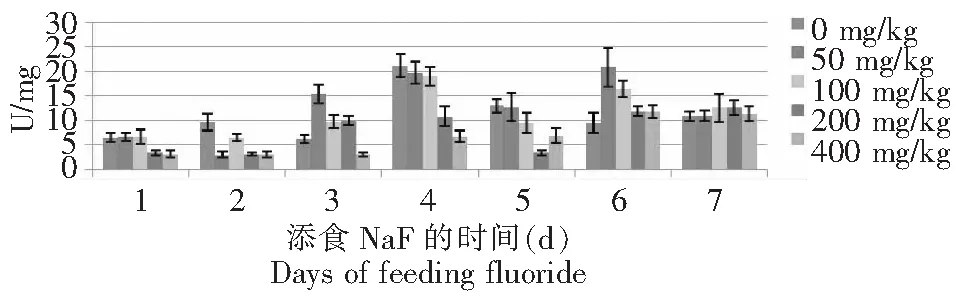
图3 734的5龄幼虫添食NaF后中肠酪氨酸酶活性的变化Fig.3 Variations of tyrosinase activity of midgut in 5th instar larvae of Bombyx mori 734 after treatment with NaF
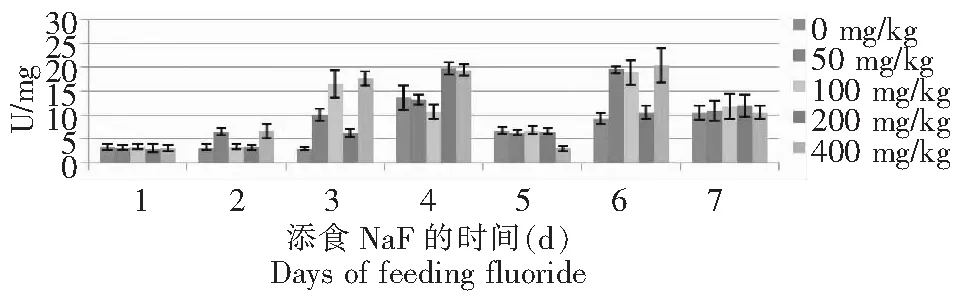
图4 T6的5龄幼虫添食NaF后中肠酪氨酸酶活性的变化Fig.4 Variations of tyrosinase activity of midgut in 5th instar larvae of Bombyx mori T6 after treatment with NaF
2.3 不同浓度氟化物及氟化物处理后不同天数血液酪氨酸酶活性差异显著性分析
734可分为对照组,低浓度添氟组(50、100 mg/kg NaF处理组)和高浓度添氟组(200、400 mg/kg NaF处理组)3组,对照组和低浓度添氟组之间差异不仅显著,而且极显著,而和高浓度添氟组之间的差异不显著,2个高浓度添氟组之间差异显著。T6对照组和最高浓度添氟组之间的差异不仅显著而且极显著,和100 mg/kg NaF处理组之间差异显著(表1)。
734血液的酪氨酸酶活性在添氟后第4天与其添氟后第2、5、6和7天差异显著,添氟后4 d和第6和7天差异极显著。T6在添氟处理后第2天与添氟后第3、4和5天差异不仅显著,而且极显著。2品种添氟处理后之间的差异不显著(表2)。
2.4 不同浓度氟化物及氟化物处理后不同天数中肠酪氨酸酶活性差异显著性分析
734对照组和最高浓度添氟组之间差异显著,50 mg/kg NaF处理组和400 mg/kg NaF处理组之间差异不仅显著,而且极显著。T6对照组和最高浓度添氟组之间差异显著(表1)。
734添氟后1~2、3和5、4和6 d 3组之间差异显著,组内差异不显著,第7天仅和第1、2、4 天之间的差异显著,第2天和除1 d以外时间点差异极显著,第4天和其它时间点差异极显著。T6添氟后1、2和5 d、3和7 d、4和6 d 3组之间的差异不仅显著,而且极显著。2品种在添氟处理后的5 d差异显著(表2)。
表1 734与T6添食不同浓度氟化物后血液和中肠酪氨酸酶活性多重比较
Table 1 Multiple comparison on activity variations of tyrosinase in hemolymph and midgut between 734 and T6 after treatment with different sodium fluoride
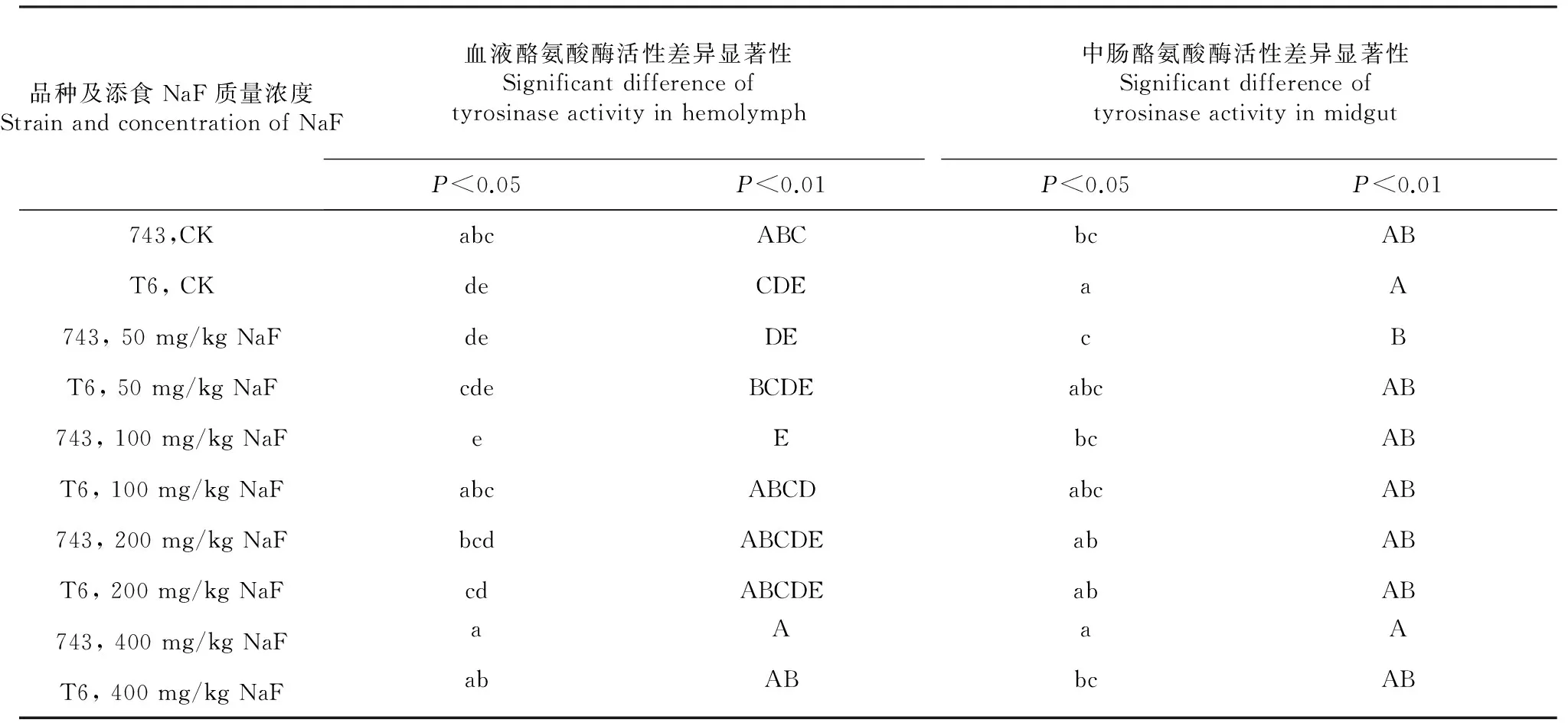
品种及添食NaF质量浓度StrainandconcentrationofNaF血液酪氨酸酶活性差异显著性Significantdifferenceoftyrosinaseactivityinhemolymph中肠酪氨酸酶活性差异显著性SignificantdifferenceoftyrosinaseactivityinmidgutP<0.05P<0.01P<0.05P<0.01743,CKabcABCbcABT6,CKdeCDEaA743,50mg/kgNaFdeDEcBT6,50mg/kgNaFcdeBCDEabcAB743,100mg/kgNaFeEbcABT6,100mg/kgNaFabcABCDabcAB743,200mg/kgNaFbcdABCDEabABT6,200mg/kgNaFcdABCDEabAB743,400mg/kgNaFaAaAT6,400mg/kgNaFabABbcAB
注:表中不同小写字母表示组间比较差异显著(P<0.05),大写字母表示组间比较差异极显著(P<0.01)。下同。 Note:Different low-case letters in the table represent significant difference between different groups (P<0.05),and the different upper-case letters represent extremely significant difference between different groups (P< 0.01). The same as below.
表2 734与T6添食NaF后不同时间段血液和中肠酪氨酸酶活性多重比较
Table 2 Multiple comparison on activity variations of tyrosinase in hemolymph and midgut at different time between 734 and T6 after treatment with sodium fluoride
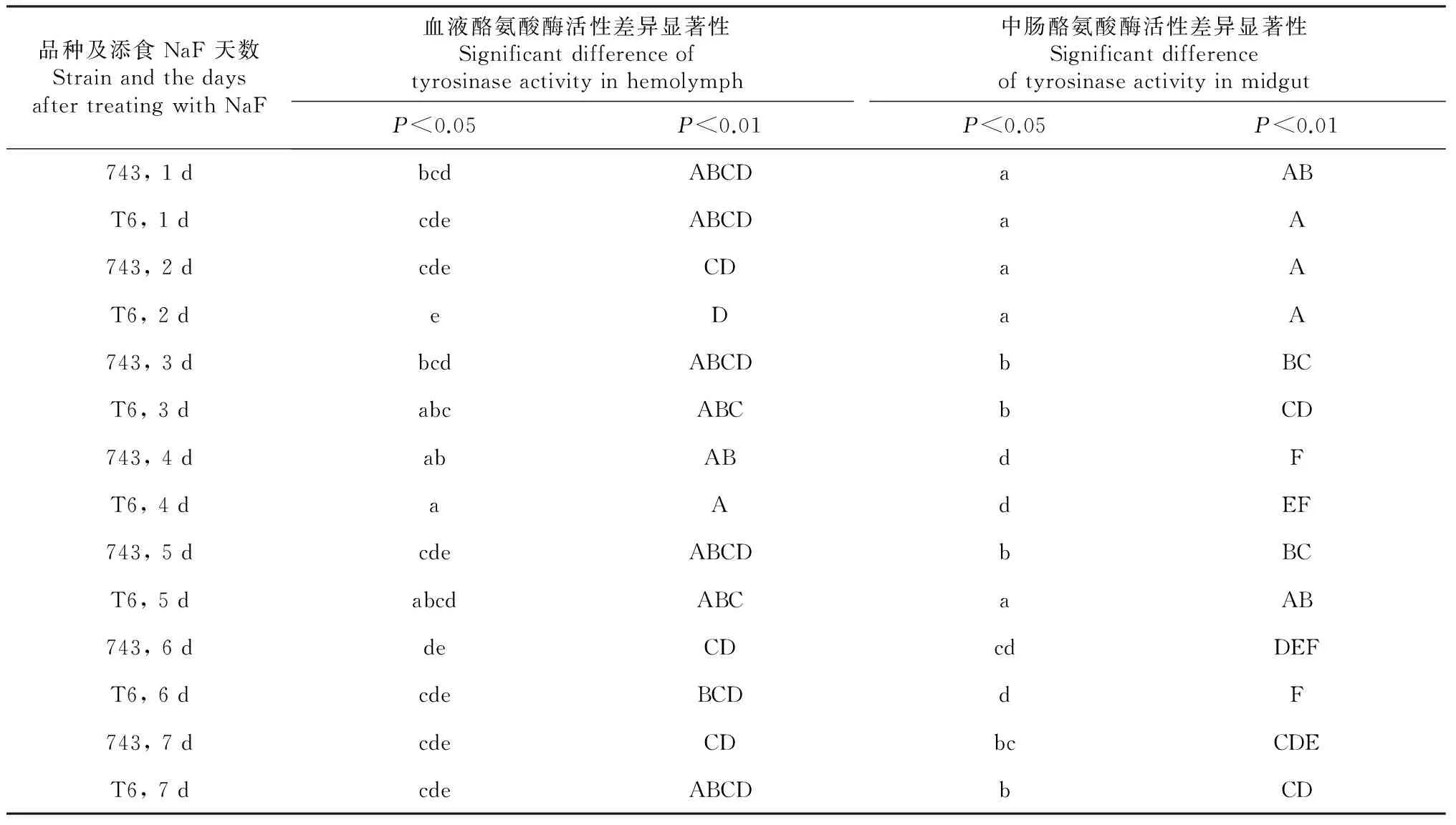
品种及添食NaF天数StrainandthedaysaftertreatingwithNaF血液酪氨酸酶活性差异显著性Significantdifferenceoftyrosinaseactivityinhemolymph中肠酪氨酸酶活性差异显著性SignificantdifferenceoftyrosinaseactivityinmidgutP<0.05P<0.01P<0.05P<0.01743,1dbcdABCDaABT6,1dcdeABCDaA743,2dcdeCDaAT6,2deDaA743,3dbcdABCDbBCT6,3dabcABCbCD743,4dabABdFT6,4daAdEF743,5dcdeABCDbBCT6,5dabcdABCaAB743,6ddeCDcdDEFT6,6dcdeBCDdF743,7dcdeCDbcCDET6,7dcdeABCDbCD
3 讨 论
酪氨酸酶在昆虫的正常发育过程中具有重要的生理功能:①参与表皮的硬化和黑化;②对卵壳的鞣化作用;③参与伤害防御;④加速伤口的愈合[21],是昆虫体内起主要免疫作用的氧化还原酶[22],当外来物入侵时,酪氨酸酶在外来物周围沉积形成黑色素,通过包裹和黑化来限制入侵的外来物。另外在酪氨酸酶被激活过程中,还产生具有细胞毒作用的氧自由基和潜在细胞毒作用的半醌及三羟酚,进一步增强寄主的防御能力[23]。
本实验对不同家蚕品系添食NaF,检测其血液和中肠的酪氨酸酶活性,在血液中,氟化物敏感品种734添氟组约是对照组的0.79~1.71倍,耐氟品种T6添氟组约是对照组的0.59~0.96倍。T6添氟处理后以及734的400 mg/kg NaF处理组的酪氨酸酶活性均低于对照组,而734的其它添氟组的酶活性反而高于对照组,原因可能与酪氨酸酶的化学结构有关,它是一种以Cu“为辅助因子的金属酶,每一个亚基含2个金属铜离子,2个铜离子分别与蛋白质分子中2个平展的组氨酸和一个弱的直立组氨酸配体结合,另有一个内源桥基将2个铜离子联系在一起,构成酪氨酸酶催化氧化反应活性中心[24]。当家蚕食有可溶性的NaF后,通过其消化、吸收等作用,氟离子以游离的状态存在于家蚕体内,这种非金属性较强的离子会和一些蛋白质或者金属阳离子结合,形成络合物或者较为稳定的盐,进而被代谢。由于酪氨酸酶是以铜离子为辅基的酶类,可能氟离子与铜离子竞争性结合之后,降低了酪氨酸酶活性,这种复合物进而被代谢。734对照组和2个低浓度添氟组(50、100 mg/kg NaF处理组)之间差异极显著,而和2个高浓度添氟组之间的差异不显著,2个高浓度添氟组之间差异显著。T6对照组和最高浓度添氟组之间的差异极显著。
在中肠中,734添氟组是对照组的0.60~1.16倍,T6添氟组是对照组的1.23~1.62倍。T6和734的2个低浓度添氟组的酪氨酸酶活性均大于对照组,而734的2个高浓度添氟组的酶活性低于对照组。由于中肠是各种毒物较早接触的器官,故NaF刺激家蚕体内免疫体系,发生防御性免疫反应,产生更多的酪氨酸酶(或提高了体内的酶活性),从而生成更多黑色素包被[19]。734在高浓度的NaF作用下,严重扰乱了酶的代谢系统[25],表现出酪氨酸酶活性降低。再者酪氨酸酶是一个很大的酶系,其在昆虫的不同种类以及昆虫的不同部位、不同发育时期的表达不同。734、T6对照组和最高浓度添氟组之间差异显著(P<0.05)。
本实验表明,NaF对耐氟品种T6血液酪氨酸酶活性起抑制作用,而对中肠酪氨酸酶活性起促进作用。敏感品种734的酪氨酸酶活性因NaF浓度的高低表现出不同的活性。推测家蚕酪氨酸酶活性与蚕体的耐氟性能有一定的相关性,而这种酶在家蚕对氟化物代谢过程中的作用机理尚不清楚,有待进一步研究。
[1]黄君霆, 朱万民, 夏建国, 等. 中国蚕丝大全[M]. 成都:四川科学技术出版社,1996:462-467.
[2]张 平. 氟化物遗传毒性的研究进展[J]. 畜禽业, 2009, 238(2):42-44.
[3]Sdnchez-Ferrer A, Rodriguez-Lopez J N, Garcia-Canovas F, et a1. Tyrosinase:a comprehensive review of its mechanism[J]. Biochim. Biophys. Acta, 1995,1247:1-11.
[4]Spira-Solomon D J, Solomon E I. Chemical and spectroscopic studies of the coupled binuclear copper site in type 2 depleted Rhus laccase. Comparison to the hemocyanins and tyrosinase[J]. J Am Chem Soc, 1987, 109(21):6421-6432.
[5]Hackman R H. Chemistry of insect cuticle. In the physiology of Insectal[M]. New York:Academic Press, 1974:216-270.
[6]Anderen S O. The biochemistry of insect cuticle[J]. A Rev Ent, 1979,24:29-61.
[7]Lontie R. Copper Proteins and copper enzymes[M].Boca Raton Fla:CRC Press, 1984:1-35, 207-241.
[8]Cerenius L, Lee B L, Soderhall K. The proPO-system:pros and cons for its role in invertebrate immunity[J].Trends Immunol, 2008, 29(6):263-271.
[9]Michel K, Suwanchaichinda C, Morlais I, et al.Increased melanizing activity inAnophelesgambiaedoes not affect development of Plasmodium falciparum[J]. Proc Natl Acad Sci USA, 2006, 103(45):16858-16863.
[10]Jinbing Liu, Wei Yi, Yiqian Wan, et al. 1-(1-Arylethylidene) thiosemicarbazide derivatives:A new class of tyrosinase inhibitors[J]. Bioorganic & Medicinal Chemistry, 2008,16:1096-1102.
[11]Kubo I, Yokokawa Y, Kinst-Hori I. Tyrosinase inhibitors from Bolivian medicinal plants [J].J Nat Prod., 1995, 58(5):739-743.
[12]Choi S W, Sepers G M. Purpling Reaction of Sinapic Acid Model Systems Containing L-DOPA and Mushroom Tyrosinase [J]. J Agric food Chem., 1994,42(5):1183-1189.
[13]Lei T C. Tyrosinase gene family and shin melanin biosynthesis [J]. Foreign Med Sci-Sec Dermotol, 1998, 24(2):811.
[14]Yan F, William H F. Purification and characterization of tyrosinase from gill tissue of Portabella mushrooms[J]. Phytoehemistry, 2004, 65(6):671-678.
[15]黄玲莉, 韦博尤, 蒙艺英. 氟化钠溶液浸泡时间对桑叶含氟浓度变化的试验[J]. 广西蚕业, 2005, 42(4):5-7.
[16]Wegener G, Tschiedel V, Schloder P, et al.The toxic and lethal effects of the trehalase inhibitor trehazolin in Iocusts are caused by hypoglycaemia[J]. Exp. Biol., 2003, 206(7):1233-1240.
[17]Silva M C P, Terra W R, Ferreira C. The role of carboxyl, guanidine and imidazole groups in catalysis by a midgut trehalase purified from an insect larvae[J]. Insect Biochem. Mol. Biol., 2004, 34(10):1089-1099.
[18]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analyt Biochem, 1976, 72:248-254.
[19]刘吉平, 汤宇杰, 王玉强, 等. 柞蚕感染微孢子虫前后的酪氨酸酶活力变化的研究[A]. 中国蚕学会第六届家蚕和柞蚕遗传育种学术研讨会论文集[C], 2009.
[20]Benjamin N D, Montgomery M W. Polyphenol oxidase of royal ann cherries:purification and characterization[J]. Journal of Food Science, 1973, 38:799-806.
[21]Chase M R, Raina K, Bruno J, Sugumaran M. Purification, characterization and molecular cloning of prophenoloxidase from Sarcophage bullata[J]. Insect Biochemistry and Molecular Biology, 2000, 30:953-967.
[22]罗克斯坦, 李绍文译. 昆虫生物化学[M]. 北京:科学出版社, 1988:151-153.
[23]Anderson R S, Oliver L M, Brubaeher L L. Superoxideanion generation by Crassostrea virgiuica hemocytes as measured by nitroblue tetrazolium reduction[J]. J. Invertebr Pathol, 1992, 59:303-307.
[24]Nwlson D, Maria A R, Alessandro D A.Application of laecases and tyrosinases (phenoloxidase) immobilized on different supports:a review[J]. Enzyme and Microbial Technology, 2002, 31:907-931.
[25]刘雨清. 氟化物的诱变性[J]. 国外医学(医学地理分册), 1996,17(2):58-60.
(责任编辑 陈 虹)
Effects of Fluoride on Activity of Tyrosinase in Hemolymph and Midgut ofBombyxmori
MI Zhi1,2, ZENG Biao1,XU Shui1, ZHU Yong1*
(1.College of Biotechnology, Southwest University, Chongqing 400716, China; 2.College of Life Science, Shanxi Datong University, Shanxi Datong 037009, China)
In order to explore the effects of NaF on the metabolic mechanism of silkworm (Bombyxmori) , the fluoride-resistant silkworm variety T6 and the fluoride-sensitive variety 734 were used as materials, the silkworm larvae from the first day of fifth instar with mulberry leaves soaked in 50, 100, 200 and 400 mg/kg NaF solutions were fed, respectively, and the tyrosinase activity in the silkworm’s hemolymph and midgut were examined. The results showed that the activity of tyrosinase in hemolymph was 0.79-1.71 times in 734 strain and 0.58-0.96 times in T6 strain compared with control group, respectively. The 734 strain tyrosinase activities of the two lower concentration(50, 100 mg/kg)NaF-treated groups and the control group were extremely significantly different(P<0.01), and their two higher concentration NaF-treated groups performed significant differences(P<0.05); T6’s control group and the highest concentration NaF-treated groups performed extremely significant differences. In midgut, the activities of tyrosinase in 734 strain were 0.60-1.16 times and in T6 strain 1.23-1.62 times compared with control group, and 734, T6’s control group and their highest concentration NaF-treated groups were significantly different(P<0.05). The activity fluoride-sensitive variety’s tyrosinase showed difference with feeding different concentrations of NaF. Fluoride could decrease the tyrosinase activity in the fluoride-resistant silkworm’s hemolyph but increase the activity in midgut. This results indicated that the tyrosinase activity had a certain relationship with the fluoride-resistant to silkworm.
Bombyxmori; Fluoride; Hemolymph; Midgut; Tyrosinase
1001-4829(2016)11-2763-06
10.16213/j.cnki.scjas.2016.11.046
2015-11-16
重庆市重大攻关项目(CSTC,2009AA1024);山西大同大学博士科研启动资金
米 智(1985-),男,山西大同人,博士,讲师,从事家蚕遗传育种研究,E-mail:mizhi775@126.com,*为通讯作者:朱 勇,教授,博士生导师,E-mail: zhuy@swu.edu.cn。
S851.34+7.31
A
