DHA对慢性应激诱导的抑郁行为及外周巨噬细胞功能的影响
2016-12-17薛红莎李玉玉刘白平张永平
张 才,薛红莎,李玉玉,刘白平,张永平,宋 采
(广东海洋大学食品科技学院,广东 湛江 524088)
DHA对慢性应激诱导的抑郁行为及外周巨噬细胞功能的影响
张 才,薛红莎,李玉玉,刘白平,张永平,宋 采
(广东海洋大学食品科技学院,广东 湛江 524088)
以慢性应激诱导的抑郁症为模型,通过测定大鼠蔗糖水偏好度、强迫游泳静止时间、肾上腺指数、血清皮质酮水平、巨噬细胞活性和吞噬能力,研究DHA的抗抑郁效果。结果表明:应激组与对照组相比,蔗糖水偏好度显著下降(P<0.05),强迫游泳静止时间显著延长(P<0.01),肾上腺指数、巨噬细胞活性和吞噬能力均显著增强(P<0.05);长期喂食DHA可以改善蔗糖水偏好度和静止时间(P<0.01),降低肾上腺指数、血清皮质酮水平、巨噬细胞活性和吞噬能力(P<0.05)。慢性应激可引起外周炎症反应增强和应激激素水平升高,DHA可在一定程度上调节外周炎症反应和激素水平,改善慢性应激诱导的抑郁症状。
抑郁症;行为;慢性不可预知性轻度应激;巨噬细胞;DHA
抑郁症是一种常见的情感性精神障碍疾病,预测到2020年将跃居世界疾病负担第二位[1-2]。过去几十年里,学者们提出了一系列经典抑郁症假说:遗传因素假说、单胺类神经递质假说、下丘脑-垂体-肾上腺功能障碍假说等。但基于这些假说研发的药物往往存在疗效差、副作用大的缺陷[3-5]。近些年来,精神神经免疫假说为抑郁症的研究开辟了新的方向。
慢性不可预知性应激(Chronic unpredictable mild stress,CUMS)能激活下丘脑-垂体-肾上腺轴(Hypothalamus-pituitary-adrenal,HPA),促进糖皮质激素(Glucocorticoid,GC)持续释放滞留,导致HPA轴反馈系统失衡,机体免疫系统功能紊乱,激活巨噬细胞释放大量炎症因子,活化 NF-κB(Nuclear factor-κB)炎症通道[6],吲哚胺2,3-双加氧酶(Ⅰndoleamine-2,3-Dioxygenase,ⅠDO)炎症通道[7]释放大量中枢炎症因子,造成中枢单胺类物质和神经营养物质减少,细胞毒性物质增加,从而改变神经传导,诱发中枢神经细胞死亡,进而导致抑郁症状。目前,CUMS抑郁症模型已被广泛用于抗抑郁药物的基础研究及筛选,且实验也已证明慢性应激刺激,动物明显表现出兴趣缺乏、绝望无助等抑郁样的行为变化[8-9]。此外,实验表明抑郁症伴随着炎症因子的改变,如白细胞介素-1β(Ⅰnterleukin-1β,ⅠL-1β),肿瘤坏死因子-ɑ(Tumor necrosis factor-ɑ ,TNF-ɑ)上升,ⅠL-10水平降低等[10-13],表明炎症在抑郁症中扮演重要角色。
Omega-3多不饱和脂肪酸(n-3PUF)作为天然的抗炎活性物质[14],它与抑郁症的负相关性假设早在20世纪80年代就被提出[15]。n-3PUFA系列的海洋资源极其丰富,主要抗抑郁的海洋生物活性物质为二十碳五烯酸(Eicosapentaenoic acid,EPA)和二十二碳六烯酸(Docosahexaenoic acid,DHA)。然而EPA和DHA在体内合成量远远不能满足机体对它们的需求,只能从饮食(特别是鱼类)中摄取。目前对EPA改善抑郁症状已有诸多报道[16-17],但对DHA研究较少。DHA是有22个碳原子、6个双键的直链脂肪酸,具有软化血管、健脑、益智等功效,俗称“脑黄金”[18]。DHA能抑制氧化应激和炎症因子的表达,促进神经元分化,提高认知能力[19]。但有研究显示纯的DHA对抑郁症或许无效,故目前对 DHA治疗抑郁症仍存在争议[10],特别在CUMS模型中DHA如何改变外周巨噬细胞免疫功能进而诱发抑郁症状仍不明确。
笔者以CUMS诱导的抑郁症为基础模型,结合精神神经免疫假说研究 CUMS诱导的抑郁行为和外周巨噬细胞免疫功能的亢进状况以及DHA对其的改善作用,为开发海洋多不饱和脂肪酸治疗抑郁症提供临床前依据。
1 材料与方法
1.1 实验动物
健康、性成熟SPF级Wistar雄性大鼠(250~280 g,合格证号:NO.44005800002878)由广州中医药大学实验动物中心提供。饲养条件为:每笼(380mm×325mm×180mm)饲养2只大鼠,温度(22±2)℃,湿度(50±10)%,12 h光照(7:00—19:00),自由摄食和饮水。实验动物的饲养和操作规程均遵守广东海洋大学实验动物饲养和使用的相关规定。
1.2 主要实验仪器及材料
强迫游泳装置购自上海欣软信息科技有限公司,DHA购自苏州仁普药业有限公司,棕榈油购自广州果漾生物科技有限公司,粉状基础饲料由广东医学实验动物中心加工,大鼠血清CORT试剂盒购自北京冬歌生物技术有限公司,中性红试剂购自北京鼎国昌盛生物技术有限责任公司,无水乙醇、无水乙酸、二甲基亚砜购自成都市科龙化工试剂厂,MTT试剂购自上海君创生物科技有限公司,胎牛血清和RPMⅠ1640购自天津市灏洋生物制品科技有限责任公司。
1.3 实验动物分组
将32只大鼠随机分为3组,分别为对照组(CT,混以质量分数5% palm,N=12),应激组(S,混以质量分数5% palm,N=10),应激+DHA组(S+DHA,混以质量分数 1%DHA+4%palm,N=10)。因为DHA/EPA已被广泛用于保健食品,结合课题组前期及他人诸多相关研究[20-22],表明DHA和EPA对正常饲养大鼠基本无影响,故本实验未设置 DHA正常对照组。各组大鼠体质量无显著性差异(P>0.05)。饲料制备及喂食方法均参考文献[22],即将DHA和棕榈油(无n-3PUF)按以上比率添加到粉状基础饲料,混合均匀。2~3 d制备饲料1次,-20℃存储。
1.4 应激策略
本实验采用CUMS抑郁症模型[22],42 d内,大鼠每天随机给予2种刺激且3 d内不重复。应激源为:4℃环境 1 h,18℃游泳10min,束缚1 h,光照过夜,小鼠笼过夜,孤独过夜,45°倾斜鼠笼过夜,频闪光照过夜,拥挤过夜,异味过夜,缺食/缺水过夜,3 h循环光照,湿垫料过夜。
1.5 蔗糖水偏好实验
实验第1天晚上给予大鼠2瓶0.01 g/mL蔗蔗糖水和充足食物,第2天晚上给予1瓶0.01 g/mL蔗蔗糖水、1瓶自来水和充足食物,第3天晚上撤去水和食物,禁水禁食24 h后给予1瓶0.01 g/mL蔗蔗糖水、1瓶自来水和充足食物测试1 h。按“蔗糖水偏嗜度=蔗糖水消耗量(/蔗糖水消耗量+自来水消耗量)×100%”计算蔗糖水偏嗜度[23]。
1.6 强迫游泳实验
实验前 24 h将大鼠放置于水温 25℃、水深30cm圆柱型透明容器(直径20cm,高50cm)中预强迫游泳10min;正式实验记录大鼠5min内保持静止时间[12]。
1.7 肾上腺指数
按公式“肾上腺指数=肾上腺质量/大鼠体质量”计算大鼠肾上腺指数[24]。
1.8 大鼠血清糖皮质激素测定
大鼠取血保存,1 800 r/min常温离心10min,收集上清液并储存于-80℃冰箱中备用。根据大鼠血清CORT试剂盒说明书检测样品血清中皮质酮含量。
1.9 巨噬细胞吞噬能力实验
[25],巨噬细胞计数后调整细胞浓度至1× 106/mL,吸取180μL细胞悬液于96孔板中,于37℃含体积分数5% CO2培养箱中孵育24 h,除上清,每孔加入180μL的 0.001 g/mL中性红溶液继续孵育3 h后,用37℃生理盐水充分洗涤3次,加入细胞裂解液(1∶1的无水乙醇和无水乙酸)180μL/孔,置4℃冰箱12 h,酶标仪570 nm测OD值。
1.10 巨噬细胞MTT活性实验
参考张莘莘[26]MTT法,吸取 180μL的 1× 106/mL细胞悬液于96孔板中,置37℃含体积分数5%CO2培养箱中孵育24 h,去上清,加入5mg/mL的MTT溶液20μL/孔,继续孵育4 h,去上清,每孔加二甲亚砜(DMSO)150μL,震荡混匀,使结晶物充分溶解,15min后,酶标仪490 nm测吸光度值。
1.11 数据统计
采用SPSS19.0统计分析软件,结果以均值±标准误差(±SE )表示,Origin作图,单因素方差分析(One-way ANOⅤA)实验数据,Bonferroni检验。显著性水平 α为 0.05 ,对比 CT组,“*”为P<0.05,“**”为P<0.01 ;对比S组,“#” P<0.05,“##”P<0.01。
2 结果与分析
2.1 DHA对CUMS诱导的蔗糖水偏嗜度的影响
蔗糖水偏好实验结果如图1所示。方差分析显示慢性应激显著影响大鼠蔗糖水偏嗜度(F(2,29)=6.292,P<0.01)。S组大鼠蔗糖水偏嗜度显著低于CT组(P<0.05),而喂食DHA后,蔗糖水偏嗜度显著增加(P<0.01)。
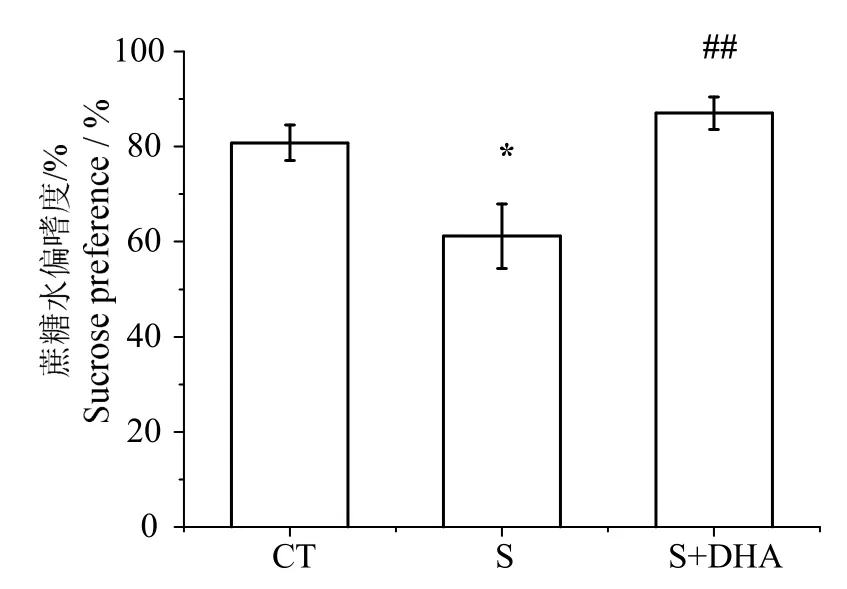
图1 DHA对CUMS诱导的蔗糖水偏嗜度的影响Fig.1 Effects of DHA on sucrose preference test induced by CUMS
2.2 DHA对 CUMS诱导的强迫游泳静止时间的影响
强迫游泳实验结果(图 2)显示,慢性应激对大鼠静止时间有显著影响(F(2,29)=8.327,P<0.01)。CT组大鼠挣扎时间比 S组显著延长(P<0.01),S+DHA组大鼠静止时间显著少于S组(P<0.01)。
2.3 DHA对CUMS诱导的肾上腺指数的影响
方差分析结果(图 3)表明,应激显著改变大鼠肾上腺指数(F(2,29)=6.01,P<0.01)。S组大鼠肾上腺指数显著高于CT组(P<0.05),喂食DHA后大鼠肾上腺指数显著降低(P<0.05)。
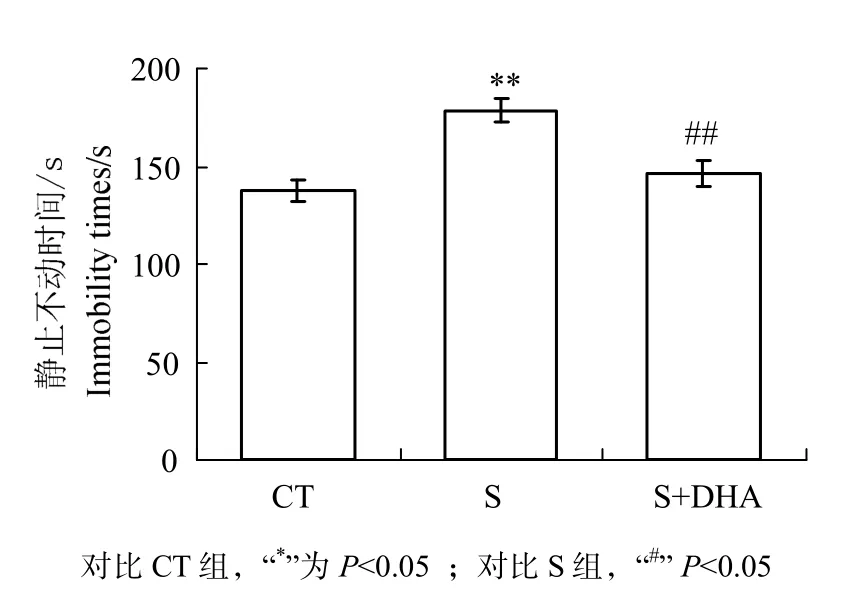
图2 DHA对CUMS诱导的强迫游泳静止时间的影响Fig 2 Effects of DHA on immobility times of force swimming test induced by CUMS

图3 DHA对CUMS诱导的肾上腺指数的影响Fig 3 Effects of DHA on adrenal index induced by CUMS
2.4 DHA对CUMS诱导的皮质酮浓度的影响
大鼠血清皮质酮测定数据(图 4)表明,应激对大鼠外周血中皮质酮浓度均有显著作用(F(2,26)= 5.466,P<0.05)。S组大鼠血清皮质酮浓度较CT组要高,而长期喂食DHA大鼠血清皮质酮浓度显著低于S组(P<0.05)。
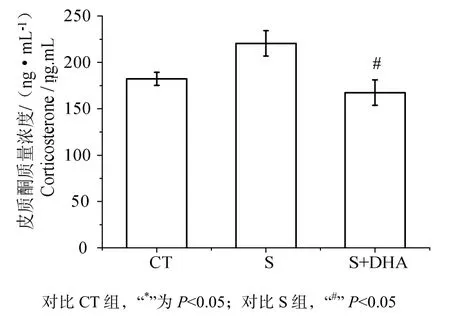
图4 DHA对CUMS诱导的皮质酮浓度的影响Fig 4 Effects of DHA on corticosterone concentrations induced by CUMS
2.5 DHA对 CUMS诱导的巨噬细胞吞噬能力的影响
巨噬细胞吞噬能力结果如图5所示。方差分析显示应激对巨噬细胞的吞噬能力有显著作用[F(2,28) =6.039,P<0.01]。CT组巨噬细胞吞噬能力显著弱于S组(P<0.05),S+DHA组大鼠与CT组趋势一致,巨噬细胞吞噬能力也显著弱于S组(P<0.05)。
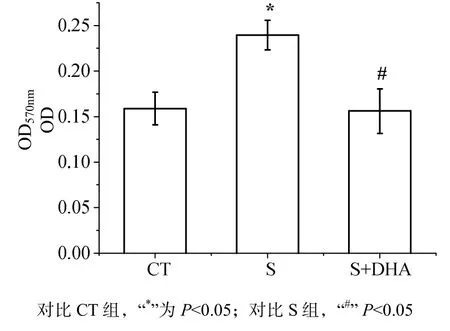
图5 DHA对CUMS诱导的巨噬细胞吞噬能力的影响Fig 5 Effects of DHA on phagocytosis of macrophage induced by CUMS
2.6 DHA对CUMS诱导的巨噬细胞活性的影响
巨噬细胞活性结果(图 6)表明,应激对巨噬细胞活性有显著影响[F(2,28)=4.768,P<0.05]。S组大鼠的巨噬细胞活性明显高于对照组(P<0.05),喂食DHA后巨噬细胞活性显著降低(P<0.05)接近CT组。
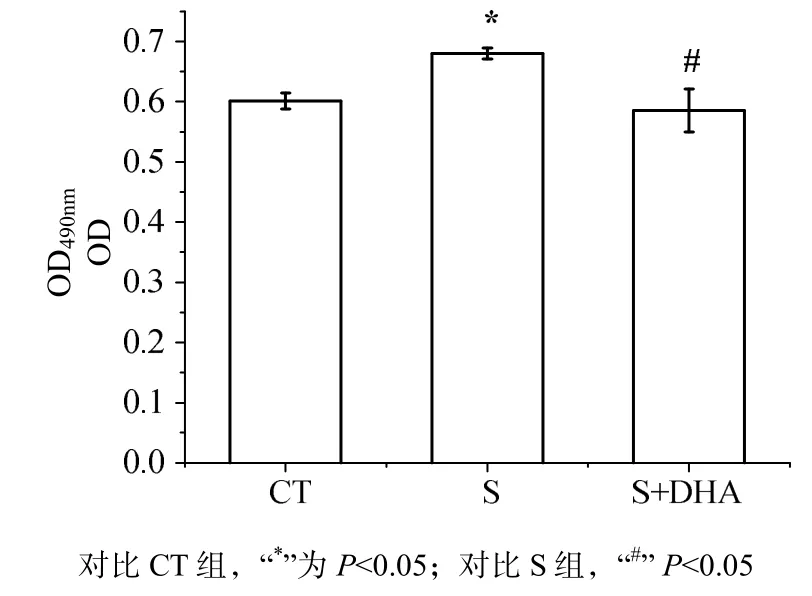
图6 DHA对CUMS诱导的巨噬细胞活性的影响Fig 6 Effects of DHA on activity of macrophage induced by CUMS
3 讨 论
动物给予CUMS刺激后明显出现抑郁样行为,例如蔗糖水偏好度降低,社交探索能力下降及易产生绝望无助情绪[27]。临床研究表明,持续性的日常压力是引发抑郁症的主要诱因[28]。本实验中,应激的动物蔗糖水偏好度较正常动物要低,表明动物受慢性刺激后快感缺乏;在强迫游泳实验中,给予42 d慢性应激的动物在水中挣扎时间较短,说明动物很容易出现绝望放弃的抑郁行为,这与前人研究结果趋势一致。
早在1991年Smith在巨噬细胞假说中便提出巨噬细胞的激活是抑郁症的一个特征,且鱼油能够抑制巨噬细胞活化,降低抑郁症的发病率[29]。慢性应激刺激,机体HPA轴功能紊乱,大量释放各种皮质激素,特别是促肾上腺皮质激素的持续释放迫使肾上腺处于超负荷工作状态,造成肾上腺增生;肾上腺的超负荷工作则造成外周糖皮质激素的大量滞留,从而诱导巨噬细胞释放大量炎症因子,激活炎症通道,反馈至中枢炎症系统引起神经细胞大量死亡,导致抑郁行为[7]。本实验中,应激动物肾上腺指数、外周血皮质酮浓度均比对照组要大,说明应激动物肾上腺处于超负荷工作状态,造成外周血中皮质酮大量滞留,并形成恶性循环,最终导致抑郁。此外,慢性应激动物体内巨噬细胞被大量激活。然而巨噬细胞具体哪部分被激活还需检测外周炎症因子的变化,以此观察巨噬细胞M1和M2的极化效果[30],从而系统的阐明抑郁症患者外周巨噬细胞免疫功能的变化情况。
流行病学发现,鱼类高摄取国家的精神疾病患病率低,此外,抑郁症患者血和脑中n-3PUFA含量较低,补充n-3PUFA能够改善抑郁症状[31]。研究显示 DHA可有效地激活神经元突触融合蛋白(syntaxin3),有利于神经元生长锥延伸,从而促进神经再生和神经可塑性,预防抑郁[32]。临床也发现DHA或EPA或联合使用有抗抑郁作用[10],且低水平DHA的抑郁症患者更易自杀[33],显示DHA对抑郁症有预防及保护作用。本实验中,喂食DHA后,动物抑郁行为明显得到改善。DHA组和应激组相比,动物对蔗糖水的偏好显著增加,水中挣扎时间明显延长,说明DHA有助于改善动物快感缺乏和绝望无助的抑郁行为。而且,喂食DHA的动物肾上腺增生现象不明显且外周血中皮质酮水平也较正常,说明DHA改善了应激造成的HPA轴功能紊乱现象。此外,本实验证实了长期喂食DHA的动物相比应激的动物巨噬细胞激活状态明显趋于正常,提示外周炎症因子水平亦得到改善。这些结果均显示,在一定程度上,喂食DHA有助于改善慢性应激造成的外周巨噬细胞免疫功能紊乱现象,从而缓解抑郁症状。
综上所述,DHA可在一定程度上改善CUMS诱导的抑郁样行为变化及外周巨噬细胞的激活亢进状态。然而外周及中枢炎症等变化情况不明确,有待进一步研究,希望以此系统地阐明DHA-CUMS-抑郁症的关系。
参考文献
[1]BⅠTEW T.Prevalence and risk factors of depression in Ethiopia:a review[J].Ethiopian journal of health sciences,2014,24(2):161-169.
[2]GONZALEZ H M,TARRAF W,WHⅠTFⅠELD K E,et al.The epidemiology of major depression and ethnicity in the United States[J].J Psychiatr Res,2010,44(15):1043-1051.
[3]FOURNⅠER J C,DERUBEⅠS R J,HOLLON S D,et al.Antidepressant drug effects and depression severity:a patient-level meta-analysis[J].Jama,2010,303(1):47-53.
[4]ⅤASWANⅠ M,LⅠNDA F K,RAMESHS.Role of selective serotonin reuptake inhibitors in psychiatric disorders:a comprehensive review[J].Progress in neuropsychopharmacology and biological psychiatry,2003,27(1):85-102.
[5]MONTGOMERY S,BALDWⅠN D,RⅠLEY A.Antidepressant medications: a review of the evidence for drug-induced sexual dysfunction[J].Journal of affective disorders,2002,69(1):119-140.
[6]BORTOLOTTO Ⅴ,CUCCURAZZU B,CANONⅠCO P L,et al.NF-kB mediated regulation of adult hippocampal neurogenesis: relevance to mood disorders and antidepressant activity[J].BioMed research international,2014,2014:612798.
[7]MⅠURA H,OZAKⅠ N,SAWADA M,et al.A link between stress and depression:shifts in the balance between the kynurenine and serotonin pathways of tryptophan metabolism and the etiology and pathophysiology of depression[J].Stress,2008,11(3):198-209.
[8]WⅠLLNER P.Chronic mild stress(CMS)revisited:consistency and behavioural-neurobiological concordance in the effects of CMS[J].Neuropsychobiology,2005,52(2):90-110.
[9]STREKALOⅤA T,COUCHY,KHOLOD N,et al.Update in the methodology of the chronic stress paradigm:internal control matters[J].Behavioral and brain functions,2011,7:9.
[10]SONG C,ZHAO S.Omega-3 fatty acid eicosapentaenoic acid.A new treatment for psychiatric and neurodegenerative diseases:a review of clinical investigations[J].Expert opinion on investigational drugs,2007,16(10):1627-1638.
[11]SONG C,PHⅠLLⅠPS A,LEONARD B,et al.Ethyl-eicosapentaenoic acid ingestion prevents corticosterone-mediated memory impairment induced by central administration of interleukin-1β in rats[J].Molecular psychiatry,2004,9(6):630-638.
[12]BOURⅠN M,MOCZER E,PORSOLT R.Antidepressant-like activity of S 20098(agomelatine)in the forced swimming test in rodents: involvement of melatonin and serotonin receptors[J].Journal of psychiatry & neuroscience Jpn,2004,29(2):126.
[13]FERRAZ A C,DELATTRE A M,ALMENDRA R G,et al.Chronic ω-3 fatty acids supplementation promotes beneficial effects on anxiety,cognitive and depressive-like behaviors in rats subjected to a restraint stress protocol[J].Behavioural brain research,2011,219(1):116-122.
[14]SU K P.Ⅰnflammation in psychopathology of depression:clinical,biological,and therapeutic implications[J].Biomedicine,2012,2(2):68-74.
[15]ELLⅠS F,SANDERS T.Long chain polyunsaturated fatty acids in endogenous depression[J].Journal of Neurology,Neurosurgery & Psychiatry,1977,40(2):168-169.
[16]SONG C,ZHANG X Y,MANKU M.Ⅰncreased phospholipase A2 activity and inflammatory response but decreased nerve growth factor expression in the olfactory bulbectomized rat model of depression:effects of chronic ethyl-eicosapentaenoate treatment[J].The Journal of Neuroscience,2009,29(1):14-22.
[17]LUCHTMAN D W,MENG Q,WANG X,et al.Omega-3 fatty acid eicospentaenoic acid attenuates MPP+‐induced neurodegeneration in fully differentiated human SH-SY5Y and primary mesencephalic cells[J].J Neurochem,2013,124(6):855-868.
[18]黄升谋.ω-3 系列多不饱和脂肪酸生理功能及其机理[J].襄樊学院学报,2010,31(5):16-19.
[19]LUCHTMAN D W,SONG C.Cognitive enhancement by omega-3 fatty acids from child-hood to old age:findings from animal and clinical studies[J].Neuropharmacology,2013,64:550-565.
[20]SONG C,LEONARD B E,HORROBⅠN D F.Dietary ethyl-eicosapentaenoic acid but not soybean oil reverses central interleukin-1-induced changes in behavior,corticosterone and immune response in rats[J].Stress,2004,7(1):43-54.
[21]TAPAⅤARAPRUK P,SONG C.Reductions of acetylcholine release and nerve growth factor expression are correlated with memory impairment induced by interleukin-1beta administrations:effects of omega-3 fatty acid EPA treatment[J].Journal of neurochemistry,2010,112(4):1054-1064.
[22]SONG C,Li X,LEONARD B E,et al.Effects of dietary n-3 or n-6 fatty acids on interleukin-1beta-induced anxiety,stress and inflammatory responses in rats[J].Journal of lipid research,2003,44(10):1984-1991.
[23]LⅠNGE R,PAZOS Á,DⅠAZ Á.Social isolation differentially affects anxiety and depressive-like responses of bulbectomized mice[J].Behavioural brain research,2013,245:1-6.
[24]谭永振,武凯歌,张竞之,等.王氏连朴饮对脾胃湿热证大鼠行为,肾上腺指数及血清 Cort 的影响[J].现代生物医学进展,2012,12(14):2623-2625.
[25]杨杰,卫东锋,王文潇,等.五指毛桃水提物对免疫抑制小鼠细胞免疫的影响[J].中药药理与临床,2015,31(6):111-114.
[26]张莘莘,李文娟,聂少平,等.黑灵芝多糖对体外培养的小鼠腹腔巨噬细胞功能的影响[J].中国药理学通报,2010,26(9):1139-1142.
[27]KREⅠSEL T,FRANK M G,LⅠCHT T,et al.Dynamic microglial alterations underlie stress-induced depressive-like behavior and suppressed neurogenesis[J].Molecular Psychiatry,2013,19(6):699-709.
[28]AKⅠL H.Stressed and depressed[J].Nature medicine,2005,11(2):116-118.
[29]SMⅠTH R.The macrophage theory of depression[J].Med Hypotheses,1991,35(4):298-306.
[30]李康,郭强,王翠妮,等.M1 和 M2 型巨噬细胞表型的比较分析[J].现代免疫学,2008,28(3):177-183.
[31]SONG C,ZHAO S.Omega-3 fatty acid eicosapentaenoic acid.A new treatment for psychiatric and neurodegenerative diseases:a review of clinical investigations[J].2007,16(10):1627-38.
[32]DARⅠOS F,DAⅤLETOⅤ B.Omega-3 and omega-6 fatty acids stimulate cell membrane expansion by acting on syntaxin 3[J].Nature,2006,440(7085):813-817.
[33]SUBLETTE M E,HⅠBBELN J R,GALFALⅤY H,et al.Omega-3 polyunsaturated essential fatty acid status as a predictor of future suicide risk[J].American Journal of Psychiatry,2006,163(6):1100-1102.
(责任编辑:陈庄)
Effects of DHA on Depression-Like Behaviors and the Function of Peripheral MacrophageⅠnduced by Chronic Stress
ZHANG Cai,XUE Hong-sha,LⅠ Yu-yu,LⅠU Bai-ping,ZHANG Yong-ping,SONG Cai
(Research Institute for Marine Drugs and Nutrition,College of Food Science and Technology,Guangdong Ocean University,Zhanjiang 524088, China)
On the basis of the depression model induced by chronic stress,sucrose preference,immobility times of forced-swimmin,adrenal gland index,corticosterone concentrations in serum,activity and phagocytosis of macrophages were measured to study the potential antidepressant-like effect of DHA.Compared to controls,stress decreased sucrose intake significantly(P<0.05),immobility times in forced-swimming significantly prolonged (P<0.01),adrenal gland index and the activity and phagocytosis of macrophages were enhanced significantly (P<0.05).However,sucrose preference and immobility times were significantly attenuated by feeding DHA (P<0.01).The index of adrenal gland,corticosterone concentrations and the activity and phagocytosis of macrophages were also significantly reduced (P<0.05).The study indicated that DHA may improve depression-like behavior and regulate inflammatory response and stress hormones induced by chronic stress.
depression; behavior; chronic unpredictable mild stress; macrophage; DHA
R749.4
A
1673-9159(2016)06-0081-06
10.3969/j.issn.1673-9159.2016.06.013
2016-07-09
国家自然科学基金(81171118,81471223)
张才(1991-),男,硕士研究生,主要从事精神神经免疫学和海洋生物活性物质研究。E-mail:zhangcai910206@163.com
宋采,女,教授,研究方向为精神神经免疫学和海洋活性物质药理学。E-mail:cai.song@dal.ca
