不同年龄段规律运动联合NAD合成酶基因CG9940表达改变对果蝇生命周期和运动能力的影响
2016-12-17文登台李秋芳后文其阮湘程
文登台,郑 澜,李秋芳,后文其,阮湘程,刘 羿
不同年龄段规律运动联合NAD合成酶基因CG9940表达改变对果蝇生命周期和运动能力的影响
文登台,郑澜,李秋芳,后文其,阮湘程,刘羿
目的:在NAD合成酶基因表达改变后的遗传背景下,研究不同年龄段进行规律运动干预对果蝇生命周期和快速攀爬能力的影响,为研究NAD合成酶基因的运动抗衰老效应以及训练效应提供更全面的理论依据。方法:利用UAS/GAL4系统使果蝇NAD合成酶基因表达正常、下调、上调和突变,不同遗传背景果蝇分为对照组、运动6周组、7周后运动组和终身运动组,利用转动平台对不同时期果蝇进行运动训练,qRT-PCR检测NAD合成酶基因mRNA表达量,测量果蝇攀爬速度和统计生命周期。结果:表达下调组果蝇CG9940 mRNA表达量低于正常表达组(P<0.01),下调率为56.98%;表达上调组高于正常表达组(P<0.01),上调率为129.21%;突变组表达量低于正常表达组(P<0.01)。CG9940表达下调组果蝇寿命低于正常表达组(P<0.05),表达上调组和突变组寿命高于正常表达组(P<0.05,P<0.01);正常表达组和表达上调组果蝇的运动6周、7周后运动、终身运动组寿命高于安静组(P<0.05,P<0.01,P<0.05;P<0.01,P<0.01,P<0.05);表达下调的运动6周组寿命低于安静组(P<0.01);突变的运动6周组、终身运动组寿命低于安静组(P<0.01,P<0.01)。正常表达组和表达上调组3周龄果蝇的攀爬速度高于安静组(P<0.05,P<0.05)。结论:果蝇NAD合成酶基因CG9940表达不同的群体中,生命晚期开始的适宜规律运动能对更广泛群体的寿命产生效益;CG9940基因表达上调的攀爬效应能与生命早期训练的攀爬效应产生叠加,提高攀爬能力。果蝇CG9940功能与生命周期、攀爬能力密切相关,不同个体的运动抗衰老效应、运动的攀爬效应可能与NAD合成酶基因表达及突变有关。
CG9940;规律运动;生命周期;衰老
果蝇基因组简单、转基因技术成熟的特点[1],使果蝇成为遗传学,以及发育学研究的经典模式生物。如沉默信息调节因子2(silent information regulator,Sir2)从单细胞动物到人具有很好保守性,利用UAS/GAL4系统过表达果蝇Sir2,能促进寿命延长[2]。此外,研究[3]还发现果蝇饮食限制(dietary restriction,DR)产生的延寿效应与Sir2激活有关。进一步的研究表明,NAD+对Sir2的激活至关重要,过表达NAD补救合成途径的关键酶基因Nmnat能提高果蝇NAD+水平,产生延寿效应[4]。因此,Sir2和Nmnat是与衰老密切相关的基因,且大鼠及人类Sirtuin家族的许多类似功能已被越来越多的研究证实[5]。果蝇生命周期短,繁殖速度快,且对运动具有保守性[6-7]也是其优势。研究表明,规律运动能提高幼龄果蝇的攀爬能力和延缓老龄果蝇攀爬能力的增龄衰退[6],改善老龄果蝇睡眠质量[8]和增强生命活动节律性[9],提高幼龄和老龄果蝇心脏功能[10-11]等。而果蝇规律运动对攀爬能力和心脏功能的增强与果蝇骨骼肌和心肌内线粒体效率的提高有关[12]。正因为果蝇的许多运动效应与人类及大鼠的运动效应十分相似[13-14],所以果蝇成为研究基因功能、运动功能、衰老等相互关系一种重要的模式生物[10,15]。
CG9940基因在果蝇体内编码合成NAD合成酶基因,NAD合成酶是NAD从头合成的关键酶。早期研究结果表明,果蝇NAD合成酶基因CG9940过表达有延寿作用[16],且该遗传背景的果蝇运动敏感性强于野生型果蝇[11]。进一步证实果蝇CG9940基因在延缓衰老和运动敏感性方面的功能,我们构建CG9940基因表达下调(loss-of-function)、上调(gain-of-function)、突变(mutation)型和正常表达4种不同遗传背景的果蝇。同时,为研究不同年龄段开始的规律对果蝇寿命的影响,对1周龄(幼龄)果蝇实施持续6周运动干预第7周末(老龄)结束(生命晚期无运动干预)、8周龄(老龄)开始运动干预(生命早期无运动干预)、终身运动干预的运动模型,研究不同年龄阶段运动干预联合CG9940不同遗传背景对寿命的影响,以及CG9940不同遗传背景果蝇快速攀爬能力的运动敏感性,为研究NAD合成酶基因的运动抗衰老效应以及训练效应提供更全面的理论依据。
1 材料与方法
1.1实验材料
1.1.1果蝇品系来源及处女蝇收集CG9940转基因品系果蝇购于美国Bloomington Drosophila Stock Center,野生型W1118和arm-Gal4品系由湖南师范大学心脏发育中心馈赠(见表1)。所有品系果蝇放置于相同环境下进行培养,果蝇从产卵到成虫周期约为12天,在果蝇成虫的6~8 h内,收集未杂交的处女果蝇。雌雄分离:二氧化碳对果蝇麻醉,在体式显微镜下,根据雄性果蝇足上有性梳特征区分雌性。取野生型、CG9940转基因的3个品系处女蝇,每组收集500只左右,arm-Gal4调控系雄性果蝇收集大约2 000只,每管20只,均放置于新培养基中饲养3~4天,检验是否含有异性果蝇而导致产卵,如果培养基有卵,则该管不用于实验杂交。

表1 果蝇品系及来源Table1 Strains and sources of Drosophila
1.1.2杂交及分组CG9940基因位于X染色体上,是被调控目标基因,14158品系的插入元素在CG9940启动子区域且方向与CG9940正常转录方向相同,那么在arm-Gal4诱导下使EP插入区域的全身CG9940基因过表达;18730品系的插入元素在CG9940启动子区域且方向而与CG9940正常转录方向相反,在arm-Gal4诱导下使EP插入区域的全身CG9940基因表达被干扰[17]。
雌 性 W1118、PBac{WH}CG9940f04110、P{Mae-UAS.6.11} CG9940[GG01267]和Mi{MIC}CG9940MI07227均与雄性调控系arm-Gal4杂交,杂交后F1代处女蝇有4种不同基因,分别为野生对照组W1118>arm-Gal4,CG9940基 因 表 达下调组 PBac{WH} CG9940f04110>arm-gal4,表达上调组P{Mae-UAS.6.11}CG9940GG01267>arm-gal4,突变组Mi{MIC}CG9940MI07227>arm-gal4(见表2)。不同基因表达系又分为4组,分别为安静组、持续运动6周组、7周后运动组和终身运动组。总共16组,每组300只,均放入HWS智能型恒温恒湿(宁波江南仪器厂制造)果蝇培养箱中,保持温度25摄氏度、湿度50%、12小时昼∕夜循环饲养。

表2 果蝇杂交后F1代基因型Table2 Genotype of Drosophila in F1 generation
1.1.3运动方案及分组利用果蝇逆重力攀爬特性,采用第3代果蝇运动装置进行耐力运动训练,运动6周组从第2周(8天幼龄)开始运动第7周末停止运动,7周后运动组从第8周(49天老龄)开始运动第9周末停止运动,终身运动组从第2周(8天幼龄)开始运动第9周末停止运动。运动负荷根据果蝇年龄以及训练情况进行梯度增减,如通过观察果蝇运动过程中是否能跟上转动速度,是否保持逆重力攀爬和趋光性等判断果蝇是否运动疲劳[6,8],电机转动速度从2周至7周分别控制为0.18 r/s、0.20 r/s、0.18 r/s、0.16 r/s、0.14 r/s、0.12 r/s,8周至9周的速度均为0.10 r/s,每天下午14时开始训练,每次训练1.5 h,训练用试管直径约为2.80 cm,连续训练5天,每周休息2天,运动方案结束24 h后测量攀爬速度(见图1)。

图1 第三代果蝇运动装置和运动分组Figure1 The third generation training device of Drosophila and grouping
1.1.4果蝇培养基以配制1 L水的培养基为例(可按比例增减量),加入黄豆粉20.1 g、酵母粉24.8 g、玉米粉84 g搅匀,加热过程中加入琼脂8.57 g,加热至沸腾(注意加热过程中需不断搅拌,防止烧糊)。沸腾后停止加热,冷却过程中加入蔗糖和麦芽糖各61.6 g(麦芽糖要慢慢加入,防止成团)。待蔗糖和麦芽糖充分溶解后,加入防腐剂丙酸3.33 mL、对羟基苯(3.33 g溶于33.33 mL无水乙醇),充分搅拌后立即分装于洁净的培养管中,培养基厚度为0.5~1.0 cm。
1.2指标检测
1.2.1实时荧光定量PCR检测100 mg(10只果蝇)组织样品匀浆,用Tripure试剂(Roche公司)提取RNA,用RNeasey mini spin cloumn试剂盒(Qiagen公司)对RNA进行纯化,然后用紫外分光光度计(美国Amersham Biosciences公司)定量,-70℃保存备用。Premiers5.0软件设计引物,经NCBI-BLAST基因库检索验证,与其他基因无高度同源性,内参为rp49基因。CG9940基因引物序列F:5’-ATTTTTCCTGCCCCTAAGCG-3’;R:5’-GGACAGCCTGCACGATTTG-3’,取2 uLRNA,逆转录成cDNA,将PCR扩增后,用2%的琼脂糖电泳鉴定。内参引物序列F:5’-CTAAGCTGTCGCACAAATGG-3’;R:5’-AACTTCTTGAATCCGGTGG G-3’。逆转录反应后,取稀释的反转录产物5 uL,加入SYBR®Premix Ex Taq(2×)15 uL(Takara)、PCR Forward Primer(10 μM)1 uL、PCR Reverse Primer(10 uM)1 uL、ROX 0.6 uL、ddH2O 7.4 uL,总体系30 uL,分3个重复孔,每孔10 uL。反应条件:95℃变性30 s,95℃5 s,60℃30 s,40个循环。反应结束,由熔点曲线判定PCR反应的特异性,根据荧光曲线的Ct值以及标准曲线计算定量结果,检测在ABI 7900HT(美国应用生物系统公司)中进行,计算基因相对表达值以及根据相对表达值计算平均过表达率。
1.2.2果蝇快速攀爬能力检测分别在安静组和终身运动组果蝇第1、3、5、7周龄末,将果蝇震落至培养瓶底部后,用NVGS400摄像机拍摄负其趋地性爬行的行为学特征。每组随机取样100只,分5管,每管20只。拍摄前,先震落5次进行适应。拍摄时,要求每次果蝇必须全部震落。检测时间17︰00到18︰00。测量的试管底部至棉塞下端预留18 cm作为果蝇运动区域,记录全部果蝇个体震落至试管底部后第5 s时果蝇的攀爬位置,测量每只果蝇的攀爬高度,平均攀爬速度(cm/s)=攀爬高度(cm)/5(s)。
1.2.3生命周期检测每组取200只果蝇,从第42天龄开始,在18︰00至19︰00观察和记录果蝇死亡数,每隔一天换培养基并记录死亡数量,直到各组果蝇全部死亡为止。制作果蝇存活曲线,统计每组果蝇的最高寿命,全部果蝇寿命的算术平均数为果蝇的平均寿命,平均延寿命率(%)=(运动组平均寿命-对照组平均寿)/对照组平均寿命×100%。
1.3统计学处理
实验数据用SPSS16.0统计学处理,相同周龄各安静组果蝇攀爬速度比较、各安静组生命周期比较和相同基因型安静组与各运动组的生命周期比较用单因素方差分析的LSD分析,进行多重比较;相同周龄相同基因型果蝇安静组与运动组攀爬速度用独立样本T检验。实验数据用均数±标准差(x±s)表示,显著性水平取P=0.05。此外,“运动”“基因”2因素对寿命和攀爬速度的影响进行双因素方差中析因分析,分析其主效应以及二者相互作用。
2 结 果
2.1CG9940基因mRNA表达量检测结果
与野生型果蝇相对表达量相比,表达下调型果蝇CG9940基因mRNA表达量表达下降(P<0.01),下调率为56.98%;表达上调型果蝇相对表达量上升(P<0.01),上调率为129.21%;突变组表达量非常低,与正常表达组相差约8.70倍(见图2)。
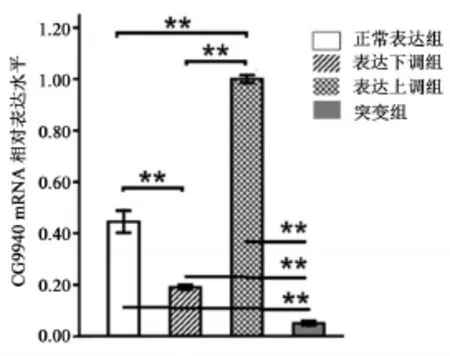
图2 CG9940基因mRNA相对表达量Figure2 The relative expression of CG9940 gene mRNA
2.2CG9940基因表达改变、运动及二者联合对果蝇生命周期的影响
2.2.1CG9940基因表达改变对果蝇生命周期影响CG9940基因表达下调组果蝇寿命低于正常表达组(P<0.05),表达上调组果蝇寿命和突变组果蝇生命周期高于正常表达组(P<0.05,P<0.01);表达上调组和突变组果蝇生命周期均高于表达下调型果蝇(P<0.01,P<0.01);突变型果蝇生命周期高于表达上调型果蝇(P<0.01)。野生型果蝇最高寿命为83天,表达下调、表达上调和突变型果蝇最高寿命和延寿率分别为81、83和88天,平均延寿率分别为-3.31%、2.59%和13.21%(见图3)。

图3 不同基因型果蝇生命周期情况Figure 3 The lifespan of Drosophila
2.2.2不同年龄段运动干预对CG9940表达正常果蝇生命周期的影响运动6周组、7周后运动组、终身运动组寿命均高于安静组(P<0.05,P<0.01,P<0.05);运动6周组寿命低于7周后运动组(P<0.01);7周后运动组寿命高于终身运动组(P<0.01)。安静组最高寿命为83天,运动6周、7周后运动和终身运动的最高寿命分别为83、86和83,平均延寿率分别为3.11%、7.35%和2.42%(见表3)。
2.2.3不同年龄阶段运动干预联合对CG9940表达下调果蝇生命周期的影响运动6周组寿命低于安静组(P<0.05),7周后运动组寿命高于安静组(P<0.01);运动6周组寿命低于7周后运动组和终身运动组(P<0.01,P<0.01);7周后运动组寿命高于终身运动(P<0.01)。安静组最高寿命为81天,运动6周、7周后运动和终身运动的最高寿命分别为82、85和80,平均延寿率分别为-9.37%、7.21%和-0.39%(见表3)。
2.2.4不同年龄阶段运动干预联合对CG9940表达上调果蝇生命周期的影响运动6周组、7周后运动组、终身运动组寿命均高于安静组(P<0.01,P<0.01,P<0.05);运动6周的生命周期与7周后运动的、终身运动的生命周期相比无显著差异;7周后运动的生命周期高于终身运动组(P<0.01)。安静组最高寿命为83天,运动6周、7周后运动和终身运动的最高寿命分别为88、88和83,平均延寿率分别为3.53%、5.98%和2.39%(见表3)。
2.2.5不同年龄阶段运动干预联合对CG9940突变果蝇生命周期的影响运动6周组和终身运动组寿命低于安静组(P<0.01,P<0.05);运动6周组寿命低于7周后运动组和终身运动组(P< 0.01,P<0.01);7周后运动的生命周期与终身运动的相比无显著差异。安静组最高寿命为88天,运动6周、7周后运动和终身运动的最高寿命分别为84、88和91,平均延寿率分别为-6.35%、-1.78%和-2.91%(见表3)。
2.3CG9940基因表达改变、运动及二者联合对果蝇快速攀爬能力的影响
2.3.1CG9940基因表达改变对果蝇快速攀爬能力的影响1周龄攀爬速度比较,CG9940基因表达下调、上调和突变组果蝇攀爬速度均高于正常表达果蝇(P<0.01,P<0.01,P<0.01),其余各组比较无显著差异(见图4)。

表3 果蝇平均寿命(天)、最高寿命(天)、平均延寿率(n=200)Table 3 The mean lifesan of Drosophila(days),the highest lifespan(days),the average lifespan extension rate(n=200)
3周龄攀爬速度比较,CG9940基因表达上调组果蝇攀爬速度高于正常表达组果蝇(P<0.01),CG9940基因表达上调和突变组果蝇攀爬速度高于表达下调型果蝇(P<0.01),CG9940基因突变型果蝇低于上调型果蝇(P<0.05),其余各组比较无显著差异。
5周龄攀爬速度比较,CG9940基因突变型果蝇攀爬速度高于野生组果蝇(P<0.01),表达下调组果蝇攀爬速度低于正常表达组果蝇(P<0.01),CG9940基因表达上调和突变组果蝇攀爬速度高于表达下调组果蝇(P<0.01,P<0.01),CG9940基因突变组攀爬速度果蝇高于上调组果蝇(P<0.05),其余各组比较无显著差异。
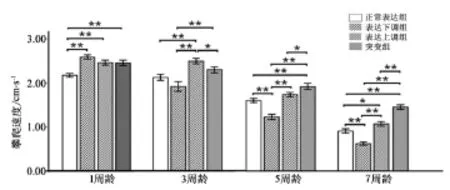
图4 不同年龄阶段果蝇5 s内攀爬速度比较。Figure4 Comparison of the rate of climbing speed of Drosophila 5s at different ages.
7周龄攀爬速度比较,表达下调组果蝇攀爬速度低于野生组果蝇(P<0.01),CG9940基因表达上调组果蝇攀爬速度高于野生组果蝇(P<0.05),CG9940基因突变组果蝇攀爬速度高于野生组果蝇(P<0.01),CG9940基因表达上调和突变组果蝇攀爬速度高于表达下调型果蝇(P<0.01,P<0.01),CG9940基因突变组果蝇高于上调组果蝇(P<0.01),其余各组比较无显著差异。
2.3.2运动对野生型果蝇快速攀爬能力的影响3周龄野生型果蝇攀爬速度比较,运动组高于安静组(P<0.05),5周和7周龄果蝇野生型果蝇攀爬速度比较,运动组与安静组比较均无显著差异(见表4)。
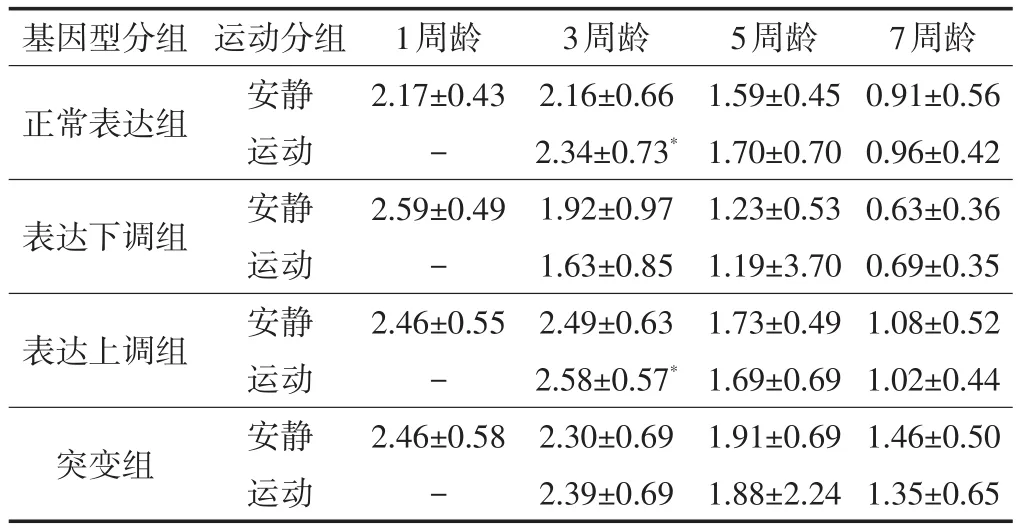
表4 果蝇5 s内平均攀爬速度/cm·s-1Table4 TheaverageclimbingspeedofDrosophila5S/cm·s-1(n=100)
2.3.3运动对CG9940基因表达下调对果蝇快速攀爬能力的影响表达下调组中,3周龄、5周龄、7周龄果蝇运动组与安静组攀爬速度比较无显著差异。
2.3.4运动对CG9940基因表达上调对果蝇快速攀爬能力的影响表达上调组中,3周龄果蝇运动组攀爬速度高于安静组(P<0.05),5周龄、7周龄果蝇运动组与安静组攀爬速度比较无显著差异。
2.3.5运动对CG9940基因突变对果蝇快速攀爬能力的影响突变组中,3周龄、5周龄、7周龄果蝇运动组与安静组攀爬速度比较无显著差异。
2.4基因、运动对寿命、攀爬影响的析因分析
析因分析表明基因是影响的寿命主要因素(P<0.01),基因和运动对寿命的影响有交互作用(P<0.01),简单效应综合分析表明对于无运动干预果蝇,寿命有显著差异(F(1,2190)=15.37,P< 0.01);对于运动干预的果蝇,寿命无显著差异(F(1,2190)=1.10,P> 0.05)。基因是影响7周龄攀爬速度的主要因素(P<0.01),基因和运动对攀爬的影响无交互作用(P>0.05)(见表5)。
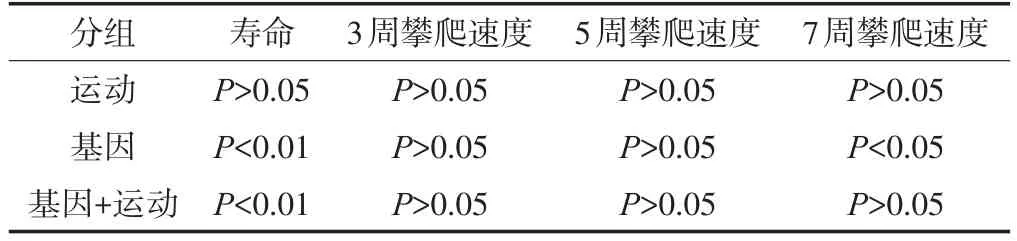
表5 基因、运动对寿命、攀爬影响的析因分析Table5 Analysis of Gene and training impact of lifespan and climbing
3 讨 论
3.1NAD合成酶基因表达改变、不同年龄段开始的规律的运动对生命周期的影响
利用UAS/GAL4系统对靶基因调控,使基因过表达(gain-offunction)、或表达下调(loss-of-function)、或突变(mutation)是研究基因功能的常用方法,当3种不同的突变体同时存在实验中,对基因功能的证实更全面[17-18]。CG9940基因在果蝇体内编码合成NAD合成酶基因,NAD合成酶是NAD从头合成的关键酶,而NAD+对衰老有着重要影响。我们的研究结果显示,NAD合成酶基因表达上调能延缓衰老,延长生命周期;反之亦然。此外,NAD合成酶基因突变的延寿效果最佳,说明这种突变对延缓衰老是积极的。尽管对果蝇和人而言,大多数突变是有害的,但也存在有利突变,如果蝇的Lgl(Lethal 2 giant larvae)基因,与人类Hugl-1基因同源,具有肿瘤抑制作用,该基因完全突变可能诱发癌症,最近研究表明Lgl不完全突变在一定程度上有利于果蝇存活[19]。本实验果蝇NAD合成酶基因表达高低影响果蝇寿命长短的分子机制,可能与NAD合成酶活性对老龄果蝇NAD+水平的影响有关。研究表明酵母、果蝇以及大鼠的衰老能造成个体NAD+水平系统性下降[20-22],这可能是衰老导致线粒体功能失常[23-24]、Sir2活性降低[2],端粒调节失常[25],氧化应激增加[26]等的原因之一。反之,线粒体功能失常、Sir2活性降低,端粒调节失常,氧化应激会加快衰老进程。通过提高衰老个体的NAD+水平,如饮食限制[4]、过表达Nmnat基因[3],均能延长寿命,其主要原因是NAD+水平的提高能保证线粒体正常能量代谢、促进Sir2的活性和端粒的调节,CG9940过表达和突变果蝇可能产生类似效应,均能促进NAD+水平升高,以对抗衰老导致的NAD+水平降低。尽管我们实验证实NAD合成酶基因CG9940与果蝇寿命密切相关,并推测其机制可能与NAD+水平有关,但并未检测果蝇个体NAD+水平,Sir2活性,线粒体功能等,所以其机制需要更深的研究证实。
此外,本实验还证实NAD合成酶基因表达不同对运动的延寿效果产生影响。在衰老果蝇个体中,有没有充足的NAD可能是适宜运动能否延长寿命因素之一[24]。NAD+产生运动适应的前提可能与运动训练过程中是否有充足的NAD+维持其代谢平衡,来对抗运动产生破坏NAD+平衡的氧化应激、ATP合成加快等因素有关[27]。如果NAD+本身不足,运动可能会使NAD+代谢更加紊乱,对延寿无益,甚至在某些方面造成消极效应[28]。而NAD合成酶基因突变尽管安静状态下是一种有利突变,但该突变可能导致生成的NAD合成酶不利于运动应激,运动干预可能会造成突变个体的NAD+水平下降或活性降低,导致衰老加快[21]。而关于不同年龄阶段进行开始运动干预对果蝇寿命产生不同影响,其内在机制可能是:运动6周和终身运动组的前3周可能是大强度运动,这对NAD本身不足的CG9940基因表达下调型果蝇产生了很不利影响,对突变型果蝇的NAD合成酶产生不利效应,所以两个年龄段运动干预均能缩短寿命,但对野生型和表达上调型果蝇寿命有延长作用,因为体内NAD+合成正常且充足;7周后运动组,由于运动强度适宜,加上是初始产生运动效应,果蝇机体可能对这种新鲜适宜刺激产生有益效应,使NAD+活性和含量产生有利变化[29]。因此对CG9940基因正常表达、表达下调和表达上调型果蝇均有延寿作用,而不会降低突变型果蝇寿命。提示生命晚期开始的规律运动能促进更广泛果蝇群体的寿命。
3.2运动训练联合NAD合成酶基因表达改变对果蝇5 s内快速攀爬能力的影响
NAD+是参与能量代谢的重要酶,在氧化磷酸化,三羧酸循环和呼吸链等生化过程中,NAD+接受脱下的H+成为NADH,NADH作为氢的载体,通过磷酸甘油穿梭从线粒体外进入肌肉线粒体,在其内膜上将电子传递给氧,氧化过程中释放的能量合成ATP,ATP是能量的直接来源,与肌肉收缩密切相关,也直接影响运动能力[30]。通过改变果蝇CG9940基因表达,发现CG9940表达下调虽然提高1周幼龄果蝇运攀爬速度,但对3周龄果蝇攀爬速度无明显影响,甚至降低5周、7周龄果蝇攀爬速度;CG9940基因表达上调和突变果蝇在各个年龄阶段的攀爬速度都强于野生型。提示CG9940基因作为NAD合成酶的关键基因,通过间接影响NAD合成影响果蝇的运动能力。此外,CG9940基因作为影响果蝇运动能力的基因之一,不同的表达对果蝇早期的运动训练敏感性不同,从1周龄开始运动干预,在第3周检测,发现2周的训练能提高野生型和CG9940基因表达上调型果蝇的攀爬速度,同样的运动训练对表达下调型和突变型果蝇攀爬速度无明显影响,4周和6周运动训练对所有果蝇攀爬速度无明显影响,这可能与后期运动强度降低、测量快速攀爬而不是时间稍长的耐力性攀爬有关[31]。CG9940基因表达差异导致运动训练效益不同,其内在机制也可能与NAD+含量和活性有关[27]。研究表明大强度运动时体内NAD+水平会暂时下降,主要与NADH不能及时传递H+而大量积累有关,长期训练使细胞质和线粒体内的NAD+水平和活性产生运动适应,促进能量代谢,从而提高运动能力[12,32]。尽管CG9940基因表达下调、上调和突变都有利于幼龄果蝇的快速攀爬,但只有CG9940基因表达上调能与运动训练产生叠加,进一步提高攀爬速度,其机制之一可能与过表达增加果蝇体内NAD+水平,运动适应对NAD+影响产生联合作用有关,能更利于能量代谢[33]。虽然突变导致果蝇个体运动能力增加,但运动能力对运动训练的敏感性不明显,其机制可能是与突变后果蝇机体生成的NAD合成酶结构功能发生变化有关[34]。
4 结 论
果蝇NAD合成酶基因CG9940表达不同的群体中,生命晚期开始的适宜规律运动能对更广泛群体的寿命产生效益;CG9940表达上调的攀爬效应能与生命早期训练的攀爬效应产生叠加,提高攀爬能力。果蝇CG9940基因功能与生命周期、攀爬能力密切相关,不同个体的运动抗衰老效应、运动的攀爬效应可能与NAD合成酶基因表达及突变有关。
[1]BUSSON D,PRET AM.GAL4/UAS targeted gene expression for study in Drosophi-la Hedgehog signaling[J].Methods Mol Biol,2007,397:161-201.
[2]JULIA H,RENJA R,CHRISTINE F,et al.Overexpression of Sir2 in the adult fat body is sufficient to extend lifespan of male and female Dro⁃sophila[J].Aging(Albany NY),2013,5(4):315-327.
[3]ROGINA B,HELFAND SL.Sir2 mediates longevity in the fly through a pathway related to calorie restriction[J].Proc Natl Acad Sci.2004,101:15998–16003.
[4]ALI YO,RUAN K,ZHAI RG.NMNAT suppresses tau-induced neurode⁃generation by promoting clearance of hyperphosphorylated tau oligomers in a Drosophila model of tauopathy[J].Hum Mol Genet,2012,21(2):237-250.
[5]ANDREW M.DAVENPORT,FERDINAND M,et al.Structural and Func⁃tional Analysis of Human SIRT1[J].J Mol Biol,2014,426(3):526-541.
[6]MARTIN J,TINKERHESS,SARA G,et al.Endurance Training Protocol and Longitudinal Performance Assays for Drosophila melanogaster[J]. Journal of Visualized Experiments,2012,(61):1-5.
[7]郑澜,王小月,吴越,等.不同运动方案对果蝇运动能力、生命周期及心脏功能的影响[J].中国运动医学杂志,2013,31(7):611-616.
[8]ZHENG L,FENG Y,WEN DT,et al.Fatiguing exercise initiated later in life reduces incidence of fibrillation and improves sleep quality in Dro⁃sophila[J].AGE,2015,37(77):1-12.
[9]KUNTOL R,REBECCA W,TOMASZ M,et al.Effects of exercise on cir⁃cadian rhythms and mobility in aging Drosophila melanogaster[J].Exp Gerontol,2013,48(11):1260-1265.
[10]MAYUKO N,KAREN O,ROLF B,et al.Drosophila as a model to study cardiac aging[J].Exp Gerontol,2011,46(5):326-330.
[11]文登台,郑澜,田旭,等.耐力运动联合NAD合成酶基因CG9940过表达对中老龄果蝇心脏功能、运动能力和寿命的影响[J].中国运动医学杂志,2015,34(10):982-988.
[12]MARTIN J.TINKERHESS,LINDSEY H,et al.The Drosophila PGC-1a Homolog spargel Modulates the Physiological Effects of Endurance Ex⁃ercise[J].PLoS ONE,2012,7(2):e31633.
[13]GRAEME CR,JEFFREY L.HASTINGS,PAUL S.B,et al.The effect of lifelong exercise dose on cardiovascular function during exercise[J].J Appl Physiol(1985),2014,116(7):736-745.
[14]MASSIMO V,FEDERIO S,RUSSELL S.R.The role of exercise capaci⁃ty in the health and longevity of centenarians[J].Maturitas,2012,73(2):115-120.
[15]SODA BD,ROLF B.Drosophila as a Model to Study the Genetic Mecha⁃nismsofObesity-AssociatedHeartDysfunction[J].JCellMol Med.2012,16(5):966-971.
[16]文登台,郑澜,林丽容,等.CG9940基因过表达对中老龄果蝇心脏功能运动能力及寿命的影响[J].北京体育大学学报,2014,37(7):62-68.
[17]RORTH P,SZABO K,BAILEY A,et al.Systematic gain-of-function genetics in Drosophila[J].Development,1998,125:1049-1057.
[18]NAGARKAR J S.,Lee P T,CAMPBELL M E.A library of MiMICs al⁃lows tagging of genes and reversible,spatial and temporal knockdown of proteins in Drosophila[J].eLife,2015,4:e05338.
[19]YAMASHITA K,IDE M,FURUKAWA KT,et al.Tumor suppressor protein Lgl mediates G1 cell cycle arrest at high cell density by form⁃ing an Lgl-VprBP-DDB1 complex[J].Mol Biol Cell,2015,26(13):2426-2438.
[20]WOJCIK M,SEIDLE H F,BIEGANOWSKI P,et al.Glutamine-depen⁃dent NAD(+)synthetase-How a two-domain,three-substrate en⁃zyme avoids waste[J].Journal of Biological Chemistry,2006,281:33395-33402.
[21]SOHAL RS,ARNOLD L,ORR WC.Effect of age on superoxide dis⁃mutase,catalase,glutathione reductase,inorganic peroxides,TBA-reac⁃tive material,GSH/GSSG,NADPH/NADP+and NADH/NAD+in Dro⁃sophila melanogaster[J].Mech Ageing Dev,1990,56(3):223-235.
[22]RAMSEY K M,MILLS K F,SATOH A.,et al.Age-associated loss of Sirt1-mediated enhancement of glucose-stimulated insulin secretion in beta cell-specific Sirt1-overexpressing(BESTO)mice[J].Aging Cell,2008,7:78-88.
[23]MAMMUCARI C,RIZZUTO R.Signaling pathways in mitochondrial dysfunction and aging[J].Mechanisms of Ageing and Developmen,2010,131:536-543.
[24]FERGUSON M,MOCKETT RJ,SHEN Y,et al.Age-associated decline in mitochondrial respiration and electron transport in Drosophila mela⁃nogaster[J].Biochem J,2005,390(Pt 2):501-511.
[25]WALTER MF1,BIESSMANN MR,BENITEZ C,et al.Effects of telo⁃mere length in Drosophila melanogaster on life span,fecundity,and fertility[J].Chromosoma,2007,116(1):41-51.
[26]JIA H,LI X,GAO H,et al.High doses of nicotinamide prevent oxida⁃tive mitochondrial dysfunction in a cellular model and improve motor deficit in a Drosophila model of Parkinson's disease[J].J Neurosci Res,2008,86(9):2083-2890.
[27]MENDEL R,ZHIQIANG W,WENYONG C.Sirtuins in Hematological Aging and Malignancy[J].Crit Rev Oncog,2013,18(6):531-547.
[28]ERIKA K,ZSOFIA S,MUSTAFA A,et al.Exercise alters SIRT1,SIRT6,NAD and NAMPT levels in skeletal muscle of aged rats[J]. Mech Ageing Dev,2010,131(1):21-28.
[29]SUWA M,SAKUMA K.The potential role of sirtuins regarding the ef⁃fects of exercise on aging-related diseases[J].Curr Aging Sci,2013,6(2):178-88.
[30]黄熙泰,于自然,李翠凤.现代生物化学[M].2版.北京:化学工业出版社,2012,357-358.
[31]RHODENIZER D,MARTIN I,BHANDARI P,et al.Genetic and envi⁃ronmental factors impact age-related impairment of negative geotaxis in Drosophila by altering age-dependent climbing speed[J].Exp Geron⁃tol,2008,43:739-748.
[32]CANTO C,JIANG LQ,DESHMAKH AS,et al.Interdependence of AMPK and SIRT1 for metabolic adaptation to fasting and exercise in skeletal muscle[J].Cell Metab,2010,11:213-219.
[33]KOLTAI E,SZABO Z,ATALAY M,et al.Exercise alters SIRT1,SIRT6,NAD and NAMPT levels inskeletal muscle of aged rats[J]. Mech Ageing,2010,131:21-28.
[34]BEWLEY GC,DEZURIK JM,PAGELSON G.Analysis of l-glycerol-3-phosphate dehydrogenase mutants in Drosophila melanogaster:comple⁃mentation for intracellular degradation of the mutant polypeptide[J]. Mol Gen Genet,1980,78(2):301-308.
The Effects of Regular Exercise at Different Ages Combined the NAD Synthetase Gene CG9940 Expression ChangesonLifespanandExerciseCapacityinDrosophila
WEN Dengtai,ZHENG Lan,LI Qiufang,HOU Wenqi,RUAN Xiangcheng,LIU Yi
(School of PE,Hunan Normal University,Changsha 410001,China)
Objective:Constructed CG9940 expression decreasing,raising and mutation,to studies The effects of regular exercise begins at different ages combined CG9940 gene polymorphism on fast climbing ability and lifespan in drosophila.Methods:used the UAS/GAL4 system to make CG9940 gene expres⁃sion changes after flies crossing,rotating platform is used to training at different age stages of fruit flies,detected CG9940 gene mRNA expression by q-RTPCR,measured climbing speed and lifespan statistics of fly.Results:Compared with the relative expression of wild-type flies,NAD synthetase gene downregulation fruit flies mRNA expression expression decreased(P<0.01),lower rate of 56.98%;over-xpression fruit flies relatively increased expression(P<0.01),increase rate of 129.21%;mutation expression amount is very low,and the normal expression group differ about 8.70 times.compared with wild-type flies,climbing speed increased after raised CG9940 gene expression on young(P<0.01)and elderly(P<0.05)fruit flies,Mutant enhanced climbing speed on young(P<0.01)and elderly(P<0.01)drosophila,at 3rd week,control group climbing speed is lower than the exercise group in both in wild-type flies(P<0.05)and CG9940 over-expression flies(P<0.05).Compared with heart fibrillation index in wild-type flies,decreased the CG9940 gene expression in⁃creased fibrillation index(P<0.05),over-expression’s is lower(P<0.05),mutant’s is lower(P<0.01);Compared with wild-type flies,CG9940 gene ex⁃pression reduced makes lifespan shorten(P<0.05),over-expression and mutant extend the lifespan(P<0.05,P<0.01),exercising 6 weeks,trained after the 6th week,lifelong exercised prolong lifespan of the wild type(P<0.05,P<0.01,P<0.05)and over-expression CG9940 gene flies(P<0.01,P<0.01,P<0.05),exercising 6 weeks shorten lifespan in CG9940 gene expression decreased drosophila(P<0.01),exercising 6 weeks and lifetime training shorten lifespan in mutant(P<0.01,P<0.01).Conclusion:Under the different genetic background of CG9940 gene,exercise has different effects on fast climbing,only wild andover-expression flies’fast climbing benefit from early exercise;Training begins at different ages show the different influences on lifespan,but exercise after the 6th week prolong life widely.Suggesting NAD synthetase gene expression can be used as one of athlete gene selection index;Older individuals should par⁃ticipate in appropriate exercise.
CG9940;regular exercise;lifespan;aging
●研究报道Short Comunications
10.13297/j.cnki.issn1005-0000.2016.04.012
G 804.5
A
1005-0000(2016)04-340-06
2016-03-26;
2016-06-12;录用日期:2016-06-13
教育部博士点基金资助项目(项目编号:20134306110009);湖南省研究生科研创新项目(项目编号:CX2016B174)
文登台(1989-),男,湖南株洲人,在读博士研究生,研究方向为运动抗衰老候选基因筛选;通信作者:郑澜(1967-),女,湖南长沙人,教授,博士生导师,研究方向为运动抗衰老候选基因筛选。
湖南师范大学体适能与运动康复湖南省重点实验室,湖南长沙410001。
