互花米草幼苗对NaCl和CdCl2交互胁迫的生理响应研究
2016-12-15侯栋梁何东进游巍斌蔡金标肖石红简立燕李威威
侯栋梁 何东进 游巍斌 王 韧 蔡金标 王 鹏 肖石红 简立燕 李威威
(1. 福建农林大学生命科学学院,福建 福州 350002;2. 福建农林大学海洋研究中心,福建 福州 350002;3. 福建农林大学林学院,福建 福州 350002;4. 福鼎市林业局,福建 福鼎 355200;5. 霞浦县林业局,福建 霞浦 355100;6. 宁德市林业局,福建 宁德 352100)
互花米草幼苗对NaCl和CdCl2交互胁迫的生理响应研究
侯栋梁1,2何东进2,3游巍斌2,3王 韧4蔡金标5王 鹏6肖石红3简立燕3李威威3
(1. 福建农林大学生命科学学院,福建 福州 350002;2. 福建农林大学海洋研究中心,福建 福州 350002;3. 福建农林大学林学院,福建 福州 350002;4. 福鼎市林业局,福建 福鼎 355200;5. 霞浦县林业局,福建 霞浦 355100;6. 宁德市林业局,福建 宁德 352100)
以互花米草幼苗为材料,利用室内河沙盆栽试验,研究不同盐 (NaCl) 浓度和重金属 (CdCl2) 浓度下互花米草幼苗叶片内渗透调节物质和抗氧化酶体系的变化规律。结果表明:当CdCl2浓度范围在0.2~0.8 mmol/L时,高NaCl浓度 (700、900 mmol/L) 交互胁迫下处理组均枯死,表明NaCl和CdCl2交互胁迫并不能促进互花米草幼苗的耐盐机制,反而加速其灭亡,交互胁迫下互花米草幼苗生长所能忍受的胁迫浓度下降,互花米草幼苗最大耐NaCl浓度为500 mmol/L;在4组CdCl2浓度胁迫下,NaCl增加了互花米草幼苗叶片中SOD活性、POD活性和可溶性蛋白含量,且3个指标均随着NaCl浓度的增大呈现先升后降的单峰趋势。可溶性蛋白含量在NaCl浓度 (500~700 mmol/L) 达到峰值,POD活性最大值出现在NaCl浓度为500~900 mmol/L处,SOD活性最大值出现在胁迫浓度低的处理组中,也说明SOD先于另外两种酶出现在互花米草幼苗抗氧化过程中;SOD活性同时与POD活性和CAT活性呈负相关,但均不显著 (P> 0.05),只有渗透调节物质中的游离脯氨酸和抗氧化酶体系中的POD活性呈显著正相关 (P< 0.05)。综合考虑各个指标,互花米草在0~0.8 mmol/L CdCl2和0~900 mmol/L NaCl交互胁迫下,渗透调节物质中的可溶性蛋白与抗氧化酶体系中的SOD活性、POD活性均较为敏感且对胁迫浓度表现出相同的变化规律。
互花米草;NaCl;CdCl2;幼苗;胁迫;生理响应
互花米草 (Spartinaalterniflora) 隶属禾本科、米草属,是一种多年生草本植物,起源于美洲大西洋沿岸和墨西哥湾,适宜生活于高潮位的潮间带。我国的互花米草是继大米草 (Spartinaangelice) 引种成功后,于1979年12月从美国引入[1]。1981年福建省罗源湾在海滩上多次多点小规模移栽,由于沿海人多地少,滩涂围垦在历史上一直被沿用,互花米草秸秆密集粗壮、地下根茎发达,能够促进泥沙的快速沉降和淤积,且其适应性强、繁殖速度快,故互花米草种群急剧上升,现己对福建省沿海生态环境和水产养殖造成严重危害。据统计,仅闽东地区,互花米草总面积达103 km2,已侵占全省滩涂湿地约2/3[2]。
潮滩盐沼湿地是陆海交互作用的重要界面,但也是典型的环境脆弱带和敏感带,极易受到人类活动的破坏。重金属通过径流输入、污水排放等方式进入潮滩湿地,因其特殊的化学性质和毒性效应威胁着湿地生态系统[3]。人类活动导致的盐分聚积正在使湿地遭受的盐碱化程度加剧,湿地植被普遍受到盐度胁迫。湿地植物在对盐和重金属的耐性方面差别较大,互花米草之所以能够成功在各滨海湿地扩散生长,是因为其对高盐环境和重金属有较强的适应性和耐性[4]。研究表明互花米草幼苗对重金属Cd具有一定程度的耐受性,可以通过提高抗氧化酶体系活性来应答Cd导致的氧化胁迫[5]。随着Cd2+浓度的增大,互花米草叶、根生物量逐渐降低,膜透性、丙二醛 (MDA) 增加[6]。互花米草幼苗在不同盐度下其渗透调节物质 (游离脯氨酸、可溶性糖和可溶性蛋白) 的积累作用是互花米草对盐胁迫的主要响应过程[7]。
目前,国内外关于互花米草的研究多集中于入侵现状与治理方法[8-9],互花米草对干扰源响应的研究也已逐渐增多且多集中在盐胁迫上[1, 10-11],对于NaCl、CdCl2以及交互胁迫的研究尚少。为此,笔者以闽东滨海湿地采回的互花米草幼苗为材料,通过河沙培养试验,分析4组不同浓度重金属Cd环境下互花米草幼苗对NaCl的生理响应,初步确定其对NaCl和CdCl2交互胁迫的阈值,突出反应互花米草幼苗在逆境下其渗透调节物质和抗氧化酶体系的变化过程,旨在为互花米草入侵机理提供基础理论数据。
1 材料与方法
1.1 试验对象和样品处理
本试验选用的互花米草幼苗取自闽东霞浦县长春镇武曲村,区域已将近30 a的入侵历史,人为干扰较少,保留有较完整的滩涂原生植被演替序列。闽东于20世纪80年代初从罗源湾引种互花米草,凡潮汐能影响到的高、中潮滩几乎均有分布, 2004年12月闽东互花米草分布已有103 km2[2],已然成为我国受米草植物入侵最严重的地区之一。霞浦县为福建省宁德市下辖的1个县,位于北纬26°25′~27°09′,东经119°46′~120°26′,年平均温度16~19 ℃,春多雨水,夏多台风,冬暖夏凉,霜雪少见[12-14]。
2015年4月 (闽东滨海湿地互花米草幼苗期) 于霞浦县长春镇武曲村进行采样 (北纬26°47′,东经120°04′,海拔14.1 m,高潮带),样区内设置3块大小为8 m × 8 m的样地,样地两两间距确保大于20 m。在3个样地内选择大小均一、长势相同的克隆苗 (高约35 cm,4~5片叶),幼苗两两间距确保大于1 m,以防止取到同一克隆体,每个样地分别取48株,共釆集互花米草当年生克隆幼苗144株,附带根系少许原位土壤,用塑料薄膜封住根系土壤以免破坏根系。并取回少量土壤,装入自封袋带回实验室用于测定原位土壤盐度和Cd2+浓度 (测得盐度 (14.00 ± 1.82) ‰,Cd2+浓度 (1.25 ± 0.35) mg/kg)。
1.2 室内培养试验
将幼苗移栽到盛有河沙的无孔培养盆中 (23 cm × 16 cm × 19 cm (顶口内径 × 底内径 × 高),沙高15 cm),试验地点为福建农林大学温室大棚 (自然透光并遮雨)。白天平均气温为 (24 ± 2) ℃,夜间平均气温为 (19 ± 3) ℃。将72盆互花米草幼苗分成4组 (CdCl2浓度第1、2、3、4组分别为0、0.2、0.4、0.8 mmol/L),每组6个处理,每处理3盆,每盆定植2株。浓度梯度结合柴民伟[15]和本课题组在当地对土壤Cd含量的测定设计。用自来水复壮7 d后进行胁迫试验,生长恢复期结束后开始进行盐胁迫和重金属胁迫处理,以Hoagland 营养液为母液,根据计算量取一定质量的NaCl和CdCl2,与Hoagland营养液混合后,得到所需浓度的Hoagland 营养液。NaCl浓度为0、100、300、500、700、900 mmol/L。第1次进行胁迫处理时以100 mmol/L为起始盐度,并且以200 mmol/L的梯度逐天递增,在达到设计盐度后维持盐度不变,第2次胁迫直接加入所需NaCl量,无需逐天递增。重金属浓度为0、0.2、0.4、0.8 mmol/L,所有处理组一次性加入所需浓度。每隔4 d将培养盆侧翻弃旧液,浇注新鲜的胁迫溶液,浇灌量为300 mL。溶液pH用KOH和HCl调至 (8.0 ± 0.5)。胁迫期为4个月,测定其生长状况并选定从顶端向下第3~5片充分伸展的完整叶片测定其生理生化指标 (注:Na0、Na1、Na2、Na3、Na4和Na5分别代表NaCl浓度梯度0、100、300、500、700、900 mmol/L;Cd0、Cd1、Cd2和Cd3分别代表CdCl2浓度梯度0、0.2、0.4、0.8 mmol/L)。
1.3 指标测定
土壤水溶性盐总量测定采用电导法 (水土比5∶1),土壤中Cd含量测定应用原子吸收分光光度法,游离脯氨酸含量测定采用磺基水杨酸法,可溶性糖含量测定采用蒽酮比色法,可溶性蛋白测定采用考马斯亮蓝染色法,采用氮蓝四挫 (NBT) 光化还原法测定超氧化物歧化酶 (SOD) 活性,过氧化物酶 (POD) 活性测定采用愈创木酚法,采用紫外吸收法测定过氧化氢酶 (CAT) 活性。以上所用测定方法参考文献[16]。
1.4 数据统计分析
试验所得数据应用Excel 2007整理并制图,并利用SPSS 20.0数据分析软件对数据进行统计检验。采用单因素方差分析和Duncan检验比较样本间的显著性。
2 结果与分析
2.1 NaCl、CdCl2及其交互胁迫对互花米草幼苗渗透调节物质的影响
互花米草幼苗胁迫前游离脯氨酸含量 (62.50 ± 5.34) μg/g,可溶性糖含量 (14.70 ± 2.89) mg/g,可溶性蛋白含量 (7.70 ± 1.66) mg/g,SOD活性 (87.63 ± 8.56) U/g,POD活性 (656.67 ± 67.21) U/(g·min),CAT活性 (8.63 ± 1.16) U/(g·min)。在NaCl、CdCl2及其交互胁迫4个月后,Na4Cd1、Na5Cd1、Na4Cd2、Na5Cd2、Na4Cd3和Na5Cd3均枯死,只有NaCl单因素胁迫 (第1组) 下700、900 mmol/L耐受存活,说明NaCl和CdCl2交互胁迫并不能促进互花米草幼苗的耐盐机制,反而加速其灭亡,在CdCl2浓度范围0.2~0.8 mmol/L下 (第2~4组),互花米草幼苗最大耐NaCl浓度为500 mmol/L。
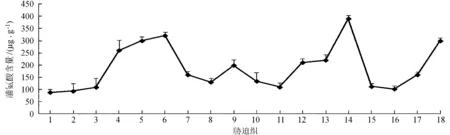
互花米草幼苗叶片中3种渗透调节物质:游离脯氨酸、可溶性糖和可溶性蛋白在NaCl、CdCl2及其交互胁迫下的变化规律分别见图1~2。NaCl单因素胁迫下,互花米草幼苗叶片游离脯氨酸含量随着NaCl浓度梯度的升高而显著增大 (P< 0.05)。0.4、0.8 mmol/L CdCl2浓度胁迫 (第3、4组) 下也具有相同变化规律 (P< 0.05),0.2 mmol/L CdCl2浓度胁迫 (第2组) 下波动上升并不明显 (图1),不同CdCl2浓度游离脯氨酸含量变化有差异。
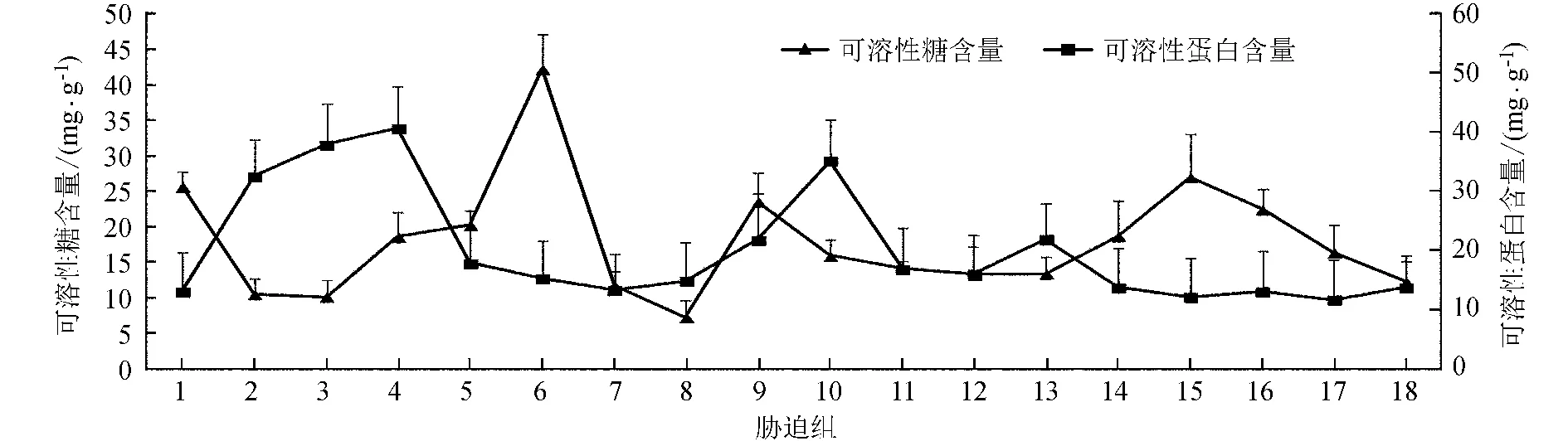
CdCl2浓度 (0.4、0.8 mmol/L) 胁迫组均随着NaCl浓度的增加波动上升 (P< 0.05),0.2 mmol/L CdCl2浓度胁迫下波动上升并不明显,但0.8 mmol/L CdCl2浓度胁迫组下互花米草幼苗叶片可溶性糖波动下降 (P< 0.05) (图2),这可能是由于在高浓度的CdCl2胁迫下反而破坏了互花米草幼苗的抗逆机制。互花米草幼苗叶片中的可溶性蛋白含量在单因素NaCl胁迫下表现为:先升高到500 mmol/L的40.68 mg/g,随后极速下降,并在900 mmol/L处达到15.29 mg/g (P< 0.05);同时,在0.2 mmol/L、0.8 mmol/L CdCl2浓度胁迫组下也表现出在500 mmol/L达到最大值,只有0.4 mmol/L CdCl2浓度胁迫组下在300 mmol/L达到最大,说明在0~0.8 mmol/L CdCl2浓度范围胁迫下,互花米草幼苗叶片可溶性蛋白含量在适度的NaCl胁迫下 (300~500 mmol/L) 将达到最大值。
1. Na0Cd0; 2. Na1Cd0; 3. Na2Cd0; 4. Na3Cd0; 5. Na4Cd0; 6. Na5Cd0; 7. Na0Cd1; 8. Na1Cd1; 9. Na2Cd1;10. Na3Cd1; 11. Na0Cd2; 12. Na1Cd2; 13. Na2Cd2; 14. Na3Cd2; 15. Na0Cd3; 16. Na1Cd3; 17. Na2Cd3; 18. Na3Cd3。
图1 不同胁迫处理下互花米草幼苗叶片游离脯氨酸含量
Fig.1 Free proline contents in leaves ofS.alternifloraunder different stress treatments
1. Na0Cd0; 2. Na1Cd0; 3. Na2Cd0; 4. Na3Cd0; 5. Na4Cd0; 6. Na5Cd0; 7. Na0Cd1; 8. Na1Cd1; 9. Na2Cd1;10. Na3Cd1; 11. Na0Cd2; 12. Na1Cd2; 13. Na2Cd2; 14. Na3Cd2; 15. Na0Cd3; 16. Na1Cd3; 17. Na2Cd3; 18. Na3Cd3。
图2 不同胁迫处理下互花米草幼苗叶片可溶性糖和可溶性蛋白含量
Fig.2 Soluble sugar contents and soluble protein contents in leaves ofS.alternifloraunder different stress treatments
2.2 NaCl、CdCl2及其交互胁迫对互花米草幼苗抗氧化酶活性的影响
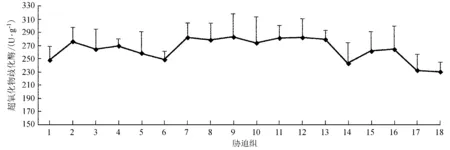
在NaCl单因素胁迫下,互花米草幼苗叶片SOD活性呈先增后减的变化规律,在浓度为100 mmol/L时最大,为276.30 U/g (图3);CdCl2单因素胁迫下,互花米草幼苗叶片SOD活性在CdCl2浓度为0.2 mmol/L时最大 (P> 0.05),表明在NaCl、CdCl2及其交互胁迫4个月后SOD活性最大值出现在胁迫液浓度低的处理组中,也说明SOD先于另外2种酶出现在互花米草幼苗抗氧化过程中。
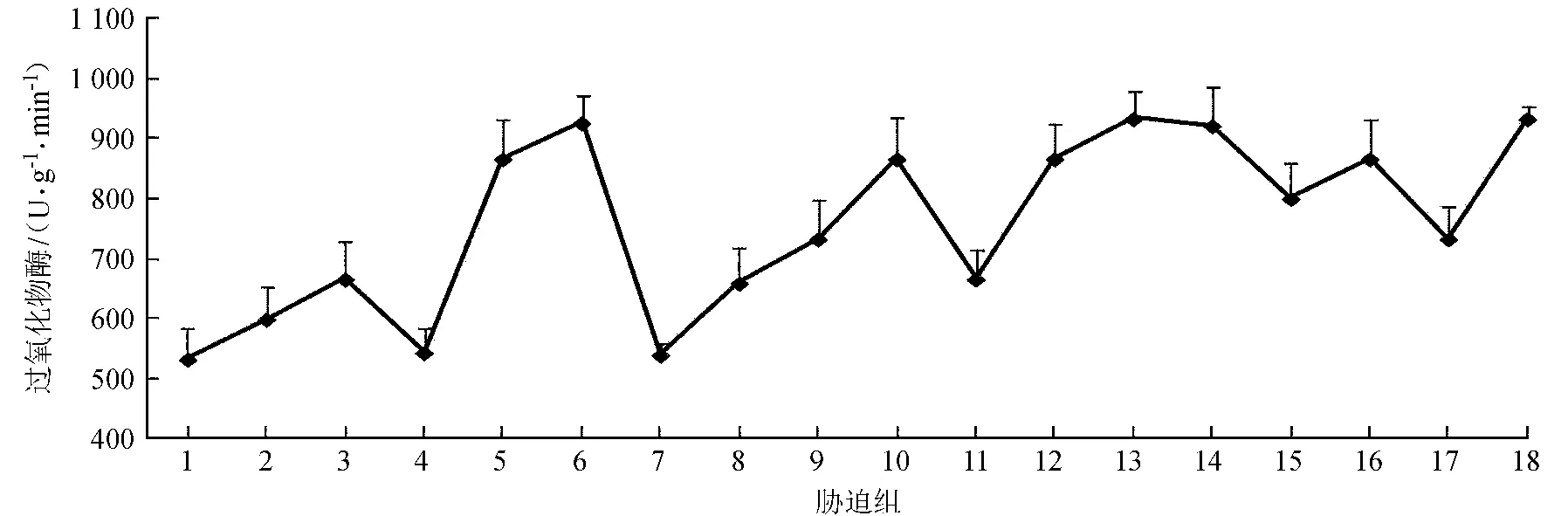
NaCl单因素胁迫下,POD活性随着胁迫浓度的增加呈现波动上升趋势,并分别在300、900 mmol/L处形成两个高峰;其他3组基本随着NaCl浓度的增加而上升 (P< 0.05)。4组胁迫组POD活性最大值出现在NaCl浓度为500~900 mmol/L处。在CdCl2单因素胁迫下,互花米草幼苗叶片POD活性随着CdCl2浓度的增大而显著增强 (P< 0.05),由无胁迫浓度下的533.33 U/(g·min) 增强到CdCl2浓度为0.8 mmol/L的800.73 U/(g·min),增长33.39 % (图4)。
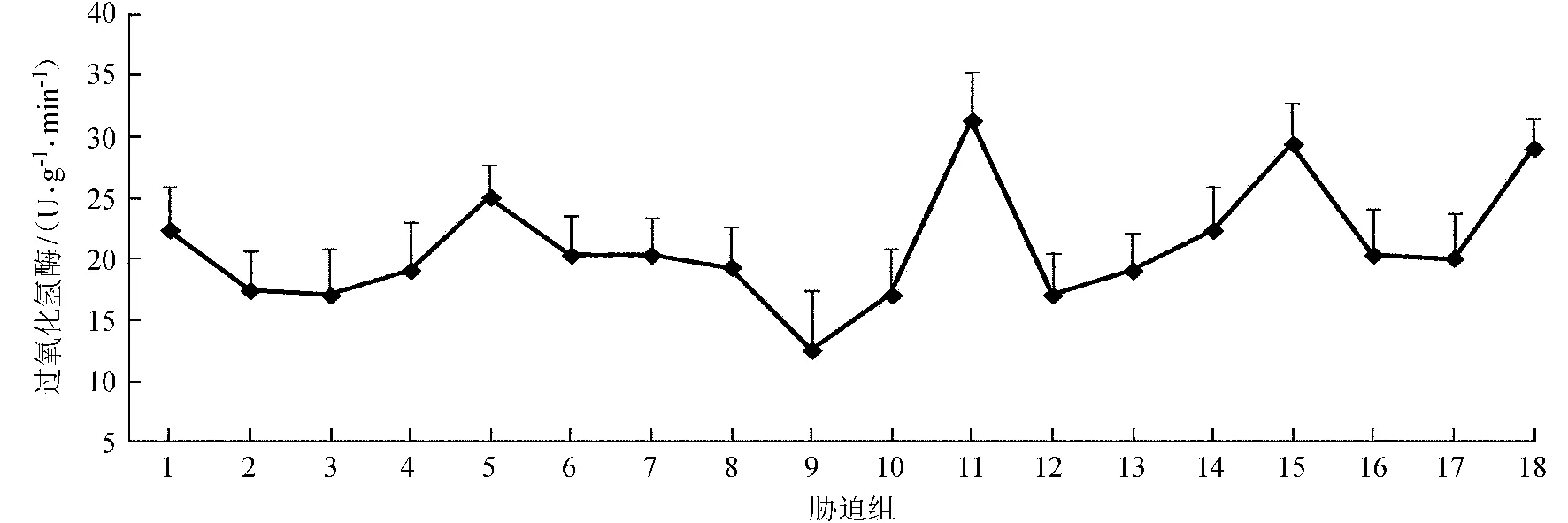
由图5可见,在CdCl2单因素胁迫下,CAT活性均较大。即在0~0.8 mmol/L CdCl2胁迫下,无NaCl交互胁迫的处理组其叶片CAT活性更强,表明NaCl和CdCl2交互胁迫会抑制互花米草幼苗叶片CAT活性。在这4组CdCl2胁迫下,CAT活性整体呈下降后上升趋势,经统计分析表明,除了在单因素NaCl胁迫下不具显著性差异外 (P> 0.05),其他3组均具有显著性差异 (P< 0.05)。
1. Na0Cd0; 2. Na1Cd0; 3. Na2Cd0; 4. Na3Cd0; 5. Na4Cd0; 6. Na5Cd0; 7. Na0Cd1; 8. Na1Cd1; 9. Na2Cd1;10. Na3Cd1; 11. Na0Cd2; 12. Na1Cd2; 13. Na2Cd2; 14. Na3Cd2; 15. Na0Cd3; 16. Na1Cd3; 17. Na2Cd3; 18. Na3Cd3。
图3 不同胁迫处理下互花米草幼苗叶片SOD活性
Fig.3 SOD activities in leaves ofS.alternifloraunder different stress treatments
1. Na0Cd0; 2. Na1Cd0; 3. Na2Cd0; 4. Na3Cd0; 5. Na4Cd0; 6. Na5Cd0; 7. Na0Cd1; 8. Na1Cd1; 9. Na2Cd1;10. Na3Cd1; 11. Na0Cd2; 12. Na1Cd2; 13. Na2Cd2; 14. Na3Cd2; 15. Na0Cd3; 16. Na1Cd3; 17. Na2Cd3; 18. Na3Cd3。
图4 不同胁迫处理下互花米草幼苗叶片POD活性
Fig.4 POD activities in leaves ofS.alternifloraunder different stress treatments
1. Na0Cd0; 2. Na1Cd0; 3. Na2Cd0; 4. Na3Cd0; 5. Na4Cd0; 6. Na5Cd0; 7. Na0Cd1; 8. Na1Cd1; 9. Na2Cd1;10. Na3Cd1; 11. Na0Cd2; 12. Na1Cd2; 13. Na2Cd2; 14. Na3Cd2; 15. Na0Cd3; 16. Na1Cd3; 17. Na2Cd3; 18. Na3Cd3。
图5 不同胁迫处理下互花米草幼苗叶片CAT活性
Fig.5 CAT activities in leaves ofS.alternifloraunder different stress treatments
2.3 互花米草幼苗生理指标相关性
互花米草幼苗叶片中抗氧化酶活性指标SOD活性同时与POD活性和CAT活性呈负相关,但均不显著 (P> 0.05),这是由于SOD活性较早达到峰值 (100 mmol/L),当POD活性和CAT活性开始随着NaCl浓度梯度上升而上升时,SOD活性已经呈下降的变化趋势。NaCl、CdCl2交互胁迫下只有渗透调节物质的游离脯氨酸和抗氧化酶中的POD活性显著正相关 (P< 0.05)。
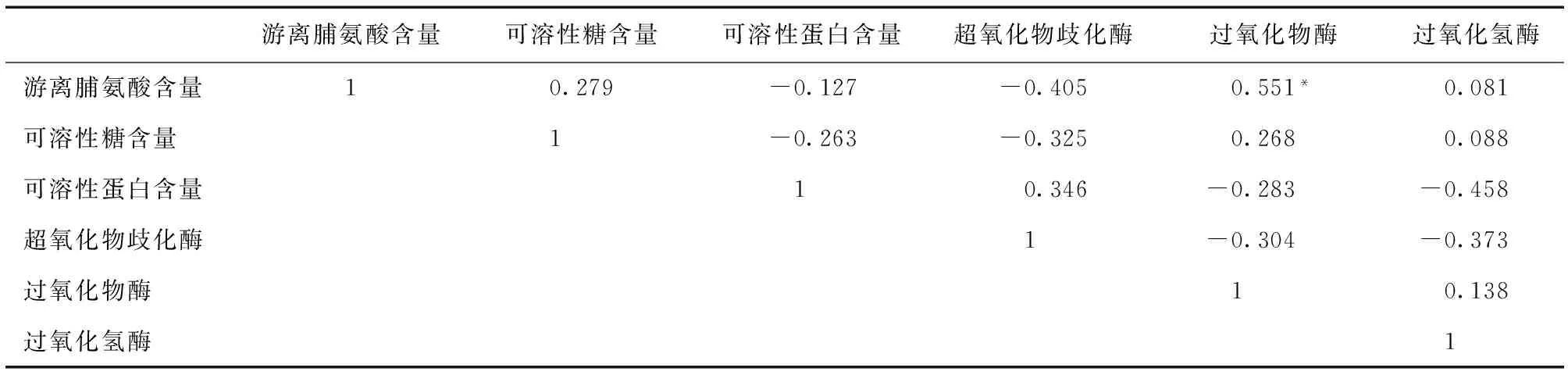
表1 互花米草幼苗生理指标Pearson相关分析
3 结论与讨论
游离脯氨酸参与调节细胞的渗透势,保护蛋白质分子和酶活性,作为活性氧的清除剂和抗冷剂,是植物抵抗渗透胁迫的有效方式之一[2]。本文研究发现随着CdCl2浓度的升高,游离脯氨酸含量显著上升 (P< 0.05),这与柴民伟[15]的研究结果一致。柴民伟的研究中发现在低 (1 mmol/L)、高 (3 mmol/L) Cd2+浓度下,游离脯氨酸的含量会随着NaCl浓度的增加分别呈上升 (P< 0.05) 和下降的趋势 (P< 0.05),本研究在0~0.8 mmol/L CdCl2浓度范围内得出上升的变化规律与之相符。可溶性糖在许多盐生植物体内作为渗透调节剂,同时也是合成其他有机溶质的碳架和能量来源,对细胞质膜和原生质胶体有稳定作用,还可在细胞内无机离子浓度高时起保护酶类的作用,可溶性糖及可溶性蛋白含量的增加被认为是植物对盐胁迫和重金属胁迫的一种适应机制[2]。本研究表明4组不同CdCl2胁迫下互花米草幼苗叶片内可溶性蛋白均随NaCl胁迫溶液增加而上升,当胁迫超出植物体忍耐范围 (500~700 mmol/L) 之后,叶片中可溶性蛋白含量下降。在NaCl、CdCl2及其交互胁迫下,互花米草幼苗叶片可溶性蛋白含量呈上升趋势,表明互花米草在受到胁迫时可能通过提高体内的大分子蛋白质含量,再将其分解为多肽、氨基酸等小分子物质来进行自我保护。
逆境胁迫会促进活性氧增加,其结果一方面诱导有关的保护酶:SOD活性、POD活性和CAT活性升高,另一方面可以直接破坏生物大分子,使酶活性丧失。在Cd2+胁迫条件下,细胞活性氧防御酶系和非酶促物质组成的抗氧化防御系统将被激活,从而可清除因Cd2+诱导产生的过量活性氧,维持细胞稳定的生理生化状态[5]。SOD、POD是植物酶促防御系统重要的保护酶,SOD能催化植物体内的超氧阴离子自由基 (O2-) 发生歧化反应生成H2O2和O2,POD能消耗H2O2,SOD和POD相互协调,有效地清除代谢过程产生的活性氧,从而防止了活性氧引起的膜脂过氧化及其他伤害过程[17],SOD先于POD在植物体内发生反应,本试验发现SOD早于POD出现峰值。互花米草与其他高抗逆性植物具有相似的抗镉毒机理,表现为低强度胁迫条件下,植物体内酶活性随胁迫程度增加而上升,当胁迫程度超出植物体忍耐范围之后,胁迫程度越高,酶活性越低[18],试验中除CAT活性外,SOD活性和POD活性也表现出相同趋势。在单因素NaCl胁迫下,互花米草幼苗叶片SOD活性和POD活性随着NaCl浓度呈现先升后降的趋势,表明随着NaCl胁迫浓度增大,互花米草幼苗叶片增强SOD活性和POD活性以抵御活性氧引起的膜脂过氧化及其他伤害过程,但随着NaCl胁迫浓度的继续增大,互花米草幼苗叶片SOD活性和POD活性开始下降,SOD活性比POD活性更早达到阈值。在单因素CdCl2胁迫下,互花米草幼苗叶片POD活性呈现持续上升的趋势,这与石贵玉等[6]在0~0.8 mmol/L浓度范围内的研究结果相符。李丽霞等[5]研究结果表明,互花米草CAT活性受到Cd2+胁迫的影响较为显著,表现为先降后升的变化趋势。试验中对CAT活性的研究中也得出CAT活性随着CdCl2浓度增加呈现先降后升的变化趋势,同时得出在0~0.8 mmol/L的4组CdCl2浓度胁迫组下,CAT活性也是随着NaCl胁迫浓度的增加表现出先降后升的趋势。试验中SOD活性变化并不明显,在230.37~282.96 U/g之间波动。古志钦和张利权[17]对互花米草进行40 cm淹水胁迫,在胁迫4个月时其叶片SOD活性的变化也不明显 (胁迫组与对照组大约相差30 U/g)。而沈文燕等[19]对不同浓度Na2S处理下互花米草叶片SOD活性进行研究,虽然逆境胁迫与本试验不同,但在一定程度上说明互花米草叶片SOD活性虽然在抗氧化酶体系中较为敏感 (较其他两种酶更早出现峰值),但波动幅度不大。
综上所述,在CdCl2浓度范围0.2~0.8 mmol/L下,互花米草幼苗最大耐NaCl浓度为500 mmol/L;在NaCl、CdCl2及其交互胁迫下互花米草幼苗叶片中SOD活性、POD活性和可溶性蛋白含量均随着NaCl浓度的增大呈现先升后降的单峰趋势;可溶性蛋白含量在NaCl浓度 (500~700 mmol/L) 达到峰值,SOD活性最大值出现在胁迫浓度低的处理组中 (0~100 mmol/L),POD活性最大值出现在NaCl浓度为500~900 mmol/L处;SOD活性同时与POD活性和CAT活性呈负相关 (P> 0.05),游离脯氨酸和POD活性显著正相关 (P< 0.05)。
[1] 胡楚琦, 刘金珂, 王天弘, 等. 三种盐胁迫对互花米草和芦苇光合作用的影响[J]. 植物生态学报, 2015, 39(1): 92-103.
[2] 洪荣标. 滨海湿地入侵植物的生态经济和生态安全管理[D]. 福州: 福建农林大学, 2005.
[3] Rai P K. Heavy metal pollution in aquatic ecosystems and its phytoremediation using wetland plants:an ecosustainable approach[J]. International Journal of Phytoremediation, 2008, 10(2): 131-158.
[4] Wang Y J, Zhou L M, Zheng X M, et al. Influence ofSpartinaalternifloraon the mobility of heavy metals in salt marsh sediments of the Yangtze River Estuary, China[J]. Environmental Science and Pollution Research, 2013, 20(3): 1675-1685.
[5] 李丽霞, 赵吉强, 陈世华, 等. 互花米草 (Spartinaalterniflora) 对重金属Cd胁迫的生理响应[J]. 烟台大学学报 (自然科学与工程版), 2009, 22(4): 328- 332.
[6] 石贵玉, 粱士楚, 黄雅丽, 等. 互花米草幼苗对重金属镉胁迫的生理响应[J]. 广西植物, 2013, 33(6): 812-816.
[7] 肖强, 郑海雷, 陈瑶, 等. 盐度对互花米草生长及脯氨酸、可溶性糖和蛋白质含量的影响[J]. 生态学杂志, 2005, 24(4): 373-376.
[8] Tang L, Gao Y, Wang C H, et al. How tidal regime and treatment timing influence the clipping frequency for controlling invasiveSpartinaalterniflora: implications for reducing management costs[J]. Biological Invasions, 2010, 12(3): 593-601.
[9] 谭芳林. 机械法治理互花米草效果及其对滩涂土壤性状影响研究[J]. 湿地科学, 2008, 6(4): 526- 530.
[10] 肖燕, 汤俊兵, 安树青. 芦苇、互花米草的生长和繁殖对盐分胁迫的响应[J]. 生态学杂志, 2011, 30(2): 267-272.
[11] Niranjan B, Prasanta K S, Pritish V. Primary responses to salt stress in a halophyte, smooth cordgrass (SpartinaalternifloraLoisel.) [J]. Functional & Integrative Genomics, 2008, 8(3): 287-300.
[12] 何东进, 游巍斌, 王韧, 等. 中国红树林天然分布北缘区不同起源秋茄林湿地沉积物重金属空间分布特征比较[J]. 应用与环境生物学报, 2013, 19(6): 945-951.
[13] 谭勇, 何东进, 游巍斌, 等. 闽东滨海湿地入侵种互花米草表型可塑性及生物量分配对潮位梯度的响应[J]. 应用与环境生物学报, 2014, 20(5): 863-868.
[14] Zhao L L, You W B, Hu H Q, et al. Spatial distribution of heavy metals (Cu, Pb, Zn, and Cd) in sediments of a coastal wetlands in eastern Fujian, China[J]. Journal of Forestry Research, 2015, 26(3): 703- 710.
[15] 柴民伟. 外来种互花米草和黄顶菊对重金属和盐碱胁迫的生态响应[D]. 天津: 南开大学, 2013.
[16] 蔡庆生. 植物生理学实验[M]. 北京: 中国农业大学出版社, 2013.
[17] 古志钦, 张利权. 互花米草对持续淹水胁迫的生理响应[J]. 环境科学报, 2009, 29(4): 876-881.
[18] 石福臣, 鲍芳. 盐和温度胁迫对外来种互花米草 (Spartinaalterniflora) 生理生态特性的影响[J]. 生态学报, 2007, 27(7): 2733-2741.
[19] 沈文燕, 陆长梅, 周长芳. 互花米草和芦苇抗氧化系统在抵御硫胁迫过程中的响应差异[J]. 复旦学报 (自然科学版), 2011, 50(5): 653-661.
(责任编辑 张 坤)
Physiological Response ofSpartinaalternifloraSeedlings to NaCl, CdCl2and Their Interactions Stress
Hou Dongliang1,2, He Dongjin2,3, You Weibin2,3, Wang Ren4, Cai Jinbiao5, Wang Peng6,Xiao Shihong3, Jian Liyan3, Li Weiwei3
(1. College of Life Science, Fujian Agriculture and Forestry University, Fuzhou Fujian 350002, China; 2. Marine Research Center, Fujian Agriculture and Forestry University, Fuzhou Fujian 350002, China; 3. College of Forestry, Fujian Agriculture and Forestry University, Fuzhou Fujian 350002, China;4. Forestry Bureau of Fuding City, Fuding Fujian 355200, China; 5. Forestry Bureau of Xiapu County, Xiapu Fujian 355100, China;6. Forestry Bureau of Ningde City, Ningde Fujian 352100, China)
Pot experiment was conducted to study the change regulation of osmotic adjustment substance and antioxidant enzyme in leaves ofSpartinaalternifloraseedlings under salt stress and heavy metal stress. When the CdCl2concentration in the range of 0.2-0.8 mmol/L, the group under interaction stress with high concentration of NaCl (700, 900 mmol/L) were dead. The results indicated that NaCl and CdCl2interaction stress does not promote salt tolerance mechanism ofS.alternifloraseedlings, but accelerated its demise. The concentration ofS.alternifloraseedling growth decreased under the interaction stress, and the maximum NaCl tolerance concentration was 500 mmol/L. Under different concentrations of CdCl2in the 4 groups,the activity of superoxide dismutase (SOD), peroxidase (POD) and soluble protein content (SPC) in leaves ofS.alternifloraincreased, and the three indicators increased first and then decreased, showing a single peak trend with the increase of NaCl concentration. SPC reached the peak at the NaCl concentration of 500-700 mmol/L. The maximum of POD activity appeared at the NaCl concentration of 500-900 mmol/L. The maximum of SOD activity appeared in the treatment group with low stress concentrations, suggesting that SOD was appeared in the antioxidant process prior to the other two kinds of antioxidant enzymes. SOD activity was negatively correlated with POD activity and CAT activity, but not significant (P> 0.05). And only free proline of osmotic adjustment substance and POD activity of antioxidant enzyme presented significantly positivecorrelation (P< 0.05). Comprehensive consideration of the various indicators, the results showed that SPC of osmotic adjustment substance, SOD activity of antioxidant enzyme and POD activity were more sensitive and showed the same change regulations under the stress concentrations of CdCl2and NaCl at the range of 0-0.8 mmol/L and 0-900 mmol/L, respectively.
Spartinaalterniflora, NaCl, CdCl2, seedling, stress, physiological response

10. 11929/j. issn. 2095-1914. 2016. 06. 003
2016-03-18
福建省科技厅引导性项目 (2015N0018) 资助;闽林科 [2015] 1号资助;福建省科技厅重点项目 (2009N0009) 资助;国家自然科学基金项目 (31370624、30870435) 资助。
何东进 (1969—),男,教授,博士生导师。研究方向:景观生态学。Email: fjhdj1009@126.com。
S718.43
A
2095-1914(2016)06-0015-07
第1作者:侯栋梁 (1991—),男,硕士生。研究方向:森林生态学。Email: 419312967@qq.com。
