青连宁心胶囊的质量标准研究Δ
2016-12-15司席席孙洪胜曹广尚陈倩倩山东中医药大学药学院济南50355山东中医药大学附属医院济南500
司席席,孙洪胜,曹广尚,陈倩倩,刘 丹(.山东中医药大学药学院,济南 50355;.山东中医药大学附属医院,济南 500)
青连宁心胶囊的质量标准研究Δ
司席席1*,孙洪胜2#,曹广尚2,陈倩倩1,刘 丹1(1.山东中医药大学药学院,济南 250355;2.山东中医药大学附属医院,济南 250011)
目的:建立青连宁心胶囊的质量标准。方法:采用薄层色谱法(TLC)对制剂中黄连、青蒿进行定性鉴别;采用高效液相色谱法测定制剂中青蒿素的含量:色谱柱为Diamonsil C18,流动相为甲醇-磷酸盐缓冲液(45∶55,V/V),流速为1.0 ml/min,检测波长为260 nm,柱温为30℃,进样量为10 μl。结果:黄连、青蒿的TLC斑点清晰,分离度好,阴性对照无干扰。青蒿素检测质量浓度线性范围为5.62~56.2 μg/ml(r=0.999 4);精密度、稳定性、重复性的RSD<1.0%;加样回收率为97.46%~99.72%(RSD=0.75%,n=6)。结论:该研究所建标准可用于青连宁心胶囊的质量控制。
青连宁心胶囊;青蒿素;高效液相色谱法;薄层色谱法;质量标准
快速性心律失常是临床上常见的心血管系统疾病,属于中医“心悸”范畴,具有起病急、病情复杂、治疗效果不佳等特点。青连宁心胶囊由黄连和青蒿两味药材组合而成,方中黄连味苦,性寒,有清热泻火、燥湿解毒之效;青蒿味苦、辛,性寒,有清热除蒸、化湿消痰之功。二药合用共奏清热化痰、宁心安神之功效,是治疗快速性心律失常的临床经验加减方。为有效控制该制剂的质量,笔者对其质量标准进行了研究——采用薄层色谱法(TLC)鉴别制剂中黄连和青蒿,高效液相色谱法(HPLC)测定其中青蒿素的含量。
1 材料
1.1 仪器
1260型HPLC仪,包括DAD二极管阵列检测器(美国Agilent公司);AV412型电子分析天平、CP2250型电子分析天平(奥豪斯国际贸易有限公司);LC-600B型数控超声波清洗机(山东济宁鲁超超声设备有限公司,功率:250 W,频率:40 kHz);电热恒温水浴锅(北京市永光明医疗仪器有限公司)。
1.2 药品与试剂
青连宁心胶囊(山东中医药大学附属医院药剂实验室自制,批号:20150518、20150524、20150530,规格:0.3 mg/粒);青蒿素对照品(批号:100202-201004,纯度:98.8%)、盐酸小檗碱对照品(批号:MUST-15010411)、黄连对照药材(批号:120913-200407)均购于中国食品药品检定研究院;硅胶G薄层板(青岛海洋化工厂);甲醇为色谱纯,其余试剂均为分析纯,水为纯化水。
2 方法与结果
2.1 定性鉴别
2.1.1 黄连 取本品内容物0.25 g,研细,加甲醇25 ml,超声处理30 min,滤过,取滤液作为供试品溶液。另取盐酸小檗碱对照品适量,加甲醇制成盐酸小檗碱质量浓度为0.5 mg/ml的对照品溶液。再取黄连对照药材0.25 g,同供试品溶液制备方法制成对照药材溶液。按青连宁心胶囊处方和工艺制备缺黄连的阴性样品,并按供试品溶液制备方法制成阴性对照溶液。按TLC法[2015年版《中国药典》(四部)][1]试验,吸取上述4种溶液各1 μl,分别点于同一硅胶G薄层板上,以环己烷-乙酸乙酯-异丙醇-甲醇-水-三乙胺(3∶3.5∶1∶1.5∶0.5∶1,V/V/V/V/V/V)为展开剂,置于浓氨液预饱和20 min的展开缸内,展开,取出,晾干,置紫外光灯(365 nm)下检视。结果,供试品色谱中,在与对照药材和对照品色谱相应位置上显相同颜色的斑点,阴性对照无干扰,详见图1。
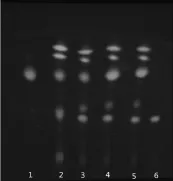
图1 黄连的薄层色谱图1.对照品;2.对照药材;3~5.供试品;6.阴性对照Fig 1 TLC chromatograms of Coptis chinensis1.reference substance;2.control medicinal herb;3-5.test samples;6.negative control
2.1.2 青蒿 取本品内容物3 g,加石油醚(60~90℃)50 ml,加热回流1 h,滤过,滤液蒸干,残渣加正己烷30 ml使溶解,加20%乙腈溶液振摇提取3次,每次10 ml,合并乙腈溶液,蒸干,残渣加95%乙醇0.5 ml使溶解,作为供试品溶液。另取青蒿素对照品适量,加95%乙醇制成青蒿素质量浓度为1 mg/ml的对照品溶液。按青连宁心胶囊处方和工艺制备缺青蒿的阴性样品,并按供试品溶液制备方法制成阴性对照溶液。按TLC法[2015年版《中国药典》(四部)][1]试验,吸取上述3种溶液各5 μl,分别点于同一硅胶G薄层板上,以石油醚(60~90℃)-乙醚(4∶5,V/V)为展开剂,展开,取出,晾干,喷以含2%香草醛的10%硫酸乙醇溶液,于105℃加热至斑点显色清晰,置日光灯下检视。结果,供试品色谱中,在与对照品色谱相应位置上显相同颜色的斑点,阴性对照无干扰,详见图2。

图2 青蒿的薄层色谱图1.对照品;2~4.供试品;5.阴性对照Fig 1 TLC chromatograms ofArtemisia carvifolia1.reference substance;2-4.test samples;5.negative control
2.2 含量测定
2.2.1 色谱条件 色谱柱:Diamonsil C18(250 mm×4.6 mm,5 μm),流动相:甲醇-磷酸盐缓冲液(45∶55,V/V);流速:1.0 ml/min;检测波长:260 nm;柱温:30℃;进样量:10 μl。
2.2.2 对照品溶液的制备[2-3]精密称取青蒿素对照品5.62 mg,置于5 ml量瓶中,加95%乙醇溶解并定容,得青蒿素对照品贮备液;精密量取上述对照品贮备液1 ml,置于10 ml量瓶中,加0.2%氢氧化钠溶液4 ml,摇匀,置于50℃恒温水浴中反应30 min,取出,冷却至室温,加0.08 mol/L醋酸溶液定容,用0.22 μm微孔滤膜滤过,取续滤液,即得。
2.2.3 供试品溶液的制备 取本品内容物适量,研细,取约1.53 g,精密称定,置于具塞锥形瓶中,加95%乙醇50 ml,密塞,称定质量,超声处理30 min,放冷,再次称定质量,加95%乙醇补足减失的质量,摇匀,滤过,得供试品溶液贮备液;精密量取上述供试品贮备液2 ml,置于10 ml量瓶中,加0.2%氢氧化钠溶液4 ml,摇匀,于50℃恒温水浴中反应30 min,取出,冷却至室温,加0.08 mol/L醋酸溶液定容,用0.22 μm微孔滤膜滤过,取续滤液,即得。
2.2.4 阴性对照溶液的制备 按青连宁心胶囊处方和工艺制备缺青蒿的阴性样品,并按“2.2.3”项下方法制成阴性对照溶液。
2.2.5 系统适用性试验 分别取“2.2.2”“2.2.3”“2.2.4”项下对照品溶液、供试品溶液和阴性对照溶液各10 μl,按“2.2.1”项下色谱条件进样测定,记录色谱,详见图3。在上述色谱条件下,理论板数以青蒿素峰计≥3 000;各成分基线分离良好,分离度>1.5。

图3 高效液相色谱图A.对照品;B.供试品;C.阴性对照;1.青蒿素Fig 3 HPLC chromatogramsA.reference substance;B.test sample;C.negative control;1.artemisinin
2.2.6 线性关系考察 分别精密量取“2.2.2”项下对照品溶液适量,分别置于10 ml量瓶中,加95%乙醇定容,制成质量浓度分别为5.62、11.24、22.48、33.72、56.2 μg/ml的系列对照品溶液。精密量取上述系列对照品溶液各10 μl,按“2.2.1”项下色谱条件进样测定,记录峰面积。以青蒿素质量浓度(x,μg/ml)为横坐标、峰面积(y)为纵坐标进行线性回归,得青蒿素回归方程为y=10.167x-14.845(r=0.999 4)。结果表明,青蒿素检测质量浓度线性范围为5.62~56.2 μg/ml。
2.2.7 精密度试验 取“2.2.2”项下对照品溶液适量,按“2.2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,青蒿素峰面积的RSD=0.59%(n=6),表明仪器精密度良好。
2.2.8 稳定性试验 取“2.2.3”项下供试品溶液(批号:20150518)适量,分别于室温下放置0、2、4、8、10、12 h时按“2.2.1”项下色谱条件进样测定,记录峰面积。结果,青蒿素峰面积的RSD=0.44%(n=6),表明供试品溶液在12 h内基本稳定。
2.2.9 重复性试验 精密称取同一批样品(批号:20150518)适量,按“2.2.3”项下方法制备供试品溶液,共6份,再按“2.2.1”项下色谱条件进样测定,记录峰面积。结果,青蒿素峰面积的RSD=0.61%(n=6),表明本方法重复性良好。
2.2.10 加样回收率试验 取已知含量样品(批号:20150518)适量,共6份,分别加入一定质量的青蒿素对照品,按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表1。

表1 加样回收率试验结果(n=6)Tab 1 Results of recovery test(n=6)
2.2.11 样品含量测定 取3批样品各适量,分别按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积并计算样品含量,结果见表2。
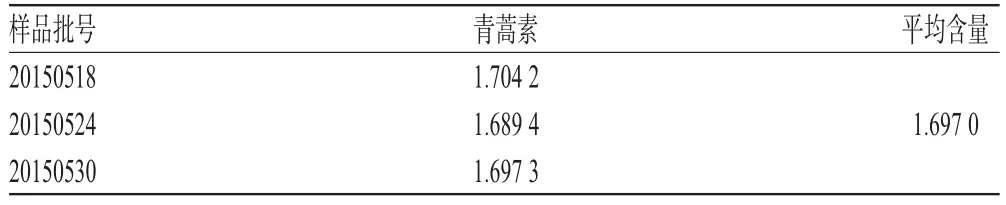
表2 样品含量测定结果(n=3,mg/g)Tab 2 Results of content determination of samples(n=3,mg/g)
3 讨论
青蒿素是一种新型倍半萜内酯类化合物,20世纪70年代发现青蒿中含有抗疟成分青蒿素,目前青蒿素的测定方法尚未收录至《中国药典》,由于青蒿素没有共轭结构,化学性质不稳定,所以给测定带来了困难。已有文献报道了采用多种方法测定青蒿素含量,如薛洪宝等[4]用紫外和蒸发光散射检测器同时测定青蒿中6种成分,结果除了青蒿素外,其他5种成分紫外检测比蒸发光散射检测灵敏度高;周翱翱等[5]用HPLC-蒸发光散射检测法测定青蒿中青蒿素的含量;张东等[6]用HPLC-紫外吸收光谱(UV)-蒸发光散射检测法同时测定青蒿中的青蒿素、青蒿乙素和青蒿酸的含量;黄宇等[7]用碘量法测定黄花蒿中青蒿素的含量;周浓等[8]用紫外分光光度法测定重庆酉阳县7份不同产地黄花蒿;丁小莉等[9]通过比较UV和HPLC法测定青蒿中青蒿素的含量,结果发现HPLC法测定青蒿素较为准确,UV法不宜单独用于青蒿素的含量分析。
HPLC法能有效地将青蒿素和青蒿素类似物分离,排除干扰,精密度、稳定性均较好。青蒿素只有在205 nm波长处有末端吸收。本试验先用未衍生化的方法测定青蒿素,结果发现甲醇、乙醇等溶剂对青蒿素吸收峰有较大影响。文献研究发现,青蒿素检测方法还有柱前衍生和柱后衍生[10],通过试验笔者最后确定采用柱前衍生化法测定青蒿素含量。查阅文献[11-13]发现,青蒿素能与碱发生反应,生成Q292,在292 nm波长处有最大吸收,但是Q292不稳定,且反应后生成的无机碱会对色谱柱造成损害,而Q292在pH5~6条件下易转化为化学性质相对稳定的Q260。故确定以衍生化HPLC法(检测波长:260 nm)测定青蒿素的含量。
综上所述,本研究所建标准可用于青连宁心胶囊的质量控制。
[1] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:57.
[2] 李春红,王琳,何兵,等.青蒿不同生长采收期青蒿素含量测定[J].时珍国医国药,2007,18(4):888.
[3] 张琳.HPLC法测定心速宁胶囊中青蒿素的含量[J].中国当代医药,2011,18(21):65.
[4] 薛洪宝,焦艳娜,庞国伟,等.青蒿中6种成分同时定量的高效液相色谱法研究[J].四川大学学报,2009,41(4):119.
[5]周翱翱,郑文欣,葛发欢.HPLC-ELSD法测定青蒿中青蒿素的含量[J].中药材,2006,29(3):242.
[6] 张东,杨岚,杨立新,等.HPLC-UV-ELSD法同时测定青蒿中的青蒿素、青蒿乙素和青蒿酸的含量[J].药学学报,2007,42(9):978.
[7] 黄宇,冯军,攀艳茹,等.碘量法测定黄花蒿中青蒿素的含量[J].广州化工,2014,42(18):135.
[8] 周浓,段意梅,陈强.青蒿素含量测定方法改进及黄花蒿植物质量评价[J].时珍国医国药,2008,19(4):911.
[9] 丁小莉,吴强,陈小波,等.UV法与HPLC法测定青蒿中青蒿素含量的比较[J].中国药房,2011,22(3):246.
[10] 刘丽芳,王茜,李海燕,等.柱前衍生-RP-HPLC法测定青蒿中青蒿素的含量[J].中国野生植物资源,2004,23(6):60.
[11] 张馨莹.黄花蒿中青蒿素的提取工艺及测定方法研究[D].重庆:西南大学,2013.
[12] 王玉春,吴江,闭静秀,等.青蒿素提取条件研究[J].中草药,2000,31(6):421.
[13] 张海容,张娜.超声萃取-紫外分光光度法测定不同产地青蒿中青蒿素的含量[J].药物分析杂志,2007,27(3):414.
Study on the Quality Standard of Qinglian Ningxin Capsule
SI Xixi1,SUN Hongsheng2,CAO Guangshang2,CHEN Qianqian1,LIU Dan1(1.College of Pharmacy,Shandong University of Traditional Chinese Medicine,Jinan 250355,China;2.The Affiliated Hospital of Shandong University of Traditional Chinese Medicine,Jinan 250011,China)
OBJECTIVE:To establish the quality standard of Qinglian ningxin capsule.METHODS:TLC was adopted for the qualitative identification of Coptis chinensis and Artemisia carvifolia.HPLC was used for the content determination of artemisinin:column was Diamonsil C18with mobile phase of methanol-phosphate buffer solution(45∶55,V/V)at a flow rate of 1.0 ml/min,detection wavelength was 260 nm,column temperature was 30℃,and injection volume was 10 μl.RESULTS:The TLC spots of C. chinensis and A.carvifolia were clear and well separated,negative control without interference.The linear range of artemisinin was 5.62-56.2 μ g/ml(r=0.999 4);RSDs of precision,stability and reproducibility tests were lower than 1.0%;recovery was 97.46%-99.72%(RSD=0.75%,n=6).CONCLUSIONS:The satandard can be used for the quality control of Qinglian ningxin capsule.
Qinglian ningxin capsule;Artemisinin;HPLC;TLC;Quality standard
R917;R927
A
1001-0408(2016)33-4707-03
2015-12-01
2016-03-07)
(编辑:张 静)
山东省重点研发计划项目(No.2014GGH219001)
*硕士研究生。研究方向:中药制剂新剂型新技术。E-mail:810700090@qq.com
#通信作者:主任药师,硕士生导师。研究方向:中药制剂新剂型新技术。电话:0531-82929059。E-mail:shs7777@163.com
DOI 10.6039/j.issn.1001-0408.2016.33.33
