丙戊酸钠联合左乙拉西坦治疗脑卒中后癫痫的临床观察Δ
2016-12-15王晓燕云南省第一人民医院神经内科昆明650032
林 岚,王晓燕,杨 淑,唐 浩,梅 茸(云南省第一人民医院神经内科,昆明 650032)
丙戊酸钠联合左乙拉西坦治疗脑卒中后癫痫的临床观察Δ
林 岚*,王晓燕,杨 淑,唐 浩,梅 茸(云南省第一人民医院神经内科,昆明 650032)
目的:观察丙戊酸钠联合左乙拉西坦治疗脑卒中后癫痫的疗效和安全性。方法:84例脑卒中后癫痫患者随机分为对照组(42例)和观察组(42例)。两组患者均给予降血脂、降血压、改善微循环、降低颅内压、抗凝、抗血小板聚集及脑神经保护药等常规治疗,对于癫痫持续状态患者酌情给予地西泮控制症状。在此基础上,对照组患者口服丙戊酸钠缓释片15~20 mg/(kg·d),每日3次,连用7 d,若症状得到控制则维持此剂量;若症状未得到控制则增加剂量至20~30 mg/(kg·d),每日3次。观察组患者在对照组治疗的基础上口服左乙拉西坦片初始剂量0.25 g,每日2次,连用7 d后增加剂量至0.5 g,每日2次,若症状得到控制则维持此剂量;若症状未得到控制则增加剂量至3 g,每日2次。两组患者均连续用药12个月,后每周减少左乙拉西坦片0.25 g至完全停药,对于停药后复发者需终身用药。观察两组患者的临床疗效、治疗前后癫痫发作次数、发作持续时间、痫样放电、累及导联数、神经元特异性烯醇化酶(NSE)、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-2、IL-6水平及不良反应发生情况。结果:观察组患者总有效率显著高于对照组,差异有统计学意义(P<0.05)。治疗前,两组患者癫痫发作次数、发作持续时间、痫样放电、累及导联数、NSE、TNF-α、IL-2、IL-6水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者癫痫发作次数、发作持续时间、痫样放电、累及导联数、NSE、TNF-α、IL-2、IL-6水平均显著低于同组治疗前,且观察组低于对照组,差异均有统计学意义(P<0.05)。两组患者不良反应发生率比较差异无统计学意义(P>0.05)。结论:在常规治疗的基础上,丙戊酸钠联合左乙拉西坦治疗脑卒中后癫痫的疗效显著优于单用丙戊酸钠,且不增加不良反应的发生。
丙戊酸钠;左乙拉西坦;脑卒中后癫痫;疗效;安全性
癫痫是常见的神经系统疾病,可分为原发性癫痫和继发性癫痫,其中继发于脑卒中后的癫痫称为脑卒中后癫痫。临床调查显示,60岁以上的癫痫患者中约有40%以上为脑卒中后癫痫[1]。目前,脑卒中后癫痫的发病机制尚未明确,其可能机制为脑卒中所致的神经元损伤可能是癫痫的致痫灶,神经系统损伤后免疫系统处于活化状态,炎症因子分泌失衡,导致了局部神经组织的异常放电。叶珊等[2]报道称,脑梗死继发癫痫患者的血清神经元特异性烯醇化酶(NSE)、炎症因子水平均与临床症状呈正相关。脑卒中后癫痫不仅能加重原有神经功能症状及脑组织损伤程度,还可能影响患者的预后。对于发作次数少、临床症状轻的继发性癫痫患者,一旦发作可短期服用抗癫痫药物,不用长期用药,但迟发型癫痫需要长期、规范服用药物。丙戊酸钠为抗癫痫药,国外研究证实丙戊酸钠对癫痫持续状态的疗效和安全性均明显优于苯二氮类抗癫痫药,对呼吸系统影响更小[3]。左乙拉西坦属于新型抗癫痫药,具有耐受性好、安全性高、疗效好等优点。Contin M等[4]报道称,左乙拉西坦单独或辅助治疗多种类型癫痫均有显著疗效。但未有丙戊酸钠联合左乙拉西坦治疗脑卒中后癫痫的相关报道。为此,在本研究中笔者观察了丙戊酸钠联合左乙拉西坦治疗脑卒中后癫痫的疗效和安全性,旨在为临床提供参考。
1 资料与方法
1.1 研究对象
选择2011年5月-2014年5月我院收治的84例脑卒中后癫痫患者,按随机数字表法将所有患者分为观察组(42例)和对照组(42例)。观察组男性28例,女性14例;年龄52~75岁,平均(57.1±4.1)岁;病程1~15个月,平均(5.2±0.6)个月;脑卒中类型:脑梗死34例,脑出血8例;癫痫发作类型:单纯发作15例,全身强直阵挛发作21例,复杂发作4例,混合性发作2例。对照组男性25例,女性17例;年龄49~78岁,平均(57.3±4.6)岁;病程1~12个月,平均(5.1±0.4)个月;脑卒中类型:脑梗死32例,脑出血10例;癫痫发作类型:单纯发作18例,全身强直阵挛发作19例,复杂发作4例,混合性发作1例。两组患者性别、年龄、病程等基本资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究方案经医院医学伦理委员会审核通过,所有患者或其家属均签署了知情同意书。
1.2 纳入与排除标准
纳入标准:①脑卒中符合《第五届全国脑血管病学术会议简介》中的相关诊断标准[5],并经CT或MRI检查证实;②癫痫符合国际抗癫痫联盟制定的癫痫综合征诊断标准[6];③脑电图及MRI检查呈典型癫痫表现。排除标准:①原发性癫痫;②既往有癫痫史、脑外伤、肿瘤、严重感染、颅脑手术所致的继发性癫痫;③合并脑肿瘤或神经功能缺陷;④认知功能障碍或无法独立沟通者;⑤无法坚持随访者;⑥对本研究所用药物过敏者。
1.3 治疗方法[7]
两组患者均给予降血脂、降血压、改善微循环、降低颅内压、抗凝、抗血小板聚集及脑神经保护药等常规治疗,对于癫痫持续状态患者酌情给予地西泮控制症状。在此基础上,对照组患者口服丙戊酸钠缓释片[赛诺菲(杭州)制药有限公司,规格:0.5 g/片,批准文号:国药准字H20140125]15~20 mg/(kg·d),每日3次,连用7 d,若症状得到控制则维持此剂量;若症状未得到控制则增加剂量至20~30 mg/(kg·d),每日3次。观察组患者在对照组治疗的基础上口服左乙拉西坦片(浙江京新药业股份有限公司,规格:0.25 g/片,批准文号:国药准字H20010595)初始剂量0.25 g,每日2次,连用7 d后增加剂量至0.5 g,每日2次,若症状得到控制则维持此剂量;若症状未得到控制则增加剂量至3 g,每日2次。两组均连续用药12个月,后每周减少左乙拉西坦片0.25 g至完全停药,对于停药后复发者需终身用药。
1.4 观察指标
观察两组患者治疗前后癫痫发作次数、发作持续时间、痫样放电、累及导联数、NSE、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-2、IL-6及不良反应发生情况。采用双抗体夹心酶联免疫吸附法检测NSE、TNF-α、IL-2、IL-6水平(试剂盒购自上海拜力生物科技有限公司)。
1.5 疗效判定标准[7]
完全控制:无癫痫发作;显效:癫痫发作次数较治疗前减少≥75%;有效:癫痫发作次数较治疗前减少50%~74%;无效:癫痫发作次数较治疗前减少<50%。总有效率=(完全控制例数+显效例数+有效例数)/总例数×100%。
1.6 统计学方法
采用SPSS 22.0统计软件对数据进行分析。计量资料以表示,采用t检验或SNK-q检验;计量资料以率表示,采用χ2检验或Fisher确切概率法,等级资料采用Ridit检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较
观察组患者总有效率显著高于对照组,差异有统计学意义(P<0.05),详见表1。

表1 两组患者临床疗效比较[例(%)]Tab 1 Comparison of clinical efficacy between 2 groups [case(%)]
2.2 两组患者治疗前后癫痫发作次数、发作持续时间比较
治疗前,两组患者癫痫发作次数、发作持续时间比较,差异均无统计学意义(P>0.05)。治疗后,两组患者癫痫发作次数、发作持续时间均显著低于同组治疗前,且观察组低于对照组,差异均有统计学意义(P<0.05),详见表2。
表2 两组患者治疗前后癫痫发作次数、发作持续时间比较()Tab 2 Comparison of times and duration of seizure between 2 groups before and after treatmen(t)
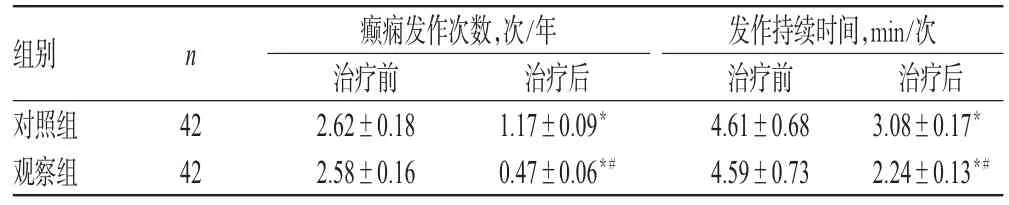
表2 两组患者治疗前后癫痫发作次数、发作持续时间比较()Tab 2 Comparison of times and duration of seizure between 2 groups before and after treatmen(t)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别对照组观察组n 42 42癫痫发作次数,次/年治疗前2.62±0.18 2.58±0.16治疗后1.17±0.09*0.47±0.06*#发作持续时间,min/次治疗前4.61±0.68 4.59±0.73治疗后3.08±0.17*2.24±0.13*#
2.3 两组患者治疗前后痫样放电、累及导联数比较
治疗前,两组患者痫样放电、累及导联数比较,差异均无统计学意义(P>0.05)。治疗后,两组患者痫样放电、累及导联数均显著低于同组治疗前,随时间延长逐渐降低,且观察组低于对照组,差异均有统计学意义(P<0.05),详见表3。
表3 两组患者治疗前后痫样放电、累及导联数比较()Tab 3 Comparison of epileptiform discharges and involved lead number between 2 groups before and after treatmen(t)

表3 两组患者治疗前后痫样放电、累及导联数比较()Tab 3 Comparison of epileptiform discharges and involved lead number between 2 groups before and after treatmen(t)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别对照组观察组n 痫样放电,180/s累及导联数,180/s 42 42治疗前15.6±1.7 15.9±2.0治疗3个月13.8±1.4*11.8±1.2*#治疗6个月12.4±1.5*8.9±0.8*#治疗12个月11.4±0.9*7.5±0.5*#治疗前7.7±0.9 7.8±1.1治疗3个月6.8±0.7*6.0±0.7*#治疗6个月6.1±0.5*5.4±0.4*#治疗12个月5.7±0.3*4.1±0.2*#
2.4 两组患者治疗前后NSE、TNF-α、IL-2、IL-6水平比较
治疗前,两组患者NSE、TNF-α、IL-2、IL-6水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者NSE、TNF-α、IL-2、IL-6水平均显著低于同组治疗前,随时间延长逐渐降低,且观察组低于对照组,差异均有统计学意义(P<0.05),详见表4。
表4 两组患者治疗前后NSE、TNF-α、IL-2、IL-6水平比较(,μg/L)Tab 4 Comparison of NSE,TNF-α,IL-2 and IL-6 levels between 2 groups before and after treatment(,μg/L)
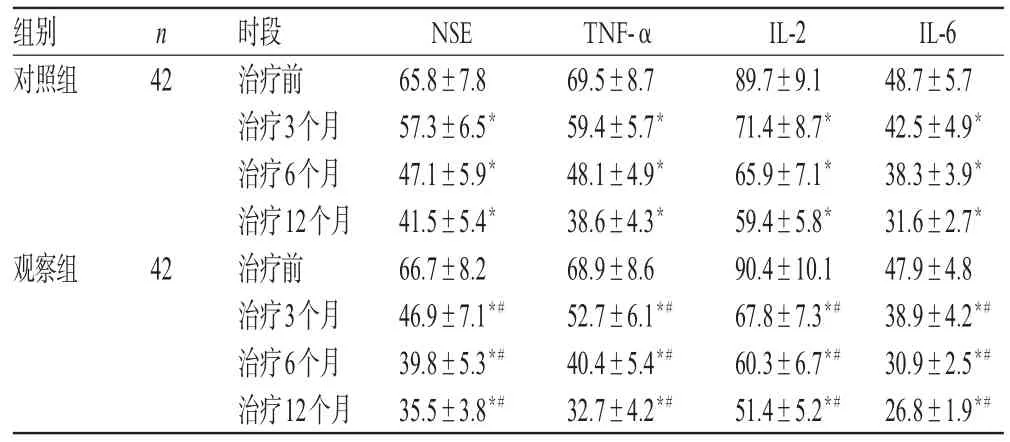
表4 两组患者治疗前后NSE、TNF-α、IL-2、IL-6水平比较(,μg/L)Tab 4 Comparison of NSE,TNF-α,IL-2 and IL-6 levels between 2 groups before and after treatment(,μg/L)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别对照组IL-6 48.7±5.7 42.5±4.9*38.3±3.9*31.6±2.7*47.9±4.8 38.9±4.2*#30.9±2.5*#26.8±1.9*#n 42观察组42时段治疗前治疗3个月治疗6个月治疗12个月治疗前治疗3个月治疗6个月治疗12个月NSE 65.8±7.8 57.3±6.5*47.1±5.9*41.5±5.4*66.7±8.2 46.9±7.1*#39.8±5.3*#35.5±3.8*#TNF-α 69.5±8.7 59.4±5.7*48.1±4.9*38.6±4.3*68.9±8.6 52.7±6.1*#40.4±5.4*#32.7±4.2*#IL-2 89.7±9.1 71.4±8.7*65.9±7.1*59.4±5.8*90.4±10.1 67.8±7.3*#60.3±6.7*#51.4±5.2*#
2.5 不良反应
对照组患者出现轻度失眠3例、皮疹2例、感觉异常7例、恶心呕吐5例、腹泻1例、腹痛3例,不良反应发生率为50.0%;观察组患者出现肝功能异常2例、认知障碍1例、皮疹1例、恶心呕吐7例、腹泻3例、中度失眠2例,不良反应发生率为38.1%。两组患者不良反应发生率比较差异无统计学意义(χ2=1.208,P=0.272)。
3 讨论
Hamidou B等[8]报道称,癫痫会加重脑卒中患者脑组织的损伤程度,患者死亡风险也会显著增加。脑卒中后癫痫的发病机制较为复杂,国外有学者认为,当神经元细胞发生缺血或出血性坏死后,神经递质、细胞内外离子大量流出,细胞膜的稳定性均会发生改变,从而导致神经元变性和细胞功能缺失,细胞兴奋性增高并同步放电,最终诱发癫痫发作[9]。临床调查显示,约有3%~5%的脑卒中患者会出现癫痫样发作,而其中55%以上的患者会进一步发展为癫痫类疾病[10]。由于癫痫会加重脑组织缺血、缺氧及神经元坏死,而神经元坏死又会诱发癫痫发作,两者形成恶性循环,一旦出现癫痫发作,应及时给予治疗。
何朝晖等[11]报道称,丙戊酸钠除能够通过血脑屏障,促进γ-氨基丁酸内源性抑制性神经递质的释放,降低神经元细胞异常放电外,还能稳定细胞膜,抑制Ca2+内流,对降低癫痫发作具有明显效果。但由于脑卒中后癫痫的发作类型较为复杂,临床常建议联合用药。班立丽等[12]报道称,传统一线抗癫痫药卡马西平、丙戊酸钠等能够使75%以上的患者症状得到控制,但仍有25%左右的患者疗效不佳,特别是长期用药后发生的不良反应可能会使患者无法耐受而终止用药。左乙拉西坦作用机制与中枢神经突触囊泡(Synaptic vesicles,SV)蛋白结合有关。De Reuck JL等[13]报道称,神经突触囊泡SV蛋白主要参与神经传导,SV蛋白亚型SV2A亚基过度释放会导致细胞膜异常放电,从而诱发癫痫发作。左乙拉西坦能够与SV2A亚基结合,进而抑制神经元异常放电,并进一步抑制由神经放电而激活的N型Ca2+通道,而N型Ca2+通道正是癫痫异常放电的主要通道[14]。另有国外学者证实,左乙拉西坦可以抑制γ-氨基丁酸水平,保持海马体CA1区内高γ-氨基丁酸水平,因此左乙拉西坦联合丙戊酸钠有协同治疗作用[15]。
本研究结果显示,观察组患者总有效率显著高于对照组,差异有统计学意义。这与Dinopoulos A等[16]报道结果一致。治疗后,两组患者癫痫发作次数、发作持续时间、痫样放电、累及导联数均显著低于同组治疗前,且观察组低于对照组,差异均有统计学意义。这说明,丙戊酸钠联合左乙拉西坦可显著改善临床症状。Weinstock A等[17]报道称,丙戊酸钠能够抑制电压依赖性Na+通道,降低Na+和Cl-内流,抑制动作电位;左乙拉西坦能加速γ-氨基丁酸所抑制的Cl-内流和平衡谷氨酸的兴奋性。由于部分癫痫患者,特别是迟发型癫痫患者需要长期用药,因此不良反应的发生率显著升高[18]。王维等[19]报道称,丙戊酸钠联合左乙拉西坦并未增加不良反应发生率。本研究结果显示,两组患者不良反应发生率比较差异无统计学意义。
国外研究证实,癫痫患者存在免疫功能异常,当癫痫发作时,谷氨酸会产生兴奋毒性作用,诱导巨噬细胞释放自由基,破坏血脑屏障,导致神经递质NSE和炎症因子大量进入体内[20]。NSE及炎症因子水平增加,提示机体启动了自动免疫应答反应,特别是脑部炎症反应增强,有学者提出监测血清NSE、炎症因子水平可评价癫痫的临床症状及预后[21]。NSE是神经元损伤敏感的标志物,其主要反映神经元损伤的数量和程度,损伤越严重,NSE分泌越多[22]。本研究结果显示,治疗后,两组患者血清NSE、TNF-α、IL-2、IL-6水平均显著低于同组治疗前,随时间延长逐渐降低,且观察组低于对照组,差异均有统计学意义。这提示,丙戊酸钠联合左乙拉西坦可显著改善神经元的损伤程度,控制机体炎症反应。
综上所述,在常规治疗的基础上,丙戊酸钠联合左乙拉西坦治疗脑卒中后癫痫的疗效显著优于单用丙戊酸钠,且不增加不良反应的发生。本研究的局限性:(1)样本量较小,此结论可能存在偏倚;(2)随访时间较短,由于脑卒中后癫痫发病时间较长,需要更长时间随访以准确评价远期疗效;(3)单中心研究无法完全避免医师的主观偏倚。故此结论有待大样本、多中心研究进一步证实。
[1] Hsieh CY,Lai EC,Yang YH,et al.Comparative stroke risk of antiepileptic drugs in patients with epilepsy[J].Epilepsia,2013,54(1):172.
[2] 叶珊,林绍鹏,解龙昌.血清神经元特异性烯醇化酶水平与缺血性卒中脑损伤程度的相关性[J].天津医药,2014,42(7):674.
[3] Olesen JB,Abildstrøm SZ,Erdal J,et al.Effects of epile-psy and selected antiepileptic drugs on risk of myocardial infarction,stroke,and death in patients with or without previous stroke:a nationwide cohort study.[J].Pharmacoepidemiol Drug Saf,2011,20(9):964.
[4] Contin M,Mohamed S,Albani F,et al.Simple and validated HPLC-UV analysis of levetiracetam in deproteinized plasma of patients with epilepsy[J].J Chromatogr B Analyt Technol Biomed Life Sci,2008,873(1):129.
[5] 魏兴海.第五届全国脑血管病学术会议简介[J].现代康复,2000,4(3):357.
[6] LaFrance WC Jr,Baker GA,Duncan R,et al.Minimum requirements for the diagnosis of psychogenic nonepileptic seizures:A staged approach:A report from the International League Against Epilepsy Nonepileptic Seizures Task Force[J].Epilepsia,2013,54(11):2 005.
[7] 全国神经外科癫痫防治协助组.神经外科围手术期和外伤后癫痫的预防及治疗指南:草案[J].中华神经医学杂志,2006,5(12):1 189.
[8] Hamidou B,Aboa-Eboulé C,Durier J,et al.Prognostic value of early epileptic seizures on mortality and functional disability in acute stroke:The Dijon Stroke Registry(1985-2010)[J].J Neurol,2013,260(4):1 043.
[9] NGraham NS,Crichton S,Koutroumanidis M,et al.Incidence and associations of poststroke epilepsy:the prospective South London Stroke Register.[J].Stroke,2013,44(3):605.
[10] 朱培俊,周利民,王苑华,等.脑卒中后癫痫的临床特点[J].临床神经病学杂志,2001,14(2):101.
[11] 何朝晖,孙晓川,唐文渊,等.丙戊酸钠预防自发性蛛网膜下腔出血后癫痫发作[J].中国药房,2008,19(8):613.
[12] 班立丽,唐晓霞.丙戊酸钠血药浓度与抗癫痫疗效及不良反应关系研究[J].中国医院用药评价与分析,2013,13(12):1 086.
[13] De Reuck JL,Van MaeleG.Seizures and epilepsy in patients with a posterior circulation infarct[J].J Stroke Cerebrovasc Dis,2012,21(1):1.
[14] Jung S,Schindler K,Findling O,et al.Adverse effect of early epileptic seizures in patients receiving endovascular therapy for acute stroke[J].Stroke,2012,43(6):1 584.
[15] Halliday AJ,Campbell TE,Razal JM,et al.Inviwo biocompatibility and in vitro characterization of poiy-Iactide-co-glycolide structures containing Levetiracetam,for the treatment of epilepsy[J].J Biomed Mater Res A,2012,100(2):424.
[16] Dinopoulos A,Attilakos A,PaschalidouM,et al.Shortterm effect of levetiracetam monotherapy on haematological parameters in children with epilepsy:A prospective study[J].Epilepsy Res,2014,108(4):820.
[17] Weinstock A,Ruiz M,Gerard D,et al.Prospective openlabel,single-arm,multicenter,safety,tolerability,and pharmacokinetic studies of intravenous levetiracetam in children with epilepsy[J].J Child Neurol,2013,28(11):1 423.
[18] 陈伟,施德,刘振国,等.左乙拉西坦添加治疗青年难治性部分性癫痫患者的效果及对认知功能的影响[J].实用医学杂志,2013,29(3):456.
[19] 王维,陈兴旺,陈春富,等.左乙拉西坦预防难治性偏头痛的疗效及安全性[J].中国神经精神疾病杂志,2014,40(3):172.
[20] Morais NM,Ranzan J,Riesgo RS.Predictors of epilepsy in children with cerebrovascular disease[J].J Child Neurol,2013,28(11):1 387.
[21] 朱秀丽,舒晓丹,丁晶,等.老年癫痫患者脑电图检查与血清细胞因子水平及T淋巴细胞亚群的相关性[J].中国老年学杂志,2014(9):2 372.
[22] Pezzini A,Grassi M,Del Zotto E,et al.Complications of acute stroke and the occurrence of early seizures[J]. Cerebrovasc Dis,2013,35(5):444.
Clinical Observation of Sodium Valproate Combined with Levetiracetam in the Treatment of Post-stroke Epilepsy
LIN Lan,WANG Xiaoyan,YANG Shu,TANG Hao,MEI Rong(Dept.of Neurology,the First People's Hospital of Yunnan Province,Kunming 650032,China)
OBJECTIVE:To observe the efficacy and safety of sodium valproate combined with levetiracetam in the treatment of post-stroke epilepsy.METHODS:84 patients with post-stroke epilepsy were randomly divided into control group(42 cases)and observation group(42 cases).All patients were given lowering lipid,lowering blood pressure,improving microcirculation,reducing intracranial pressure,anticoagulation,anti-platelet aggregation,cranial nerve protection and other conventional treatment,patients with status epilepticus were given stability control symptoms.Based on it,control group orally received Sodium valproate sustained-release tablet 15-20 mg/(kg·d),3 times a day,for 7 d,maintaining the dose if symptom was controlled;the dose increased to 20-30 mg/(kg·d)if it was not controlled,3 times a day.Observation group was additionally received Levetiracetam tablet with initial dose of 0.25 g,twice a day,increased to 0.5 g after 7 d,maintaining the dose if symptom was controlled;then increased to 3 g if symptom was not controlled,twice a day.2 groups of patients were continuous treated for 12 months,then decreased Levetiracetam tablet 0.25 g weekly until complete withdrawal,patients with recurrence required lifelong medication.The clinical observation,times of seizures,seizure duration,epileptiform discharges,involved lead number,serum neuron specific enolase(NSE),TNF-α,IL-2 and IL-6 before and after treatment,the incidence of adverse reactions in 2 groups were observed.RESULTS:The total effective rate in observation group was significantly higher than control group,with statistical significance(P<0.05).Before treatment,there were no significant differences in the times of seizures,seizure duration,epileptiform discharges,involved lead number,NSE,TNF-α,IL-2 and IL-6 levels in 2 groups(P>0.05).After treatment,the times of seizures,seizure duration,epileptiform discharges,involved lead number,NSE,TNF-α,IL-2 and IL-6 levels in 2 groups were significantly lower than before,and observation group was lower than control group,with statistical significances(P<0.05).There was no significant difference in the incidence of adverse reactions in 2 groups(P>0.05).CONCLUSIONS:Based on conventional treatment,the efficacy of sodium valproate combined with levetiracetam is significantly superior to sodium valproate alone in the treatment of post-stroke epilepsy,and do not increase the indence of adverse reactions.
Sodium valproate;Levetiracetam;Post-stroke epilepsy;Efficacy;Safety
R741.05
A
1001-0408(2016)33-4634-04
2016-04-11
2016-09-07)
(编辑:陈 宏)
云南省医疗卫生单位内设研究机构科研项目(No.2016NS223)
*副主任医师。研究方向:癫痫病学。E-mail:linlanyun69@163. com
DOI 10.6039/j.issn.1001-0408.2016.33.09
