循环肿瘤DNA检测在乳腺癌诊断中的临床应用
2016-12-15综述江泽飞审校
叶 青 综述 江泽飞 审校
军事医学科学院附属医院乳腺肿瘤科,北京 100071
循环肿瘤DNA检测在乳腺癌诊断中的临床应用
叶青 综述江泽飞 审校
军事医学科学院附属医院乳腺肿瘤科,北京 100071
随着二代测序技术的发展,循环肿瘤DNA(circulating tumor DNA,ctDNA)检测在乳腺癌中的应用得到越来越多的关注。目前国内外大量研究显示ctDNA检测技术在监测肿瘤负荷、疗效预测、早期诊断、预后分析等方面具有广阔的应用价值。在乳腺癌诊疗走向个体化精准的时代,ctDNA检测能够为患者提供更为精准的诊断,指导临床治疗。
循环肿瘤DNA;乳腺癌;诊断;临床应用
早在1948年,Mandel和Metais就在人的血浆中检测出细胞外游离DNA的存在,由此拉开了游离DNA研究的序幕;1965年,Bendich的团队发现肿瘤与循环游离DNA(circulating cell-free DNA,cfDNA)存在相关性;1977年,Leon等人通过放射免疫测定法对比了正常人和肿瘤患者血中游离DNA的表达,表明血中游离DNA水平与肿瘤病程及疗效相关;随后更多证据表明血中游离DNA与原发肿瘤基因突变存在一致性[1];2010年,García-Olmo等[2]的研究确定了游离DNA的致癌性。近几年循环DNA的研究已成为癌症诊断的热门研究领域,在肿瘤负荷监测、药物疗效预测、复发转移监测、早期诊断及预后分析等方面具有潜在的临床应用价值。
1 循环肿瘤DNA (circulating tumor DNA,ctDNA)
1.1cfDNA与ctDNA
cfDNA是由正常细胞、肿瘤细胞、循环肿瘤细胞等凋亡、坏死后释放到血管中的游离的DNA片段组成的。这些DNA片段通常与蛋白质结合形成核小体游离于循环中[3]。其中ctDNA特指能够反映肿瘤基因组信息的cfDNA[4]。
关于ctDNA的释放、降解机制目前尚无定论。目前认为,ctDNA来源于坏死、凋亡的肿瘤细胞,或是肿瘤细胞的外排体[5]。而ctDNA的降解可能与肝脏和肾脏代谢相关,根据不同DNA片段大小、结构其半衰期差异较大,范围从10 min至2 h不等。
1.2ctDNA的检测优势及困难
组织学活检能够提供疾病的初始状态,为疾病的诊断、治疗提供重要的信息。尽管组织学检测目前是临床和科研测序的金标准,但是组织获取、样本保存、肿瘤异质性等局限性限制了肿瘤组织测序的发展。因此,为了弥补组织活检的局限性,研究者开展“液体活检”工作。因能反映与组织相同的基因组信息,ctDNA成为补充替代组织学测序的最佳来源。相对无创的ctDNA检测不仅能够反映短时间体内瘤负,实时动态监测药物疗效,而且在保证较高敏感性和特异性的同时能够提早预测病情变化。
在原理上,ctDNA测序简单易懂,但该技术用于临床仍面临着许多技术难点和现实问题。首先是对于大部分肿瘤患者而言,在全部的血浆游离DNA中,ctDNA只占很小的一部分,大约只有千分之几[6],因此,目标突变信号相对与背景信号其强度极低。其次,因每毫升血浆中仅有几十至几百纳克(ng)的游离DNA,分离样本量极少的cfDNA难度大。传统的酚-氯仿抽提法提取效率低,而商业试剂盒简便易行,且可以针对不同目标检测设计专门的试剂盒。Kuang等[7]对比了以下3种商业试剂盒分离cfDNA的效能:QIAamp DNA Micro 试剂盒(德国Qiagen公司)、NucleoSpin Plasma XS(德国Macherey-Nagel公司)和Wizaed(美国Promega公司),结果显示QIAamp DNA Micro试剂盒更适用于ctDNA的检测。此外,由于ctDNA检测技术对实验室和操作人员要求较高,检测设备昂贵,检测标准不一,也难以在短时间内推广至临床应用。
1.3ctDNA检测方法
理论上,所有检测基因组信息的手段都可以检测ctDNA,但是由于以sanger测序为代表的一代测序方法检测敏感性不高,长久以来一直限制着ctDNA检测的发展。随着二代测序技术的出现,使cfDNA的检测成为可能。目前,常用的方法包括实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)、BEAMing(beads,emulsion,amplification, and magnetics)技术[6]、基因芯片技术和二代测序技术等,这些检测各有其优缺点(表1)。
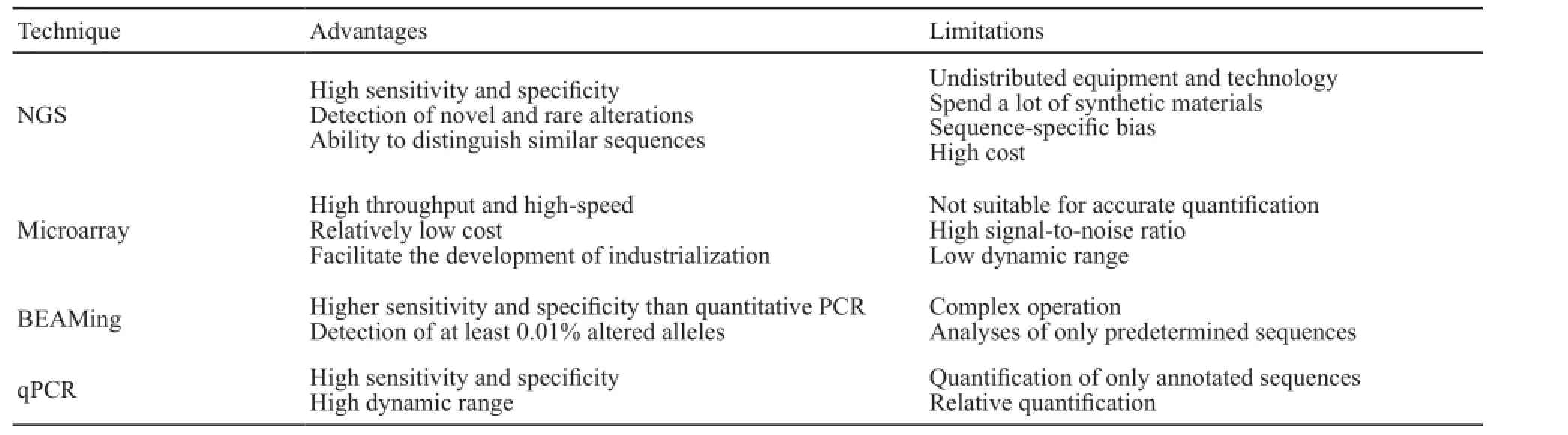
表1 常用循环肿瘤DNA检测技术比较Tab. 1 Commonly used technologies to analyze cell-free DNA
2 ctDNA检测在乳腺癌中的临床应用
关于乳腺癌ctDNA的研究,可以追溯到1977年,Leon等人发现乳腺癌患者的血液中游离DNA水平显著上升,通过放射免疫检测法他们检测到这些游离DNA范围在0~2 000 ng/mL间波动[1]。此后,大量乳腺癌的ctDNA临床应用的文献被报道,这些应用主要集中在ctDNA与肿瘤负荷监测、药物疗效预测、复发转移风险评估、早期诊断及预后分析等方面。
2.1ctDNA与肿瘤负荷监测
肿瘤负荷监测是指对肿瘤危害机体程度的监测,包括肿瘤大小、活跃程度、转移情况等,是乳腺癌患者管理的重要内容之一。临床实践中,一般通过影像、蛋白质类生物标志物(CEA、CA15-3和CA-125)来监测肿瘤负荷。而影像学检查有时难以区分肿瘤轻微的变化,肿瘤标志物(如CA15-3)监测虽便捷但前期研究表明其敏感性仅为60%~70%[8]。ctDNA因其特有的优势,有望成为监测肿瘤负荷的特异性标志物。
对于晚期乳腺癌患者,有研究报道显示,ctDNA能够监测实体瘤患者的肿瘤负荷,ctDNA的水平与临床疗效是显著相关的。Dawson等[9]动态监测了30例晚期乳腺癌患者的ctDNA、循环肿瘤细胞(circulating tumor cell,CTC)和CA15-3水平。研究者将循环中携带与组织相同的乳腺癌相关体细胞突变(其检测了PIK3CA和TP53两个基因)认定为ctDNA。结果显示,与CA15-3、CTC相比,在治疗期间患者特异性ctDNA水平变化与疗效相关性最强,具有更高的敏感性和特异性;并且ctDNA水平的增高平均能早于临床影像检查5个月提示疾病进展。提示了对于晚期乳腺癌患者,ctDNA是监测肿瘤负荷敏感、特异的生物标志物,其水平变化提示肿瘤负荷变化从而反映药物疗效。在临床疗效评价不确定如疾病稳定,或是病灶分离情况出现时,ctDNA检测可能更有优势。
对于早期乳腺癌患者,ctDNA的检测同样能提示肿瘤的负荷。Tangvarasittichai等[10]研究了cfDNA水平与乳腺癌临床分期间的关系,发现Ⅱ~Ⅳ期患者cfDNA浓度显著高于术后患者和健康对照组,并且肿块大小、TNM分期、远处转移与cfDNA浓度是显著相关的。另外,Umetani等[11]同样发现Ⅱ~Ⅳ期乳腺癌患者血浆DNA完整性显著高于健康女性,ROC曲线分析显示以cfDNA完整性诊断Ⅱ期以上乳腺癌患者的AUC值为0.79,诊断淋巴结转移乳腺癌的AUC值为0.81。另外,近期发布的一项研究入组了87例接受新辅助治疗的乳腺癌患者,分别在新辅助治疗前、治疗后和术后1年监测ctDNA的甲基化(met-ctDNA)。结果显示,新辅助治疗后的met-ctDNA与残留肿瘤负荷显著相关(P=0.008)[12]。
ctDNA浓度、完整性的检测均能够间接反映肿瘤负荷。对于晚期乳腺癌通过动态监测这些指标能够早于影像检查判断疾病进展,为患者及时调整治疗方案创造机会;对于早期乳腺癌患者通过检测这些指标能够协助临床诊断,提供更为全面的诊断信息,为治疗方案的制定提供补充信息。
2.2ctDNA与药物疗效预测
乳腺癌治疗已经进入分子分型指导下的个体化治疗的时代,通过检测一些指标能很好地预测患者对某些治疗的反应,这些指标包括:激素受体状况、HER-2基因扩增、Ki-67基因表达等。但这些预测指标现行的检测重复性较差,无法动态监测肿瘤治疗过程中的变化,而ctDNA的检测因能特异性地反应肿瘤基因组状况并且无需通过组织活检,在肿瘤疗效预测方面(特别是预测耐药)具有潜在应用前景。
Stoetzer等[13]发现,新辅助化疗不敏感组患者治疗前cfDNA显著高于治疗获益的患者。提示,治疗前cfDNA水平可能预测新辅助化疗获益程度。Gevensleben等[14]利用数字PCR方法检测乳腺癌患者cfDNA中HER-2基因拷贝数目的情况。验证组58例晚期乳腺癌患者,64%的HER-2阳性患者血浆HER-2检测为阳性,94%的HER-2阴性患者的血浆HER-2检测为阴性,其阳性、阴性预测值分别为70%和92%。证明了cfDNA检测乳腺癌患者HER-2基因扩增情况的可行性。但Bechmann等[15]的结果却完全不同,其前瞻性研究结果提示,采用RTFQ-PCR技术检测cfDNA和HER-2基因扩增情况,结果发现组织学HER-2基因扩增并未观察到患者血浆HER-2基因拷贝数目的差异。这些实验结果差异可能是由于检测技术敏感性、入组人群、操作规范、阳性预测阈值的不同而引起的。因此采用cfDNA检测技术评估部分患者HER-2基因扩增情况,以此预测靶向治疗的敏感性仍需要大型临床研究证实。
另外一些小样本研究结果显示,cfDNA检测能早于临床预测获得性耐药的发生。对于内分泌治疗,已有研究表明ESR1配体结合域的活化是乳腺癌内分泌耐药的主要原因。Guttery等[16]检测48例激素受体阳性晚期乳腺癌患者cfDNA的ESR1突变情况,初步探索了利用cfDNA技术预测乳腺癌内分泌治疗耐药的可行性。Murtaza等[17]利用全外显子测序技术检测ctDNA用于获得性耐药预测的可行性。结果发现6个与不同药物耐药相关的基因突变,该研究首次证明全外显子测序技术检测ctDNA提早预测治疗耐药发生的可行性。
2.3ctDNA与复发转移风险评估
目前认为,晚期乳腺癌是不可治愈的,原因可能与临床诊断滞后相关。因此寻找早期、特异的指标检测微小转移灶,预测复发转移风险对于治愈肿瘤十分重要;既能通过治疗提早干预临床转移灶的出现,又能避免部分术后治愈的患者接受过度的辅助治疗。
Shaw等[18]通过分析辅助阶段乳腺癌患者cfDNA水平,探究该方法用于筛选经辅助治疗治愈的患者、避免其接受过度治疗的可能性。Olsson等[19]通过全基因组测序筛选出20例乳腺癌患者原发灶可信的特异肿瘤相关染色体重排,之后采用高度敏感的微滴数字PCR方法,连续监测这20例辅助治疗阶段患者循环血与原发灶中相同的特异性DNA的重排情况,发现其预测复发转移敏感变为89%,且平均早于临床复发转移11个月。首次证明了ctDNA用于乳腺癌复发风险监测的可能性。随后Garcia-Murillas等[20]检测55例接受新辅助化疗患者原发灶肿瘤DNA突变情况,其中43例患者存在至少1个体细胞突变,通过个体化设计的数字PCR技术监测这43例乳腺癌患者新辅助化疗前、术后2~4周内、辅助治疗期间游离血浆中每个肿瘤特异性体细胞突变的情况。结果显示,80%的复发转移患者在辅助治疗连续随访期间检测到ctDNA,50%的复发患者在术后首次血液检测中就能检测到ctDNA,并能平均早于临床影像检查7.9个月预测复发转移发生。一系列的研究结果表明ctDNA检测技术监测复发转移可能较影像、癌标等传统手段更为特异,敏感。
2.4ctDNA与早期诊断
早期诊断是降低乳腺癌死亡率的最重要方法之一。现行筛查手段主要依靠影像学方法,但影像学检查的分辨率有限,有时难以区分良恶性,并且难以实现群体间的筛查。cfDNA检测因取样方便、检测结果判读客观可能成为乳腺癌早诊筛查的有力工具。
Gong等[21]分析了乳腺良、恶性疾病患者、健康者cfDNA浓度,ROC曲线分析结果提示cfDNA用于诊断3组人群的特异性均大于0.9,提示cfDNA浓度的检测能够用于早期诊断。近期发布的一项研究纳入了749例早期乳腺癌、良性疾病和健康者,仅检测6个基因的甲基化情况诊断乳腺癌的特异性和敏感性分别达到78.1%和82.4%,提示血浆中的表观遗传学的生物标志物具有潜在诊断价值[22]。
2.5ctDNA与预后分析
目前关于ctDNA的预后价值尚存在争议,各实验室间的结论并不一致,原因可能是多方面的,包括样本处理、操作规范、DNA提取、检测技术、入组人群等差异。
Madic等[23]纳入40例三阴性乳腺癌患者,采用NGS平台检测26例肿瘤组织存在TP53体细胞突变,并且在21例匹配的血样样本中检测相同TP53突变即ctDNA,结果并未发现这21例患者ctDNA的水平与疾病进展时间(time to progression,TTP)和总生存期(overall survival,OS)的相关性。而Madhavan等[24]的研究结果却截然不同。他们通过定量PCR方法检测了晚期乳腺癌患者cfDNA完整性及水平,结果显示cfDNA完整性与水平都能预测晚期乳腺癌无进展生存期(progression-free survival,PFS)和OS。另外,Dawson等[9]的结果提示乳腺癌患者ctDNA水平与预后密切相关,含量越高5年生存率越低。Ocaña等[25]近期发布的一项入组了31项实验包括4 052例实体瘤患者的Meta分析结果也提示高水平的cfDNA和ctDNA与实体瘤患者的不良预后是显著相关的。
3 结语
随着精准医疗概念的提出,乳腺癌诊疗将从个体化走向精准;以基因检测为代表的精准诊断模式,将会是未来乳腺癌精准诊疗的重要组成部分。ctDNA检测技术的发展正是迈向精准诊断重要的一步。但目前该领域研究仍处于起步阶段,ctDNA研究还处于科研阶段,其临床应用仍然任重道远。
[1] SCHWARZENBACH H, PANTEL K. Circulating DNA as biomarker in breast cancer [J]. Breast Cancer Res, 2015, 17(1): 136.
[2] GARCÍA-OLMO D C, DOM NGUEZ C, GARC A-ARRANZ M, et al. Cell-free nucleic acids circulating in the plasma of colorectal cancer patients induce the oncogenic transformation of susceptible cultured cells [J]. Cancer Res, 2010, 70(2): 560-567.
[3] ROTH C, PANTEL K, M LLER V, et al. Apoptosis-related deregulation of proteolytic activities and high serum levels of circulating nucleosomes and DNA in blood correlate with breast cancer progression [J]. BMC Cancer, 2011, 11(1): 4.
[4] DIAZ L A, BARDELLI A. Liquid biopsies: genotyping circulating tumor DNA [J]. J Clin Oncol, 2014, 32(6): 579-586.
[5] THAKUR B K, ZHANG H, BECKER A, et al. Doublestranded DNA in exosomes: a novel biomarker in cancer detection [J]. Cell Res, 2014, 24(6): 766-769.
[6] DIEHL F, SCHMIDT K, CHOTI M A, et al. Circulating mutant DNA to assess tumor dynamics [J]. Nat Med, 2008, 14(9): 985-990.
[7] KUANG Y, ROGERS A, YEAP B Y, et al. Noninvasive detection of EGFR T790M in gefitinib or erlotinib resistant non–small cell lung cancer [J]. Clin Cancer Res, 2009, 15(8): 2630-2636.
[8] DUFFY M J, EVOY D, MCDERMOTT E W. CA 15-3: uses and limitation as a biomarker for breast cancer [J]. Clin Chim Acta, 2010, 411(23): 1869-1874.
[9] DAWSON S J, TSUI D W, MURTAZA M, et al. Analysis of circulating tumor DNA to monitor metastatic breast cancer[J]. New Engl J Med, 2013, 368(13): 1199-2009.
[10] TANGVARASITTICHAIO, JAIWANGW, TANGVARASITTICHAI S. The plasma DNA concentration as a potential breast cancer screening marker [J]. Indian J Clin Biochem, 2015, 30(1): 55-58.
[11] UMETANI N, GIULIANO A E, HIRAMATSU S H, et al. Prediction of breast tumor progression by integrity of free circulating DNA in serum [J]. J Clin Oncol, 2006, 24(26): 4270-4276.
[12] TAKAHASHI H, KAGARA N, TANEI T, et al. Correlation of methylated circulating tumor DNA with response to neoadjuvant chemotherapy in breast cancer patients [J]. Clin Breast Cancer, 2016, pii: S1526-8209(16)30148-30153.[Epub ahead of print].
[13] STOETZER O J, FERSCHING D M, SALAT C, et al. Prediction of response to neoadjuvant chemotherapy in breast cancer patients by circulating apoptotic biomarkers nucleosomes, DNAse, cytokeratin-18 fragments and survivin[J]. Cancer Lett, 2013, 336(1): 140-148.
[14] GEVENSLEBEN H, GARCIA-MURILLAS I, GRAESER M K, et al. Noninvasive detection of HER-2 amplification with plasma DNA digital PCR [J]. Clin Cancer Res, 2013, 19(12): 3276-3284.
[15] BECHMANN T, ANDERSEN R F, PALLISGAARD N, et al. Plasma HER-2 amplification in cell-free DNA during neoadjuvant chemotherapy in breast cancer [J]. J Cancer Res Clin Oncol, 2013, 139(6): 995-1003.
[16] GUTTERY D S, PAGE K, HILLS A, et al. Non-invasive detection of activating estrogen receptor 1 (ESR1) mutations in estrogen receptor–positive metastatic breast cancer [J]. Clin Chem, 2015, 61(7): 974-982.
[17] MURTAZA M, DAWSON S-J, TSUI D W, et al. Noninvasive analysis of acquired resistance to cancer therapy by sequencing of plasma DNA [J]. Nature, 2013, 497(7447): 108-112.
[18] SHAW J A, PAGE K, BLIGHE K, et al. Genomic analysis of circulating cell-free DNA infers breast cancer dormancy[J]. Genome Res, 2012, 22(2): 220-231.
[19] OLSSON E, WINTER C, GEORGE A, et al. Serial monitoring of circulating tumor DNA in patients with primary breast cancer for detection of occult metastatic disease [J]. EMBO Mol Med, 2015, 18, 7(8): 1034-1047.
[20] GARCIA-MURILLAS I, SCHIAVON G, WEIGELT B, et al. Mutation tracking in circulating tumor DNA predicts relapse in early breast cancer [J]. Sci Transl Med, 2015, 7(302): 302ra133-302ra133.
[21] GONG B, XUE J, YU J, et al. Cell-free DNA in blood is a potential diagnostic biomarker of breast cancer [J]. Oncol Lett, 2012, 3(4): 897-900.
[22] SHAN M, YIN H, LI J, et al. Detection of aberrant methylation of a six-gene panel in serum DNA for diagnosis of breast cancer [J]. Oncotarget, 2016, 7(14): 18485-18494.
[23] MADIC J, KIIALAINEN A, BIDARD F C, et al. Circulating tumor DNA and circulating tumor cells in metastatic triple negative breast cancer patients [J]. Int J Cancer, 2015, 136(9): 2158-2165.
[24] MADHAVAN D, WALLWIENER M, BENTS K, et al. Plasma DNA integrity as a biomarker for primary and metastatic breast cancer and potential marker for early diagnosis [J]. Breast cancer Res Treat, 2014, 146(1): 163-174.
[25] OCAÑA A, DÍEZ-GONZÁLEZ L, GARCÍA-OLMO D C, et al. Circulating DNA and survival in solid tumors [J]. Cancer Epidemiol Biomarkers Prev, 2016, 25(2): 399-406.
Clinical utility of circulating tumor DNA detection for diagnosis of breast cancer
YE Qing, JIANG Zefei
(Department of Breast Cancer, Affiliated Hospital of Academy of Military Medical Sciences, Beijing 100071, China)
Correspondence to: JIANG Zefei E-mail: jiangzf@hotmail.com
With the development of the next generation sequencing technology, considerable attention has been paid to the utility of circulating tumor DNA (ctDNA) detection in breast cancer. There are many clinical trials showed the ctDNA detection is a potential biomarker for the diagnosis, management and prognosis of breast cancer. ctDNA detection can provide a more accurate diagnosis for patients to guide clinical treatment in precision medicine era.
Circulating tumor DNA; Breast cancer; Diagnosis; Clinical utility
10.19401/j.cnki.1007-3639.2016.11.012
R730.43
A
1007-3639(2016)11-0947-05
国家自然科学基金资助项目(81472477)。
江泽飞E-mail:jiangzf@hotmail.com
(2015-12-10
2016-03-10)
